名校
解题方法
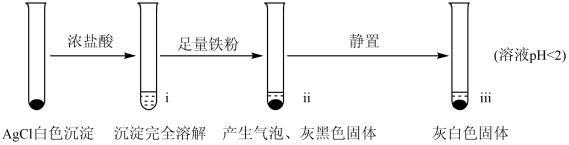
1 . 工业上用铁粉还原AgCl制取银,某小组探究其过程和影响因素。
【实验A】在试管中加入NaCl溶液,然后滴入AgNO3溶液,产生白色沉淀。滤出白色沉淀,继续实验如图:
【资料】 ;②Fe3++4Cl−⇌FeCl
;②Fe3++4Cl−⇌FeCl
(1)检验ⅱ中产物
①取ⅱ中上层清液,滴加K3[Fe(CN)6]溶液,有_______ (填现象),说明溶液中含有Fe2+。
②取ⅱ中少量灰黑色固体,洗涤后将固体等分两份。取其中一份,加入_______ (填试剂)溶解,再加入NaCl溶液生成白色沉淀,证明灰黑色固体中含有Ag。向另一份加入KI溶液,无明显现象。
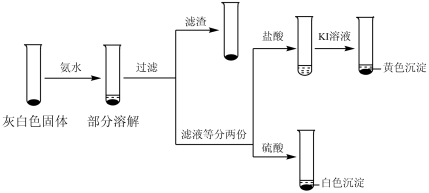
(2)检验ⅲ中产物。
①取ⅲ中灰白色固体,洗涤。进行如图实验,确认灰白色固体中含AgCl:_______ 。
②取iii中上层溶液,加几滴KSCN溶液。取样时间与溶液颜色如表。
用离子方程式表示溶液变红的原因_______ ,Fe3++3SCN−⇌Fe(SCN)3。
(3)小组同学认为不能排除O2直接氧化Ag继而生成AgCl,对此设计实验:_______ 。结果发现,该实验产生AgCl所需的时间更长。说明AgCl的产生主要与Fe3+有关。
(4)实验A中的i~iii中,i中AgCl溶解,iii中又生成AgCl,试解释iii中生成AgCl的原因:_______ 。
实验反思:铁粉还原AgCl制取银时应控制铁粉、盐酸的浓度和浸泡时间等因素。
【实验A】在试管中加入NaCl溶液,然后滴入AgNO3溶液,产生白色沉淀。滤出白色沉淀,继续实验如图:
【资料】
 ;②Fe3++4Cl−⇌FeCl
;②Fe3++4Cl−⇌FeCl
(1)检验ⅱ中产物
①取ⅱ中上层清液,滴加K3[Fe(CN)6]溶液,有
②取ⅱ中少量灰黑色固体,洗涤后将固体等分两份。取其中一份,加入
(2)检验ⅲ中产物。
①取ⅲ中灰白色固体,洗涤。进行如图实验,确认灰白色固体中含AgCl:
②取iii中上层溶液,加几滴KSCN溶液。取样时间与溶液颜色如表。
| 取样时间 | 10分钟 | 12小时 | 24小时 |
| 溶液颜色 | 浅红色 | 红色 | 深红色 |
(3)小组同学认为不能排除O2直接氧化Ag继而生成AgCl,对此设计实验:
(4)实验A中的i~iii中,i中AgCl溶解,iii中又生成AgCl,试解释iii中生成AgCl的原因:
实验反思:铁粉还原AgCl制取银时应控制铁粉、盐酸的浓度和浸泡时间等因素。
您最近一年使用:0次
解题方法
2 . 含砷废水常见于采矿、半导体等工业,部分砷的化合物有毒,因此需除去废水中的砷。
Ⅰ.天然水体中砷元素主要以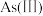 和
和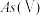 存在。在
存在。在 水溶液中,各种微粒的物质的量分数与溶液
水溶液中,各种微粒的物质的量分数与溶液 的关系如图1所示。
的关系如图1所示。
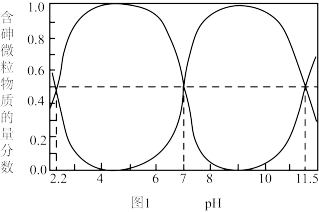
(1)当天然水体的 为4时,水体中所含
为4时,水体中所含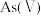 的主要微粒是
的主要微粒是_______ 。
(2)将 溶液滴入
溶液滴入 溶液中,当
溶液中,当 达到8时,所发生反应的离子方程式为
达到8时,所发生反应的离子方程式为_______ 。此时,溶液中含砷离子浓度由大到小的顺序为_______ 。
(3) 时,向
时,向 溶液中加入
溶液中加入 溶液至中性,此时溶液中
溶液至中性,此时溶液中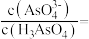
_______ 。
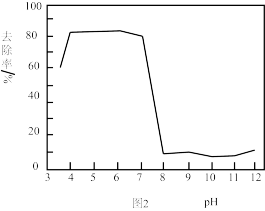
Ⅱ.利用高铁酸盐处理含砷废水。在一定 范围内,高铁酸盐被还原成胶体,而吸附含砷化合物。不同
范围内,高铁酸盐被还原成胶体,而吸附含砷化合物。不同 对
对 除砷影响如图2所示。
除砷影响如图2所示。
已知:溶液的 对胶体粒子表面所带电荷有影响。
对胶体粒子表面所带电荷有影响。 时,胶体粒子表面带正电荷,
时,胶体粒子表面带正电荷, 越低,表面所带正电荷越多。
越低,表面所带正电荷越多。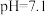 时,胶体粒子表面不带电荷;
时,胶体粒子表面不带电荷;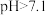 时,胶体粒子表面带负电荷,
时,胶体粒子表面带负电荷, 越高,表面所带负电荷越多。
越高,表面所带负电荷越多。
(4)结合图1和图2分析,除砷过程中控制废水 约为
约为_______ 适宜, 过低或过高,砷的去除率都会下降。
过低或过高,砷的去除率都会下降。 过低,主要以
过低,主要以 形式存在,不易形成
形式存在,不易形成 胶体。
胶体。 过高,一是
过高,一是 氧化性减弱,产生
氧化性减弱,产生 胶体的量少;二是
胶体的量少;二是_______ ;三是 过高,生成
过高,生成 沉淀而不是
沉淀而不是 胶体。
胶体。
(5)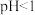 时,
时, 氧化
氧化 的离子方程式为
的离子方程式为_______ 。
Ⅰ.天然水体中砷元素主要以
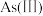 和
和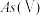 存在。在
存在。在 水溶液中,各种微粒的物质的量分数与溶液
水溶液中,各种微粒的物质的量分数与溶液 的关系如图1所示。
的关系如图1所示。
(1)当天然水体的
 为4时,水体中所含
为4时,水体中所含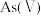 的主要微粒是
的主要微粒是(2)将
 溶液滴入
溶液滴入 溶液中,当
溶液中,当 达到8时,所发生反应的离子方程式为
达到8时,所发生反应的离子方程式为(3)
 时,向
时,向 溶液中加入
溶液中加入 溶液至中性,此时溶液中
溶液至中性,此时溶液中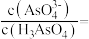
Ⅱ.利用高铁酸盐处理含砷废水。在一定
 范围内,高铁酸盐被还原成胶体,而吸附含砷化合物。不同
范围内,高铁酸盐被还原成胶体,而吸附含砷化合物。不同 对
对 除砷影响如图2所示。
除砷影响如图2所示。
已知:溶液的
 对胶体粒子表面所带电荷有影响。
对胶体粒子表面所带电荷有影响。 时,胶体粒子表面带正电荷,
时,胶体粒子表面带正电荷, 越低,表面所带正电荷越多。
越低,表面所带正电荷越多。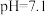 时,胶体粒子表面不带电荷;
时,胶体粒子表面不带电荷;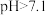 时,胶体粒子表面带负电荷,
时,胶体粒子表面带负电荷, 越高,表面所带负电荷越多。
越高,表面所带负电荷越多。(4)结合图1和图2分析,除砷过程中控制废水
 约为
约为 过低或过高,砷的去除率都会下降。
过低或过高,砷的去除率都会下降。 过低,主要以
过低,主要以 形式存在,不易形成
形式存在,不易形成 胶体。
胶体。 过高,一是
过高,一是 氧化性减弱,产生
氧化性减弱,产生 胶体的量少;二是
胶体的量少;二是 过高,生成
过高,生成 沉淀而不是
沉淀而不是 胶体。
胶体。(5)
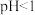 时,
时, 氧化
氧化 的离子方程式为
的离子方程式为
您最近一年使用:0次
2022-01-25更新
|
226次组卷
|
2卷引用:山东省威海市2021-2022学年高二上学期期末考试化学试题
名校
3 . 二氧化氯( )是国际上公认的安全、无毒的绿色消毒剂,对酸性污水中的
)是国际上公认的安全、无毒的绿色消毒剂,对酸性污水中的 有明显的去除效果,其反应原理为:
有明显的去除效果,其反应原理为: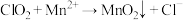 (部分反应物和产物省略、未配平),工业上可用
(部分反应物和产物省略、未配平),工业上可用 制取
制取 ,化学方程式如下:
,化学方程式如下: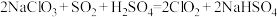 。实验室用如下方法制备饮用水消毒剂
。实验室用如下方法制备饮用水消毒剂 :
:
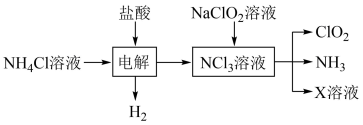
已知: 为强氧化剂,其中N元素为+3价。下列说法
为强氧化剂,其中N元素为+3价。下列说法不 正确的是
 )是国际上公认的安全、无毒的绿色消毒剂,对酸性污水中的
)是国际上公认的安全、无毒的绿色消毒剂,对酸性污水中的 有明显的去除效果,其反应原理为:
有明显的去除效果,其反应原理为: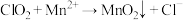 (部分反应物和产物省略、未配平),工业上可用
(部分反应物和产物省略、未配平),工业上可用 制取
制取 ,化学方程式如下:
,化学方程式如下: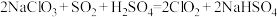 。实验室用如下方法制备饮用水消毒剂
。实验室用如下方法制备饮用水消毒剂 :
:
已知:
 为强氧化剂,其中N元素为+3价。下列说法
为强氧化剂,其中N元素为+3价。下列说法A. 的空间构型为三角锥形 的空间构型为三角锥形 |
B.电解池中总反应的化学方程式为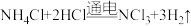 |
C.X溶液中主要存在的离子有: 、 、 、 、 |
D.饮用水制备过程中残留的 可用适量 可用适量 溶液去除 溶液去除 |
您最近一年使用:0次
2021-11-19更新
|
1348次组卷
|
4卷引用:江苏省无锡市2021-2022学年高三上学期期中教学质量调研测试化学试题
4 . 某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是___________ 。
(2)已知2个KBrO3在反应中得到10个电子生成X,则X的化学式为___________ 。
(3)根据上述反应可推知___________。
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并用单线桥法标出电子转移的方向和数目:  。
。___________
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是
(2)已知2个KBrO3在反应中得到10个电子生成X,则X的化学式为
(3)根据上述反应可推知___________。
| A.氧化性:KBrO3>H3AsO4 | B.氧化性:H3AsO4>KBrO3 |
| C.还原性:AsH3>X | D.还原性:X>AsH3 |
 。
。
您最近一年使用:0次
名校
解题方法
5 . 零价铁还原性强、活性高,对很多重金属离子及含磷、砷离子都有较好的去除和富集作用。
Ⅰ.零价铁的制备。
(1)富铁矿石经破碎、筛分到微米级后,在氢气氛围下 高温还原
高温还原 可以制备微米级零价铁。请写出磁铁矿与氢气反应制备零价铁的化学方程式
可以制备微米级零价铁。请写出磁铁矿与氢气反应制备零价铁的化学方程式_______ 。
(2)采用 还原铁盐,可以制备出纳米级的零价铁。
还原铁盐,可以制备出纳米级的零价铁。
已知: 的电负性是2.0,
的电负性是2.0, 的电负性是2.1
的电负性是2.1
①请写出 的电子式
的电子式_______ 。
②请写出 与硫酸反应的离子方程式
与硫酸反应的离子方程式_______ 。
③补充完整下列化学方程式_______ 。

每生成 零价铁
零价铁 ,转移电子的物质的量是
,转移电子的物质的量是_______  。
。
Ⅱ.零价铁的结构和作用机理。
研究发现,纳米级和微米级的零价铁,均具有“核-壳”结构。
已知:①壳层可以导电;
②当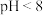 时,铁的氧化物质子化,壳层表面带正电;当
时,铁的氧化物质子化,壳层表面带正电;当 时,铁的氧化物去质子化,壳层表面带负电;
时,铁的氧化物去质子化,壳层表面带负电;
③磷酸盐溶解度一般较小。
(3)去离子水中加入零价铁, 从6上升到9.5左右。检测壳层物质,发现有
从6上升到9.5左右。检测壳层物质,发现有 、
、 、
、 、
、 等。导致产生壳层微粒的氧化剂是
等。导致产生壳层微粒的氧化剂是 、
、_______ 。
(4)部分金属阳离子去除机理如图所示。纳米零铁去除污水中 、
、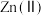 主要机理不同,请简述两者的区别并解释原因
主要机理不同,请简述两者的区别并解释原因_______ 。 )微粒:
)微粒:
①控制
_______ 8,原因是_______ 。
②通过形成_______ (填化学式)进一步去除 。
。
(6)综上所述,零价铁去除重金属离子及含磷微粒的主要机理有_______ 。
Ⅰ.零价铁的制备。
(1)富铁矿石经破碎、筛分到微米级后,在氢气氛围下
 高温还原
高温还原 可以制备微米级零价铁。请写出磁铁矿与氢气反应制备零价铁的化学方程式
可以制备微米级零价铁。请写出磁铁矿与氢气反应制备零价铁的化学方程式(2)采用
 还原铁盐,可以制备出纳米级的零价铁。
还原铁盐,可以制备出纳米级的零价铁。已知:
 的电负性是2.0,
的电负性是2.0, 的电负性是2.1
的电负性是2.1①请写出
 的电子式
的电子式②请写出
 与硫酸反应的离子方程式
与硫酸反应的离子方程式③补充完整下列化学方程式

每生成
 零价铁
零价铁 ,转移电子的物质的量是
,转移电子的物质的量是 。
。Ⅱ.零价铁的结构和作用机理。
研究发现,纳米级和微米级的零价铁,均具有“核-壳”结构。
已知:①壳层可以导电;
②当
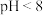 时,铁的氧化物质子化,壳层表面带正电;当
时,铁的氧化物质子化,壳层表面带正电;当 时,铁的氧化物去质子化,壳层表面带负电;
时,铁的氧化物去质子化,壳层表面带负电;③磷酸盐溶解度一般较小。
(3)去离子水中加入零价铁,
 从6上升到9.5左右。检测壳层物质,发现有
从6上升到9.5左右。检测壳层物质,发现有 、
、 、
、 、
、 等。导致产生壳层微粒的氧化剂是
等。导致产生壳层微粒的氧化剂是 、
、(4)部分金属阳离子去除机理如图所示。纳米零铁去除污水中
 、
、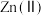 主要机理不同,请简述两者的区别并解释原因
主要机理不同,请简述两者的区别并解释原因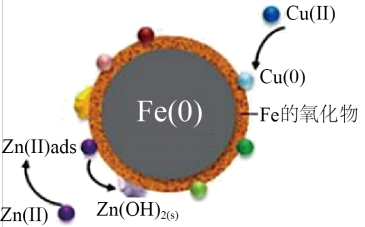
 )微粒:
)微粒:①控制

②通过形成
 。
。(6)综上所述,零价铁去除重金属离子及含磷微粒的主要机理有
您最近一年使用:0次
名校
解题方法
6 . 含有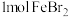 的溶液中,通入
的溶液中,通入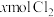 ,反应的离子方程式表示错误的是
,反应的离子方程式表示错误的是
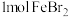 的溶液中,通入
的溶液中,通入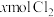 ,反应的离子方程式表示错误的是
,反应的离子方程式表示错误的是A.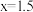 , ,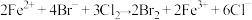 |
B.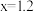 , ,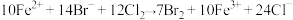 |
C. , ,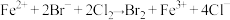 |
D. , ,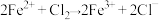 |
您最近一年使用:0次
2021-04-08更新
|
651次组卷
|
4卷引用:上海市金山区2021届高三二模化学试题
上海市金山区2021届高三二模化学试题宁夏石嘴山市第三中学2021-2022学年高三上学期期中考试化学(理)试题(已下线)三轮冲刺卷3-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(上海卷)陕西省西安市铁一中学2023-2024学年高一上学期第二次月考化学试题
19-20高三·江苏苏州·期末
名校
7 . 铁及其化合物在处理工业废水、废气过程中发挥着重要作用。
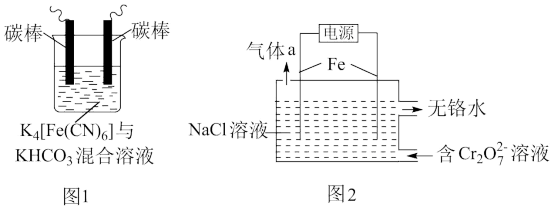
(1)用铁的化合物除硫化氢:2[Fe(CN)6]3-+ 2 +HS- =2[Fe(CN)6]4-+ 2
+HS- =2[Fe(CN)6]4-+ 2 +S↓,可通过图1使[Fe(CN)6]3-再生,电解时,阳极的电极反应式为
+S↓,可通过图1使[Fe(CN)6]3-再生,电解时,阳极的电极反应式为_______ ;电解过程中阴极区溶液的pH_______ (填“变大”、 “变小”或“不变")。
(2)以铁为电极电解除铬,如图2
已知: + H2O=2
+ H2O=2 +2H+
+2H+
氧化性: >
>
①电解过程中主要反应之一: +6Fe2++17H2O= 2Cr(OH)3↓+6Fe(OH)3↓+10H+;气体a主要成分是
+6Fe2++17H2O= 2Cr(OH)3↓+6Fe(OH)3↓+10H+;气体a主要成分是_______ 。
②电解过程中,不同pH时,通电时间与Cr元素的去除率关系如图3所示,pH=10相比pH=4,Cr元素的去除率偏低的原因可能是_______ 。
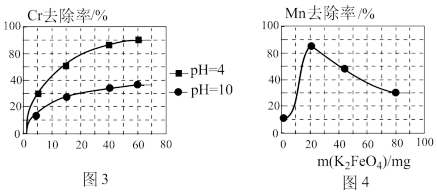
(3)高铁酸钾(K2FeO4)除锰
已知:K2FeO4具有强氧化性,极易溶于水
①在酸性条件下,能与废水中的Mn2+反应生成Fe(OH)3和MnO2沉淀来除锰,该反应的离子方程式_______ 。
②用K2FeO4处理1L 50 mg/L的含Mn2+废水,Mn元素的去除率与K2FeO4量的关系如图4所示,当K2FeO4超过20 mg时,Mn元素的去除率下降的原因可能是_______ 。

(1)用铁的化合物除硫化氢:2[Fe(CN)6]3-+ 2
 +HS- =2[Fe(CN)6]4-+ 2
+HS- =2[Fe(CN)6]4-+ 2 +S↓,可通过图1使[Fe(CN)6]3-再生,电解时,阳极的电极反应式为
+S↓,可通过图1使[Fe(CN)6]3-再生,电解时,阳极的电极反应式为(2)以铁为电极电解除铬,如图2
已知:
 + H2O=2
+ H2O=2 +2H+
+2H+氧化性:
 >
>
①电解过程中主要反应之一:
 +6Fe2++17H2O= 2Cr(OH)3↓+6Fe(OH)3↓+10H+;气体a主要成分是
+6Fe2++17H2O= 2Cr(OH)3↓+6Fe(OH)3↓+10H+;气体a主要成分是②电解过程中,不同pH时,通电时间与Cr元素的去除率关系如图3所示,pH=10相比pH=4,Cr元素的去除率偏低的原因可能是

(3)高铁酸钾(K2FeO4)除锰
已知:K2FeO4具有强氧化性,极易溶于水
①在酸性条件下,能与废水中的Mn2+反应生成Fe(OH)3和MnO2沉淀来除锰,该反应的离子方程式
②用K2FeO4处理1L 50 mg/L的含Mn2+废水,Mn元素的去除率与K2FeO4量的关系如图4所示,当K2FeO4超过20 mg时,Mn元素的去除率下降的原因可能是
您最近一年使用:0次
2021-03-25更新
|
454次组卷
|
5卷引用:【苏州新东方】化学试卷
(已下线)【苏州新东方】化学试卷(已下线)2.3.1 浓度变化对化学平衡的影响-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)湖北省武汉市蔡甸区汉阳一中2021-2022学年高二上学期12月月考化学试题湖北省武汉市部分重点中学2021-2022学年高二上学期12月联考化学试题江苏省常州市第一中学2023-2024学年高二上学期11月期中考试化学试题
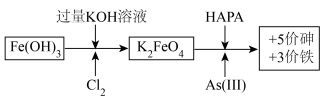
8 . 制备高铁酸钾[K2FeO4]并用其除去土壤和废水中的有机砷(HAPA)与无机砷[+3价砷表示As(Ⅲ)]的流程如图所示:
已知:酸性越强,K2FeO4越容易发生反应生成O2。
回答下列问题:
(1)生成K2FeO4的化学方程式为___ 。
(2)K2FeO4去除砷污染时作__ (填“氧化剂”或“还原剂”)。若污染物中的砷全部以Na3AsO3计,则去除全部污染时Na3AsO3与K2FeO4的物质的量之比为__ 。
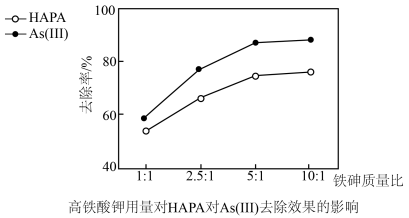
(3)氢离子浓度、高铁酸钾的用量对HAPA和As(Ⅲ)去除效果的影响如图所示。
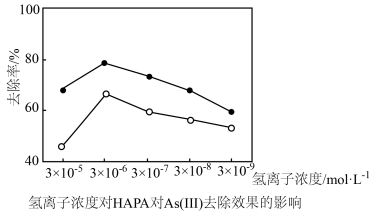
①氢离子浓度为3×10-5mol•L-1时去除率低,原因是(用离子方程式表示)__ 。
②最佳铁砷质量比为___ ,理由是__ 。

已知:酸性越强,K2FeO4越容易发生反应生成O2。
回答下列问题:
(1)生成K2FeO4的化学方程式为
(2)K2FeO4去除砷污染时作
(3)氢离子浓度、高铁酸钾的用量对HAPA和As(Ⅲ)去除效果的影响如图所示。


①氢离子浓度为3×10-5mol•L-1时去除率低,原因是(用离子方程式表示)
②最佳铁砷质量比为
您最近一年使用:0次
2021-01-28更新
|
723次组卷
|
4卷引用:山东省潍坊市2020-2021学年高一上学期期末统考化学试题
山东省潍坊市2020-2021学年高一上学期期末统考化学试题(已下线)解密06 金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密06 金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练山东省高密市第一中学2023-2024学年高一上学期1月冬学竞赛化学试题
9 . 将 通入足量
通入足量 溶液中,完全反应后再加入
溶液中,完全反应后再加入 溶液,发生的两个化学反应为①
溶液,发生的两个化学反应为①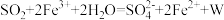 ,②
,②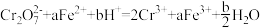 。下列有关说法正确的是
。下列有关说法正确的是
 通入足量
通入足量 溶液中,完全反应后再加入
溶液中,完全反应后再加入 溶液,发生的两个化学反应为①
溶液,发生的两个化学反应为①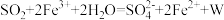 ,②
,②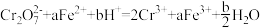 。下列有关说法正确的是
。下列有关说法正确的是A.还原性:  |
B.方程式②中,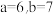 |
C. 能将 能将 氧化成 氧化成 |
D.方程式①中 为 为 |
您最近一年使用:0次
2021-01-11更新
|
587次组卷
|
2卷引用:专题4 本专题复习提升-高中化学苏教2019版必修第一册
名校
10 . 据所学知识完成以下题目:
(1)在下列反应中,HCl做还原剂的是_______ ,HCl做氧化剂的是_______ 。
①CaCO3+2HCl=CaCl2+CO2↑+H2O
②Fe+2HCl=FeCl2+H2↑
③PbO2+4HCl(浓) PbCl2+Cl2↑+2H2O
PbCl2+Cl2↑+2H2O
④KClO3+6HCl(浓) KCl+3Cl2↑+3H2O
KCl+3Cl2↑+3H2O
⑤CuO+2HCl=CuCl2+H2O
(2)在横线上补充所需的离子或分子,并配平方程式,。
①KMnO4+HCl=KCl+MnCl2+Cl2↑+H2O,_______ 。
②Mn2++ +H2O=MnO2↓+Cl2↑+___ ,
+H2O=MnO2↓+Cl2↑+___ ,_______ 。
(3)用单线桥表示下列反应中电子转移方向和数目:KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O,_______ 。
(4)钙元素是人体必需的常量元素,所有的细胞都需要钙元素。测定人体血液中钙元素的含量常用到如下两个反应:
①CaC2O4+H2SO4=H2C2O4+CaSO4
②2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
上述反应②的还原剂是____ ;若收集到44.8mL(标准状况)的CO2时,消耗氧化剂_____ mol,有_____ mol电子发生转移,相当于测出含钙元素的质量是_____ g。
(5)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、 、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:
、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:_____ 。
(1)在下列反应中,HCl做还原剂的是
①CaCO3+2HCl=CaCl2+CO2↑+H2O
②Fe+2HCl=FeCl2+H2↑
③PbO2+4HCl(浓)
 PbCl2+Cl2↑+2H2O
PbCl2+Cl2↑+2H2O④KClO3+6HCl(浓)
 KCl+3Cl2↑+3H2O
KCl+3Cl2↑+3H2O⑤CuO+2HCl=CuCl2+H2O
(2)在横线上补充所需的离子或分子,并配平方程式,。
①KMnO4+HCl=KCl+MnCl2+Cl2↑+H2O,
②Mn2++
 +H2O=MnO2↓+Cl2↑+___ ,
+H2O=MnO2↓+Cl2↑+___ ,(3)用单线桥表示下列反应中电子转移方向和数目:KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O,
(4)钙元素是人体必需的常量元素,所有的细胞都需要钙元素。测定人体血液中钙元素的含量常用到如下两个反应:
①CaC2O4+H2SO4=H2C2O4+CaSO4
②2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
上述反应②的还原剂是
(5)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、
 、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:
、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:
您最近一年使用:0次
2020-12-24更新
|
1712次组卷
|
5卷引用:福建省连城县第一中学2020-2021学年高一上学期第二次月考化学试题
福建省连城县第一中学2020-2021学年高一上学期第二次月考化学试题(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)专题05 氧化还原反应(限时精练)-2022届高考化学一轮复习热点题型归纳与变式训练 (已下线)第一章《物质及其变化》能力提升单元检测-【帮课堂】2022-2023学年高一化学必修第一册精品讲义(人教版2019)



