1 . 某离子反应涉及H2O、ClO-、 、OH-、N2、Cl-等微粒,其中N2、ClO-的数目随时间变化的曲线如图所示,下列说法正确的是
、OH-、N2、Cl-等微粒,其中N2、ClO-的数目随时间变化的曲线如图所示,下列说法正确的是
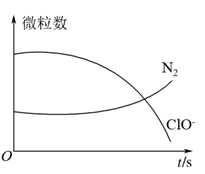
 、OH-、N2、Cl-等微粒,其中N2、ClO-的数目随时间变化的曲线如图所示,下列说法正确的是
、OH-、N2、Cl-等微粒,其中N2、ClO-的数目随时间变化的曲线如图所示,下列说法正确的是
| A.该反应中Cl-为氧化产物 |
| B.消耗1个还原剂微粒,转移6e- |
C. 被ClO-氧化成N2 被ClO-氧化成N2 |
| D.反应后溶液的酸性减弱 |
您最近一年使用:0次
2020-10-02更新
|
1135次组卷
|
8卷引用:山东省济南外国语学校2018届高三12月考试化学试题
2 . 写出下列反应的离子方程式(已知还原性: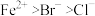 ):
):
(1)向 溶液中通入少量
溶液中通入少量 (
( 与
与 的微粒数的比值
的微粒数的比值 ):
):_________ ;
(2)向 溶液中通入足量
溶液中通入足量 :
:______ ;
(3)向 溶液中通入
溶液中通入 ,
, 与
与 的化学计量数之比为
的化学计量数之比为 :
:______ 。
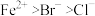 ):
):(1)向
 溶液中通入少量
溶液中通入少量 (
( 与
与 的微粒数的比值
的微粒数的比值 ):
):(2)向
 溶液中通入足量
溶液中通入足量 :
:(3)向
 溶液中通入
溶液中通入 ,
, 与
与 的化学计量数之比为
的化学计量数之比为 :
:
您最近一年使用:0次
2020-10-01更新
|
1462次组卷
|
3卷引用:人教版(2019)高一必修第一册 第一章 物质及其变化 章末总结
解题方法
3 . 锂离子电池广泛应用于日常电子产品中,也是电动汽车动力电池的首选。正极材料的选择决定了锂离子电池的性能。磷酸亚铁锂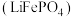 以其高倍率性、高比能量、高循环特性、高安全性、低成本、环保等优点而逐渐成为“能源新星”。
以其高倍率性、高比能量、高循环特性、高安全性、低成本、环保等优点而逐渐成为“能源新星”。
(1)高温固相法是生产磷酸亚铁锂的主要方法。通常以亚铁盐、磷酸盐和锂盐为原料,按化学计量比充分混匀后,在惰性气氛中先经过较低温预分解,再经高温焙烧,最后研磨粉碎制成。请回答下列问题:
①补充完整该反应的化学方程式: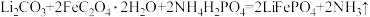
_____ 
______ 。
②理论上,反应中每转移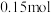 电子,会生成
电子,会生成
_____ g。
③反应需在惰性气氛中进行,其原因是____________ 。
(2)磷酸亚铁锂电池装置如图所示,其中正极材料橄榄石型 通过黏合剂附着在铝箔表面,负极石墨材料附着在铜箔表面,电解质为溶解在有机溶剂中的锂盐。
通过黏合剂附着在铝箔表面,负极石墨材料附着在铜箔表面,电解质为溶解在有机溶剂中的锂盐。
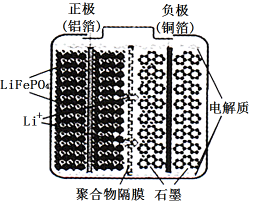
电池工作时的总反应为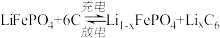 ,则放电时,正极的电极反应式为
,则放电时,正极的电极反应式为________ ,充电时, 迁移方向为
迁移方向为_____ (填“由左向右”或“由右向左”),图中聚合物隔膜应为_____ (填“阳”或“阴”)离子交换膜。
 以其高倍率性、高比能量、高循环特性、高安全性、低成本、环保等优点而逐渐成为“能源新星”。
以其高倍率性、高比能量、高循环特性、高安全性、低成本、环保等优点而逐渐成为“能源新星”。(1)高温固相法是生产磷酸亚铁锂的主要方法。通常以亚铁盐、磷酸盐和锂盐为原料,按化学计量比充分混匀后,在惰性气氛中先经过较低温预分解,再经高温焙烧,最后研磨粉碎制成。请回答下列问题:
①补充完整该反应的化学方程式:
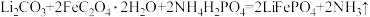
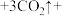

②理论上,反应中每转移
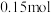 电子,会生成
电子,会生成
③反应需在惰性气氛中进行,其原因是
(2)磷酸亚铁锂电池装置如图所示,其中正极材料橄榄石型
 通过黏合剂附着在铝箔表面,负极石墨材料附着在铜箔表面,电解质为溶解在有机溶剂中的锂盐。
通过黏合剂附着在铝箔表面,负极石墨材料附着在铜箔表面,电解质为溶解在有机溶剂中的锂盐。
电池工作时的总反应为
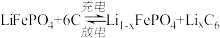 ,则放电时,正极的电极反应式为
,则放电时,正极的电极反应式为 迁移方向为
迁移方向为
您最近一年使用:0次
2020-09-19更新
|
812次组卷
|
3卷引用:鲁科版(2019)选择性必修1 第1章 化学反应与能量转化 第2节 化学能转化为电能——电池
鲁科版(2019)选择性必修1 第1章 化学反应与能量转化 第2节 化学能转化为电能——电池山东省青岛通济实验学校学校2021届高三上学期10月月考化学试题(已下线)练习8 原电池 化学电源-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)
解题方法
4 . 配平下列反应方程式。
(1)正向配平类
①___ HCl(浓)+___ MnO2
___ Cl2↑+___ MnCl2+___ H2O
②___ KI+___ KIO3+___ H2SO4=____ I2+___ K2SO4+___ H2O
③___ MnO +
+___ H++___ Cl-=___ Mn2++___ Cl2↑+___ H2O
(2)逆向配平类
①___ S+___ KOH=___ K2S+___ K2SO3+___ H2O
②___ P4+___ KOH+___ H2O=___ K3PO4+___ PH3↑
(3)缺项配平类
①___ ClO-+___ Fe(OH)3+___ =___ Cl-+___ FeO +
+___ H2O
②___ MnO +
+___ H2O2+___ =___ Mn2++___ O2↑+___ H2O
③某高温还原法制备新型陶瓷氮化铝(AlN)的反应体系中的物质有Al2O3、C、N2、AlN、CO。请将反应物与生成物分别填入以下空格内,并配平。___

(1)正向配平类
①

②
③
 +
+(2)逆向配平类
①
②
(3)缺项配平类
①
 +
+②
 +
+③某高温还原法制备新型陶瓷氮化铝(AlN)的反应体系中的物质有Al2O3、C、N2、AlN、CO。请将反应物与生成物分别填入以下空格内,并配平。

您最近一年使用:0次
2020-09-02更新
|
2236次组卷
|
3卷引用:苏教版(2020)高一必修第一册专题4 突破3 氧化还原反应与离子反应的综合应用
苏教版(2020)高一必修第一册专题4 突破3 氧化还原反应与离子反应的综合应用鲁科版(2019)高一必修第一册第2章 元素与物质世界 第3节 氧化还原反应 专题4 氧化还原反应的计算及方程式的配平(已下线)易错专题07 氧化还原反应电子转移的表示及方程式的书写-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)
真题
名校
5 . 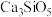 是硅酸盐水泥的重要成分之一,其相关性质的说法
是硅酸盐水泥的重要成分之一,其相关性质的说法不正确 的是
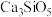 是硅酸盐水泥的重要成分之一,其相关性质的说法
是硅酸盐水泥的重要成分之一,其相关性质的说法A.可发生反应: |
| B.具有吸水性,需要密封保存 |
C.能与 ,反应生成新盐 ,反应生成新盐 |
D.与足量盐酸作用,所得固体产物主要为 |
您最近一年使用:0次
2020-07-11更新
|
5403次组卷
|
31卷引用:2020年浙江省高考化学试卷(7月选考)
2020年浙江省高考化学试卷(7月选考)(已下线)专题05 元素及其化合物-2020年高考真题和模拟题化学分项汇编(已下线)第9讲 硅及其化合物-2021年高考化学一轮复习名师精讲练(已下线)第13讲 碳、硅及无机非金属材料(精讲)——2021年高考化学一轮复习讲练测(已下线)小题必刷08 氧化还原反应的规律及应用——2021年高考化学一轮复习小题必刷(通用版)(已下线)小题必刷17 碳、硅与无机非金属材料——2021年高考化学一轮复习小题必刷(通用版)(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练天津市实验中学滨海学校2021届高三上学期第一次月考化学试题(已下线)课时20 碳、硅与无机非金属材料-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考向05 氧化还原反应-备战2022年高考化学一轮复习考点微专题(已下线)考点10 碳、硅及其无机非金属材料-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点10 碳、硅及其无机非金属材料-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)第9讲 无机非金属材料 (讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)考向10 碳、硅及其化合物-备战2022年高考化学一轮复习考点微专题(已下线)专题05.元素及其化合物-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)专题07 常见非金属及其化合物-备战2022年高考化学学霸纠错(全国通用)重庆市第七中学校2021-2022学年高一下学期3月月考化学试题(已下线)考点12 硅及其无机非金属材料-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第11讲 碳、硅及无机非金属材料(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第14练 无机非金属材料-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第09讲 无机非金属材料(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第09讲 无机非金属材料(讲)-2023年高考化学一轮复习讲练测(新教材新高考)北京市昌平区2022-2023学年高三上学期期末质量检测化学试题第四章 非金属及其化合物 第17讲 无机非金属材料(已下线)第10讲 硅及其化合物(已下线)第7讲 碳、硅及无机非金属材料(已下线)考点13 硅及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)浙江省杭州市西湖高级中学2023-2024学年高一下学期4月期中考试化学试题湖北省武汉市第三中学2023-2024学年高一下学期3月月考化学试卷(已下线)第05讲 氧化还原反应方程式的配平、书写及计算(练习)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)
名校
6 . 三氯氧磷(POCl3)广泛用于农药、医药等生产。工业制备三氯氧磷的过程中会产生副产品亚磷酸(H3PO3)。回答下列问题:
(1)三氯氧磷可由三氯化磷、水、氯气加热反应生成,反应的化学方程式为_______
(2)已知亚磷酸(H3PO3)为二元弱酸,则Na2HPO3溶液中,各离子浓度的大小关系为_______
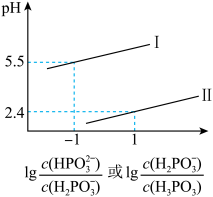
(3)常温下,将NaOH溶液滴加到亚磷酸(H3PO3)溶液中,混合溶液的pH与离子浓度变化的关系如图所示,则表示lg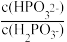 的是曲线
的是曲线_____ (填“Ⅰ”或“Ⅱ”),亚磷酸(H3PO3)的Ka1=_____ ,反应HPO32-+H2O H2PO3-+OH-的平衡常数的值是
H2PO3-+OH-的平衡常数的值是_____ 。
(4)工业上生产三氯氧磷的同时会产生含磷废水(主要成分为H3PO4、H3PO3)。向废水中先加入适量漂白粉,再加入生石灰调节pH,将磷元素转化为磷酸的钙盐沉淀并回收。若处理后的废水中c(Ca2+)=5×10-6 mol·L-1,则溶液中c(PO43-)=_____ mol·L-1。(已知Ksp[Ca3(PO4)2]=2×10-29)
(1)三氯氧磷可由三氯化磷、水、氯气加热反应生成,反应的化学方程式为
(2)已知亚磷酸(H3PO3)为二元弱酸,则Na2HPO3溶液中,各离子浓度的大小关系为
(3)常温下,将NaOH溶液滴加到亚磷酸(H3PO3)溶液中,混合溶液的pH与离子浓度变化的关系如图所示,则表示lg
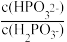 的是曲线
的是曲线 H2PO3-+OH-的平衡常数的值是
H2PO3-+OH-的平衡常数的值是
(4)工业上生产三氯氧磷的同时会产生含磷废水(主要成分为H3PO4、H3PO3)。向废水中先加入适量漂白粉,再加入生石灰调节pH,将磷元素转化为磷酸的钙盐沉淀并回收。若处理后的废水中c(Ca2+)=5×10-6 mol·L-1,则溶液中c(PO43-)=

您最近一年使用:0次
2020-04-03更新
|
792次组卷
|
4卷引用:湖北省武汉市武昌区武汉中学2019-2020学年高二上学期化学(人教版选修4)期末复习试题:专题19 大题综合训练
7 . MnO2是一种重要的无机功能材料,可由MnSO4和NaClO3溶液反应制得,反应原理为: MnSO4+ NaClO3+ H2O Cl2↑ + Na2SO4 + MnO2 ↓+ (未配平),则关于此反应的叙述不正确的是
Cl2↑ + Na2SO4 + MnO2 ↓+ (未配平),则关于此反应的叙述不正确的是
 Cl2↑ + Na2SO4 + MnO2 ↓+ (未配平),则关于此反应的叙述不正确的是
Cl2↑ + Na2SO4 + MnO2 ↓+ (未配平),则关于此反应的叙述不正确的是| A.NaClO3中Cl的化合价为+5 |
| B.每生成8.7 g氧化产物,反应中转移的电子数约为0.2×6.02×1023 |
| C.NaClO3的氧化性强于MnO2的氧化性 |
| D.该反应右边方框内的产物是NaOH |
您最近一年使用:0次
2020-01-19更新
|
364次组卷
|
2卷引用:甘肃省武威第六中学2020届高三上学期第六次诊断考试化学试题
名校
8 . 用“银-Ferrozine”法检测室内甲醛含量的原理如下:

下列说法错误的是

下列说法错误的是
| A.标准状况下,11.2 L CO2中含C=O键的数目为6.02×1023 |
| B.反应①的化学方程式为2Ag2O+HCHO=4Ag+CO2↑+H2O |
| C.理论上吸收HCHO与消耗Fe3+的物质的量之比为4:1 |
| D.30 g HCHO被氧化时转移电子数目为4×6.02×1023 |
您最近一年使用:0次
2020-01-09更新
|
290次组卷
|
3卷引用:安徽省濉溪县2020届高三上学期第一次月考化学试题
9 . 金属的回收是工业生产中的重要课题,利用某工业冶炼废渣 主要成分为
主要成分为 和铁、锡、铅、铜的氧化物
和铁、锡、铅、铜的氧化物 回收锡、铜、铅的工艺流程如图所示:
回收锡、铜、铅的工艺流程如图所示:
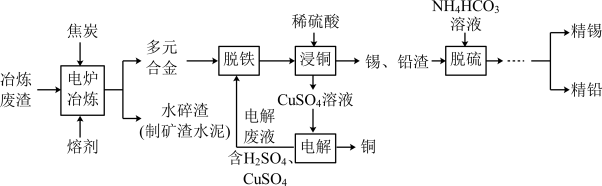
回答下列问题:
 电炉冶炼时,焦炭的作用是
电炉冶炼时,焦炭的作用是______  填“氧化剂”或“还原剂”
填“氧化剂”或“还原剂” ,将焦炭粉碎的目的是
,将焦炭粉碎的目的是______ 。熔剂的主要成分是氟石 ,高温下能与
,高温下能与 反应生成两种钙盐,其中之一为CaSiF6,该反应的化学方程式为
反应生成两种钙盐,其中之一为CaSiF6,该反应的化学方程式为______ 。
 脱铁后的溶液中含有少量的
脱铁后的溶液中含有少量的  ,为减少锡的损失,可用锡、铜、铅、铁多元合金回收处理,反应的离子方程式为
,为减少锡的损失,可用锡、铜、铅、铁多元合金回收处理,反应的离子方程式为______ 。
 已知
已知  可表示为:
可表示为: ,则
,则  也可用氧化物表示为:
也可用氧化物表示为:______ 。
 脱硫后需过滤、洗涤再进入下一步工序,检验滤渣是否洗涤干净的方法是
脱硫后需过滤、洗涤再进入下一步工序,检验滤渣是否洗涤干净的方法是______ 。
 若该冶炼废渣中锡的质量分数为
若该冶炼废渣中锡的质量分数为  ,30t 废渣制得精锡
,30t 废渣制得精锡  ,则锡的回收率为
,则锡的回收率为______ 。
 主要成分为
主要成分为 和铁、锡、铅、铜的氧化物
和铁、锡、铅、铜的氧化物 回收锡、铜、铅的工艺流程如图所示:
回收锡、铜、铅的工艺流程如图所示:
回答下列问题:
 电炉冶炼时,焦炭的作用是
电炉冶炼时,焦炭的作用是 填“氧化剂”或“还原剂”
填“氧化剂”或“还原剂” ,将焦炭粉碎的目的是
,将焦炭粉碎的目的是 ,高温下能与
,高温下能与 反应生成两种钙盐,其中之一为CaSiF6,该反应的化学方程式为
反应生成两种钙盐,其中之一为CaSiF6,该反应的化学方程式为 脱铁后的溶液中含有少量的
脱铁后的溶液中含有少量的  ,为减少锡的损失,可用锡、铜、铅、铁多元合金回收处理,反应的离子方程式为
,为减少锡的损失,可用锡、铜、铅、铁多元合金回收处理,反应的离子方程式为 已知
已知  可表示为:
可表示为: ,则
,则  也可用氧化物表示为:
也可用氧化物表示为: 脱硫后需过滤、洗涤再进入下一步工序,检验滤渣是否洗涤干净的方法是
脱硫后需过滤、洗涤再进入下一步工序,检验滤渣是否洗涤干净的方法是 若该冶炼废渣中锡的质量分数为
若该冶炼废渣中锡的质量分数为  ,30t 废渣制得精锡
,30t 废渣制得精锡  ,则锡的回收率为
,则锡的回收率为
您最近一年使用:0次
10 . 硝酸是一种重要的化工原料,用来制取一系列硝酸盐类氮肥,如硝酸铵、硝酸钾等;也用来制取含硝基的炸药等。试回答下列问题:
(1)某同学对铁与稀硝酸的反应进行探究,若HNO3只被还原成NO,则:
①写出铁与过量稀硝酸反应的离子方程式:__ 。
②写出过量铁与稀硝酸反应的离子方程式:__ 。
③若28g铁与含1.6mol硝酸的稀硝酸恰好完全反应,则生成的Fe3+和Fe2+的物质的量之比为__ 。上述反应结束后,向反应后的溶液中加足量氢氧化钠溶液,滤出沉淀洗涤后,在空气中灼烧至质量不变,最终得到的固体质量为__ g。
(2)饮用水中NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,可在碱性条件下用铝粉将NO3-还原为N2。
①配平方程式:__ Al+__ NO3-+__ OH-+__ =__ [Al(OH)4]-+__ N2↑。
②上述反应中,还原剂与还原产物的物质的量之比是__ ,反应中转移电子0.3mol,生成__ mL(标准状况下)N2。
(1)某同学对铁与稀硝酸的反应进行探究,若HNO3只被还原成NO,则:
①写出铁与过量稀硝酸反应的离子方程式:
②写出过量铁与稀硝酸反应的离子方程式:
③若28g铁与含1.6mol硝酸的稀硝酸恰好完全反应,则生成的Fe3+和Fe2+的物质的量之比为
(2)饮用水中NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,可在碱性条件下用铝粉将NO3-还原为N2。
①配平方程式:
②上述反应中,还原剂与还原产物的物质的量之比是
您最近一年使用:0次
2019-12-05更新
|
617次组卷
|
5卷引用:鲁科版必修一2019—2020学年第三章检测试题
鲁科版必修一2019—2020学年第三章检测试题云南省广南县二中2019-2020学年高一上学期期末考试化学试题云南省贡山县第三中学2017-2018学年高一上学期期末考试化学试题贵州省独山县第四中学2019-2020学年高一上学期期末考试化学试题(已下线)第三单元 物质的性质与转化(能力提升)-2020-2021学年高一化学必修第一册单元测试定心卷 (鲁科版2019)



