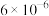名校
1 . 以红土镍矿(主要含有Fe2O3、FeO、NiO、SiO2等)为原料,获取净水剂黄钠铁矾[NaFe3(SO4)2(OH)6]和纳米镍粉的部分工艺流程如图:
已知:
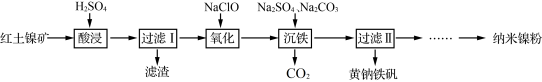
①Fe3+在pH约为3.7时可完全转化为Fe(OH)3,Fe2+在pH约为9时可完全转化为Fe(OH)2;
②SiO2为不溶于水的酸性氧化物,常温下和硫酸不反应,但可以溶于强碱溶液。
下列说法不正确的是

已知:
①Fe3+在pH约为3.7时可完全转化为Fe(OH)3,Fe2+在pH约为9时可完全转化为Fe(OH)2;
②SiO2为不溶于水的酸性氧化物,常温下和硫酸不反应,但可以溶于强碱溶液。
下列说法不正确的是
| A.“滤渣”的主要成分是SiO2 |
| B.为提高“酸浸”速率,可将稀硫酸更换为浓硫酸 |
| C.“氧化”过程发生的离子方程式为:2H++2Fe2++ClO-=2Fe3++Cl-+H2O |
| D.“沉铁”过程中加入碳酸钠的作用是调节溶液的酸碱度,应将pH控制在3.7~9 |
您最近一年使用:0次
2023-01-14更新
|
376次组卷
|
2卷引用:山东师范大学附属中学 2022-2023 学年高一上学期学科水平自我诊断化学试题
解题方法
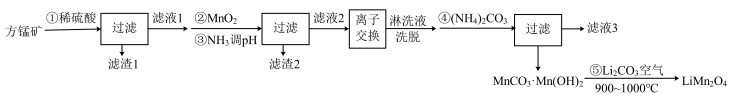
2 . 锰酸锂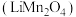 是一种锂电池的正极材料。工业上以方锰矿(主要成分为
是一种锂电池的正极材料。工业上以方锰矿(主要成分为 ,还含有少量的
,还含有少量的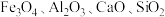 )为原料制备锰酸锂的流程如下:
)为原料制备锰酸锂的流程如下:
已知:I. 时,相关物质的
时,相关物质的 如下表:
如下表:
II. 时,
时, 电离常数
电离常数
III.离子浓度低于 时即为沉淀完全
时即为沉淀完全
回答下列问题:
(1)写出步骤①溶于稀硫酸时杂质 反应的离子方程式
反应的离子方程式___________ 。
(2)滤渣1的成分是_____ (填化学式);步骤②加入 的目的是
的目的是____ 。
(3)步骤③加入 目的是除去杂质离子,若溶液中
目的是除去杂质离子,若溶液中 浓度为
浓度为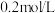 ,要确保杂质离子沉淀完全,同时不降低产品产率,步骤③调控
,要确保杂质离子沉淀完全,同时不降低产品产率,步骤③调控 的范围应该为
的范围应该为_______ 。反应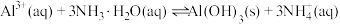 的平衡常数
的平衡常数
________ 。
(4)“离子交换”步骤和“洗脱”过程是利用反应: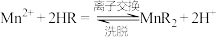 (
( 是氢型交换树脂)的平衡移动将
是氢型交换树脂)的平衡移动将 进一步提纯,为了提高洗脱效率,又不引入其他杂质,淋洗液应选用
进一步提纯,为了提高洗脱效率,又不引入其他杂质,淋洗液应选用_____ 。
(5)步骤④反应未见气体生成,则该反应留存在滤液3中的产物有___________ (填化学式)。
(6)步骤⑤反应的化学方程式为___________ 。
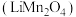 是一种锂电池的正极材料。工业上以方锰矿(主要成分为
是一种锂电池的正极材料。工业上以方锰矿(主要成分为 ,还含有少量的
,还含有少量的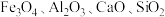 )为原料制备锰酸锂的流程如下:
)为原料制备锰酸锂的流程如下:
已知:I.
 时,相关物质的
时,相关物质的 如下表:
如下表:物质 |
|
|
|
|
|
|
|
|
|
|
|
 时,
时, 电离常数
电离常数
III.离子浓度低于
 时即为沉淀完全
时即为沉淀完全回答下列问题:
(1)写出步骤①溶于稀硫酸时杂质
 反应的离子方程式
反应的离子方程式(2)滤渣1的成分是
 的目的是
的目的是(3)步骤③加入
 目的是除去杂质离子,若溶液中
目的是除去杂质离子,若溶液中 浓度为
浓度为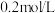 ,要确保杂质离子沉淀完全,同时不降低产品产率,步骤③调控
,要确保杂质离子沉淀完全,同时不降低产品产率,步骤③调控 的范围应该为
的范围应该为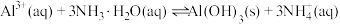 的平衡常数
的平衡常数
(4)“离子交换”步骤和“洗脱”过程是利用反应:
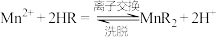 (
( 是氢型交换树脂)的平衡移动将
是氢型交换树脂)的平衡移动将 进一步提纯,为了提高洗脱效率,又不引入其他杂质,淋洗液应选用
进一步提纯,为了提高洗脱效率,又不引入其他杂质,淋洗液应选用(5)步骤④反应未见气体生成,则该反应留存在滤液3中的产物有
(6)步骤⑤反应的化学方程式为
您最近一年使用:0次
2023-01-13更新
|
1142次组卷
|
2卷引用:四川省绵阳市2023届高三第二次诊断性考试理科综合化学试题
名校
3 . 氯气可用于制取漂白剂和自来水消毒。
(1)下图是实验室制备氯气的制备和除杂装置
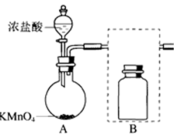
①A为氯气发生装置。A中反应方程式是_______ (锰被还原为 )。
)。
②将除杂装置B补充完整并标明所用试剂_______ 。
(2)“84”消毒液也可用于漂白,其工业制法是控制在常温条件下,将氯气通入NaOH溶液中,反应的离子方程式为_______ 。
(3)同学们探究“84”消毒液在不同pH下使红纸褪色的情况,做了如下实验:
步骤1:将5mL市售“84”消毒液稀释100倍,测得稀释后溶液的 ;
;
步骤2:将稀释后溶液各20mL分别加入3个洁净的小烧杯中;
步骤3:用 溶液将3个烧杯内溶液的pH分别调至10、7和4(溶液体积变化忽略不计)。
溶液将3个烧杯内溶液的pH分别调至10、7和4(溶液体积变化忽略不计)。
步骤4:在3个烧杯中分别放入大小相同的红纸,观察现象,记录如下:
已知,溶液中 、HClO和
、HClO和 物质的量分数
物质的量分数 随溶液pH变化的关系如下图所示:
随溶液pH变化的关系如下图所示:
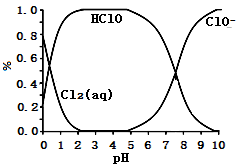
①由实验现象可得以下结论:溶液pH在4~10范围内,pH越大,红纸褪色_______ 。
②结合图像进行分析,b、c两烧杯中实验现象出现差异的原因是_______ 。
(4)由于氯气会与自来水中的有机物发生反应生成对人体有害的物质,人们尝试研究并使用新的自来水消毒剂,如 气体就是一种新型高效含氯消毒剂。
气体就是一种新型高效含氯消毒剂。
①一种制备 的方法是用
的方法是用 通入硫酸酸化的
通入硫酸酸化的 溶液中,反应的离子方程式为
溶液中,反应的离子方程式为_______ 。
②另一种制备 的方法是用
的方法是用 与盐酸反应,同时有
与盐酸反应,同时有 生成,产物中
生成,产物中 体积约占
体积约占 ,每生成
,每生成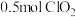 ,转移
,转移_______  。
。
③ 在杀菌消毒过程中会产生副产物亚氯酸盐
在杀菌消毒过程中会产生副产物亚氯酸盐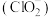 ,需将其转化为
,需将其转化为 除去。下列试剂中,可将
除去。下列试剂中,可将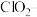 转化为
转化为 的是
的是_______ (填字母序号)。
a. b.
b. c.
c. d.KI
d.KI
(1)下图是实验室制备氯气的制备和除杂装置

①A为氯气发生装置。A中反应方程式是
 )。
)。②将除杂装置B补充完整并标明所用试剂
(2)“84”消毒液也可用于漂白,其工业制法是控制在常温条件下,将氯气通入NaOH溶液中,反应的离子方程式为
(3)同学们探究“84”消毒液在不同pH下使红纸褪色的情况,做了如下实验:
步骤1:将5mL市售“84”消毒液稀释100倍,测得稀释后溶液的
 ;
;步骤2:将稀释后溶液各20mL分别加入3个洁净的小烧杯中;
步骤3:用
 溶液将3个烧杯内溶液的pH分别调至10、7和4(溶液体积变化忽略不计)。
溶液将3个烧杯内溶液的pH分别调至10、7和4(溶液体积变化忽略不计)。步骤4:在3个烧杯中分别放入大小相同的红纸,观察现象,记录如下:
| 烧杯 | 溶液的pH | 现象 |
| a | 10 | 10min后,红纸基本不褪色;4h后红纸褪色 |
| b | 7 | 10min后,红纸颜色变浅;4h后红纸褪色 |
| c | 4 | 10min后,红纸颜色变得更浅;4h后红纸褪色 |
 、HClO和
、HClO和 物质的量分数
物质的量分数 随溶液pH变化的关系如下图所示:
随溶液pH变化的关系如下图所示:
①由实验现象可得以下结论:溶液pH在4~10范围内,pH越大,红纸褪色
②结合图像进行分析,b、c两烧杯中实验现象出现差异的原因是
(4)由于氯气会与自来水中的有机物发生反应生成对人体有害的物质,人们尝试研究并使用新的自来水消毒剂,如
 气体就是一种新型高效含氯消毒剂。
气体就是一种新型高效含氯消毒剂。①一种制备
 的方法是用
的方法是用 通入硫酸酸化的
通入硫酸酸化的 溶液中,反应的离子方程式为
溶液中,反应的离子方程式为②另一种制备
 的方法是用
的方法是用 与盐酸反应,同时有
与盐酸反应,同时有 生成,产物中
生成,产物中 体积约占
体积约占 ,每生成
,每生成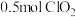 ,转移
,转移 。
。③
 在杀菌消毒过程中会产生副产物亚氯酸盐
在杀菌消毒过程中会产生副产物亚氯酸盐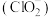 ,需将其转化为
,需将其转化为 除去。下列试剂中,可将
除去。下列试剂中,可将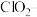 转化为
转化为 的是
的是a.
 b.
b. c.
c. d.KI
d.KI
您最近一年使用:0次
2023-01-07更新
|
450次组卷
|
2卷引用:北京市第八中学2022-2023学年高一上学期期末考试化学试题
名校
解题方法
4 . 红矾钠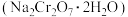 可用于制备制革产业中的铬鞣剂。对含铬污泥进行酸浸处理后,得到浸出液(主要含
可用于制备制革产业中的铬鞣剂。对含铬污泥进行酸浸处理后,得到浸出液(主要含 、
、 、
、 、
、 、
、 和
和 ),经过如下主要流程,可制得红矾钠,实现铬资源的有效循环利用。
),经过如下主要流程,可制得红矾钠,实现铬资源的有效循环利用。

已知:i. 溶液中存在以下平衡:
溶液中存在以下平衡:
ii.相关金属离子形成氢氧化物沉淀的pH范围如下:
(1)Ⅰ中, 溶液呈酸性,结合化学用语说明其原因:
溶液呈酸性,结合化学用语说明其原因:_______ 。
(2)Ⅱ中,加入NaOH调节pH至_______ (填字母序号)。
a.4.3~5.6 b.4.3~7.1 c.5.6~7.1 d.7.1~9.2
(3)Ⅲ中, 氧化
氧化 沉淀的化学方程式为
沉淀的化学方程式为_______ 。
(4)Ⅲ中,在投料比、反应时间均相同时,若温度过高, 的产率反而降低,可能的原因是
的产率反而降低,可能的原因是_______ 。
(5)Ⅳ中,加入 的作用是
的作用是_______ (结合平衡移动原理解释)。
(6)为了测定获得红矾钠( )的纯度,称取上述流程中的产品ag配成100mL溶液,取出25mL放于锥形瓶中,加入稀硫酸和足量的KI溶液,置于暗处充分反应至
)的纯度,称取上述流程中的产品ag配成100mL溶液,取出25mL放于锥形瓶中,加入稀硫酸和足量的KI溶液,置于暗处充分反应至 全部转化为
全部转化为 后,滴入2~3滴淀粉溶液,最后用浓度为
后,滴入2~3滴淀粉溶液,最后用浓度为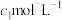 的
的 标准溶液滴定,共消耗
标准溶液滴定,共消耗 。(已知:
。(已知: 。)
。)
①滴定终点的现象为_______ 。
②所得 (摩尔质量为
(摩尔质量为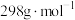 )的纯度的表达式为
)的纯度的表达式为_______ (用质量分数表示)。
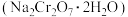 可用于制备制革产业中的铬鞣剂。对含铬污泥进行酸浸处理后,得到浸出液(主要含
可用于制备制革产业中的铬鞣剂。对含铬污泥进行酸浸处理后,得到浸出液(主要含 、
、 、
、 、
、 、
、 和
和 ),经过如下主要流程,可制得红矾钠,实现铬资源的有效循环利用。
),经过如下主要流程,可制得红矾钠,实现铬资源的有效循环利用。
已知:i.
 溶液中存在以下平衡:
溶液中存在以下平衡:
ii.相关金属离子形成氢氧化物沉淀的pH范围如下:
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
 | 4.3 | 5.6 |
 | 7.1 | 9.2 |
 溶液呈酸性,结合化学用语说明其原因:
溶液呈酸性,结合化学用语说明其原因:(2)Ⅱ中,加入NaOH调节pH至
a.4.3~5.6 b.4.3~7.1 c.5.6~7.1 d.7.1~9.2
(3)Ⅲ中,
 氧化
氧化 沉淀的化学方程式为
沉淀的化学方程式为(4)Ⅲ中,在投料比、反应时间均相同时,若温度过高,
 的产率反而降低,可能的原因是
的产率反而降低,可能的原因是(5)Ⅳ中,加入
 的作用是
的作用是(6)为了测定获得红矾钠(
 )的纯度,称取上述流程中的产品ag配成100mL溶液,取出25mL放于锥形瓶中,加入稀硫酸和足量的KI溶液,置于暗处充分反应至
)的纯度,称取上述流程中的产品ag配成100mL溶液,取出25mL放于锥形瓶中,加入稀硫酸和足量的KI溶液,置于暗处充分反应至 全部转化为
全部转化为 后,滴入2~3滴淀粉溶液,最后用浓度为
后,滴入2~3滴淀粉溶液,最后用浓度为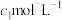 的
的 标准溶液滴定,共消耗
标准溶液滴定,共消耗 。(已知:
。(已知: 。)
。)①滴定终点的现象为
②所得
 (摩尔质量为
(摩尔质量为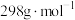 )的纯度的表达式为
)的纯度的表达式为
您最近一年使用:0次
2023-01-06更新
|
939次组卷
|
9卷引用:北京海淀区2022-2023学年高二上学期期末考试化学试题
北京海淀区2022-2023学年高二上学期期末考试化学试题北京一零一中学2022-2023高二上学期期末考试化学试题北京市首都师范大学附属中学2022-2023学年高二上学期期末考试化学试题福建师范大学附属中学2022-2023学年高二下学期开学考试(期末考)化学试卷北京市顺义牛栏山第一中学2023-2024学年高二上学期期中考试化学试题北京市第三十五中学2023-2024学年高二上学期期中考试化学试题 北京市第十一中学2022-2023学年高二上学期期末考试化学试题北京一七一中学2023-2024学年高二上学期12月阶段性诊断化学试题北京交通大学附属中学第二分校2023-2024学年高二上学期12月月考化学试题
名校
5 . 向100mL
 溶液中逐渐通入
溶液中逐渐通入 ,其中
,其中 、
、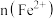 、
、 随通入
随通入 的物质的量
的物质的量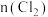 变化如图所示,下列说法错误的是
变化如图所示,下列说法错误的是

 溶液中逐渐通入
溶液中逐渐通入 ,其中
,其中 、
、 、
、 随通入
随通入 的物质的量
的物质的量 变化如图所示,下列说法错误的是
变化如图所示,下列说法错误的是
A.②代表 ,③代表 ,③代表 |
B.还原性强弱: |
C. 时,溶液中 时,溶液中 |
D.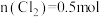 时,总的离子方程式为: 时,总的离子方程式为: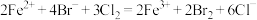 |
您最近一年使用:0次
2023-01-04更新
|
402次组卷
|
2卷引用:湖北省荆州市八县市2022-2023学年高一上学期期末联考化学试题
名校
解题方法
6 . 为保证家中所用器具与居住环境的洁净卫生,往往需使用各种各样的消毒剂,其中含氯消毒剂是目前广泛使用的一类消毒剂。
(1)用下列两种方法制取氯气:①用含有146 g HCl的浓盐酸与足量的 反应;②用87 g
反应;②用87 g  与足量的浓盐酸反应,所得氯气_______(填标号)。
与足量的浓盐酸反应,所得氯气_______(填标号)。
(2)氯气通入淀粉-KI溶液后可观察到溶液变蓝,可得氧化性:
_______ (填“>”或“<”) ,已知氧化性
,已知氧化性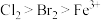 ,若将71g
,若将71g 通入含1 mol
通入含1 mol  的溶液中,写出反应的离子方程式:
的溶液中,写出反应的离子方程式:_______ 。
(3) 是新型消毒剂,已知在酸性条件下
是新型消毒剂,已知在酸性条件下 可发生反应生成NaCl并释放出
可发生反应生成NaCl并释放出 ,该反应的离子方程式为
,该反应的离子方程式为_______ 。NaOH溶液吸收 ,生成物质的量之比为1:1的两种盐,其中一种为
,生成物质的量之比为1:1的两种盐,其中一种为 ,写出该反应的离子方程式:
,写出该反应的离子方程式:_______ 。
(4)漂白粉的有效成分为_______ (填化学式,下同),露置于空气中一段时间的漂白粉,加稀盐酸后产生的气体除了可能有 和HCl外,还可能含有
和HCl外,还可能含有_______ 。在制备漂白粉的过程中,若温度控制不当,易生成 ,若向
,若向 溶液中通入一定量的
溶液中通入一定量的 ,制得的混合物中
,制得的混合物中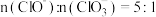 ,则反应中被氧化和被还原的Cl的物质的量之比为
,则反应中被氧化和被还原的Cl的物质的量之比为_______ 。
(1)用下列两种方法制取氯气:①用含有146 g HCl的浓盐酸与足量的
 反应;②用87 g
反应;②用87 g  与足量的浓盐酸反应,所得氯气_______(填标号)。
与足量的浓盐酸反应,所得氯气_______(填标号)。| A.②比①多 | B.①比②多 | C.一样多 | D.无法比较 |

 ,已知氧化性
,已知氧化性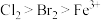 ,若将71g
,若将71g 通入含1 mol
通入含1 mol  的溶液中,写出反应的离子方程式:
的溶液中,写出反应的离子方程式:(3)
 是新型消毒剂,已知在酸性条件下
是新型消毒剂,已知在酸性条件下 可发生反应生成NaCl并释放出
可发生反应生成NaCl并释放出 ,该反应的离子方程式为
,该反应的离子方程式为 ,生成物质的量之比为1:1的两种盐,其中一种为
,生成物质的量之比为1:1的两种盐,其中一种为 ,写出该反应的离子方程式:
,写出该反应的离子方程式:(4)漂白粉的有效成分为
 和HCl外,还可能含有
和HCl外,还可能含有 ,若向
,若向 溶液中通入一定量的
溶液中通入一定量的 ,制得的混合物中
,制得的混合物中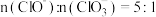 ,则反应中被氧化和被还原的Cl的物质的量之比为
,则反应中被氧化和被还原的Cl的物质的量之比为
您最近一年使用:0次
2022-11-29更新
|
269次组卷
|
3卷引用:河北省保定市唐县第一中学2022-2023学年高一上学期第三次考试化学试题
解题方法
7 . 氯化亚铜(CuCl)是常用的催化剂。以低品位铜矿(主要成分为CuS、 和铁的氧化物等)为原料制备CuCl步骤如下:
和铁的氧化物等)为原料制备CuCl步骤如下:
(1)“氧化浸取”。铜元素全部转化为 ,铁元素全部转化为
,铁元素全部转化为 。
。
① 、
、 和硫酸反应生成
和硫酸反应生成 、
、 和S,其化学方程式为
和S,其化学方程式为_______ 。
②为提高铜元素的浸出率,工艺上可采取的措施有_______ (填字母)。
A.将铜矿粉碎并搅拌 B.增加铜矿的投料量
C.适当提高硫酸浓度 D.适当缩短反应时间
(2)“除铁锰”。依次用氨水沉铁、用氨水- 混合溶液沉锰。
混合溶液沉锰。
①用氨水调节溶液的pH为3时, 为
为_______  。{室温下,
。{室温下,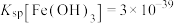 }
}
②向除铁后的溶液中滴加氨水- 混合溶液,反应生成
混合溶液,反应生成 的离子方程式为
的离子方程式为_______ 。
(3)“还原”。 溶液、NaCl溶液和
溶液、NaCl溶液和 溶液反应生成CuCl沉淀。
溶液反应生成CuCl沉淀。
已知:CuCl易被 氧化,易与
氧化,易与 形成可溶的
形成可溶的 。
。
①反应生成CuCl的离子方程式为_______ 。
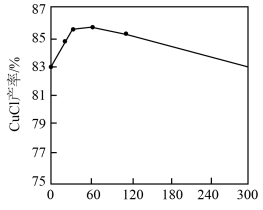
②如图所示,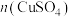 和其他条件相同时,CuCl产率随
和其他条件相同时,CuCl产率随 增大先升高后降低的原因是
增大先升高后降低的原因是_______ 。_______ 。
 和铁的氧化物等)为原料制备CuCl步骤如下:
和铁的氧化物等)为原料制备CuCl步骤如下:(1)“氧化浸取”。铜元素全部转化为
 ,铁元素全部转化为
,铁元素全部转化为 。
。①
 、
、 和硫酸反应生成
和硫酸反应生成 、
、 和S,其化学方程式为
和S,其化学方程式为②为提高铜元素的浸出率,工艺上可采取的措施有
A.将铜矿粉碎并搅拌 B.增加铜矿的投料量
C.适当提高硫酸浓度 D.适当缩短反应时间
(2)“除铁锰”。依次用氨水沉铁、用氨水-
 混合溶液沉锰。
混合溶液沉锰。①用氨水调节溶液的pH为3时,
 为
为 。{室温下,
。{室温下,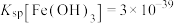 }
}②向除铁后的溶液中滴加氨水-
 混合溶液,反应生成
混合溶液,反应生成 的离子方程式为
的离子方程式为(3)“还原”。
 溶液、NaCl溶液和
溶液、NaCl溶液和 溶液反应生成CuCl沉淀。
溶液反应生成CuCl沉淀。已知:CuCl易被
 氧化,易与
氧化,易与 形成可溶的
形成可溶的 。
。①反应生成CuCl的离子方程式为
②如图所示,
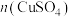 和其他条件相同时,CuCl产率随
和其他条件相同时,CuCl产率随 增大先升高后降低的原因是
增大先升高后降低的原因是
您最近一年使用:0次
解题方法
8 . 氨氮已成为环境的主要污染物并引起了社会各界的关注,氨氮在水体中以 (pH>11)和
(pH>11)和 (pH<7)两种形式存在,开发经济、高效的除氛技术成为水污染治理的重点和热点。回答下列问题:
(pH<7)两种形式存在,开发经济、高效的除氛技术成为水污染治理的重点和热点。回答下列问题:
(1)生物脱氮法
通常包括生物硝化和生物反硝化两个阶段,反应流程如下:_______ 。
②反硝化阶段,在缺氧条件下,反硝化菌与有机碳源(醇、有机酸等)使 转化为
转化为 ,从而消除污染,则有机碳源的作用是
,从而消除污染,则有机碳源的作用是_______ 。
(2)汽提法
当废水中pH较高时(氨氮以 分子存在),利用水蒸气将其从水中吹出,消除污染。该操作一般在吹脱塔中进行,废水从吹脱塔的塔顶往下流,水蒸气从下面鼓入。用水蒸气吹出
分子存在),利用水蒸气将其从水中吹出,消除污染。该操作一般在吹脱塔中进行,废水从吹脱塔的塔顶往下流,水蒸气从下面鼓入。用水蒸气吹出 的原理是
的原理是_______ ;吹脱塔中进料方式的优点为_______ 。
(3)光催化降解法(最先进的方法)
该方法是指利用 作催化剂,在其获得能量后,释放出光电子(
作催化剂,在其获得能量后,释放出光电子( )和形成空穴(
)和形成空穴( ),空穴(
),空穴( )与
)与 产生活性很强的羟基自由基(·OH),将
产生活性很强的羟基自由基(·OH),将 转化为
转化为 ,光电子(
,光电子( )再将
)再将 转化为
转化为 。反应机理用方程式简单表示如下:
。反应机理用方程式简单表示如下:
Ⅰ.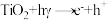
Ⅱ. _______
_______
Ⅲ.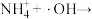
Ⅳ.
①反应机理“Ⅱ”空格中物质的化学式为_______ 。
②反应机理“Ⅲ、Ⅳ”中的离子方程式分别为_______ 、_______ 。
 (pH>11)和
(pH>11)和 (pH<7)两种形式存在,开发经济、高效的除氛技术成为水污染治理的重点和热点。回答下列问题:
(pH<7)两种形式存在,开发经济、高效的除氛技术成为水污染治理的重点和热点。回答下列问题:(1)生物脱氮法
通常包括生物硝化和生物反硝化两个阶段,反应流程如下:

②反硝化阶段,在缺氧条件下,反硝化菌与有机碳源(醇、有机酸等)使
 转化为
转化为 ,从而消除污染,则有机碳源的作用是
,从而消除污染,则有机碳源的作用是(2)汽提法
当废水中pH较高时(氨氮以
 分子存在),利用水蒸气将其从水中吹出,消除污染。该操作一般在吹脱塔中进行,废水从吹脱塔的塔顶往下流,水蒸气从下面鼓入。用水蒸气吹出
分子存在),利用水蒸气将其从水中吹出,消除污染。该操作一般在吹脱塔中进行,废水从吹脱塔的塔顶往下流,水蒸气从下面鼓入。用水蒸气吹出 的原理是
的原理是(3)光催化降解法(最先进的方法)
该方法是指利用
 作催化剂,在其获得能量后,释放出光电子(
作催化剂,在其获得能量后,释放出光电子( )和形成空穴(
)和形成空穴( ),空穴(
),空穴( )与
)与 产生活性很强的羟基自由基(·OH),将
产生活性很强的羟基自由基(·OH),将 转化为
转化为 ,光电子(
,光电子( )再将
)再将 转化为
转化为 。反应机理用方程式简单表示如下:
。反应机理用方程式简单表示如下:Ⅰ.
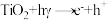
Ⅱ.
 _______
_______Ⅲ.
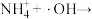
Ⅳ.

①反应机理“Ⅱ”空格中物质的化学式为
②反应机理“Ⅲ、Ⅳ”中的离子方程式分别为
您最近一年使用:0次
2022-09-29更新
|
530次组卷
|
6卷引用:河南省豫北名校普高联考2022-2023学年上学期高三测评(一)化学试题
河南省豫北名校普高联考2022-2023学年上学期高三测评(一)化学试题河南省重点高中2023届高三上学期9月联合考试化学试题(已下线)江苏省南京市、盐城市2021-2022学年高三第一次模拟考试(原理综合题)(已下线)江苏省南京市、盐城市2021-2022学年高三第一次模拟考试(反应原理-氧化还原反应)(已下线)江苏省南京市、盐城市2021-2022学年高三第一次模拟考试(原理综合题)江苏省徐州市睢宁县第一中学2023-2024学年高一下学期5月月考化学试卷
9 . 以废锌电池预处理物(主要成分为ZnO,另含少量 、CuO、
、CuO、 、MnO等)为原料可生产草酸锌晶体(
、MnO等)为原料可生产草酸锌晶体(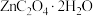 )、生产流程如下图所示。
)、生产流程如下图所示。 分别为
分别为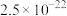 、
、 。
。
回答下列问题:
(1)“酸浸”后所得“滤渣A”的主要成分为_______ 。
(2)“除锰”时,反应的离子方程式为_______ 。
(3)“除铁”时,加入ZnO的目的是_______ 。
(4)“除铜”后要求溶液中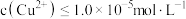 ,若溶液中
,若溶液中 浓度为
浓度为 ,试计算说明溶液能否达到要求:
,试计算说明溶液能否达到要求:_______ (要求写出计算过程)。
(5)“沉淀”后,需经过滤、洗涤、干燥系列操作分离出草酸锌晶体,检验沉淀是否洗净的操作为_______ 。
(6)在通风橱中,将草酸锌晶体置于陶瓷仪器_______ (填仪器名称)中加热分解可制得ZnO。已知一种ZnO晶体晶胞结构如下图所示,晶体密度为 ,NA表示阿伏加德罗常数的值,则该晶体中与
,NA表示阿伏加德罗常数的值,则该晶体中与 等距离且最近的
等距离且最近的 共有
共有_______ 个,相邻两个 之间的距离为
之间的距离为_______ nm。
 、CuO、
、CuO、 、MnO等)为原料可生产草酸锌晶体(
、MnO等)为原料可生产草酸锌晶体(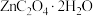 )、生产流程如下图所示。
)、生产流程如下图所示。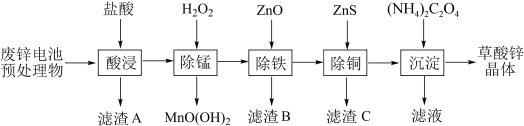
 分别为
分别为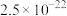 、
、 。
。回答下列问题:
(1)“酸浸”后所得“滤渣A”的主要成分为
(2)“除锰”时,反应的离子方程式为
(3)“除铁”时,加入ZnO的目的是
(4)“除铜”后要求溶液中
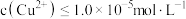 ,若溶液中
,若溶液中 浓度为
浓度为 ,试计算说明溶液能否达到要求:
,试计算说明溶液能否达到要求:(5)“沉淀”后,需经过滤、洗涤、干燥系列操作分离出草酸锌晶体,检验沉淀是否洗净的操作为
(6)在通风橱中,将草酸锌晶体置于陶瓷仪器
 ,NA表示阿伏加德罗常数的值,则该晶体中与
,NA表示阿伏加德罗常数的值,则该晶体中与 等距离且最近的
等距离且最近的 共有
共有 之间的距离为
之间的距离为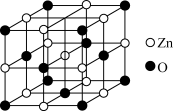
您最近一年使用:0次
2022-04-29更新
|
482次组卷
|
4卷引用:湖北省武汉市2022届高三下学期4月调研考试化学试题
名校
10 . 铁与不同密度硝酸溶液反应时,还原产物百分比与硝酸密度的关系如图所示,下列说法错误的是
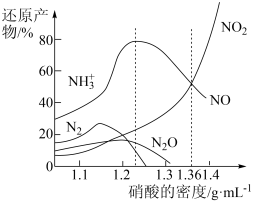
| A.其他条件相同,铁与足量密度为1.23g/mL的硝酸反应,还原产物主要为NO |
| B.一定量的铁粉与足量密度为1.36g/mL的HNO3反应,得到气体2.24L(标准状况),则参加反应的硝酸的物质的量为0.3mol |
| C.足量铁与一定量密度为1.36g/mL的硝酸反应,反应的化学方程式始终为:2Fe+6HNO3=2Fe(NO3)2+NO↑+NO2↑+3H2O |
| D.硝酸的密度越大,其还原产物中高价态的成分所占比例越多 |
您最近一年使用:0次
2022-04-21更新
|
1078次组卷
|
7卷引用:湖北省武汉市部分重点中学2021-2022学年高一下学期期中联考化学试题