名校
1 . 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法不正确的是( )


| A.反应中转移电子的物质的量是0.21mol |
| B.一定有3. 36L氯气参加反应 |
| C.苛性钾溶液中KOH的质量是16.8g |
D.ClO 的生成可能是由于温度升高引起的 的生成可能是由于温度升高引起的 |
您最近一年使用:0次
2017-10-28更新
|
1014次组卷
|
8卷引用:2017届山东省莱州一中高三上第一次质检化学试卷
2017届山东省莱州一中高三上第一次质检化学试卷2018届高三一轮复习化学:微考点26-氯水和常见漂白剂性质探究辽宁省实验中学分校2018届高三10月月考化学试题广东省珠海市珠海二中、斗门一中2018届高三上学期期中联考化学试题(已下线)2019年8月18日 《每日一题》 (一轮复习) 每周一测辽宁省大连海湾高级中学2019-2020学年高三上学期期中考试化学试题(已下线)第02章 海水中的重要元素——钠和氯(B卷能力提高篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)上海市吴淞中学2022-2023学年高一上学期期末学科指标评估化学试题
真题
名校
2 . 绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:______________ 、_______________ 。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。

①仪器B的名称是____________________ 。
②将下列实验操作步骤正确排序___________________ (填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目x=________________ (列式表示)。若实验时按a、d次序操作,则使x__________ (填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
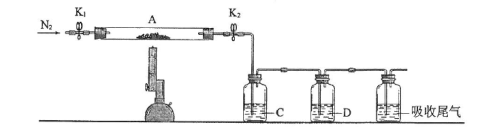
①C、D中的溶液依次为_________ (填标号)。C、D中有气泡冒出,并可观察到的现象分别为_______________ 。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式_____________________ 。
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。

①仪器B的名称是
②将下列实验操作步骤正确排序
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目x=
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。

①C、D中的溶液依次为
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式
您最近一年使用:0次
2017-08-08更新
|
9214次组卷
|
30卷引用:2017年全国普通高等学校招生统一考试理综化学(新课标Ⅲ卷精编版)
2017年全国普通高等学校招生统一考试理综化学(新课标Ⅲ卷精编版)安徽省六安市第一中学2017-2018学年高二上学期开学考试化学试题四川省双流中学2017-2018学年高二上学期开学考试化学试题江西省上高二中2018届高三上学期第三次月考化学试题(已下线)《考前20天终极攻略》-5月27日 综合实验设计、探究和评价(已下线)解密18 物质的制备、实验方案的设计与评价——备战2018年高考化学之高频考点解密百所名校联考-金属及其化合物吉林省延边市第二中学2020届高三入学考试化学试题安徽省黄山市屯溪第一中学2019-2020学年高二上学期入学摸底考试化学试题2020届高考化学二轮复习大题精准训练——定量分析化学实验中物质含量的测定2020届高考化学二轮复习大题精准训练——化学实验方案的设计及评价河北省衡水中学2020届高三四月份质量监测理综化学试题湖南省长沙市长郡中学2020届高三4月份教学质量监测理综化学试题(已下线)广东省深圳中学2020届高三3月份教学质量监测卷理综化学试题河北省石家庄市第二中学2020届高中毕业班二月份网络教学质量监测卷理科综合化学部分河南省郑州市第一中学2020年高中毕业班教学质量监测卷理科综合化学试题2020届湖南省长沙市礼雅中学高中毕业班四月份网络教学质量监测卷理科综合化学部分贵州省贵阳市第一中学2020届高三教学质量监测理科综合化学试题湖南省长沙市雅礼中学2020届高三5月高考化学模拟试卷(已下线)专题讲座(三)“铁三角”综合实验题解题策略(精讲)——2021年高考化学一轮复习讲练测山东济南市历城第二中学2020-2021学年高二上学期开学考试化学试题高一必修第一册(鲁科2019)第3章 第2节 硫的转化 高考帮福建省福州市第二中学2021届高三上学期第一次月考化学试题(人教版2019)必修第二册 第五章 化工生产中的重要非金属元素 第一节 硫及其化合物云南省保山第九中学2021届高三上学期开学考试化学试题云南省玉溪师范学院附属中学2021-2022学年高三 上学期期末考试化学试题(已下线)【教材实验热点】04 Fe(OH)2与Fe(OH)3胶体的制备云南省普洱市第一中学2021-2022学年高三下学期3月份考试理综化学试题(已下线)专题26 定量测定类综合性实验题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)题型31 Fe2+、Fe3+的检验与性质探究
名校
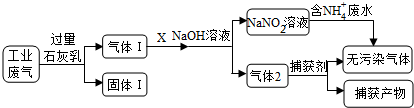
3 . 为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
(1)固体I中主要成分为__________ ,捕获剂所捕获的气体主要是_________ 。
(2)处理含NH4+废水时,发生反应的离子方程式为___________ 。
(3)若X为适量空气,严格控制空气用量的原因是____________ 。
(4)工业废气中的SO2、NO还可采用NaClO2溶液作为吸收剂进行净化,在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323K,NaClO2溶液浓度为5×10-3mol·L-1。反应一段时间后溶液中离子浓度的分析结果如下表:
①写出NaClO2溶液脱硝过程中主要反应的离子方程式_________________ 。增加压强,NO的转化率__________ (填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐__________ (填“增大”、“不变”或“减小”)。
③如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是_______________ 。
(1)固体I中主要成分为
(2)处理含NH4+废水时,发生反应的离子方程式为
(3)若X为适量空气,严格控制空气用量的原因是
(4)工业废气中的SO2、NO还可采用NaClO2溶液作为吸收剂进行净化,在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323K,NaClO2溶液浓度为5×10-3mol·L-1。反应一段时间后溶液中离子浓度的分析结果如下表:
离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
c(mol·L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式
②随着吸收反应的进行,吸收剂溶液的pH逐渐
③如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是
您最近一年使用:0次
2017-03-19更新
|
484次组卷
|
2卷引用:2017届吉林省长白山市高三第二次模拟考试理综化学试卷
名校
解题方法
4 . 利用硫铁矿(主要成分FeS2)生产硫酸和绿矾(FeSO4·7H2O)的工业流程示意图如下:
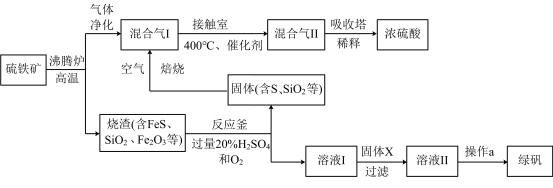
(1)沸腾炉中,硫铁矿进行粉碎处理的目的是______________ 。
(2)接触室中,发生的主要反应是SO2与O2的反应,其化学方程式是________________ 。
(3)反应釜中,烧渣经过反应转化为溶液I和固体。
① 烧渣中的FeS在反应中做_______________ 剂(填“氧化”或“还原”)。
② 溶液I中所含溶质的化学式是_____________ 。
(4)操作a的主要步骤是:加热浓缩、______________ 、过滤洗涤。
(5)流程中,固体X可以选择硫铁矿(FeS2)或_______________ ;当固体X为硫铁矿(FeS2)时,将溶液I与固体X发生反应的离子方程式补充完整:
FeS2+
______ +
______ === Fe2++
Fe2++ SO42-+
SO42-+
_______

(1)沸腾炉中,硫铁矿进行粉碎处理的目的是
(2)接触室中,发生的主要反应是SO2与O2的反应,其化学方程式是
(3)反应釜中,烧渣经过反应转化为溶液I和固体。
① 烧渣中的FeS在反应中做
② 溶液I中所含溶质的化学式是
(4)操作a的主要步骤是:加热浓缩、
(5)流程中,固体X可以选择硫铁矿(FeS2)或
FeS2+


 Fe2++
Fe2++ SO42-+
SO42-+
您最近一年使用:0次
2016-12-09更新
|
922次组卷
|
7卷引用:2017届北京市海淀区高三上学期期中化学试卷
2017届北京市海淀区高三上学期期中化学试卷辽宁省沈阳市2019-2020 学年高二下学期期末联考化学试题(已下线)5.1.3 不同价态含硫物质的转化(能力提升)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)北京市中央民族大学附属中学2022届高三9月月考化学试题山西省长治市第二中学校2021-2022学年高一下学期第一次月考化学试题河北省承德市围场满族蒙古族自治县卉原中学2022-2023学年高一上学期期末网考化学试题云南省宣威市第三中学2022-2023学年高一下学期第三次月考化学试题
解题方法
5 . 大气污染问题日益引起全民关注.
(1)PM2.5是指大气中直径小于或等于2.5μm(1μm=103nm)的颗粒物.下列说法不正确的是______ (填字母序号)。
a.PM2.5主要来源于火力发电、工业生产、汽车尾气排放等过程
b.PM2.5颗粒小,所以对人体无害
c.直径介于1~2.5μm的颗粒物分散到空气中可形成胶体
d.推广使用电动汽车,可以减少PM2.5的污染
(2)某地科研工作者用五年时间研究出利用石灰乳除工业燃煤尾气中的硫(SO2、SO3)和氮(NO、NO2)的新工艺,既能净化尾气,又能获得应用广泛的CaSO4和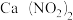
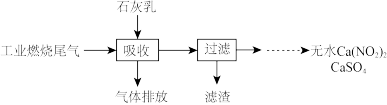
①硫酸型酸雨的形成过程是大气中的SO2溶于雨水生成某种弱酸,在空气中经催化氧化生成硫酸,该过程中反应的化学方程式为___________ 、__________ .
②CaSO4可以调节水泥的硬化时间.尾气中2molSO2被石灰乳逐渐吸收最终生成了1molCaSO4,该过程中转移的电子数目为___________ 。
③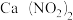 可制成混凝土防冻剂、钢筋阻锈剂等。尾气中NO、NO2与石灰乳反应生成
可制成混凝土防冻剂、钢筋阻锈剂等。尾气中NO、NO2与石灰乳反应生成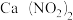 的化学方程式
的化学方程式_________________ .
(3)人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注。
工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下:
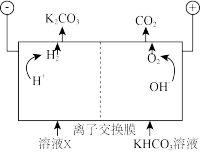
①在阳极区发生的反应包括___________ 和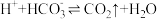 。
。
②简述 在阴极区再生的原理
在阴极区再生的原理___________ 。
③再生装置中产生的CO2和H2在一定条件下反应生成甲醇,工业上利用该反应合成甲醇。
已知:25℃,101KPa下:
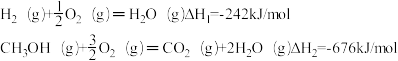
写出CO2和H2生成气态甲醇等产物的热化学方程式____________ .
(1)PM2.5是指大气中直径小于或等于2.5μm(1μm=103nm)的颗粒物.下列说法不正确的是
a.PM2.5主要来源于火力发电、工业生产、汽车尾气排放等过程
b.PM2.5颗粒小,所以对人体无害
c.直径介于1~2.5μm的颗粒物分散到空气中可形成胶体
d.推广使用电动汽车,可以减少PM2.5的污染
(2)某地科研工作者用五年时间研究出利用石灰乳除工业燃煤尾气中的硫(SO2、SO3)和氮(NO、NO2)的新工艺,既能净化尾气,又能获得应用广泛的CaSO4和
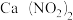

①硫酸型酸雨的形成过程是大气中的SO2溶于雨水生成某种弱酸,在空气中经催化氧化生成硫酸,该过程中反应的化学方程式为
②CaSO4可以调节水泥的硬化时间.尾气中2molSO2被石灰乳逐渐吸收最终生成了1molCaSO4,该过程中转移的电子数目为
③
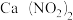 可制成混凝土防冻剂、钢筋阻锈剂等。尾气中NO、NO2与石灰乳反应生成
可制成混凝土防冻剂、钢筋阻锈剂等。尾气中NO、NO2与石灰乳反应生成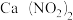 的化学方程式
的化学方程式(3)人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注。
工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下:

①在阳极区发生的反应包括
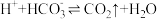 。
。②简述
 在阴极区再生的原理
在阴极区再生的原理③再生装置中产生的CO2和H2在一定条件下反应生成甲醇,工业上利用该反应合成甲醇。
已知:25℃,101KPa下:
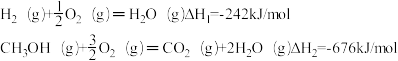
写出CO2和H2生成气态甲醇等产物的热化学方程式
您最近一年使用:0次
2016-12-09更新
|
847次组卷
|
4卷引用:2017届河北省石家庄二中高三上第二期联考化学试卷
13-14高一上·广西柳州·期末
名校
解题方法
6 . 请回答下列问题
(1)向H2O2溶液中滴加FeCl3溶液,可发生下列反应:H2O2+2Fe3+=2Fe2++ O2↑+2H+, H2O2+ 2Fe2++2H+=2Fe3++ 2H2O 。在以上反应中Fe3+实际上起着___________ 作用,总反应式为___________ 。
(2)I2与Fe3+一样也可以发生上述类似反应,类比(1)在下面填入合适的化学反应方程式:H2O2+I2=2HIO,___________ 。总反应式为___________ 。
(3)在硫酸和KI的混合溶液中加入足量的H2O2,放出大量的无色气体,溶液呈棕色,并可使淀粉变蓝色。该反应的离子方程式为:___________ 。
(4)高铁酸钠(Na2FeO4)可作为一种新型净水剂,在反应中Na2FeO4被还原为Fe3+离子,请简述高铁酸钠之所以能净水,除了具有强氧化性,能消毒杀菌外,另一原因是___________ 。
(5)高铁酸钠的制备常用氧化铁在碱性溶液中与硝酸钠反应制得:Fe2O3 + NaNO3 + NaOH → Na2FeO4 + NaNO2 + H2O,配平化学方程式,并标出电子转移的方向和数目___________ 。
(1)向H2O2溶液中滴加FeCl3溶液,可发生下列反应:H2O2+2Fe3+=2Fe2++ O2↑+2H+, H2O2+ 2Fe2++2H+=2Fe3++ 2H2O 。在以上反应中Fe3+实际上起着
(2)I2与Fe3+一样也可以发生上述类似反应,类比(1)在下面填入合适的化学反应方程式:H2O2+I2=2HIO,
(3)在硫酸和KI的混合溶液中加入足量的H2O2,放出大量的无色气体,溶液呈棕色,并可使淀粉变蓝色。该反应的离子方程式为:
(4)高铁酸钠(Na2FeO4)可作为一种新型净水剂,在反应中Na2FeO4被还原为Fe3+离子,请简述高铁酸钠之所以能净水,除了具有强氧化性,能消毒杀菌外,另一原因是
(5)高铁酸钠的制备常用氧化铁在碱性溶液中与硝酸钠反应制得:Fe2O3 + NaNO3 + NaOH → Na2FeO4 + NaNO2 + H2O,配平化学方程式,并标出电子转移的方向和数目
您最近一年使用:0次
11-12高三上·河北唐山·期中
名校
解题方法
7 . 前一时期“非典型肺炎”在我国部分地区流行,严重危害广大人民的身体健康,做好环境消毒是预防“非典型肺炎”的重要措施,常用的消毒剂是ClO2或Cl2等的稀溶液,其中ClO2溶液的消毒效果较好。已知ClO2常温下呈气态,其分子构型与水分子的分子构型相似,在自然环境中ClO2最终变为Cl-。下列有关说法中正确的是
| A.ClO2的分子结构呈V形,属非极性分子 |
| B.ClO2中氯元素显+4价,具有很强的氧化性,其消毒效率(以单位体积得电子的数目表示)是Cl2的5倍 |
| C.ClO2、Cl2的稀溶液用于环境消毒,具有广谱高效的特点,对人畜无任何危害 |
| D.常用Na2SO3在H2SO4的酸性条件下,还原NaClO3来制ClO2,这一反应的化学方程式可表示为Na2SO3+2NaClO3+H2SO4=2Na2SO4+2ClO2↑+H2O |
您最近一年使用:0次
2016-12-09更新
|
1117次组卷
|
4卷引用:2012届河北省唐山一中高三上学期期中考试化学试卷
(已下线)2012届河北省唐山一中高三上学期期中考试化学试卷宁夏吴忠市高二人教版选修3第2章 分子结构与性质综合练习2云南省西双版纳州民族中学2017-2018学年高二6月份考试化学试题贵州省普定县一中2018-2019学年高二上学期期中考试化学试题



