三氯氧磷(POCl3)广泛用于农药、医药等生产。工业制备三氯氧磷的过程中会产生副产品亚磷酸(H3PO3)。回答下列问题:
(1)三氯氧磷可由三氯化磷、水、氯气加热反应生成,反应的化学方程式为_______
(2)已知亚磷酸(H3PO3)为二元弱酸,则Na2HPO3溶液中,各离子浓度的大小关系为_______
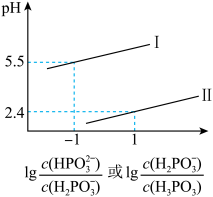
(3)常温下,将NaOH溶液滴加到亚磷酸(H3PO3)溶液中,混合溶液的pH与离子浓度变化的关系如图所示,则表示lg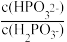 的是曲线
的是曲线_____ (填“Ⅰ”或“Ⅱ”),亚磷酸(H3PO3)的Ka1=_____ ,反应HPO32-+H2O H2PO3-+OH-的平衡常数的值是
H2PO3-+OH-的平衡常数的值是_____ 。
(4)工业上生产三氯氧磷的同时会产生含磷废水(主要成分为H3PO4、H3PO3)。向废水中先加入适量漂白粉,再加入生石灰调节pH,将磷元素转化为磷酸的钙盐沉淀并回收。若处理后的废水中c(Ca2+)=5×10-6 mol·L-1,则溶液中c(PO43-)=_____ mol·L-1。(已知Ksp[Ca3(PO4)2]=2×10-29)
(1)三氯氧磷可由三氯化磷、水、氯气加热反应生成,反应的化学方程式为
(2)已知亚磷酸(H3PO3)为二元弱酸,则Na2HPO3溶液中,各离子浓度的大小关系为
(3)常温下,将NaOH溶液滴加到亚磷酸(H3PO3)溶液中,混合溶液的pH与离子浓度变化的关系如图所示,则表示lg
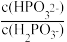 的是曲线
的是曲线 H2PO3-+OH-的平衡常数的值是
H2PO3-+OH-的平衡常数的值是
(4)工业上生产三氯氧磷的同时会产生含磷废水(主要成分为H3PO4、H3PO3)。向废水中先加入适量漂白粉,再加入生石灰调节pH,将磷元素转化为磷酸的钙盐沉淀并回收。若处理后的废水中c(Ca2+)=5×10-6 mol·L-1,则溶液中c(PO43-)=

更新时间:2020-04-03 10:16:28
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐1】高氯酸铵是一种常见的强氧化剂,常用作火箭发射的推进剂。根据下列信息回答问题:
已知:①高氯酸铵受热分解为N2、Cl2、O2和H2O;②Mg3N2易水解;③Cu与N2在酒精灯加热条件下不反应。
(1)写出高氯酸铵受热分解的化学反应方程式:_____________ ,Mg3N2的电子式为________ 。
(2)现有23.5g NH4ClO4分解,用下列装置设计实验,验证其分解产物并计算分解率。(注:①装置中空气已除尽;②装置可重复使用;③B~F装置中的试剂均过量且能与相应物质反应完全。)

①用E装置质量的增加来验证生成的气体产物之一,则E中盛放的试剂是:_______ 。
②请按气流由左至右的方向连接装置:A →E→D →B→______ →_____ →_______ →E (选择B~F装置,并用B~F字母填空)。
③证明产物中有Cl2的实验现象:________ 。
④反应结束后,若C装置质量增加了2.38g,则NH4ClO4的分解率是:________ %。
(3)样品中NH4ClO4的含量(杂质中不含NH4+)还可用蒸馏法测定(如图所示,加热和夹持装置已略去),实验步骤如下:
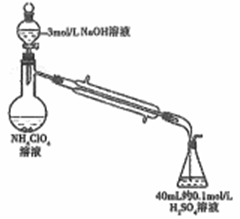
步骤1:组装仪器,检查气密性;准确称取样品a g(不超过0.5g)于蒸馏烧瓶中,加入约150mL水溶解。
步骤2:准确量取40.00mL约0.1mol/L H2SO4于锥形瓶中。
步骤3:向蒸馏烧瓶中加入20mL 3mol/L NaOH溶液;加热蒸馏使NH3全部挥发。
步骤4:用新煮沸过的水冲洗冷凝装置2~3次,洗涤液并入锥形瓶中。
步骤5:向锥形瓶中加2~3滴甲基橙,用c mol/L NaOH标准溶液滴定至终点,消耗NaOH标准溶液V1mL。
步骤6:重复实验2~3次。
回答下列问题:
①步骤2中,准确量取40.00ml H2SO4溶液的玻璃仪器是:__________ 。
②为获得样品中NH4ClO4的含量,还需补充的实验是:______ 。
已知:①高氯酸铵受热分解为N2、Cl2、O2和H2O;②Mg3N2易水解;③Cu与N2在酒精灯加热条件下不反应。
(1)写出高氯酸铵受热分解的化学反应方程式:
(2)现有23.5g NH4ClO4分解,用下列装置设计实验,验证其分解产物并计算分解率。(注:①装置中空气已除尽;②装置可重复使用;③B~F装置中的试剂均过量且能与相应物质反应完全。)

①用E装置质量的增加来验证生成的气体产物之一,则E中盛放的试剂是:
②请按气流由左至右的方向连接装置:A →E→D →B→
③证明产物中有Cl2的实验现象:
④反应结束后,若C装置质量增加了2.38g,则NH4ClO4的分解率是:
(3)样品中NH4ClO4的含量(杂质中不含NH4+)还可用蒸馏法测定(如图所示,加热和夹持装置已略去),实验步骤如下:

步骤1:组装仪器,检查气密性;准确称取样品a g(不超过0.5g)于蒸馏烧瓶中,加入约150mL水溶解。
步骤2:准确量取40.00mL约0.1mol/L H2SO4于锥形瓶中。
步骤3:向蒸馏烧瓶中加入20mL 3mol/L NaOH溶液;加热蒸馏使NH3全部挥发。
步骤4:用新煮沸过的水冲洗冷凝装置2~3次,洗涤液并入锥形瓶中。
步骤5:向锥形瓶中加2~3滴甲基橙,用c mol/L NaOH标准溶液滴定至终点,消耗NaOH标准溶液V1mL。
步骤6:重复实验2~3次。
回答下列问题:
①步骤2中,准确量取40.00ml H2SO4溶液的玻璃仪器是:
②为获得样品中NH4ClO4的含量,还需补充的实验是:
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
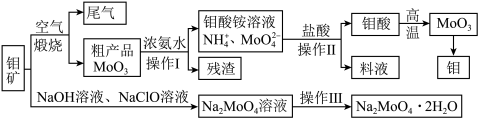
【推荐2】过渡性金属元素在工业生产中有很重要的作用,如金属钼用于制火箭、卫星的合金构件,钼酸钠晶体(Na2MoO4·2H2O)是一种重要的金属缓蚀剂。某工厂利用钼精矿(主要成分MoS2,还含少量钙、镁等元素)为原料冶炼金属钼和钼酸钠晶体(Na2MoO4·2H2O)的主要流程图如下:_______ ,已知Rb(铷)质子数为37,在第五周期ⅠA,Mo的质子数为42,那么Mo在周期表中的位置为第五周期_______ 族。
(2)用浓氨水溶解粗产品的离子方程式是_______ ,由图中信息可以判断MoO3是_______ 氧化物。(填“酸性”、“碱性”或“两性”)
(3)操作Ⅰ是_______ ,操作Ⅱ所得的钼酸要水洗,检验钼酸是否洗涤干净的方法是_______ 。
(4)采用NaClO氧化钼矿的方法将矿石中的钼浸出,该过程放热。①请配平以下化学反应:_______ 。
_______NaClO+_______MoS2+_______NaOH→_______Na2MoO4+_______Na2SO4+_______NaCl+_______H2O
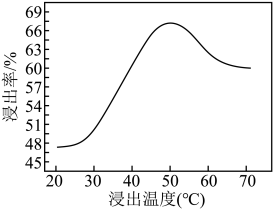
②钼的浸出率随着温度变化如图,当温度高于50℃后浸出率降低的可能原因是_______ (写一点)。 Lix(MoS2)n,则电池工作时正极上的电极反应式为
Lix(MoS2)n,则电池工作时正极上的电极反应式为_______ 。
(2)用浓氨水溶解粗产品的离子方程式是
(3)操作Ⅰ是
(4)采用NaClO氧化钼矿的方法将矿石中的钼浸出,该过程放热。①请配平以下化学反应:
_______NaClO+_______MoS2+_______NaOH→_______Na2MoO4+_______Na2SO4+_______NaCl+_______H2O
②钼的浸出率随着温度变化如图,当温度高于50℃后浸出率降低的可能原因是
 Lix(MoS2)n,则电池工作时正极上的电极反应式为
Lix(MoS2)n,则电池工作时正极上的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】水体中的过量的硝态氮(主要以NO 的形式存在)是一种重要污染物,可利用合适的还原剂将其还原为N2除去。
的形式存在)是一种重要污染物,可利用合适的还原剂将其还原为N2除去。
(1)纳米铁粉(Fe)具有还原性强、比表面积大、吸附性能良好等优点。实验室制取纳米铁粉的反应原理是通过强还原剂来还原溶液中的Fe2+、Fe3+。
①在室温下,向FeSO4溶液中滴加NaBH4溶液,得到Fe、B(OH)3沉淀和H2,反应的离子方程式为___ 。
②制备纳米铁粉的反应过程中需要不断通入N2,否则得到的铁粉会导致硝态氮的去除率下降,其原因可能是___ 。
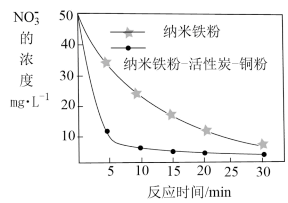
(2)相同条件下,向含有50mg·L-1NO 的两份水样中分别加入纳米铁粉、纳米铁粉—活性炭—铜粉,水样中NO
的两份水样中分别加入纳米铁粉、纳米铁粉—活性炭—铜粉,水样中NO 的去除速率差异如图所示,产生该差异的可能原因有
的去除速率差异如图所示,产生该差异的可能原因有___ 。
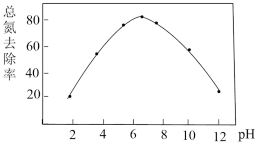
(3)向含有一定浓度的水样中加入纳米铁粉,并调节溶液的pH,溶液中的总氮去除率与pH的关系如图所示。pH>7时,随着pH的升高,溶液中的总氮去除率逐渐降低,其原因是___ 。
 的形式存在)是一种重要污染物,可利用合适的还原剂将其还原为N2除去。
的形式存在)是一种重要污染物,可利用合适的还原剂将其还原为N2除去。(1)纳米铁粉(Fe)具有还原性强、比表面积大、吸附性能良好等优点。实验室制取纳米铁粉的反应原理是通过强还原剂来还原溶液中的Fe2+、Fe3+。
①在室温下,向FeSO4溶液中滴加NaBH4溶液,得到Fe、B(OH)3沉淀和H2,反应的离子方程式为
②制备纳米铁粉的反应过程中需要不断通入N2,否则得到的铁粉会导致硝态氮的去除率下降,其原因可能是
(2)相同条件下,向含有50mg·L-1NO
 的两份水样中分别加入纳米铁粉、纳米铁粉—活性炭—铜粉,水样中NO
的两份水样中分别加入纳米铁粉、纳米铁粉—活性炭—铜粉,水样中NO 的去除速率差异如图所示,产生该差异的可能原因有
的去除速率差异如图所示,产生该差异的可能原因有
(3)向含有一定浓度的水样中加入纳米铁粉,并调节溶液的pH,溶液中的总氮去除率与pH的关系如图所示。pH>7时,随着pH的升高,溶液中的总氮去除率逐渐降低,其原因是

您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
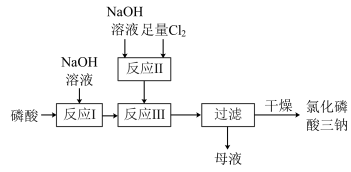
【推荐1】氯化磷酸三钠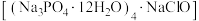 具有良好的灭菌消毒能力.以磷酸为原料制备氯化磷酸三钠的流程如图所示:
具有良好的灭菌消毒能力.以磷酸为原料制备氯化磷酸三钠的流程如图所示:
已知:a.温度高时, 易分解
易分解
b.常温下 的
的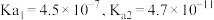
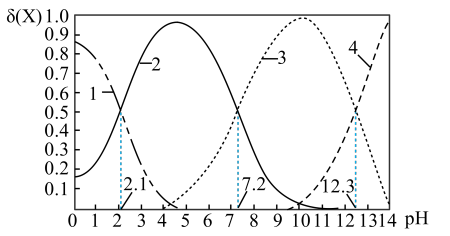
C.常温下,反应Ⅰ中磷酸的物种分布分数 [如
[如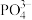 的分布分数
的分布分数 与
与 的关系如下图所示.
的关系如下图所示.
回答下列问题:
(1)反应Ⅰ中不用 溶液的原因是
溶液的原因是____________
(2)反应Ⅰ中加 溶液,常温下应控制
溶液,常温下应控制 约为
约为__________
(3)反应Ⅲ中两种溶液混合后需快速冷却,目的是____________ ,溶液中的___________ 、___________ (填化学式)可以循环利用.
(4)结合有关数据解释 溶液显碱性的原因
溶液显碱性的原因___________ ,
(5)下列说法正确的是___________
 具有良好的灭菌消毒能力.以磷酸为原料制备氯化磷酸三钠的流程如图所示:
具有良好的灭菌消毒能力.以磷酸为原料制备氯化磷酸三钠的流程如图所示:
已知:a.温度高时,
 易分解
易分解b.常温下
 的
的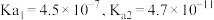
C.常温下,反应Ⅰ中磷酸的物种分布分数
 [如
[如 的分布分数
的分布分数 与
与 的关系如下图所示.
的关系如下图所示.
回答下列问题:
(1)反应Ⅰ中不用
 溶液的原因是
溶液的原因是(2)反应Ⅰ中加
 溶液,常温下应控制
溶液,常温下应控制 约为
约为(3)反应Ⅲ中两种溶液混合后需快速冷却,目的是
(4)结合有关数据解释
 溶液显碱性的原因
溶液显碱性的原因(5)下列说法正确的是___________
A.曲线2代表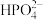 ,曲线4代表 ,曲线4代表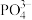 |
B. 时, 时,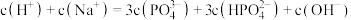 |
C. 时,溶液中水电离出的 时,溶液中水电离出的 |
D. 时,溶液中离子浓度最大的是 时,溶液中离子浓度最大的是 |
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】NH4Al(SO4)2、NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)常温时,0.1mol•L-1NH4Al(SO4)2溶液的pH=3。
①溶液中的Kw=____ (填数值),由水电离出的c(H+)=_____ mol•L-1。
②溶液中c(NH )+c(NH3•H2O)
)+c(NH3•H2O)_____ c(Al3+)+c[Al(OH)3](填“>”“=”或“<”);2c(SO )-c(NH
)-c(NH )-3c(Al3+)=
)-3c(Al3+)=_____ mol•L-1(填精确计算式)。
(2)80℃时,0.1mol•L-1NH4Al(SO4)2溶液的pH小于3,分析导致pH随温度变化的原因是____ 。
(3)常温时,向100mL0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。

①图中a、b、c、d四点中水的电离程度最大的是____ 。
②向NH4HSO4溶液中滴加NaOH溶液从a点到d点的过程中,发生反应的离子方程式_____ 。
③NH4HSO4溶液中各离子浓度由大到小的排列顺序是____ 。
(1)常温时,0.1mol•L-1NH4Al(SO4)2溶液的pH=3。
①溶液中的Kw=
②溶液中c(NH
 )+c(NH3•H2O)
)+c(NH3•H2O) )-c(NH
)-c(NH )-3c(Al3+)=
)-3c(Al3+)=(2)80℃时,0.1mol•L-1NH4Al(SO4)2溶液的pH小于3,分析导致pH随温度变化的原因是
(3)常温时,向100mL0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。

①图中a、b、c、d四点中水的电离程度最大的是
②向NH4HSO4溶液中滴加NaOH溶液从a点到d点的过程中,发生反应的离子方程式
③NH4HSO4溶液中各离子浓度由大到小的排列顺序是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】氮、砷及其化合物在工农业生产等方面有着重要应用。回答下列问题:
(1)氮氧化物( )是常见的大气污染气体之一,用
)是常见的大气污染气体之一,用 催化还原
催化还原 可消除氮氧化物的污染。
可消除氮氧化物的污染。
已知:
①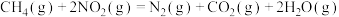
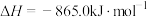 ;
;
②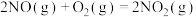
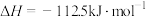 ;
;
③适量的 和
和 完全反应,每生成2.24L(标准状况下)NO时,吸收8.9kJ的热量。
完全反应,每生成2.24L(标准状况下)NO时,吸收8.9kJ的热量。
则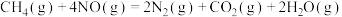

___________  。
。
(2)基态砷原子核外电子云轮廓图呈哑铃形的能级上占据的电子总数为___________ 。(已知:d轨道电子云轮廓图呈花瓣形。)
(3)在恒容密闭容器中,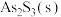 分解反应:
分解反应: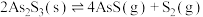 达平衡时,气体总压的对数值
达平衡时,气体总压的对数值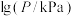 与温度的关系如图1所示。
与温度的关系如图1所示。___________ (填“增大”“减小”或“不变”)。
②A点对应温度下的
___________ 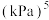 (用分数表示)。
(用分数表示)。
(4)25℃时,向0.1 三元弱酸
三元弱酸 溶液中滴加NaOH溶液,溶液中
溶液中滴加NaOH溶液,溶液中 、
、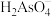 、
、 及
及 的物质的量分布分数随pH的变化如图2所示。
的物质的量分布分数随pH的变化如图2所示。___________ 。
②反应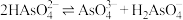 的平衡常数
的平衡常数
___________ 。
(5)某原电池装置如图3所示,电池总反应为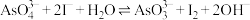 。当P池中溶液由无色变蓝色时,正极上的电极反应式为
。当P池中溶液由无色变蓝色时,正极上的电极反应式为___________ ;当电流计指针归中后向Q中加入一定量的NaOH,电流计指针反向偏转,此时P中的反应式是___________ 。
(1)氮氧化物(
 )是常见的大气污染气体之一,用
)是常见的大气污染气体之一,用 催化还原
催化还原 可消除氮氧化物的污染。
可消除氮氧化物的污染。已知:
①
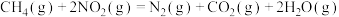
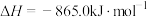 ;
;②
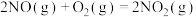
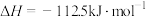 ;
;③适量的
 和
和 完全反应,每生成2.24L(标准状况下)NO时,吸收8.9kJ的热量。
完全反应,每生成2.24L(标准状况下)NO时,吸收8.9kJ的热量。则
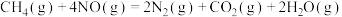

 。
。(2)基态砷原子核外电子云轮廓图呈哑铃形的能级上占据的电子总数为
(3)在恒容密闭容器中,
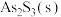 分解反应:
分解反应: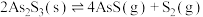 达平衡时,气体总压的对数值
达平衡时,气体总压的对数值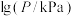 与温度的关系如图1所示。
与温度的关系如图1所示。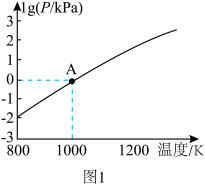
②A点对应温度下的

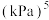 (用分数表示)。
(用分数表示)。(4)25℃时,向0.1
 三元弱酸
三元弱酸 溶液中滴加NaOH溶液,溶液中
溶液中滴加NaOH溶液,溶液中 、
、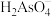 、
、 及
及 的物质的量分布分数随pH的变化如图2所示。
的物质的量分布分数随pH的变化如图2所示。
②反应
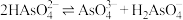 的平衡常数
的平衡常数
(5)某原电池装置如图3所示,电池总反应为
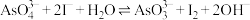 。当P池中溶液由无色变蓝色时,正极上的电极反应式为
。当P池中溶液由无色变蓝色时,正极上的电极反应式为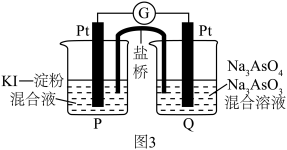
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】磷的含氧酸有次磷酸(H3PO2)、亚磷酸(H3PO3)、磷酸(H3PO4)等多种,都是重要的化工原料。
(1)已知次磷酸(H3PO2)的水溶液中存在H3PO2分子,H3PO2与足量NaOH溶液充分反应,消耗的酸和碱的物质的量相等,反应的离子方程式为____ ,生成的盐属于____ (填“正盐”或“酸式盐”)。
(2)查阅资料知25℃时,亚磷酸(H3PO3)的Ka1=5×10-2,Ka2=2.5×10-7。25℃时,Na2HPO3水解反应的Kh=____ (填数值)。
(3)若用甲基橙做指示剂,用NaOH溶液滴定某浓度的H3PO3溶液,达到滴定终点时所得溶液中c(Na+)____ c(H2PO )+2c(HPO
)+2c(HPO )(填“>”、“<”或“=”)。
)(填“>”、“<”或“=”)。
(4)磷酸(H3PO4)在水溶液中各种微粒的物质的量分数δ随pH的变化曲线如图所示:
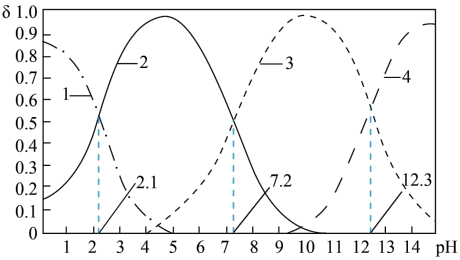
①向某浓度的磷酸溶液中滴加NaOH溶液,以酚酞为指示剂,当溶液由无色变为浅红色时,发生的主要反应的离子方程式是____ 。
②从图中推断下列说法正确的是___ 。
A.25℃时,H3PO4的第三步电离常数为10-12.3
B.Na2HPO4溶液中:c(Na+)>c(H2PO )>c(H3PO4)>c(HPO
)>c(H3PO4)>c(HPO )
)
C.Na2HPO4溶液中:c(Na+)>c(H2PO )>c(PO
)>c(PO )>c(HPO
)>c(HPO )
)
D.pH=7.2时,溶液中c(Na+)+c(H+)=3c(H2PO )+3c(PO
)+3c(PO )+c(OH-)
)+c(OH-)
(1)已知次磷酸(H3PO2)的水溶液中存在H3PO2分子,H3PO2与足量NaOH溶液充分反应,消耗的酸和碱的物质的量相等,反应的离子方程式为
(2)查阅资料知25℃时,亚磷酸(H3PO3)的Ka1=5×10-2,Ka2=2.5×10-7。25℃时,Na2HPO3水解反应的Kh=
(3)若用甲基橙做指示剂,用NaOH溶液滴定某浓度的H3PO3溶液,达到滴定终点时所得溶液中c(Na+)
 )+2c(HPO
)+2c(HPO )(填“>”、“<”或“=”)。
)(填“>”、“<”或“=”)。(4)磷酸(H3PO4)在水溶液中各种微粒的物质的量分数δ随pH的变化曲线如图所示:

①向某浓度的磷酸溶液中滴加NaOH溶液,以酚酞为指示剂,当溶液由无色变为浅红色时,发生的主要反应的离子方程式是
②从图中推断下列说法正确的是
A.25℃时,H3PO4的第三步电离常数为10-12.3
B.Na2HPO4溶液中:c(Na+)>c(H2PO
 )>c(H3PO4)>c(HPO
)>c(H3PO4)>c(HPO )
)C.Na2HPO4溶液中:c(Na+)>c(H2PO
 )>c(PO
)>c(PO )>c(HPO
)>c(HPO )
)D.pH=7.2时,溶液中c(Na+)+c(H+)=3c(H2PO
 )+3c(PO
)+3c(PO )+c(OH-)
)+c(OH-)
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】氧族元素及其化合物在生产、生活中发挥着重要的作用。回答下列问题:
(1)工业上常用硫化物(FeS等)作沉淀剂除去废水中的Cu2+等重金属离子。已知常温下 饱和溶液中,
饱和溶液中,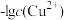 和
和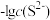 关系如图所示,
关系如图所示,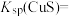
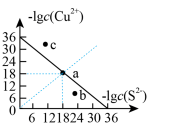
___________ ;图中a、b、c三点对应的溶液中,一定存在 沉淀的是
沉淀的是___________ (填序号)。
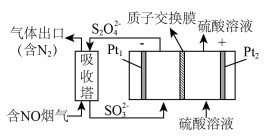
(2)工业上常用连二亚硫酸钠 消除烟气中的
消除烟气中的 ,通过电解可使
,通过电解可使 再生,装置如图所示。吸收塔内发生的离子反应方程式为
再生,装置如图所示。吸收塔内发生的离子反应方程式为___________ 。吸收塔内每吸收 的
的 ,理论上
,理论上 电极上会放出
电极上会放出___________  气体(气体体积均为标准状况)。
气体(气体体积均为标准状况)。
(3)硒是人体必需的微量元素。工业上将含硒工业废料处理得到亚硒酸( )和硒酸(
)和硒酸(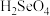 ),进而制备单质硒。亚硒酸(
),进而制备单质硒。亚硒酸( )在溶液中存在多种微粒形态,25℃时各微粒的分布系数
)在溶液中存在多种微粒形态,25℃时各微粒的分布系数 与溶液pH的关系如图所示。(分布系数即组分的平衡浓度占总浓度的分数)
与溶液pH的关系如图所示。(分布系数即组分的平衡浓度占总浓度的分数)
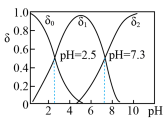
①将 滴入
滴入 溶液中,当pH达到2.0时,发生反应的离子方程式是
溶液中,当pH达到2.0时,发生反应的离子方程式是___________ 。
②25℃时,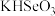 溶液的pH<7,通过计算和必要的文字加以解释:
溶液的pH<7,通过计算和必要的文字加以解释:___________ 。
③已知硒酸的电离方程式为: ,
, 。25℃时,下列关于
。25℃时,下列关于
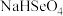 溶液的说法错误的是
溶液的说法错误的是___________ 。
A.
B.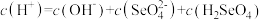
C.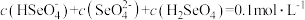
D.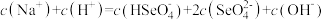
(1)工业上常用硫化物(FeS等)作沉淀剂除去废水中的Cu2+等重金属离子。已知常温下
 饱和溶液中,
饱和溶液中,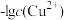 和
和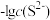 关系如图所示,
关系如图所示,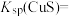
 沉淀的是
沉淀的是
(2)工业上常用连二亚硫酸钠
 消除烟气中的
消除烟气中的 ,通过电解可使
,通过电解可使 再生,装置如图所示。吸收塔内发生的离子反应方程式为
再生,装置如图所示。吸收塔内发生的离子反应方程式为 的
的 ,理论上
,理论上 电极上会放出
电极上会放出 气体(气体体积均为标准状况)。
气体(气体体积均为标准状况)。
(3)硒是人体必需的微量元素。工业上将含硒工业废料处理得到亚硒酸(
 )和硒酸(
)和硒酸(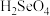 ),进而制备单质硒。亚硒酸(
),进而制备单质硒。亚硒酸( )在溶液中存在多种微粒形态,25℃时各微粒的分布系数
)在溶液中存在多种微粒形态,25℃时各微粒的分布系数 与溶液pH的关系如图所示。(分布系数即组分的平衡浓度占总浓度的分数)
与溶液pH的关系如图所示。(分布系数即组分的平衡浓度占总浓度的分数)
①将
 滴入
滴入 溶液中,当pH达到2.0时,发生反应的离子方程式是
溶液中,当pH达到2.0时,发生反应的离子方程式是②25℃时,
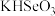 溶液的pH<7,通过计算和必要的文字加以解释:
溶液的pH<7,通过计算和必要的文字加以解释:③已知硒酸的电离方程式为:
 ,
, 。25℃时,下列关于
。25℃时,下列关于
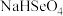 溶液的说法错误的是
溶液的说法错误的是A.

B.
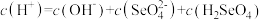
C.
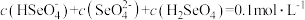
D.
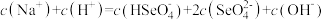
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】(1)已知25 ℃时,NH3·H2O的电离平衡常数Kb=1.8×10-5,该温度下1 mol·L-1的NH4Cl溶液中c(H+)=___________ mol·L-1.(已知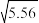 ≈2.36)。
≈2.36)。
(2)磷酸是三元弱酸,常温下三级电离常数分别是Ka1=7.1×10-3,Ka2=6.2×10-8,Ka3=4.5×10-13,解答下列问题:常温下同浓度①Na3PO4、②Na2HPO4、③NaH2PO4的pH由小到大的顺序___________ (填序号);常温下,Na2HPO4的水溶液呈___________ (填“酸”“碱”或“中”)性,用Ka与Kh的相对大小,说明判断理由:___________ 。
(3)已知:Cu(OH)2(s) Cu2+(aq)+2OH-(aq),Ksp=2×10-20,某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如要生成Cu(OH)2沉淀,应调整溶液的pH大于
Cu2+(aq)+2OH-(aq),Ksp=2×10-20,某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如要生成Cu(OH)2沉淀,应调整溶液的pH大于___________ 。
(4)不同温度下(T1、T2),CaCO3在水中的沉淀溶解平衡曲线如图所示,回答下列问题(注:CaCO3均未完全溶解)T1___________ (填“>”“<”或“=”)T2;在B点,若温度从T1升到T2,则B点变到___________ 点(填“C”“D”或“E”。)
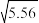 ≈2.36)。
≈2.36)。(2)磷酸是三元弱酸,常温下三级电离常数分别是Ka1=7.1×10-3,Ka2=6.2×10-8,Ka3=4.5×10-13,解答下列问题:常温下同浓度①Na3PO4、②Na2HPO4、③NaH2PO4的pH由小到大的顺序
(3)已知:Cu(OH)2(s)
 Cu2+(aq)+2OH-(aq),Ksp=2×10-20,某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如要生成Cu(OH)2沉淀,应调整溶液的pH大于
Cu2+(aq)+2OH-(aq),Ksp=2×10-20,某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如要生成Cu(OH)2沉淀,应调整溶液的pH大于(4)不同温度下(T1、T2),CaCO3在水中的沉淀溶解平衡曲线如图所示,回答下列问题(注:CaCO3均未完全溶解)T1

您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
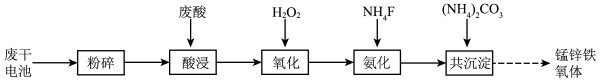
【推荐1】以废干电池[主要含 、
、 、Zn、
、Zn、 、Fe、
、Fe、 ]和钛白厂废酸(主要含
]和钛白厂废酸(主要含 ,还有少量
,还有少量 、
、 、
、 、
、 等)为原料制备锰锌铁氧体
等)为原料制备锰锌铁氧体 的流程如下:
的流程如下:
已知:①25℃时,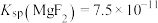 ,
,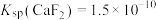 ;酸性较弱时,
;酸性较弱时, 、
、 均易形成易溶于水的
均易形成易溶于水的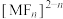 配离子(M代表金属元素);
配离子(M代表金属元素);
②在 催化下可发生反应
催化下可发生反应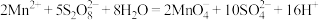 ;
;
③ 在煮沸时易分解。
在煮沸时易分解。
(1)酸浸过程中含锰物质被溶液中的 还原为
还原为 ,其中
,其中 参与反应的离子方程式为
参与反应的离子方程式为_____ 。
(2)氧化时加入 将
将 、
、 氧化,再加入
氧化,再加入 调节溶液pH为1~2,生成偏钛酸
调节溶液pH为1~2,生成偏钛酸 和黄钾铁矾
和黄钾铁矾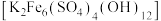 沉淀,使得钛、钾得以脱除。
沉淀,使得钛、钾得以脱除。
①加入 生成黄钾铁矾的离子方程式为
生成黄钾铁矾的离子方程式为_____ 。
②若加入 过多,将导致生成的黄钾铁矾沉淀转化为
过多,将导致生成的黄钾铁矾沉淀转化为_____ 沉淀(填化学式)。
(3)加入适量的 使
使 、
、 形成
形成 、
、 沉淀而脱除,则静置后的清液中
沉淀而脱除,则静置后的清液中
_____ 。
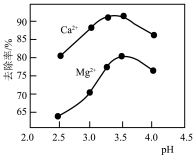
(4)氟化过程中溶液pH与钙镁去除率关系如图所示。当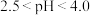 时,溶液pH过高或过低,
时,溶液pH过高或过低, 、
、 去除率都会下降,其原因是
去除率都会下降,其原因是_____ 。
(5)共沉淀前,需测定溶液中锰元素含量。准确量取 氟化后溶液于锥形瓶中,加入少量硫酸、磷酸和硝酸银溶液振荡;将溶液加热至80℃,加入
氟化后溶液于锥形瓶中,加入少量硫酸、磷酸和硝酸银溶液振荡;将溶液加热至80℃,加入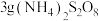 充分反应后,再将溶液煮沸;冷却后,用
充分反应后,再将溶液煮沸;冷却后,用 的
的 标准液滴定至终点,平行滴定3次,平均消耗
标准液滴定至终点,平行滴定3次,平均消耗 溶液
溶液 。计算氟化后溶液中
。计算氟化后溶液中 物质的量浓度(写出计算过程,计算结果保留到小数点后四位)
物质的量浓度(写出计算过程,计算结果保留到小数点后四位)_____ 。
 、
、 、Zn、
、Zn、 、Fe、
、Fe、 ]和钛白厂废酸(主要含
]和钛白厂废酸(主要含 ,还有少量
,还有少量 、
、 、
、 、
、 等)为原料制备锰锌铁氧体
等)为原料制备锰锌铁氧体 的流程如下:
的流程如下:
已知:①25℃时,
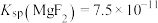 ,
,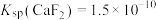 ;酸性较弱时,
;酸性较弱时, 、
、 均易形成易溶于水的
均易形成易溶于水的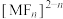 配离子(M代表金属元素);
配离子(M代表金属元素);②在
 催化下可发生反应
催化下可发生反应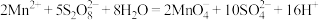 ;
;③
 在煮沸时易分解。
在煮沸时易分解。(1)酸浸过程中含锰物质被溶液中的
 还原为
还原为 ,其中
,其中 参与反应的离子方程式为
参与反应的离子方程式为(2)氧化时加入
 将
将 、
、 氧化,再加入
氧化,再加入 调节溶液pH为1~2,生成偏钛酸
调节溶液pH为1~2,生成偏钛酸 和黄钾铁矾
和黄钾铁矾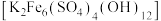 沉淀,使得钛、钾得以脱除。
沉淀,使得钛、钾得以脱除。①加入
 生成黄钾铁矾的离子方程式为
生成黄钾铁矾的离子方程式为②若加入
 过多,将导致生成的黄钾铁矾沉淀转化为
过多,将导致生成的黄钾铁矾沉淀转化为(3)加入适量的
 使
使 、
、 形成
形成 、
、 沉淀而脱除,则静置后的清液中
沉淀而脱除,则静置后的清液中
(4)氟化过程中溶液pH与钙镁去除率关系如图所示。当
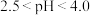 时,溶液pH过高或过低,
时,溶液pH过高或过低, 、
、 去除率都会下降,其原因是
去除率都会下降,其原因是
(5)共沉淀前,需测定溶液中锰元素含量。准确量取
 氟化后溶液于锥形瓶中,加入少量硫酸、磷酸和硝酸银溶液振荡;将溶液加热至80℃,加入
氟化后溶液于锥形瓶中,加入少量硫酸、磷酸和硝酸银溶液振荡;将溶液加热至80℃,加入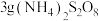 充分反应后,再将溶液煮沸;冷却后,用
充分反应后,再将溶液煮沸;冷却后,用 的
的 标准液滴定至终点,平行滴定3次,平均消耗
标准液滴定至终点,平行滴定3次,平均消耗 溶液
溶液 。计算氟化后溶液中
。计算氟化后溶液中 物质的量浓度(写出计算过程,计算结果保留到小数点后四位)
物质的量浓度(写出计算过程,计算结果保留到小数点后四位)
您最近一年使用:0次
【推荐2】某种由含锰废料(主要含MnO,也含有FeO、 、
、 )制备
)制备 的流程如下所示。回答问题:
的流程如下所示。回答问题:

(1)常温下为提高稀硫酸浸取的效果,可采取的措施是_______ (写一条)。滤渣Ⅰ的主要成分是_______ (填化学式)。
(2)向滤液Ⅰ中加入 可将
可将 氧化为
氧化为 ,反应的离子方程式为
,反应的离子方程式为_______ 。
(3)已知常温下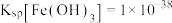 ,为将滤液Ⅱ中
,为将滤液Ⅱ中 完全沉降(溶液中离子浓度小于
完全沉降(溶液中离子浓度小于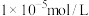 时,可认为沉淀完全),需要将pH调至
时,可认为沉淀完全),需要将pH调至_______ 。检验 是否沉降完全的实验方案是
是否沉降完全的实验方案是_______ 。
(4)用惰性电极电解滤液Ⅲ时, 将在
将在_______ 极(填“阴”或“阳”)产生,该电极反应方程式为_______ 。
(5)电解余液中的溶质主要是 ,
, 溶液中各离子浓度由大到小的关系是
溶液中各离子浓度由大到小的关系是_______ 。相同条件下,等浓度的 和
和 溶液中,
溶液中, 溶液中水的电离程度更
溶液中水的电离程度更_______ (填“大”或“小”)。
 、
、 )制备
)制备 的流程如下所示。回答问题:
的流程如下所示。回答问题:
(1)常温下为提高稀硫酸浸取的效果,可采取的措施是
(2)向滤液Ⅰ中加入
 可将
可将 氧化为
氧化为 ,反应的离子方程式为
,反应的离子方程式为(3)已知常温下
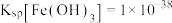 ,为将滤液Ⅱ中
,为将滤液Ⅱ中 完全沉降(溶液中离子浓度小于
完全沉降(溶液中离子浓度小于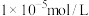 时,可认为沉淀完全),需要将pH调至
时,可认为沉淀完全),需要将pH调至 是否沉降完全的实验方案是
是否沉降完全的实验方案是(4)用惰性电极电解滤液Ⅲ时,
 将在
将在(5)电解余液中的溶质主要是
 ,
, 溶液中各离子浓度由大到小的关系是
溶液中各离子浓度由大到小的关系是 和
和 溶液中,
溶液中, 溶液中水的电离程度更
溶液中水的电离程度更
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐3】研究从含锌资源中获取Zn的途径具有重要意义。
Ⅰ.工业上酸浸提锌
氧化锌矿中含有ZnO、 、FeO、PbO、
、FeO、PbO、 、CaO、
、CaO、 等。
等。
ⅰ.几种难溶电解质的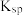
ⅱ.浸出液中主要金属阳离子浓度
(1)浸出渣的主要成分有 、
、 和
和 。PbO和
。PbO和 反应的离子方程式是
反应的离子方程式是___________ 。
(2)加入试剂a的目的是___________ 。
(3)电解前,含 溶液中铁和铝的离子浓度均需小于
溶液中铁和铝的离子浓度均需小于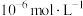 ,应调节pH的范围是(忽略①和②导致的体积变化)
,应调节pH的范围是(忽略①和②导致的体积变化)___________ 。
Ⅱ.实验室中氨浸提锌
ⅲ.

ⅳ.M的结构简式如图所示,R为 ,两个羟基中、酚羟基酸性较强。
,两个羟基中、酚羟基酸性较强。 浸取ZnO发生反应的离子方程式是
浸取ZnO发生反应的离子方程式是___________ 。
(5)M能与 形成稳定的配合物X,相关反应为
形成稳定的配合物X,相关反应为 。
。
①补全图中X的结构并用“…”标出氢键_______ 。 的萃取,原因可能是
的萃取,原因可能是___________ 。
(6)从平衡移动的角度解释 能提高有机溶液中X含量的原因:
能提高有机溶液中X含量的原因:___________ 。
Ⅰ.工业上酸浸提锌
氧化锌矿中含有ZnO、
 、FeO、PbO、
、FeO、PbO、 、CaO、
、CaO、 等。
等。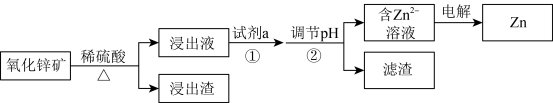
ⅰ.几种难溶电解质的
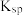
| 难溶电解质 |  |  |  |  |
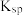 |  |  | 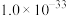 |  |
| 粒子 |  |  和Fe 和Fe | Al |
| 浓度(mol/L) | 0.3 | 0.1 | 0.1 |
(1)浸出渣的主要成分有
 、
、 和
和 。PbO和
。PbO和 反应的离子方程式是
反应的离子方程式是(2)加入试剂a的目的是
(3)电解前,含
 溶液中铁和铝的离子浓度均需小于
溶液中铁和铝的离子浓度均需小于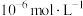 ,应调节pH的范围是(忽略①和②导致的体积变化)
,应调节pH的范围是(忽略①和②导致的体积变化)Ⅱ.实验室中氨浸提锌
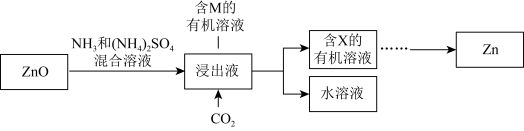
ⅲ.


ⅳ.M的结构简式如图所示,R为
 ,两个羟基中、酚羟基酸性较强。
,两个羟基中、酚羟基酸性较强。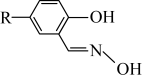
 浸取ZnO发生反应的离子方程式是
浸取ZnO发生反应的离子方程式是(5)M能与
 形成稳定的配合物X,相关反应为
形成稳定的配合物X,相关反应为 。
。①补全图中X的结构并用“…”标出氢键
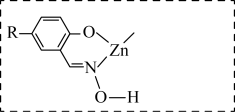
 的萃取,原因可能是
的萃取,原因可能是(6)从平衡移动的角度解释
 能提高有机溶液中X含量的原因:
能提高有机溶液中X含量的原因:
您最近一年使用:0次



