1 . A、B、C、D是原子序数依次递增的四种短周期元素。基态A原子所含的电子只有一种运动状态;基态B原子中有三个未成对电子。A、B、C、D四种元素共同组成化合物M,M可发生如下反应:
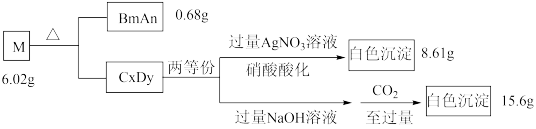
回答下列问题:
(1)B原子的价电子排布式为_______ 。实验室制备BmAn的化学方程式是_________ 。
(2)A、C、D三种元素的原子半径由大到小的顺序为_________ (用元素符号表示)。
(3)B元素的第一电离能比同周期相邻两种元素的都高;原因是____________ 。
(4) D元素的一种氧化物D2O为淡棕黄色气体,可由新制的HgO和D2发生歧化反应(氧化剂和还原剂为同一种物质的反应)制得。上述制备D2O的化学方程式为_________ 。
(5)D元素的另一种氧化物DO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaDO2、NaHSO4、NaHCO3的泡腾片,能快速溶于水,溢出大量气泡,得到DO2溶液。上述过程中,生成DO2的反应属于歧化反应,每生成1 mol DO2消耗NaDO2的量为_____ mol;若产生的“气泡”与DO2的物质的量相等,则反应过程中消耗NaDO2、NaHSO4、NaHCO3的物质的量之比为____________ 。
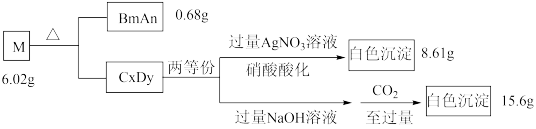
回答下列问题:
(1)B原子的价电子排布式为
(2)A、C、D三种元素的原子半径由大到小的顺序为
(3)B元素的第一电离能比同周期相邻两种元素的都高;原因是
(4) D元素的一种氧化物D2O为淡棕黄色气体,可由新制的HgO和D2发生歧化反应(氧化剂和还原剂为同一种物质的反应)制得。上述制备D2O的化学方程式为
(5)D元素的另一种氧化物DO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaDO2、NaHSO4、NaHCO3的泡腾片,能快速溶于水,溢出大量气泡,得到DO2溶液。上述过程中,生成DO2的反应属于歧化反应,每生成1 mol DO2消耗NaDO2的量为
您最近一年使用:0次
2 . 某离子反应涉及H2O、ClO-、 、OH-、N2、Cl-等微粒,其中N2、ClO-的数目随时间变化的曲线如图所示,下列说法正确的是
、OH-、N2、Cl-等微粒,其中N2、ClO-的数目随时间变化的曲线如图所示,下列说法正确的是
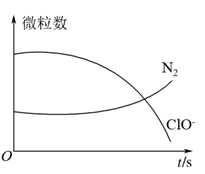
 、OH-、N2、Cl-等微粒,其中N2、ClO-的数目随时间变化的曲线如图所示,下列说法正确的是
、OH-、N2、Cl-等微粒,其中N2、ClO-的数目随时间变化的曲线如图所示,下列说法正确的是
| A.该反应中Cl-为氧化产物 |
| B.消耗1个还原剂微粒,转移6e- |
C. 被ClO-氧化成N2 被ClO-氧化成N2 |
| D.反应后溶液的酸性减弱 |
您最近一年使用:0次
2020-10-02更新
|
1136次组卷
|
8卷引用:河北省石家庄市第二中学2021-2022学年高一上学期10月月考化学试题
解题方法
3 . 配平下列反应方程式。
(1)正向配平类
①___ HCl(浓)+___ MnO2
___ Cl2↑+___ MnCl2+___ H2O
②___ KI+___ KIO3+___ H2SO4=____ I2+___ K2SO4+___ H2O
③___ MnO +
+___ H++___ Cl-=___ Mn2++___ Cl2↑+___ H2O
(2)逆向配平类
①___ S+___ KOH=___ K2S+___ K2SO3+___ H2O
②___ P4+___ KOH+___ H2O=___ K3PO4+___ PH3↑
(3)缺项配平类
①___ ClO-+___ Fe(OH)3+___ =___ Cl-+___ FeO +
+___ H2O
②___ MnO +
+___ H2O2+___ =___ Mn2++___ O2↑+___ H2O
③某高温还原法制备新型陶瓷氮化铝(AlN)的反应体系中的物质有Al2O3、C、N2、AlN、CO。请将反应物与生成物分别填入以下空格内,并配平。___

(1)正向配平类
①

②
③
 +
+(2)逆向配平类
①
②
(3)缺项配平类
①
 +
+②
 +
+③某高温还原法制备新型陶瓷氮化铝(AlN)的反应体系中的物质有Al2O3、C、N2、AlN、CO。请将反应物与生成物分别填入以下空格内,并配平。

您最近一年使用:0次
2020-09-02更新
|
2236次组卷
|
3卷引用:易错专题07 氧化还原反应电子转移的表示及方程式的书写-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)
(已下线)易错专题07 氧化还原反应电子转移的表示及方程式的书写-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)苏教版(2020)高一必修第一册专题4 突破3 氧化还原反应与离子反应的综合应用鲁科版(2019)高一必修第一册第2章 元素与物质世界 第3节 氧化还原反应 专题4 氧化还原反应的计算及方程式的配平
真题
名校
4 . 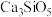 是硅酸盐水泥的重要成分之一,其相关性质的说法
是硅酸盐水泥的重要成分之一,其相关性质的说法不正确 的是
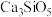 是硅酸盐水泥的重要成分之一,其相关性质的说法
是硅酸盐水泥的重要成分之一,其相关性质的说法A.可发生反应: |
| B.具有吸水性,需要密封保存 |
C.能与 ,反应生成新盐 ,反应生成新盐 |
D.与足量盐酸作用,所得固体产物主要为 |
您最近一年使用:0次
2020-07-11更新
|
5404次组卷
|
31卷引用:解密07 非金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)
(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)课时20 碳、硅与无机非金属材料-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考向05 氧化还原反应-备战2022年高考化学一轮复习考点微专题(已下线)考点10 碳、硅及其无机非金属材料-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点10 碳、硅及其无机非金属材料-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)第9讲 无机非金属材料 (讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)考向10 碳、硅及其化合物-备战2022年高考化学一轮复习考点微专题(已下线)专题05.元素及其化合物-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)专题07 常见非金属及其化合物-备战2022年高考化学学霸纠错(全国通用)2020年浙江省高考化学试卷(7月选考)(已下线)专题05 元素及其化合物-2020年高考真题和模拟题化学分项汇编(已下线)第9讲 硅及其化合物-2021年高考化学一轮复习名师精讲练(已下线)第13讲 碳、硅及无机非金属材料(精讲)——2021年高考化学一轮复习讲练测(已下线)小题必刷08 氧化还原反应的规律及应用——2021年高考化学一轮复习小题必刷(通用版)(已下线)小题必刷17 碳、硅与无机非金属材料——2021年高考化学一轮复习小题必刷(通用版)天津市实验中学滨海学校2021届高三上学期第一次月考化学试题重庆市第七中学校2021-2022学年高一下学期3月月考化学试题(已下线)考点12 硅及其无机非金属材料-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第11讲 碳、硅及无机非金属材料(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第14练 无机非金属材料-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第09讲 无机非金属材料(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第09讲 无机非金属材料(讲)-2023年高考化学一轮复习讲练测(新教材新高考)北京市昌平区2022-2023学年高三上学期期末质量检测化学试题第四章 非金属及其化合物 第17讲 无机非金属材料(已下线)第10讲 硅及其化合物(已下线)第7讲 碳、硅及无机非金属材料(已下线)考点13 硅及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)浙江省杭州市西湖高级中学2023-2024学年高一下学期4月期中考试化学试题湖北省武汉市第三中学2023-2024学年高一下学期3月月考化学试卷(已下线)第05讲 氧化还原反应方程式的配平、书写及计算(练习)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)
名校
5 . 三氯氧磷(POCl3)广泛用于农药、医药等生产。工业制备三氯氧磷的过程中会产生副产品亚磷酸(H3PO3)。回答下列问题:
(1)三氯氧磷可由三氯化磷、水、氯气加热反应生成,反应的化学方程式为_______
(2)已知亚磷酸(H3PO3)为二元弱酸,则Na2HPO3溶液中,各离子浓度的大小关系为_______
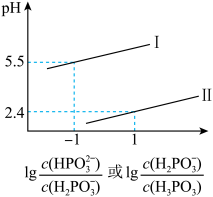
(3)常温下,将NaOH溶液滴加到亚磷酸(H3PO3)溶液中,混合溶液的pH与离子浓度变化的关系如图所示,则表示lg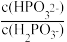 的是曲线
的是曲线_____ (填“Ⅰ”或“Ⅱ”),亚磷酸(H3PO3)的Ka1=_____ ,反应HPO32-+H2O H2PO3-+OH-的平衡常数的值是
H2PO3-+OH-的平衡常数的值是_____ 。
(4)工业上生产三氯氧磷的同时会产生含磷废水(主要成分为H3PO4、H3PO3)。向废水中先加入适量漂白粉,再加入生石灰调节pH,将磷元素转化为磷酸的钙盐沉淀并回收。若处理后的废水中c(Ca2+)=5×10-6 mol·L-1,则溶液中c(PO43-)=_____ mol·L-1。(已知Ksp[Ca3(PO4)2]=2×10-29)
(1)三氯氧磷可由三氯化磷、水、氯气加热反应生成,反应的化学方程式为
(2)已知亚磷酸(H3PO3)为二元弱酸,则Na2HPO3溶液中,各离子浓度的大小关系为
(3)常温下,将NaOH溶液滴加到亚磷酸(H3PO3)溶液中,混合溶液的pH与离子浓度变化的关系如图所示,则表示lg
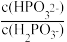 的是曲线
的是曲线 H2PO3-+OH-的平衡常数的值是
H2PO3-+OH-的平衡常数的值是
(4)工业上生产三氯氧磷的同时会产生含磷废水(主要成分为H3PO4、H3PO3)。向废水中先加入适量漂白粉,再加入生石灰调节pH,将磷元素转化为磷酸的钙盐沉淀并回收。若处理后的废水中c(Ca2+)=5×10-6 mol·L-1,则溶液中c(PO43-)=

您最近一年使用:0次
2020-04-03更新
|
792次组卷
|
4卷引用:选择性必修1(SJ)专题3专题综合检测
6 . MnO2是一种重要的无机功能材料,可由MnSO4和NaClO3溶液反应制得,反应原理为: MnSO4+ NaClO3+ H2O Cl2↑ + Na2SO4 + MnO2 ↓+ (未配平),则关于此反应的叙述不正确的是
Cl2↑ + Na2SO4 + MnO2 ↓+ (未配平),则关于此反应的叙述不正确的是
 Cl2↑ + Na2SO4 + MnO2 ↓+ (未配平),则关于此反应的叙述不正确的是
Cl2↑ + Na2SO4 + MnO2 ↓+ (未配平),则关于此反应的叙述不正确的是| A.NaClO3中Cl的化合价为+5 |
| B.每生成8.7 g氧化产物,反应中转移的电子数约为0.2×6.02×1023 |
| C.NaClO3的氧化性强于MnO2的氧化性 |
| D.该反应右边方框内的产物是NaOH |
您最近一年使用:0次
2020-01-19更新
|
364次组卷
|
2卷引用:专题4 本专题复习提升-高中化学苏教2019版必修第一册
名校
7 . 用“银-Ferrozine”法检测室内甲醛含量的原理如下:

下列说法错误的是

下列说法错误的是
| A.标准状况下,11.2 L CO2中含C=O键的数目为6.02×1023 |
| B.反应①的化学方程式为2Ag2O+HCHO=4Ag+CO2↑+H2O |
| C.理论上吸收HCHO与消耗Fe3+的物质的量之比为4:1 |
| D.30 g HCHO被氧化时转移电子数目为4×6.02×1023 |
您最近一年使用:0次
2020-01-09更新
|
290次组卷
|
3卷引用:鲁科版2019选择性必修2第1章 原子结构与元素性质 微项目 甲醛的危害与去除——利用电负性分析与预测物质性质
8 . 亚硝酸钠易溶于水,水溶液显碱性,有氧化性,也有还原性。由于NaNO2有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
NaNO2+KI+ →NO↑+I2+K2SO4+Na2SO4+____
(1)请完成该化学方程式并配平。
(2)将上述反应方程式改写为离子反应方程式:_____
(3)用上述反应来处理NaNO2并不是最佳方法,其原因是__ 。从环保角度来讲,要处理NaNO2,所用的物质的___ (填“氧化性”或“还原性”)应该比KI更__ (填“强”或“弱”)。
(4)简便鉴别亚硝酸钠和氯化钠的方法是____ 。
(5)已知亚硝酸钠可以与氯化铵反应生成氮气和氯化钠,写出该反应的化学反应方程式并用单线桥表示其电子转移的方向和数目。___
NaNO2+KI+ →NO↑+I2+K2SO4+Na2SO4+
(1)请完成该化学方程式并配平。
(2)将上述反应方程式改写为离子反应方程式:
(3)用上述反应来处理NaNO2并不是最佳方法,其原因是
(4)简便鉴别亚硝酸钠和氯化钠的方法是
(5)已知亚硝酸钠可以与氯化铵反应生成氮气和氯化钠,写出该反应的化学反应方程式并用单线桥表示其电子转移的方向和数目。
您最近一年使用:0次
2019-09-17更新
|
2985次组卷
|
7卷引用:湖北省武汉中学2021-2022高一上学期10月月考化学试题
名校
9 . 某离子反应涉及到 H2O、ClO-、NH4+、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,下列说法不正确 的是
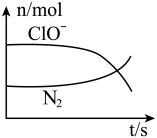

| A.该反应中Cl-为还原产物 |
| B.氧化剂与还原剂物质的量比为3:2 |
| C.消耗1 mol还原剂,转移6 mol电子 |
| D.氧化性:ClO-比 N2强 |
您最近一年使用:0次
2019-07-02更新
|
975次组卷
|
11卷引用:湖北省十堰市第二中学2021-2022学年高一上学期12月考试化学试题
湖北省十堰市第二中学2021-2022学年高一上学期12月考试化学试题福建省莆田第六中学2018-2019学年高一(实验班)下学期期中考试化学试题福建省莆田第六中学2018-2019学年高一下学期期中考试化学试题(已下线)2019年10月6日《每日一题》必修1 —— 每周一测甘肃省兰州第一中学2019-2020学年高一上学期期中考试化学试题上海市格致中学2020届高三上学期开学考试化学试题鲁科版(2019)高一必修第一册第二章B 素养拓展区 过素养 学科素养拓展训练高一必修第一册(苏教2019版)专题3 B 素养拓展区 过素养 学科素养拓展训练甘肃省嘉峪关市第一中学2021届高三上学期一模考试化学试卷辽宁省沈阳市东北育才学校2020届高三上学期第一次模拟考试化学试题福建省宁德博雅培文学校2022-2023学年高一上学期线上期末考试化学试题
名校
10 . 《我在故宫修文物》这部纪录片里关于古代青铜器的修复引起了某研学小组的兴趣。“修旧如旧”是文物保护的主旨。
(1)查阅高中教材得知铜锈为Cu2(OH)2CO3,俗称铜绿,可溶于酸。铜绿在一定程度上可以提升青铜器的艺术价值。参与形成铜绿的物质有Cu和_______ 。
(2)继续查阅中国知网,了解到铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl。考古学家将铜锈分为无害锈和有害锈,结构如图所示:
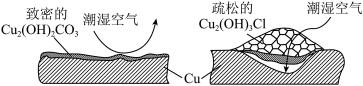
Cu2(OH)2CO3和Cu2(OH)3Cl分别属于无害锈和有害锈,请解释原因_____________ 。
(3)文献显示有害锈的形成过程中会产生CuCl(白色不溶于水的固体),请结合下图回答:
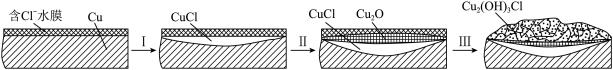
① 过程Ⅰ的正极反应物是___________ 。
② 过程Ⅰ负极的电极反应式是_____________ 。
(4)青铜器的修复有以下三种方法:
ⅰ.柠檬酸浸法:将腐蚀文物直接放在2%-3%的柠檬酸溶液中浸泡除锈;
ⅱ.碳酸钠法:将腐蚀文物置于含Na2CO3的缓冲溶液中浸泡,使CuCl转化为难溶的Cu2(OH)2CO3;
ⅲ.BTA保护法:
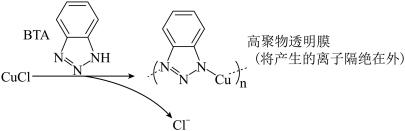
请回答下列问题:
①写出碳酸钠法的离子方程式___________________ 。
②三种方法中,BTA保护法应用最为普遍,分析其可能的优点有___________ 。
A.在青铜器表面形成一层致密的透明保护膜
B.替换出锈层中的Cl-,能够高效的除去有害锈
C.和酸浸法相比,不破坏无害锈,可以保护青铜器的艺术价值,做到“修旧如旧”
(1)查阅高中教材得知铜锈为Cu2(OH)2CO3,俗称铜绿,可溶于酸。铜绿在一定程度上可以提升青铜器的艺术价值。参与形成铜绿的物质有Cu和
(2)继续查阅中国知网,了解到铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl。考古学家将铜锈分为无害锈和有害锈,结构如图所示:

Cu2(OH)2CO3和Cu2(OH)3Cl分别属于无害锈和有害锈,请解释原因
(3)文献显示有害锈的形成过程中会产生CuCl(白色不溶于水的固体),请结合下图回答:

① 过程Ⅰ的正极反应物是
② 过程Ⅰ负极的电极反应式是
(4)青铜器的修复有以下三种方法:
ⅰ.柠檬酸浸法:将腐蚀文物直接放在2%-3%的柠檬酸溶液中浸泡除锈;
ⅱ.碳酸钠法:将腐蚀文物置于含Na2CO3的缓冲溶液中浸泡,使CuCl转化为难溶的Cu2(OH)2CO3;
ⅲ.BTA保护法:

请回答下列问题:
①写出碳酸钠法的离子方程式
②三种方法中,BTA保护法应用最为普遍,分析其可能的优点有
A.在青铜器表面形成一层致密的透明保护膜
B.替换出锈层中的Cl-,能够高效的除去有害锈
C.和酸浸法相比,不破坏无害锈,可以保护青铜器的艺术价值,做到“修旧如旧”
您最近一年使用:0次
2019-06-11更新
|
1882次组卷
|
7卷引用:河南省名校联盟2020-2021学年高二下学期开学考试化学试题



