1 . 近日,中科院上海硅酸盐研究所施剑林团队报道了MnOOH催化谷胱甘肽自氧化产生活性氧。某小组以菱锰矿(主要成分为 ,含少量
,含少量 、FeO、CoO、
、FeO、CoO、 、
、 等)为原料制备高纯度MnOOH,流程如下:
等)为原料制备高纯度MnOOH,流程如下:
②几种金属离子沉淀的pH如表所示:
下列叙述正确的是
 ,含少量
,含少量 、FeO、CoO、
、FeO、CoO、 、
、 等)为原料制备高纯度MnOOH,流程如下:
等)为原料制备高纯度MnOOH,流程如下: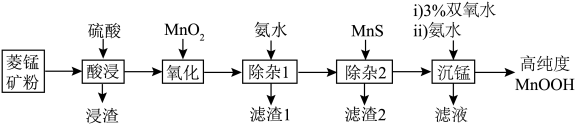
②几种金属离子沉淀的pH如表所示:
| 金属氢氧化物 |  |  |  |  |  |
| 开始沉淀的pH | 2.7 | 7.6 | 4.0 | 7.6 | 8.1 |
| 完全沉淀的pH | 3.7 | 9.6 | 5.2 | 9.2 | 10.1 |
A.滤渣1的成分是 和 和 |
B.“氧化”反应的离子方程式为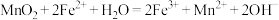 |
C.“除杂2”的原理是 |
D.双氧水氧化 ,滤液一定显酸性 ,滤液一定显酸性 |
您最近一年使用:0次
解题方法
2 . 某化学小组同学对FeCl3溶液与Na2SO3溶液的反应进行探究
(1)请用离子方程式表示Na2SO3溶液显碱性的原因___________ 。
(2)甲同学认为实验①发生了氧化还原,其反应的离子方程式为___________ ,取反应后的溶液中加入K3[Fe(CN)6]溶液,观察到___________ (填现象),证实了此结论。
(3)乙同学检验红褐色沉淀为Fe(OH)3,请用平衡移动原理解释生成沉淀的原因___________ 。
(4)丙组同学检验实验②中无Fe2+,为探究此浓度下是否能发生氧化还原反应,做了如下实验:向U形管的左侧加入___________ ,观察到___________ (填实验现象),证实此浓度下的FeCl3溶液与Na2SO3溶液可以发生氧化还原反应。

(5)查阅资料已知:Fe3+、OH-、SO 可形成难电离的红色配合物:
可形成难电离的红色配合物: 。请解释实验②中无Fe2+生成的原因
。请解释实验②中无Fe2+生成的原因___________ 。
(6)通过以上探究,FeCl3溶液与Na2SO3溶液的反应受___________ 因素影响(至少写出两项)。
| 实验操作 | 现象 | |
| ① |  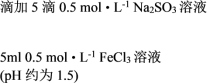 | 溶液由棕黄色变为红色,无沉淀生成。 放置6小时后,溶液变为淡黄色,始终无沉淀生成。 |
② |  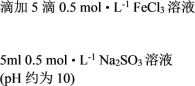 | 溶液由棕黄色变为红色,无沉淀生成。 放置6小时后,生成红褐色沉淀,上层清液为无色。 |
(1)请用离子方程式表示Na2SO3溶液显碱性的原因
(2)甲同学认为实验①发生了氧化还原,其反应的离子方程式为
(3)乙同学检验红褐色沉淀为Fe(OH)3,请用平衡移动原理解释生成沉淀的原因
(4)丙组同学检验实验②中无Fe2+,为探究此浓度下是否能发生氧化还原反应,做了如下实验:向U形管的左侧加入

(5)查阅资料已知:Fe3+、OH-、SO
 可形成难电离的红色配合物:
可形成难电离的红色配合物: 。请解释实验②中无Fe2+生成的原因
。请解释实验②中无Fe2+生成的原因(6)通过以上探究,FeCl3溶液与Na2SO3溶液的反应受
您最近一年使用:0次
名校
解题方法
3 . 含氯消毒剂会与水中有机物发生氯代反应,生成物会在人体内积留产生慢性累积中毒,诱发癌症,而 ClO2 是国际上公认的最理想的更换替代产品,我国从2000年起就逐渐用它取代了其它含氯消毒剂。市面上销售的二氧化氯消毒片都是二氧化氯的前体:亚氯酸钠,亚氯酸钠溶液与酸、有机物、还原剂或者氯供体接触,将会发生反应生成二氧化氯气体。
(1)亚氯酸钠溶液和盐酸反应产生ClO2的化学方程式为___________ 。
(2)此反应中氧化剂与还原剂的物质的量之比为____ ,反应中盐酸的作用是____ (填编号)。
A.只有还原性 B.还原性和酸性 C.只有酸性 D.氧化性和酸性
(3)将二氧化氯通入含 CN-的废水中,产生两种对环境友好的气体,氯被还原成最低价离子,发生反应的离子方程式为______ 。
(4)(CN)2、(OCN)2、(SCN)2 等通称为拟卤素,它们的性质与卤素相似,氧化性强弱顺序是:F2>(OCN)2>Cl2>(CN)2>(SCN)2>I2,下列方程式中错误的是____(填编号)。
(5)在ClO2的制备方法中,有下列两种制备方法:
方法 1:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法 2:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O:
①分析方法1的化学反应方程式,用双线桥标出电子转移方向和数目______ ,2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O。
②方法2在实际制备过程中,NaClO3与H2O2的物质的量之比小于2,可能的原因是______ 。
③用方法2制备的ClO2更适合用于饮用水的消毒,其主要原因是_______ 。
(6)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的 ,其含量应不超过0.2mg/L,可用FeCl2溶液处理饮用水中残留的
,其含量应不超过0.2mg/L,可用FeCl2溶液处理饮用水中残留的 ,反应后的溶液中可以产生丁达尔现象,写出反应的离子方程式
,反应后的溶液中可以产生丁达尔现象,写出反应的离子方程式_________ 。
(7)饮用水中的ClO2、 含量可用连续碘量法进行测定。ClO2被I-还原为
含量可用连续碘量法进行测定。ClO2被I-还原为 、Cl-的转化率与溶液pH的关系如图所示,当pH≤2.0时,
、Cl-的转化率与溶液pH的关系如图所示,当pH≤2.0时, 也能被I-完全还原为Cl-,反应生成的I-的量可以用已知浓度的Na2S2O3溶液来确定:2Na2S2O3+I2=Na2S4O6+2NaI。
也能被I-完全还原为Cl-,反应生成的I-的量可以用已知浓度的Na2S2O3溶液来确定:2Na2S2O3+I2=Na2S4O6+2NaI。
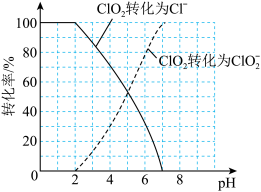
①请写出pH≤2.0时 与I-反应的离子方程式:
与I-反应的离子方程式:_________ 。
②请完成相应的实验步骤:
步骤 1:准确量取V mL水样加入到锥形瓶中;
步骤 2:调节水样的pH为7.0~8.0;
步骤 3:加入足量的KI晶体,充分反应后,滴入少量淀粉溶液,溶液显蓝色;
步骤 4:当加入的c mol/LNa2S2O3溶液体积为V1 mL,恰好完全反应,溶液蓝色恰好褪去;
步骤 5:_____ ,溶液再次显蓝色;
步骤 6:当加入的 c mol/L Na2S2O3 溶液体积达到 V2 mL,溶液蓝色恰好再次褪去。
③根据上述分析数据,测得该饮用水中 的浓度为
的浓度为_______ mol/L(用含字母的代数式表示)。
(1)亚氯酸钠溶液和盐酸反应产生ClO2的化学方程式为
(2)此反应中氧化剂与还原剂的物质的量之比为
A.只有还原性 B.还原性和酸性 C.只有酸性 D.氧化性和酸性
(3)将二氧化氯通入含 CN-的废水中,产生两种对环境友好的气体,氯被还原成最低价离子,发生反应的离子方程式为
(4)(CN)2、(OCN)2、(SCN)2 等通称为拟卤素,它们的性质与卤素相似,氧化性强弱顺序是:F2>(OCN)2>Cl2>(CN)2>(SCN)2>I2,下列方程式中错误的是____(填编号)。
| A.2NaSCN+MnO2+2H2SO4=Na2SO4+(SCN)2↑+MnSO4+2H2O |
| B.(CN)2+2KI=2KCN+I2 |
| C.Cl2+2NaOCN= (OCN)2+2NaCl |
| D.2AgCN=2Ag+(CN)2 |
(5)在ClO2的制备方法中,有下列两种制备方法:
方法 1:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法 2:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O:
①分析方法1的化学反应方程式,用双线桥标出电子转移方向和数目
②方法2在实际制备过程中,NaClO3与H2O2的物质的量之比小于2,可能的原因是
③用方法2制备的ClO2更适合用于饮用水的消毒,其主要原因是
(6)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的
 ,其含量应不超过0.2mg/L,可用FeCl2溶液处理饮用水中残留的
,其含量应不超过0.2mg/L,可用FeCl2溶液处理饮用水中残留的 ,反应后的溶液中可以产生丁达尔现象,写出反应的离子方程式
,反应后的溶液中可以产生丁达尔现象,写出反应的离子方程式(7)饮用水中的ClO2、
 含量可用连续碘量法进行测定。ClO2被I-还原为
含量可用连续碘量法进行测定。ClO2被I-还原为 、Cl-的转化率与溶液pH的关系如图所示,当pH≤2.0时,
、Cl-的转化率与溶液pH的关系如图所示,当pH≤2.0时, 也能被I-完全还原为Cl-,反应生成的I-的量可以用已知浓度的Na2S2O3溶液来确定:2Na2S2O3+I2=Na2S4O6+2NaI。
也能被I-完全还原为Cl-,反应生成的I-的量可以用已知浓度的Na2S2O3溶液来确定:2Na2S2O3+I2=Na2S4O6+2NaI。
①请写出pH≤2.0时
 与I-反应的离子方程式:
与I-反应的离子方程式:②请完成相应的实验步骤:
步骤 1:准确量取V mL水样加入到锥形瓶中;
步骤 2:调节水样的pH为7.0~8.0;
步骤 3:加入足量的KI晶体,充分反应后,滴入少量淀粉溶液,溶液显蓝色;
步骤 4:当加入的c mol/LNa2S2O3溶液体积为V1 mL,恰好完全反应,溶液蓝色恰好褪去;
步骤 5:
步骤 6:当加入的 c mol/L Na2S2O3 溶液体积达到 V2 mL,溶液蓝色恰好再次褪去。
③根据上述分析数据,测得该饮用水中
 的浓度为
的浓度为
您最近一年使用:0次
名校
4 . 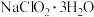 具有强氧化性,在消毒和果蔬保鲜等方面有广泛应用。
具有强氧化性,在消毒和果蔬保鲜等方面有广泛应用。
Ⅰ.下列是制备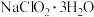 的一种流程:
的一种流程:
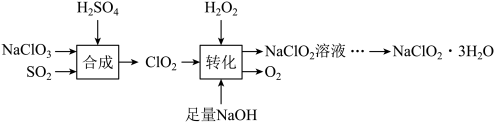
已知: 饱和溶液在低于38℃时析出
饱和溶液在低于38℃时析出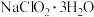 ,高于38℃时析出
,高于38℃时析出 。
。
(1)写出“合成”中发生反应的离子方程式:___________ 。若生成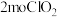 时,电子转移的数目是
时,电子转移的数目是___________ 。
(2)“转化”过程中 的作用是
的作用是___________ (选填“氧化剂”或“还原剂”),写出反应的化学方程式是___________ 。
(3)由 溶液得到
溶液得到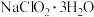 的操作为:蒸发浓缩,
的操作为:蒸发浓缩,___________ ,过滤洗涤,得到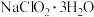 产品。
产品。
Ⅱ.为确定产品的纯度,进行如下实验:
步骤1:取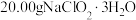 样品,溶于经煮沸冷却后的蒸馏水,配成200.00mL溶液。
样品,溶于经煮沸冷却后的蒸馏水,配成200.00mL溶液。
步骤2:取出20.00mL配制的溶液于锥形瓶中,加入略过量的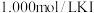 溶液,塞上瓶塞。充分反应后,向锥形瓶中滴加两滴淀粉溶液,用
溶液,塞上瓶塞。充分反应后,向锥形瓶中滴加两滴淀粉溶液,用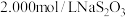 溶液滴定至终点。
溶液滴定至终点。
步骤3:重复以上操作2-3次测得滴定 溶液的平均体积为22.00mL。
溶液的平均体积为22.00mL。
已知: ,
,
(4)试计算该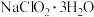 样品的纯度
样品的纯度___________ 。
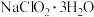 具有强氧化性,在消毒和果蔬保鲜等方面有广泛应用。
具有强氧化性,在消毒和果蔬保鲜等方面有广泛应用。Ⅰ.下列是制备
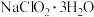 的一种流程:
的一种流程:
已知:
 饱和溶液在低于38℃时析出
饱和溶液在低于38℃时析出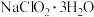 ,高于38℃时析出
,高于38℃时析出 。
。(1)写出“合成”中发生反应的离子方程式:
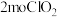 时,电子转移的数目是
时,电子转移的数目是(2)“转化”过程中
 的作用是
的作用是(3)由
 溶液得到
溶液得到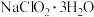 的操作为:蒸发浓缩,
的操作为:蒸发浓缩,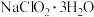 产品。
产品。Ⅱ.为确定产品的纯度,进行如下实验:
步骤1:取
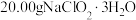 样品,溶于经煮沸冷却后的蒸馏水,配成200.00mL溶液。
样品,溶于经煮沸冷却后的蒸馏水,配成200.00mL溶液。步骤2:取出20.00mL配制的溶液于锥形瓶中,加入略过量的
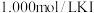 溶液,塞上瓶塞。充分反应后,向锥形瓶中滴加两滴淀粉溶液,用
溶液,塞上瓶塞。充分反应后,向锥形瓶中滴加两滴淀粉溶液,用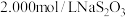 溶液滴定至终点。
溶液滴定至终点。步骤3:重复以上操作2-3次测得滴定
 溶液的平均体积为22.00mL。
溶液的平均体积为22.00mL。已知:
 ,
,
(4)试计算该
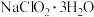 样品的纯度
样品的纯度
您最近一年使用:0次
名校
5 . 工业生产中除去电石渣浆(含 )中的
)中的 并制取硫酸盐的一种常用流程如图所示。下列说法正确的是
并制取硫酸盐的一种常用流程如图所示。下列说法正确的是
 )中的
)中的 并制取硫酸盐的一种常用流程如图所示。下列说法正确的是
并制取硫酸盐的一种常用流程如图所示。下列说法正确的是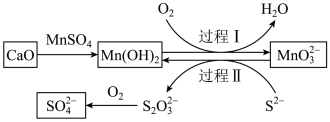
A.碱性条件下,氧化性: |
B.过程Ⅱ中,反应的离子方程式为 |
C.将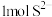 转化为 转化为 理论上需要 理论上需要 的体积为 的体积为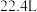 (标准状况) (标准状况) |
| D.该过程中涉及的化学反应均是氧化还原反应 |
您最近一年使用:0次
2024-01-14更新
|
908次组卷
|
2卷引用:云南省师范大学附属中学2023-2024学年高一上学期 期末化学试卷
名校
6 . 氧化还原反应在人类的生产、生活中有着重要的应用。回答下列问题:
(1)我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭按一定比例混合而成的,爆炸时发生的反应为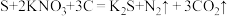 。该反应中,被还原的元素是
。该反应中,被还原的元素是________ (填元素符号),消耗的还原剂和氧化剂质量比为_________ 。
(2)实验室制备Cl2有三种常用方法:
a.
b.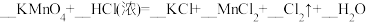
c.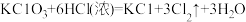
①配平反应b的方程式:___________ 。
②当三个反应中参与反应的HCl的质量相同时,得到Cl2的质量最多的是反应_____ (填“a”“b”或“c”)。
(3)以MnO2为原料在加热熔融条件下可以制取K2MnO4,该反应中包含的所有物质为MnO2、K2 MnO4、KCl、KOH、KClO3、H2O。写出该反应的化学方程式:___________ 。
(4)油画创作通常需要用到多种无机颜料。研究发现,在不同的空气湿度和光照条件下,颜料雌黄(As2S3,As为+3价,S为-2价)褪色的主要原因是发生了以下两种化学反应:
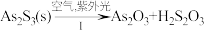 ,
,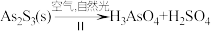 。则反应I和Ⅱ中氧化相同量的As2S3,消耗O2与H2O的化学计量数之比:I
。则反应I和Ⅱ中氧化相同量的As2S3,消耗O2与H2O的化学计量数之比:I______ Ⅱ(填“>”“<”或“=”),转移的电子数之比为_______ 。
(1)我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭按一定比例混合而成的,爆炸时发生的反应为
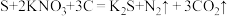 。该反应中,被还原的元素是
。该反应中,被还原的元素是(2)实验室制备Cl2有三种常用方法:
a.

b.
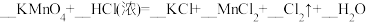
c.
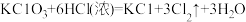
①配平反应b的方程式:
②当三个反应中参与反应的HCl的质量相同时,得到Cl2的质量最多的是反应
(3)以MnO2为原料在加热熔融条件下可以制取K2MnO4,该反应中包含的所有物质为MnO2、K2 MnO4、KCl、KOH、KClO3、H2O。写出该反应的化学方程式:
(4)油画创作通常需要用到多种无机颜料。研究发现,在不同的空气湿度和光照条件下,颜料雌黄(As2S3,As为+3价,S为-2价)褪色的主要原因是发生了以下两种化学反应:
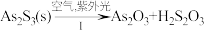 ,
,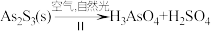 。则反应I和Ⅱ中氧化相同量的As2S3,消耗O2与H2O的化学计量数之比:I
。则反应I和Ⅱ中氧化相同量的As2S3,消耗O2与H2O的化学计量数之比:I
您最近一年使用:0次
7 . 某小组同学探究不同条件下氯气与二价锰化合物的反应
资料:i.Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、 (绿色)、
(绿色)、 (紫色)。
(紫色)。
ii.浓碱条件下, 可被OH-还原为
可被OH-还原为 。
。
iii.Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略)
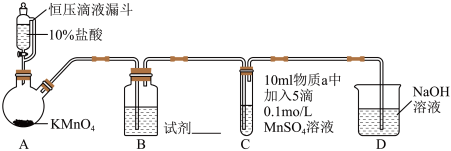
(1)实验室中利用MnO2和浓盐酸加热的反应来制取氯气,对比本实验A中的反应,说明氧化性MnO2_______ KMnO4(填“>”或“<”)。
(2)B中试剂是_______ 。(填序号)
①浓硫酸 ②饱和食盐水
(3)通入Cl2前,Ⅱ、Ⅲ中沉淀由白色[Mn(OH)2]变为棕黑色,补全发生反应的化学方程式:___________ 。
Mn(OH)2+_______=________+H2O
(4)对比实验I、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是:
①__________ ;
②在碱性条件下可以被氧化到更高价态。
(5)根据资料ii,Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将 氧化为
氧化为 。
。
①用化学方程式表示可能导致溶液碱性减弱的原因___________ ,但通过实验测定,溶液的碱性变化很小。
②针对原因二小组同学做如下探究:
Ⅳ中溶液紫色迅速变为绿色的离子方程式为_________ 。
 +OH-=
+OH-= +___________+___________。
+___________+___________。
资料:i.Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、
 (绿色)、
(绿色)、 (紫色)。
(紫色)。ii.浓碱条件下,
 可被OH-还原为
可被OH-还原为 。
。iii.Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略)

| 序号 | I | Ⅱ | Ⅲ |
| 物质a | 水 | 5%NaOH溶液 | 40%NaOH溶液 |
| 通入Cl2前 C中实验现象 | 得到无色溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 |
| 通入Cl2后 C中实验现象 | 产生棕黑色沉淀,且放置后不发生变化 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
(1)实验室中利用MnO2和浓盐酸加热的反应来制取氯气,对比本实验A中的反应,说明氧化性MnO2
(2)B中试剂是
①浓硫酸 ②饱和食盐水
(3)通入Cl2前,Ⅱ、Ⅲ中沉淀由白色[Mn(OH)2]变为棕黑色,补全发生反应的化学方程式:
Mn(OH)2+_______=________+H2O
(4)对比实验I、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是:
①
②在碱性条件下可以被氧化到更高价态。
(5)根据资料ii,Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将
 氧化为
氧化为 。
。①用化学方程式表示可能导致溶液碱性减弱的原因
②针对原因二小组同学做如下探究:
| 序号 | Ⅳ | Ⅴ |
| 操作 | 取Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液 | 取Ⅲ中放置后的1mL悬浊液,加入4mL水, |
| 现象 | 溶液紫色迅速变为绿色,且绿色缓慢加深 | 溶液紫色缓慢加深 |
 +OH-=
+OH-= +___________+___________。
+___________+___________。
您最近一年使用:0次
23-24高一上·全国·期末
名校
8 . 氯气和漂白粉是现代工业和生活中常用的杀菌消毒剂,以下为制备两种消毒剂的方法,请回答下列问题:
(1)实验室沿用舍勒的方法制取 时选用图中装置
时选用图中装置_______ (填“A”或“B”),反应的离子方程式为_______ ,装置B中管f的作用是_______ 。
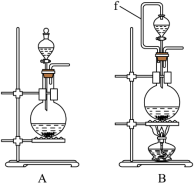
(2)实验室制取干燥、纯净的 ,所需图装置的接口连接顺序为:发生装置→
,所需图装置的接口连接顺序为:发生装置→_______ (填字母)。
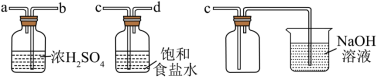
(3)反应停止后,实验小组检验烧瓶中还有 和盐酸。小组同学探究不继续产生
和盐酸。小组同学探究不继续产生 的原因。查阅资料表明,反应物或生成物浓度会影响氧化剂、还原剂的氧化性、还原性强弱。
的原因。查阅资料表明,反应物或生成物浓度会影响氧化剂、还原剂的氧化性、还原性强弱。
【提出猜想】
猜想1: 降低,氧化剂
降低,氧化剂_______ (填化学式)氧化性减弱。
猜想2:_______ 减弱。
猜想3: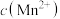 增大,氧化剂氧化性减弱。
增大,氧化剂氧化性减弱。
【实验过程】向反应后剩余物质中加入以下物质,请补充表格:
【实验拓展】经过探究,小组同学认为硫酸、 固体和
固体和 混合加热也可制取
混合加热也可制取 。请配平该反应的方程式:
。请配平该反应的方程式:_______ 。
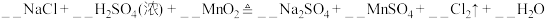
(1)实验室沿用舍勒的方法制取
 时选用图中装置
时选用图中装置
(2)实验室制取干燥、纯净的
 ,所需图装置的接口连接顺序为:发生装置→
,所需图装置的接口连接顺序为:发生装置→
(3)反应停止后,实验小组检验烧瓶中还有
 和盐酸。小组同学探究不继续产生
和盐酸。小组同学探究不继续产生 的原因。查阅资料表明,反应物或生成物浓度会影响氧化剂、还原剂的氧化性、还原性强弱。
的原因。查阅资料表明,反应物或生成物浓度会影响氧化剂、还原剂的氧化性、还原性强弱。【提出猜想】
猜想1:
 降低,氧化剂
降低,氧化剂猜想2:
猜想3:
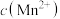 增大,氧化剂氧化性减弱。
增大,氧化剂氧化性减弱。【实验过程】向反应后剩余物质中加入以下物质,请补充表格:
| 序号 | 实验操作 | 有、无氯气 | 结论 |
| 1 | 加入浓硫酸,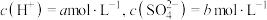 | 有氯气 | 猜想1正确 |
| 2 | 加入氯化钠固体,使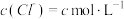 | 有氯气 | 猜想2正确 |
| 3 | 加入浓硫酸和 固体,使 固体,使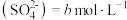 | 猜想3正确 |
 固体和
固体和 混合加热也可制取
混合加热也可制取 。请配平该反应的方程式:
。请配平该反应的方程式: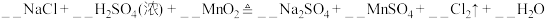
您最近一年使用:0次
2024-01-07更新
|
654次组卷
|
4卷引用:期末测试卷01-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册)
(已下线)期末测试卷01-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册)江西省上饶市清源学校2023-2024学年高三上学期12月考试化学试题 2023-2024学年高一上学期化学人教版(2019)必修第一册 期末综合测试题(一)河南省新乡市原阳县第一高级中学2023-2024学年高一上学期1月月考化学试题
名校
解题方法
9 . Ⅰ.某化学兴趣小组利用某工业废铁屑制备食品添加剂FeSO4·7H2O,流程图如下
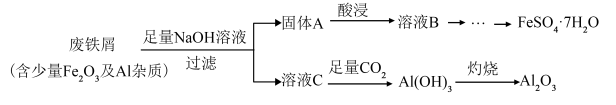
(1)溶液C中的溶质为___________ (填写化学式);
(2)“酸浸”时需加入试剂的化学式为___________ ,请写出该过程中属于非氧化还原反应的离子方程式___________ ;
(3)溶液C→Al(OH)3的离子方程式是___________ ;
(4)“灼烧”操作应选择下列哪一种仪器___________(填序号)
Ⅱ.高锰酸钾溶液常用于物质的定性检验与定量分析。
(5)现用其测定某补血剂片中亚铁的含量:称取含 (式量为278)的补血剂片a g,充分研磨后溶于水,配成100mL溶液,取25.00mL的该溶液与0.1mol/L的酸性高锰酸钾溶液反应,上述过程发生反应的离子反应式:
(式量为278)的补血剂片a g,充分研磨后溶于水,配成100mL溶液,取25.00mL的该溶液与0.1mol/L的酸性高锰酸钾溶液反应,上述过程发生反应的离子反应式: ___________ ;
(6)甲同学四次实验消耗的KMnO4溶液体积数据如下
根据甲同学的实验数据,该补血剂中 的质量分数为
的质量分数为___________ (用a表示)。
(7)补铁剂使用时建议与维生素C同服,乙同学猜测维生素C可将Fe3+转化为Fe2+,以利于人体吸收。为了验证这一猜想,设计了如下实验:
由上述实验能否得出“维生素C可将Fe3+转化为Fe2+”的结论?回答并说明理由:___________ 。

(1)溶液C中的溶质为
(2)“酸浸”时需加入试剂的化学式为
(3)溶液C→Al(OH)3的离子方程式是
(4)“灼烧”操作应选择下列哪一种仪器___________(填序号)
A. | B. | C. | D. |
Ⅱ.高锰酸钾溶液常用于物质的定性检验与定量分析。
(5)现用其测定某补血剂片中亚铁的含量:称取含
 (式量为278)的补血剂片a g,充分研磨后溶于水,配成100mL溶液,取25.00mL的该溶液与0.1mol/L的酸性高锰酸钾溶液反应,上述过程发生反应的离子反应式:
(式量为278)的补血剂片a g,充分研磨后溶于水,配成100mL溶液,取25.00mL的该溶液与0.1mol/L的酸性高锰酸钾溶液反应,上述过程发生反应的离子反应式: (6)甲同学四次实验消耗的KMnO4溶液体积数据如下
| 测定次数 | 第1次 | 第2次 | 第3次 | 第4次 |
| V(KMnO4液)/mL | 24.98 | 25.02 | 25.00 | 20.00 |
 的质量分数为
的质量分数为(7)补铁剂使用时建议与维生素C同服,乙同学猜测维生素C可将Fe3+转化为Fe2+,以利于人体吸收。为了验证这一猜想,设计了如下实验:
| 实验方案 | 实验现象 |
| 取适量Fe2(SO4)3溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液 | 紫色褪去 |
您最近一年使用:0次
2023-12-30更新
|
216次组卷
|
3卷引用:浙江省瑞安中学2023-2024学年高一上学期12月月考化学试卷
名校
解题方法
10 . 镍、钴是重要的战略物资,但资源匮乏。一种利用酸浸出法从冶金厂废炉渣中提取镍和钴的工艺流程如下:
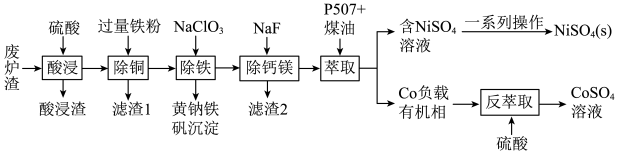
已知:i.酸浸液中的金属阳离子有Ni2+、Co2+、Cu2+、Mg2+、Ca2+等
ii.NiSO4在水中的溶解度随温度升高而增大
回答下列问题:
(1)“滤渣1”的主要成分是___________ 。(写化学式)
(2)黄钠铁矾的化学式为Na2Fe6(SO4)4(OH)12,“除铁”的离子方程式为___________ 。
(3)“除钙镁”时,随pH降低,NaF用量急剧增加,原因是___________ (结合平衡理论解释)。Ca2+和Mg2+沉淀完全时,溶液中F-的浓度c(F-)最小为___________ mol·L-1。[已知离子浓度≤10-5mol/L时,认为该离子沉淀完全,Ksp(CaF2)=1.0×10-10(mol/L)3,Ksp(MgF2)=7.5×10-11(mol/L)3]
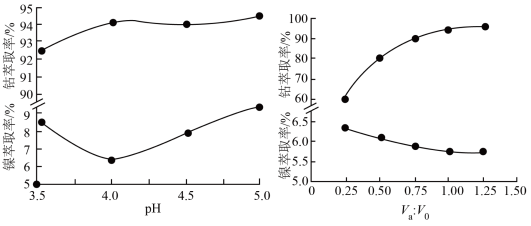
(4)镍、钴萃取率与料液pH、萃取剂体积与料液体积比Va:V0的关系曲线如下图所示,则“萃取”时应选择的pH和Va:V0分别为___________ 、___________ 。
(5)获得NiSO4(s)的“一系列操作”是___________ 。
(6)该工艺流程中,可循环利用的物质是___________ 。

已知:i.酸浸液中的金属阳离子有Ni2+、Co2+、Cu2+、Mg2+、Ca2+等
ii.NiSO4在水中的溶解度随温度升高而增大
回答下列问题:
(1)“滤渣1”的主要成分是
(2)黄钠铁矾的化学式为Na2Fe6(SO4)4(OH)12,“除铁”的离子方程式为
(3)“除钙镁”时,随pH降低,NaF用量急剧增加,原因是
(4)镍、钴萃取率与料液pH、萃取剂体积与料液体积比Va:V0的关系曲线如下图所示,则“萃取”时应选择的pH和Va:V0分别为

(5)获得NiSO4(s)的“一系列操作”是
(6)该工艺流程中,可循环利用的物质是
您最近一年使用:0次
2023-12-27更新
|
593次组卷
|
4卷引用:山东省实验中学2023-2024学年高三上学期11月二诊化学试题
山东省实验中学2023-2024学年高三上学期11月二诊化学试题山东省淄博市部分学校2023-2024学年高三上学期联考化学试卷广东省深圳市实验学校高中部2023-2024学年高二上学期第三阶段考试化学试题(已下线)题型16 无机化工流程综合分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)



