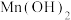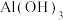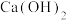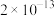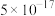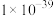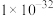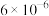22-23高一下·四川·期中
名校
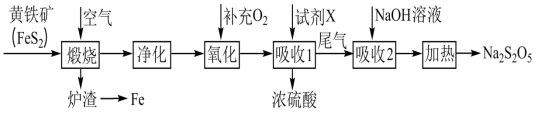
1 . 以黄铁矿(主要成分为FeS2)为原料生产硫酸,并将产出的炉渣和尾气进行资源综合利用,减轻对环境的污染,其中一种流程如下图所示。___________ 。
(2)“氧化”时,反应的化学方程式为___________ 。
(3)工业上,吸收SO3时宜选用的试剂X为___________ 。
(4)因为Na2S2O5在保存过程中发生___________ (填“氧化”或“还原”)反应,导致商品Na2S2O5中不可避免地存在Na2SO4.欲检验是否变质,可取少量样品溶于水中,___________ ,说明含有 。
。
(5)Na2S2O5可用于葡萄酒的抗氧化剂。用碘标准液可测定葡萄酒中Na2S2O5的残留量,请配平该反应的方程式:___________ 。
________S2O +________I2+_______H2O=______
+________I2+_______H2O=______ +_______I-+_______H+
+_______I-+_______H+
(6)某同学以如图所示装置用电化学原理模拟生产硫酸:________ (填“正”或“负”)极。写出通入O2的电极的电极反应式________ 。
②若此过程中转移了0.4mol电子,则理论上可以得到硫酸的质量为_____ ;溶液中的H+_____ (填“从左向右”或“从右向左”)移动。
(2)“氧化”时,反应的化学方程式为
(3)工业上,吸收SO3时宜选用的试剂X为
(4)因为Na2S2O5在保存过程中发生
 。
。(5)Na2S2O5可用于葡萄酒的抗氧化剂。用碘标准液可测定葡萄酒中Na2S2O5的残留量,请配平该反应的方程式:
________S2O
 +________I2+_______H2O=______
+________I2+_______H2O=______ +_______I-+_______H+
+_______I-+_______H+(6)某同学以如图所示装置用电化学原理模拟生产硫酸:

②若此过程中转移了0.4mol电子,则理论上可以得到硫酸的质量为
您最近一年使用:0次
名校
解题方法
2 . 下列反应的离子方程式书写正确的是
A. 溶液中加入过量醋酸溶液: 溶液中加入过量醋酸溶液: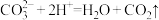 |
B. 溶液中通入过量 溶液中通入过量 : :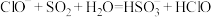 |
C. 溶液中加入 溶液中加入 溶液: 溶液: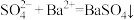 |
D.酸性高锰酸钾溶液中滴加KI溶液: |
您最近一年使用:0次
2023-02-10更新
|
990次组卷
|
2卷引用:山东省潍坊市2022-2023学年高一上学期期末考试化学试题
名校
3 . 以红土镍矿(主要含有Fe2O3、FeO、NiO、SiO2等)为原料,获取净水剂黄钠铁矾[NaFe3(SO4)2(OH)6]和纳米镍粉的部分工艺流程如图:
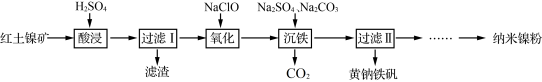
已知:
①Fe3+在pH约为3.7时可完全转化为Fe(OH)3,Fe2+在pH约为9时可完全转化为Fe(OH)2;
②SiO2为不溶于水的酸性氧化物,常温下和硫酸不反应,但可以溶于强碱溶液。
下列说法不正确的是

已知:
①Fe3+在pH约为3.7时可完全转化为Fe(OH)3,Fe2+在pH约为9时可完全转化为Fe(OH)2;
②SiO2为不溶于水的酸性氧化物,常温下和硫酸不反应,但可以溶于强碱溶液。
下列说法不正确的是
| A.“滤渣”的主要成分是SiO2 |
| B.为提高“酸浸”速率,可将稀硫酸更换为浓硫酸 |
| C.“氧化”过程发生的离子方程式为:2H++2Fe2++ClO-=2Fe3++Cl-+H2O |
| D.“沉铁”过程中加入碳酸钠的作用是调节溶液的酸碱度,应将pH控制在3.7~9 |
您最近一年使用:0次
2023-01-14更新
|
376次组卷
|
2卷引用:山东师范大学附属中学 2022-2023 学年高一上学期学科水平自我诊断化学试题
解题方法
4 . 锰酸锂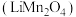 是一种锂电池的正极材料。工业上以方锰矿(主要成分为
是一种锂电池的正极材料。工业上以方锰矿(主要成分为 ,还含有少量的
,还含有少量的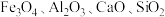 )为原料制备锰酸锂的流程如下:
)为原料制备锰酸锂的流程如下:
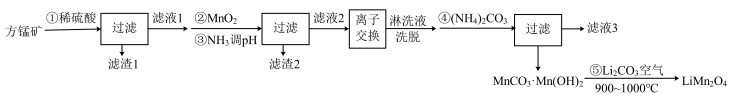
已知:I. 时,相关物质的
时,相关物质的 如下表:
如下表:
II. 时,
时, 电离常数
电离常数
III.离子浓度低于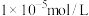 时即为沉淀完全
时即为沉淀完全
回答下列问题:
(1)写出步骤①溶于稀硫酸时杂质 反应的离子方程式
反应的离子方程式___________ 。
(2)滤渣1的成分是_____ (填化学式);步骤②加入 的目的是
的目的是____ 。
(3)步骤③加入 目的是除去杂质离子,若溶液中
目的是除去杂质离子,若溶液中 浓度为
浓度为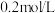 ,要确保杂质离子沉淀完全,同时不降低产品产率,步骤③调控
,要确保杂质离子沉淀完全,同时不降低产品产率,步骤③调控 的范围应该为
的范围应该为_______ 。反应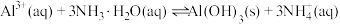 的平衡常数
的平衡常数
________ 。
(4)“离子交换”步骤和“洗脱”过程是利用反应: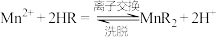 (
( 是氢型交换树脂)的平衡移动将
是氢型交换树脂)的平衡移动将 进一步提纯,为了提高洗脱效率,又不引入其他杂质,淋洗液应选用
进一步提纯,为了提高洗脱效率,又不引入其他杂质,淋洗液应选用_____ 。
(5)步骤④反应未见气体生成,则该反应留存在滤液3中的产物有___________ (填化学式)。
(6)步骤⑤反应的化学方程式为___________ 。
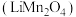 是一种锂电池的正极材料。工业上以方锰矿(主要成分为
是一种锂电池的正极材料。工业上以方锰矿(主要成分为 ,还含有少量的
,还含有少量的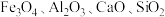 )为原料制备锰酸锂的流程如下:
)为原料制备锰酸锂的流程如下:
已知:I.
 时,相关物质的
时,相关物质的 如下表:
如下表:物质 |
|
|
|
|
|
|
|
|
|
|
|
 时,
时, 电离常数
电离常数
III.离子浓度低于
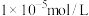 时即为沉淀完全
时即为沉淀完全回答下列问题:
(1)写出步骤①溶于稀硫酸时杂质
 反应的离子方程式
反应的离子方程式(2)滤渣1的成分是
 的目的是
的目的是(3)步骤③加入
 目的是除去杂质离子,若溶液中
目的是除去杂质离子,若溶液中 浓度为
浓度为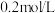 ,要确保杂质离子沉淀完全,同时不降低产品产率,步骤③调控
,要确保杂质离子沉淀完全,同时不降低产品产率,步骤③调控 的范围应该为
的范围应该为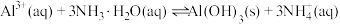 的平衡常数
的平衡常数
(4)“离子交换”步骤和“洗脱”过程是利用反应:
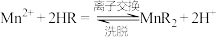 (
( 是氢型交换树脂)的平衡移动将
是氢型交换树脂)的平衡移动将 进一步提纯,为了提高洗脱效率,又不引入其他杂质,淋洗液应选用
进一步提纯,为了提高洗脱效率,又不引入其他杂质,淋洗液应选用(5)步骤④反应未见气体生成,则该反应留存在滤液3中的产物有
(6)步骤⑤反应的化学方程式为
您最近一年使用:0次
2023-01-13更新
|
1142次组卷
|
2卷引用:四川省绵阳市2023届高三第二次诊断性考试理科综合化学试题
名校
5 . 氯气可用于制取漂白剂和自来水消毒。
(1)下图是实验室制备氯气的制备和除杂装置
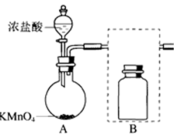
①A为氯气发生装置。A中反应方程式是_______ (锰被还原为 )。
)。
②将除杂装置B补充完整并标明所用试剂_______ 。
(2)“84”消毒液也可用于漂白,其工业制法是控制在常温条件下,将氯气通入NaOH溶液中,反应的离子方程式为_______ 。
(3)同学们探究“84”消毒液在不同pH下使红纸褪色的情况,做了如下实验:
步骤1:将5mL市售“84”消毒液稀释100倍,测得稀释后溶液的 ;
;
步骤2:将稀释后溶液各20mL分别加入3个洁净的小烧杯中;
步骤3:用 溶液将3个烧杯内溶液的pH分别调至10、7和4(溶液体积变化忽略不计)。
溶液将3个烧杯内溶液的pH分别调至10、7和4(溶液体积变化忽略不计)。
步骤4:在3个烧杯中分别放入大小相同的红纸,观察现象,记录如下:
已知,溶液中 、HClO和
、HClO和 物质的量分数
物质的量分数 随溶液pH变化的关系如下图所示:
随溶液pH变化的关系如下图所示:
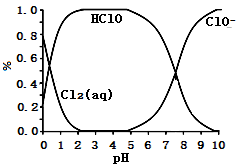
①由实验现象可得以下结论:溶液pH在4~10范围内,pH越大,红纸褪色_______ 。
②结合图像进行分析,b、c两烧杯中实验现象出现差异的原因是_______ 。
(4)由于氯气会与自来水中的有机物发生反应生成对人体有害的物质,人们尝试研究并使用新的自来水消毒剂,如 气体就是一种新型高效含氯消毒剂。
气体就是一种新型高效含氯消毒剂。
①一种制备 的方法是用
的方法是用 通入硫酸酸化的
通入硫酸酸化的 溶液中,反应的离子方程式为
溶液中,反应的离子方程式为_______ 。
②另一种制备 的方法是用
的方法是用 与盐酸反应,同时有
与盐酸反应,同时有 生成,产物中
生成,产物中 体积约占
体积约占 ,每生成
,每生成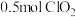 ,转移
,转移_______  。
。
③ 在杀菌消毒过程中会产生副产物亚氯酸盐
在杀菌消毒过程中会产生副产物亚氯酸盐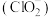 ,需将其转化为
,需将其转化为 除去。下列试剂中,可将
除去。下列试剂中,可将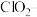 转化为
转化为 的是
的是_______ (填字母序号)。
a. b.
b. c.
c. d.KI
d.KI
(1)下图是实验室制备氯气的制备和除杂装置

①A为氯气发生装置。A中反应方程式是
 )。
)。②将除杂装置B补充完整并标明所用试剂
(2)“84”消毒液也可用于漂白,其工业制法是控制在常温条件下,将氯气通入NaOH溶液中,反应的离子方程式为
(3)同学们探究“84”消毒液在不同pH下使红纸褪色的情况,做了如下实验:
步骤1:将5mL市售“84”消毒液稀释100倍,测得稀释后溶液的
 ;
;步骤2:将稀释后溶液各20mL分别加入3个洁净的小烧杯中;
步骤3:用
 溶液将3个烧杯内溶液的pH分别调至10、7和4(溶液体积变化忽略不计)。
溶液将3个烧杯内溶液的pH分别调至10、7和4(溶液体积变化忽略不计)。步骤4:在3个烧杯中分别放入大小相同的红纸,观察现象,记录如下:
| 烧杯 | 溶液的pH | 现象 |
| a | 10 | 10min后,红纸基本不褪色;4h后红纸褪色 |
| b | 7 | 10min后,红纸颜色变浅;4h后红纸褪色 |
| c | 4 | 10min后,红纸颜色变得更浅;4h后红纸褪色 |
 、HClO和
、HClO和 物质的量分数
物质的量分数 随溶液pH变化的关系如下图所示:
随溶液pH变化的关系如下图所示:
①由实验现象可得以下结论:溶液pH在4~10范围内,pH越大,红纸褪色
②结合图像进行分析,b、c两烧杯中实验现象出现差异的原因是
(4)由于氯气会与自来水中的有机物发生反应生成对人体有害的物质,人们尝试研究并使用新的自来水消毒剂,如
 气体就是一种新型高效含氯消毒剂。
气体就是一种新型高效含氯消毒剂。①一种制备
 的方法是用
的方法是用 通入硫酸酸化的
通入硫酸酸化的 溶液中,反应的离子方程式为
溶液中,反应的离子方程式为②另一种制备
 的方法是用
的方法是用 与盐酸反应,同时有
与盐酸反应,同时有 生成,产物中
生成,产物中 体积约占
体积约占 ,每生成
,每生成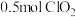 ,转移
,转移 。
。③
 在杀菌消毒过程中会产生副产物亚氯酸盐
在杀菌消毒过程中会产生副产物亚氯酸盐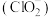 ,需将其转化为
,需将其转化为 除去。下列试剂中,可将
除去。下列试剂中,可将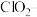 转化为
转化为 的是
的是a.
 b.
b. c.
c. d.KI
d.KI
您最近一年使用:0次
2023-01-07更新
|
450次组卷
|
2卷引用:北京市第八中学2022-2023学年高一上学期期末考试化学试题
名校
解题方法
6 . 红矾钠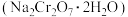 可用于制备制革产业中的铬鞣剂。对含铬污泥进行酸浸处理后,得到浸出液(主要含
可用于制备制革产业中的铬鞣剂。对含铬污泥进行酸浸处理后,得到浸出液(主要含 、
、 、
、 、
、 、
、 和
和 ),经过如下主要流程,可制得红矾钠,实现铬资源的有效循环利用。
),经过如下主要流程,可制得红矾钠,实现铬资源的有效循环利用。

已知:i. 溶液中存在以下平衡:
溶液中存在以下平衡:
ii.相关金属离子形成氢氧化物沉淀的pH范围如下:
(1)Ⅰ中, 溶液呈酸性,结合化学用语说明其原因:
溶液呈酸性,结合化学用语说明其原因:_______ 。
(2)Ⅱ中,加入NaOH调节pH至_______ (填字母序号)。
a.4.3~5.6 b.4.3~7.1 c.5.6~7.1 d.7.1~9.2
(3)Ⅲ中, 氧化
氧化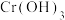 沉淀的化学方程式为
沉淀的化学方程式为_______ 。
(4)Ⅲ中,在投料比、反应时间均相同时,若温度过高, 的产率反而降低,可能的原因是
的产率反而降低,可能的原因是_______ 。
(5)Ⅳ中,加入 的作用是
的作用是_______ (结合平衡移动原理解释)。
(6)为了测定获得红矾钠(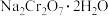 )的纯度,称取上述流程中的产品ag配成100mL溶液,取出25mL放于锥形瓶中,加入稀硫酸和足量的KI溶液,置于暗处充分反应至
)的纯度,称取上述流程中的产品ag配成100mL溶液,取出25mL放于锥形瓶中,加入稀硫酸和足量的KI溶液,置于暗处充分反应至 全部转化为
全部转化为 后,滴入2~3滴淀粉溶液,最后用浓度为
后,滴入2~3滴淀粉溶液,最后用浓度为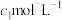 的
的 标准溶液滴定,共消耗
标准溶液滴定,共消耗 。(已知:
。(已知: 。)
。)
①滴定终点的现象为_______ 。
②所得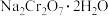 (摩尔质量为
(摩尔质量为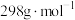 )的纯度的表达式为
)的纯度的表达式为_______ (用质量分数表示)。
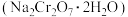 可用于制备制革产业中的铬鞣剂。对含铬污泥进行酸浸处理后,得到浸出液(主要含
可用于制备制革产业中的铬鞣剂。对含铬污泥进行酸浸处理后,得到浸出液(主要含 、
、 、
、 、
、 、
、 和
和 ),经过如下主要流程,可制得红矾钠,实现铬资源的有效循环利用。
),经过如下主要流程,可制得红矾钠,实现铬资源的有效循环利用。
已知:i.
 溶液中存在以下平衡:
溶液中存在以下平衡:
ii.相关金属离子形成氢氧化物沉淀的pH范围如下:
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
 | 4.3 | 5.6 |
 | 7.1 | 9.2 |
 溶液呈酸性,结合化学用语说明其原因:
溶液呈酸性,结合化学用语说明其原因:(2)Ⅱ中,加入NaOH调节pH至
a.4.3~5.6 b.4.3~7.1 c.5.6~7.1 d.7.1~9.2
(3)Ⅲ中,
 氧化
氧化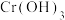 沉淀的化学方程式为
沉淀的化学方程式为(4)Ⅲ中,在投料比、反应时间均相同时,若温度过高,
 的产率反而降低,可能的原因是
的产率反而降低,可能的原因是(5)Ⅳ中,加入
 的作用是
的作用是(6)为了测定获得红矾钠(
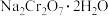 )的纯度,称取上述流程中的产品ag配成100mL溶液,取出25mL放于锥形瓶中,加入稀硫酸和足量的KI溶液,置于暗处充分反应至
)的纯度,称取上述流程中的产品ag配成100mL溶液,取出25mL放于锥形瓶中,加入稀硫酸和足量的KI溶液,置于暗处充分反应至 全部转化为
全部转化为 后,滴入2~3滴淀粉溶液,最后用浓度为
后,滴入2~3滴淀粉溶液,最后用浓度为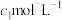 的
的 标准溶液滴定,共消耗
标准溶液滴定,共消耗 。(已知:
。(已知: 。)
。)①滴定终点的现象为
②所得
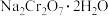 (摩尔质量为
(摩尔质量为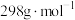 )的纯度的表达式为
)的纯度的表达式为
您最近一年使用:0次
2023-01-06更新
|
939次组卷
|
9卷引用:北京一零一中学2022-2023高二上学期期末考试化学试题
北京一零一中学2022-2023高二上学期期末考试化学试题北京市首都师范大学附属中学2022-2023学年高二上学期期末考试化学试题福建师范大学附属中学2022-2023学年高二下学期开学考试(期末考)化学试卷北京市顺义牛栏山第一中学2023-2024学年高二上学期期中考试化学试题北京市第三十五中学2023-2024学年高二上学期期中考试化学试题 北京市第十一中学2022-2023学年高二上学期期末考试化学试题北京一七一中学2023-2024学年高二上学期12月阶段性诊断化学试题北京交通大学附属中学第二分校2023-2024学年高二上学期12月月考化学试题北京海淀区2022-2023学年高二上学期期末考试化学试题
名校
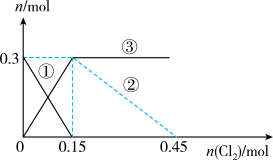
7 . 向100mL
 溶液中逐渐通入
溶液中逐渐通入 ,其中
,其中 、
、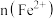 、
、 随通入
随通入 的物质的量
的物质的量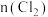 变化如图所示,下列说法错误的是
变化如图所示,下列说法错误的是

 溶液中逐渐通入
溶液中逐渐通入 ,其中
,其中 、
、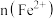 、
、 随通入
随通入 的物质的量
的物质的量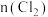 变化如图所示,下列说法错误的是
变化如图所示,下列说法错误的是
A.②代表 ,③代表 ,③代表 |
B.还原性强弱: |
C. 时,溶液中 时,溶液中 |
D.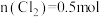 时,总的离子方程式为: 时,总的离子方程式为: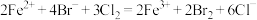 |
您最近一年使用:0次
2023-01-04更新
|
402次组卷
|
2卷引用:江西省丰城中学2023-2024学年高一上学期12月月考化学试题
名校
解题方法
8 . 为保证家中所用器具与居住环境的洁净卫生,往往需使用各种各样的消毒剂,其中含氯消毒剂是目前广泛使用的一类消毒剂。
(1)用下列两种方法制取氯气:①用含有146 g HCl的浓盐酸与足量的 反应;②用87 g
反应;②用87 g  与足量的浓盐酸反应,所得氯气_______(填标号)。
与足量的浓盐酸反应,所得氯气_______(填标号)。
(2)氯气通入淀粉-KI溶液后可观察到溶液变蓝,可得氧化性:
_______ (填“>”或“<”) ,已知氧化性
,已知氧化性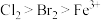 ,若将71g
,若将71g 通入含1 mol
通入含1 mol  的溶液中,写出反应的离子方程式:
的溶液中,写出反应的离子方程式:_______ 。
(3) 是新型消毒剂,已知在酸性条件下
是新型消毒剂,已知在酸性条件下 可发生反应生成NaCl并释放出
可发生反应生成NaCl并释放出 ,该反应的离子方程式为
,该反应的离子方程式为_______ 。NaOH溶液吸收 ,生成物质的量之比为1:1的两种盐,其中一种为
,生成物质的量之比为1:1的两种盐,其中一种为 ,写出该反应的离子方程式:
,写出该反应的离子方程式:_______ 。
(4)漂白粉的有效成分为_______ (填化学式,下同),露置于空气中一段时间的漂白粉,加稀盐酸后产生的气体除了可能有 和HCl外,还可能含有
和HCl外,还可能含有_______ 。在制备漂白粉的过程中,若温度控制不当,易生成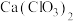 ,若向
,若向 溶液中通入一定量的
溶液中通入一定量的 ,制得的混合物中
,制得的混合物中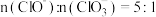 ,则反应中被氧化和被还原的Cl的物质的量之比为
,则反应中被氧化和被还原的Cl的物质的量之比为_______ 。
(1)用下列两种方法制取氯气:①用含有146 g HCl的浓盐酸与足量的
 反应;②用87 g
反应;②用87 g  与足量的浓盐酸反应,所得氯气_______(填标号)。
与足量的浓盐酸反应,所得氯气_______(填标号)。| A.②比①多 | B.①比②多 | C.一样多 | D.无法比较 |

 ,已知氧化性
,已知氧化性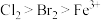 ,若将71g
,若将71g 通入含1 mol
通入含1 mol  的溶液中,写出反应的离子方程式:
的溶液中,写出反应的离子方程式:(3)
 是新型消毒剂,已知在酸性条件下
是新型消毒剂,已知在酸性条件下 可发生反应生成NaCl并释放出
可发生反应生成NaCl并释放出 ,该反应的离子方程式为
,该反应的离子方程式为 ,生成物质的量之比为1:1的两种盐,其中一种为
,生成物质的量之比为1:1的两种盐,其中一种为 ,写出该反应的离子方程式:
,写出该反应的离子方程式:(4)漂白粉的有效成分为
 和HCl外,还可能含有
和HCl外,还可能含有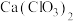 ,若向
,若向 溶液中通入一定量的
溶液中通入一定量的 ,制得的混合物中
,制得的混合物中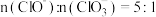 ,则反应中被氧化和被还原的Cl的物质的量之比为
,则反应中被氧化和被还原的Cl的物质的量之比为
您最近一年使用:0次
2022-11-29更新
|
269次组卷
|
3卷引用:安徽省安庆市怀宁县高河中学2023-2024学年高一上学期第二次月考化学试题
名校
解题方法
9 . 有7种短周期主族元素,其中元素A、B、C、D原子序数依次减小,该四种元素原子K层电子总数为7,L层电子中总数为22,M层电子总数为12,E与B同主族,F与C同主族,短周期中G的原子半径最大。用化学用语或文字回答下列问题。
(1)A、C、F、G简单离子半径由大到小顺序___________ 。
(2)G、C按1∶1形成的化合物含化学键类型___________ 。
(3)下列事实能说明A元素的非金属性比F元素的非金属性强的是___________ 。
a.A单质与 溶液反应溶液变混浊
溶液反应溶液变混浊
b.F氢化物的酸性比A的氢化物酸性弱
c.A和F两元素的简单氢化物受热分解,前者的分解温度高
(4)举例说明最高价氧化物对应的水化物碱性强弱:___________ >G的最高价氧化物对应的水化物>___________ 。
(5)在微电子工业中,E的简单气态氢化物的水溶液可作刻蚀剂 的清除剂,所发生反应的产物不污染环境,其化学方程式为
的清除剂,所发生反应的产物不污染环境,其化学方程式为___________ 。
(1)A、C、F、G简单离子半径由大到小顺序
(2)G、C按1∶1形成的化合物含化学键类型
(3)下列事实能说明A元素的非金属性比F元素的非金属性强的是
a.A单质与
 溶液反应溶液变混浊
溶液反应溶液变混浊b.F氢化物的酸性比A的氢化物酸性弱
c.A和F两元素的简单氢化物受热分解,前者的分解温度高
(4)举例说明最高价氧化物对应的水化物碱性强弱:
(5)在微电子工业中,E的简单气态氢化物的水溶液可作刻蚀剂
 的清除剂,所发生反应的产物不污染环境,其化学方程式为
的清除剂,所发生反应的产物不污染环境,其化学方程式为
您最近一年使用:0次
2022-07-07更新
|
460次组卷
|
3卷引用: 山东省青岛第五十八中学2022-2023学年高一下学期3月月考化学试题
10 .  、
、 、NO是有害气体,有多种方法处理有害气体的工艺。
、NO是有害气体,有多种方法处理有害气体的工艺。
Ⅰ.一种脱除 回收硫碘工艺的两个阶段主要反应分别如下:
回收硫碘工艺的两个阶段主要反应分别如下:
第一阶段: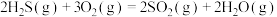
第二阶段:
(1)该工艺需控制第一阶段与第二阶段参加反应的 的物质的量之比
的物质的量之比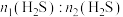 约为1:2.若过大,会导致
约为1:2.若过大,会导致_______ 。
(2) 溶液脱除空气中
溶液脱除空气中 并再生的原理如图所示。
并再生的原理如图所示。 溶液脱除空气中
溶液脱除空气中 的总反应化学方程式为
的总反应化学方程式为_______ 。

Ⅱ.有氧条件下,NO在催化剂作用下可被 还原为
还原为 。在钒基催化剂
。在钒基催化剂 作用下的脱硝反应机理如图所示。
作用下的脱硝反应机理如图所示。
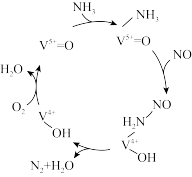
(3)根据如图机理,等物质的量的NO、 在有氧条件下的总化学方程式是
在有氧条件下的总化学方程式是_______ 。
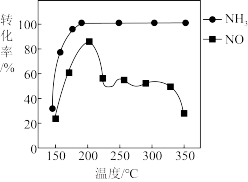
(4)按上述图中 、NO和
、NO和 的比例进行催化脱硝反应。相同反应时间,
的比例进行催化脱硝反应。相同反应时间, 和NO的转化率与温度的关系如图所示,200℃后,NO转化率急剧下降的原因是
和NO的转化率与温度的关系如图所示,200℃后,NO转化率急剧下降的原因是_______ 。
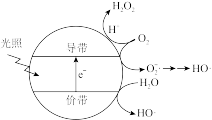
(5)羟基自由基(HO·)也可以用于脱硫脱硝。如图表示光催化氧化技术可生成HO·;光照时,价带失去电子产生有强氧化性的空穴,价带上 直接转化为HO·;描述产生HO·的另一种过程:
直接转化为HO·;描述产生HO·的另一种过程:_______ 。
 、
、 、NO是有害气体,有多种方法处理有害气体的工艺。
、NO是有害气体,有多种方法处理有害气体的工艺。Ⅰ.一种脱除
 回收硫碘工艺的两个阶段主要反应分别如下:
回收硫碘工艺的两个阶段主要反应分别如下:第一阶段:
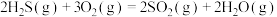
第二阶段:

(1)该工艺需控制第一阶段与第二阶段参加反应的
 的物质的量之比
的物质的量之比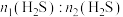 约为1:2.若过大,会导致
约为1:2.若过大,会导致(2)
 溶液脱除空气中
溶液脱除空气中 并再生的原理如图所示。
并再生的原理如图所示。 溶液脱除空气中
溶液脱除空气中 的总反应化学方程式为
的总反应化学方程式为
Ⅱ.有氧条件下,NO在催化剂作用下可被
 还原为
还原为 。在钒基催化剂
。在钒基催化剂 作用下的脱硝反应机理如图所示。
作用下的脱硝反应机理如图所示。
(3)根据如图机理,等物质的量的NO、
 在有氧条件下的总化学方程式是
在有氧条件下的总化学方程式是(4)按上述图中
 、NO和
、NO和 的比例进行催化脱硝反应。相同反应时间,
的比例进行催化脱硝反应。相同反应时间, 和NO的转化率与温度的关系如图所示,200℃后,NO转化率急剧下降的原因是
和NO的转化率与温度的关系如图所示,200℃后,NO转化率急剧下降的原因是
(5)羟基自由基(HO·)也可以用于脱硫脱硝。如图表示光催化氧化技术可生成HO·;光照时,价带失去电子产生有强氧化性的空穴,价带上
 直接转化为HO·;描述产生HO·的另一种过程:
直接转化为HO·;描述产生HO·的另一种过程:
您最近一年使用:0次
2022-05-28更新
|
777次组卷
|
5卷引用:湖南省2022-2023学年第十五届中学生数理化生综合实践活动高一化学应用知识展示A卷
湖南省2022-2023学年第十五届中学生数理化生综合实践活动高一化学应用知识展示A卷(已下线)期末模拟预测卷B-2022-2023学年高一化学下学期期中期末考点大串讲(人教版2019必修第二册)(已下线)第八章 化学与可持续发展(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册)江苏省徐州市沛县2021-2022学年高一下学期第二次学情调研化学试题(已下线)第八章 化学与可持续发展【单元测试B卷】