解题方法
1 . 钼精矿中含有 ,还含有
,还含有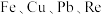 的硫化物。铼、钼的回收价值较高,科研人员可从如下图所示的工艺流程中提取铼、钼等金属。
的硫化物。铼、钼的回收价值较高,科研人员可从如下图所示的工艺流程中提取铼、钼等金属。 为一种有机萃取剂(用
为一种有机萃取剂(用 表示),萃取过程可表示:
表示),萃取过程可表示:
②高铼酸铵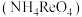 是白色片状晶体,微溶于冷水,溶于热水。
是白色片状晶体,微溶于冷水,溶于热水。
③铼是一种类锰元素,价电子与锰类似。
回答下列问题:
(1) 的价电子排布式为
的价电子排布式为___________ 。
(2)Re2O7所属的类型为___________ (填“酸性”“碱性”或“两性”)氧化物。
(3)钼精矿焙烧除了常见的氧化焙烧之外,还有石灰焙烧法,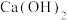 、
、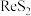 焙烧转化为
焙烧转化为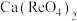 的化学方程式为
的化学方程式为___________ ,氧化焙烧法比较与石灰焙烧法的缺点是___________ 。
(4)试剂A适宜用___________ 。
(5)操作X为___________ 、过滤、洗涤、干燥。
(6)在 还原
还原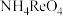 的过程中,实际
的过程中,实际 的用量大于理论值,原因是
的用量大于理论值,原因是___________ 。
 ,还含有
,还含有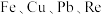 的硫化物。铼、钼的回收价值较高,科研人员可从如下图所示的工艺流程中提取铼、钼等金属。
的硫化物。铼、钼的回收价值较高,科研人员可从如下图所示的工艺流程中提取铼、钼等金属。
 为一种有机萃取剂(用
为一种有机萃取剂(用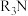 表示),萃取过程可表示:
表示),萃取过程可表示:
②高铼酸铵
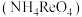 是白色片状晶体,微溶于冷水,溶于热水。
是白色片状晶体,微溶于冷水,溶于热水。③铼是一种类锰元素,价电子与锰类似。
回答下列问题:
(1)
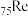 的价电子排布式为
的价电子排布式为(2)Re2O7所属的类型为
(3)钼精矿焙烧除了常见的氧化焙烧之外,还有石灰焙烧法,
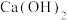 、
、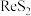 焙烧转化为
焙烧转化为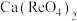 的化学方程式为
的化学方程式为(4)试剂A适宜用
(5)操作X为
(6)在
 还原
还原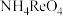 的过程中,实际
的过程中,实际 的用量大于理论值,原因是
的用量大于理论值,原因是
您最近一年使用:0次
名校
2 . 钒(V)广泛应用于冶金、化工、航天等领域。一种以钒渣(主要成分是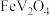 、
、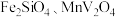 等)为原料制取金属钒的工艺流程如图所示:
等)为原料制取金属钒的工艺流程如图所示: 具有强氧化性,主要存在于
具有强氧化性,主要存在于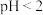 的溶液中,
的溶液中,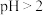 时转化成酸式多钒酸盐。
时转化成酸式多钒酸盐。
②溶液中金属离子开始沉淀和完全沉淀的 如下表所示:
如下表所示:
回答下列问题:
(1)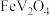 中
中 为
为 价,
价, 的化合价为
的化合价为_______ ;基态 原子价层电子排布图为
原子价层电子排布图为_______ 。
(2)“焙烧Ⅰ”中将 和空气分别加入炉中,焙烧将
和空气分别加入炉中,焙烧将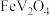 转化为
转化为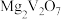 和
和 的化学方程式为
的化学方程式为_______ 。
(3)“酸浸”所得浸出液中除含有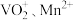 外,还含有的金属阳离子有
外,还含有的金属阳离子有_______ 。
(4)“沉钒”可得到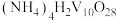 沉淀,“焙烧Ⅱ”中发生反应的化学方程式为
沉淀,“焙烧Ⅱ”中发生反应的化学方程式为_______ 。
(5)“沉钒”所得滤液中加入氨水调节溶液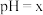 ,过滤得到
,过滤得到 沉淀和溶液A,溶液A中
沉淀和溶液A,溶液A中 浓度为
浓度为 ,为尽可能多地回收
,为尽可能多地回收 ,并避免
,并避免 中混入
中混入 ,应控制
,应控制
_______ 。
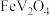 、
、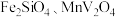 等)为原料制取金属钒的工艺流程如图所示:
等)为原料制取金属钒的工艺流程如图所示: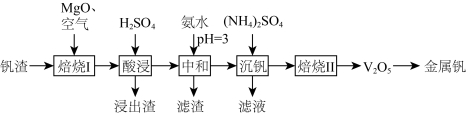
 具有强氧化性,主要存在于
具有强氧化性,主要存在于 的溶液中,
的溶液中, 时转化成酸式多钒酸盐。
时转化成酸式多钒酸盐。②溶液中金属离子开始沉淀和完全沉淀的
 如下表所示:
如下表所示:| 金属离子 |  |  |  |  |
开始沉淀时 的 的 | 1.9 | 7.0 | 8.1 | 8.9 |
沉淀完全时 的 的 | 3.2 | 9.0 | 10.1 | 10.9 |
(1)
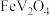 中
中 为
为 价,
价, 的化合价为
的化合价为 原子价层电子排布图为
原子价层电子排布图为(2)“焙烧Ⅰ”中将
 和空气分别加入炉中,焙烧将
和空气分别加入炉中,焙烧将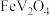 转化为
转化为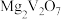 和
和 的化学方程式为
的化学方程式为(3)“酸浸”所得浸出液中除含有
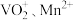 外,还含有的金属阳离子有
外,还含有的金属阳离子有(4)“沉钒”可得到
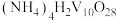 沉淀,“焙烧Ⅱ”中发生反应的化学方程式为
沉淀,“焙烧Ⅱ”中发生反应的化学方程式为(5)“沉钒”所得滤液中加入氨水调节溶液
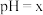 ,过滤得到
,过滤得到 沉淀和溶液A,溶液A中
沉淀和溶液A,溶液A中 浓度为
浓度为 ,为尽可能多地回收
,为尽可能多地回收 ,并避免
,并避免 中混入
中混入 ,应控制
,应控制
您最近一年使用:0次
2023-07-01更新
|
112次组卷
|
2卷引用:湖南省岳阳市2022-2023学年高二下学期6月期末考试化学试题
2023高三·全国·专题练习
解题方法
3 . 亚氯酸钠(NaClO2)和ClO2都是重要的漂白剂。
(1)草酸(H2C2O4)是一种弱酸,利用硫酸酸化的草酸还原NaClO3,可较安全地生成ClO2,反应的离子方程式为_______ 。
(2)自来水用ClO2处理后,有少量ClO2残留在水中,可用碘量法做如下检测(已知ClO2存在于pH为4~6的溶液中,ClO 存在于中性溶液中):
存在于中性溶液中):
①取0.50 L水样,加入一定量的碘化钾,用氢氧化钠溶液调至中性,再加入淀粉溶液,溶液变蓝。写出ClO2与碘化钾反应的化学方程式:_______ 。
②已知:2Na2S2O3+I2=Na2S4O6+2NaI,向①所得溶液中滴加5.00×10-4 mol·L-1的Na2S2O3溶液至恰好反应,消耗Na2S2O3溶液20.00 mL。该水样中ClO2的浓度是_______ mg·L-1。
(3)某学习小组设计如下装置制取亚氯酸钠(NaClO2)。
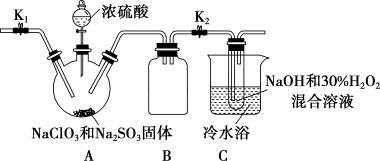
①装置A中产生的ClO2气体,在装置C中反应生成NaClO2,写出生成NaClO2的化学方程式:_______ 。
②将NaClO2溶液在一定条件下处理即可得到NaClO2晶体。装置B的作用是_______ 。
(1)草酸(H2C2O4)是一种弱酸,利用硫酸酸化的草酸还原NaClO3,可较安全地生成ClO2,反应的离子方程式为
(2)自来水用ClO2处理后,有少量ClO2残留在水中,可用碘量法做如下检测(已知ClO2存在于pH为4~6的溶液中,ClO
 存在于中性溶液中):
存在于中性溶液中):①取0.50 L水样,加入一定量的碘化钾,用氢氧化钠溶液调至中性,再加入淀粉溶液,溶液变蓝。写出ClO2与碘化钾反应的化学方程式:
②已知:2Na2S2O3+I2=Na2S4O6+2NaI,向①所得溶液中滴加5.00×10-4 mol·L-1的Na2S2O3溶液至恰好反应,消耗Na2S2O3溶液20.00 mL。该水样中ClO2的浓度是
(3)某学习小组设计如下装置制取亚氯酸钠(NaClO2)。

①装置A中产生的ClO2气体,在装置C中反应生成NaClO2,写出生成NaClO2的化学方程式:
②将NaClO2溶液在一定条件下处理即可得到NaClO2晶体。装置B的作用是
您最近一年使用:0次
名校
4 . 以高硫铝土矿(主要成分为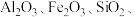 少量
少量 )为原料,生产
)为原料,生产 的部分工艺流程如下:
的部分工艺流程如下: 是一种难溶于水的酸性氧化物,
是一种难溶于水的酸性氧化物,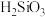 酸性比碳酸弱,难溶于水。下列说法
酸性比碳酸弱,难溶于水。下列说法不正确 的是
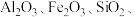 少量
少量 )为原料,生产
)为原料,生产 的部分工艺流程如下:
的部分工艺流程如下: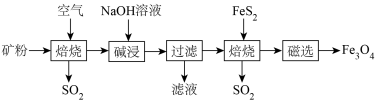
 是一种难溶于水的酸性氧化物,
是一种难溶于水的酸性氧化物,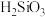 酸性比碳酸弱,难溶于水。下列说法
酸性比碳酸弱,难溶于水。下列说法| A.高硫铝土矿加工成粉状,可以加快焙烧速率,又能提高原料利用率 |
B.碱浸过程 发生的反应: 发生的反应: |
C.向过滤后得到的滤液中通入过量 ,得到的沉淀为 ,得到的沉淀为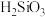 |
D.若由 与 与 在无氧条件下焙烧制得 在无氧条件下焙烧制得 ,则两者物质的量之比为 ,则两者物质的量之比为 |
您最近一年使用:0次
2023-06-27更新
|
613次组卷
|
3卷引用:江苏省连云港市2022-2023学年高一下学期6月期末考试化学试题
江苏省连云港市2022-2023学年高一下学期6月期末考试化学试题江西省赣州市全南中学2023-2024学年高二上学期开学考试化学试题(已下线)重难点05 铁及其化合物-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(江苏专用)
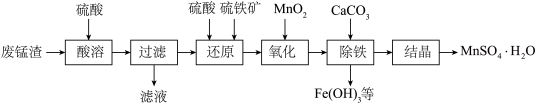
5 . 以废锰渣(含MnO2及少量KOH、MgO、Fe2O3)为原料制备MnSO4晶体,其工艺流程可表示为:_____ 。
(2)“酸浸”时为提高锰离子的浸出率,可采取的措施有_____ 。
(3)“反应I”中加入硫铁矿(主要成分FeS2)与MnO2反应生成Mn2+与Fe3+,滤渣1的主要成分为FeS2和S,写出该反应的离子方程式_____ 。
(4)已知:Ksp[Fe(OH)3]=1×10-38。“调pH”后滤液中Fe3+刚好沉淀完全(离子浓度小于1×10-5mol·L-1认为沉淀完全),此时pH约为_____ ;滤渣2除MnO2、CaCO3外主要成分是_____ (填化学式)。
(5)测定产品纯度。取制得的MnSO4晶体0.1510g,溶于适量水中,加硫酸酸化;用过量NaBiO3(难溶于水)将Mn2+完全氧化为MnO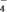 ,过滤洗涤;将几次洗涤的滤液与过滤所得的滤液合并,向其中加入Na2C2O4固体0.5360g;充分反应后,用0.0400mol·L-1KMnO4溶液滴定,用去20.00mL。计算产品中MnSO4的质量分数(写出计算过程,保留两位有效数字)
,过滤洗涤;将几次洗涤的滤液与过滤所得的滤液合并,向其中加入Na2C2O4固体0.5360g;充分反应后,用0.0400mol·L-1KMnO4溶液滴定,用去20.00mL。计算产品中MnSO4的质量分数(写出计算过程,保留两位有效数字)_____ 。
[已知: +
+ →CO2↑+Mn2+(未配平)]
→CO2↑+Mn2+(未配平)]
(2)“酸浸”时为提高锰离子的浸出率,可采取的措施有
(3)“反应I”中加入硫铁矿(主要成分FeS2)与MnO2反应生成Mn2+与Fe3+,滤渣1的主要成分为FeS2和S,写出该反应的离子方程式
(4)已知:Ksp[Fe(OH)3]=1×10-38。“调pH”后滤液中Fe3+刚好沉淀完全(离子浓度小于1×10-5mol·L-1认为沉淀完全),此时pH约为
(5)测定产品纯度。取制得的MnSO4晶体0.1510g,溶于适量水中,加硫酸酸化;用过量NaBiO3(难溶于水)将Mn2+完全氧化为MnO
 ,过滤洗涤;将几次洗涤的滤液与过滤所得的滤液合并,向其中加入Na2C2O4固体0.5360g;充分反应后,用0.0400mol·L-1KMnO4溶液滴定,用去20.00mL。计算产品中MnSO4的质量分数(写出计算过程,保留两位有效数字)
,过滤洗涤;将几次洗涤的滤液与过滤所得的滤液合并,向其中加入Na2C2O4固体0.5360g;充分反应后,用0.0400mol·L-1KMnO4溶液滴定,用去20.00mL。计算产品中MnSO4的质量分数(写出计算过程,保留两位有效数字)[已知:
 +
+ →CO2↑+Mn2+(未配平)]
→CO2↑+Mn2+(未配平)]
您最近一年使用:0次
名校
解题方法
6 . 党的二十大报告中着重强调了生态文明建设的重要性,在这场蓝天保卫战中,如何有效脱除NOx是当前科学家研究的重要课题。
(1)碱性KMnO4氧化法可将NOx进行脱除。
①KMnO4(NaOH)溶液进行烟气中NO的脱除,将该离子方程式补充完整_______ 。
_______NO+_______MnO _______
_______ =______NO
=______NO 3NO
3NO 10MnO
10MnO _______
_______
②下列叙述错误的是_______ 。
A.将脱除后的混合溶液进行分离可获得氨态氮肥
B.反应后混合溶液中:[MnO ]+[MnO
]+[MnO ]=[K+]
]=[K+]
C.在不同酸碱性条件下,KMnO4发生氧化还原反应的产物可能不同
D.NO 中的O-N-O键角大于NO
中的O-N-O键角大于NO 中的O-N-O键角
中的O-N-O键角
③在实验室用KMnO4(NaOH)溶液对模拟烟气中的NO进行脱除。若将标准状况下224L含NO体积分数为10%的模拟烟气进行处理,假设NO最终全部转化为NO ,理论上需要KMnO4的质量为
,理论上需要KMnO4的质量为_______ g。
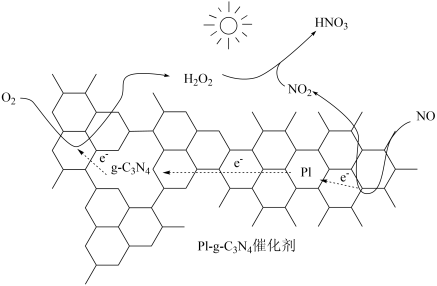
(2)用Pl-g-C3N4光催化氧化法脱除NO的过程如图所示。_______ 。
无害化处理水体中的含氮化合物(以NH3、NO 、NO
、NO 等形式存在)也是生态文明建设的重要环节之一。
等形式存在)也是生态文明建设的重要环节之一。
(3)向该酸性废水(主要是以NH 形式存在)中加入NaClO溶液可将NH
形式存在)中加入NaClO溶液可将NH 转化成无害气体放出,发生反应的离子方程式为
转化成无害气体放出,发生反应的离子方程式为_______ ;NaClO可以通过Cl2与NaOH溶液反应制得,该反应中氧化剂与还原剂的物质的量之比为_______ 。
(4)使用NH3时也要注意防止污染环境。电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图:_______ 极(填“正”或“负”);Pt电极(b)上的电极反应式为_______ 。
②电池总反应的化学反应方程式为_______ ,反应一段时间后,KOH溶液的浓度将_______ (填“增大”“减小”或“不变”)。
(1)碱性KMnO4氧化法可将NOx进行脱除。
①KMnO4(NaOH)溶液进行烟气中NO的脱除,将该离子方程式补充完整
_______NO+_______MnO
 _______
_______ =______NO
=______NO 3NO
3NO 10MnO
10MnO _______
_______
②下列叙述错误的是
A.将脱除后的混合溶液进行分离可获得氨态氮肥
B.反应后混合溶液中:[MnO
 ]+[MnO
]+[MnO ]=[K+]
]=[K+]C.在不同酸碱性条件下,KMnO4发生氧化还原反应的产物可能不同
D.NO
 中的O-N-O键角大于NO
中的O-N-O键角大于NO 中的O-N-O键角
中的O-N-O键角③在实验室用KMnO4(NaOH)溶液对模拟烟气中的NO进行脱除。若将标准状况下224L含NO体积分数为10%的模拟烟气进行处理,假设NO最终全部转化为NO
 ,理论上需要KMnO4的质量为
,理论上需要KMnO4的质量为(2)用Pl-g-C3N4光催化氧化法脱除NO的过程如图所示。
无害化处理水体中的含氮化合物(以NH3、NO
 、NO
、NO 等形式存在)也是生态文明建设的重要环节之一。
等形式存在)也是生态文明建设的重要环节之一。(3)向该酸性废水(主要是以NH
 形式存在)中加入NaClO溶液可将NH
形式存在)中加入NaClO溶液可将NH 转化成无害气体放出,发生反应的离子方程式为
转化成无害气体放出,发生反应的离子方程式为(4)使用NH3时也要注意防止污染环境。电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图:
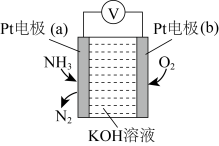
②电池总反应的化学反应方程式为
您最近一年使用:0次
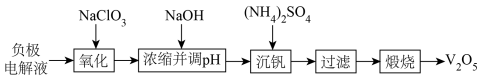
7 . 以废钒电池负极电解液(主要化学成分是V3+、V2+、H2SO4) 为原料,回收其中的钒制备V2O5的工艺流程如图所示:
回答下列问题:
(1)在“氧化”中低价态钒都转化为 ,其中V3+转化反应的离子方程式为
,其中V3+转化反应的离子方程式为___________ ,实际生产中的氧化剂不选择HClO3的原因是___________ 。
(2)“浓缩”至钒溶液质量浓度(折合V2O5质量浓度)为27.3 g·L-1'时,则溶液中c( )=
)=___________ mol·L-1。(结果保留1位小数)
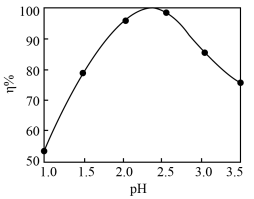
(3)pH对沉钒率(η)的影响如图所示,则沉钒时控制钒液合适的pH范围是___________ ,沉淀产物为2NH4V3O8·H2O,则加(NH4)2SO4沉钒的化学方程式是___________ 。___________ 。检验沉淀已洗涤干净的操作是___________ 。
(5)“煅烧”需要在通风或氧化气氛下进行,其目的是___________ 。
回答下列问题:
(1)在“氧化”中低价态钒都转化为
 ,其中V3+转化反应的离子方程式为
,其中V3+转化反应的离子方程式为(2)“浓缩”至钒溶液质量浓度(折合V2O5质量浓度)为27.3 g·L-1'时,则溶液中c(
 )=
)=(3)pH对沉钒率(η)的影响如图所示,则沉钒时控制钒液合适的pH范围是
(5)“煅烧”需要在通风或氧化气氛下进行,其目的是
您最近一年使用:0次
8 . 用废锰渣(主要成分为MnO2、MgO和Fe2O3)和硫铁矿(主要成分FeS2)制取MnSO4·H2O的工艺流程如下:___________ 。
(2)已知:室温下Ksp[Fe(OH)2]=4.9×10-17,Ksp[Fe(OH)3]=1×10-37.4,Ksp[Mn(OH)2]=2×10-13,“氧化”后溶液中c(Mn2+)=0.2mol·L-1。
①欲使溶液中c(Fe3+)<10-5mol·L-1,“除铁”过程需控制溶液pH的范围是___________ 。
②写出“除铁”过程中生成Fe(OH)3反应的化学方程式:___________ 。
(3)氧化后溶液的Fe3+还可用P204(一种有机萃取剂,密度比水小)萃取除去,实验装置如图所示,从图示装置中得到Mn2+水溶液的实验操作方法是___________ 。 ,过滤,洗涤,洗涤液并入滤液,加入0.4690gNa2C2O4固体,充分反应后,用0.0200mol·L-1KMnO4标准溶液滴定,用去标准溶液20.00mL,计算样品中MnSO4·H2O的质量分数
,过滤,洗涤,洗涤液并入滤液,加入0.4690gNa2C2O4固体,充分反应后,用0.0200mol·L-1KMnO4标准溶液滴定,用去标准溶液20.00mL,计算样品中MnSO4·H2O的质量分数___________ 。(写出详细计算过程)。
C2O 发生的反应为
发生的反应为 (未配平)。
(未配平)。
②若实验测定MnSO4·H2O样品的纯度大于100%,可能的原因是___________ (忽略操作过程中的误差)。
(2)已知:室温下Ksp[Fe(OH)2]=4.9×10-17,Ksp[Fe(OH)3]=1×10-37.4,Ksp[Mn(OH)2]=2×10-13,“氧化”后溶液中c(Mn2+)=0.2mol·L-1。
①欲使溶液中c(Fe3+)<10-5mol·L-1,“除铁”过程需控制溶液pH的范围是
②写出“除铁”过程中生成Fe(OH)3反应的化学方程式:
(3)氧化后溶液的Fe3+还可用P204(一种有机萃取剂,密度比水小)萃取除去,实验装置如图所示,从图示装置中得到Mn2+水溶液的实验操作方法是
 ,过滤,洗涤,洗涤液并入滤液,加入0.4690gNa2C2O4固体,充分反应后,用0.0200mol·L-1KMnO4标准溶液滴定,用去标准溶液20.00mL,计算样品中MnSO4·H2O的质量分数
,过滤,洗涤,洗涤液并入滤液,加入0.4690gNa2C2O4固体,充分反应后,用0.0200mol·L-1KMnO4标准溶液滴定,用去标准溶液20.00mL,计算样品中MnSO4·H2O的质量分数C2O
 发生的反应为
发生的反应为 (未配平)。
(未配平)。②若实验测定MnSO4·H2O样品的纯度大于100%,可能的原因是
您最近一年使用:0次
2023-06-05更新
|
432次组卷
|
3卷引用:江苏省扬州中学2023届高三下学期考前练习化学试题
解题方法
9 . 电解金属锰阳极渣(主要成分MnO2,杂质为PbCO3、Fe2O3、CuO)和黄铁矿(FeS2)为原料可制备Mn3O4,其流程如图所示:
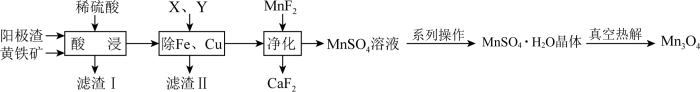
已知:部分阳离子以氢氧化物形式完全沉淀时的pH如下:Fe3+ 3.7,Fe2+ 9.7,Cu2+ 7.4,Mn2+ 9.8
回答下列问题:
(1)“酸浸”过程中,滤渣Ⅰ的主要成分为S、______ (填化学式)。
(2)“酸浸”过程中Fe2+、Fe3+的质量浓度、Mn浸出率与时间的关系如图1所示。
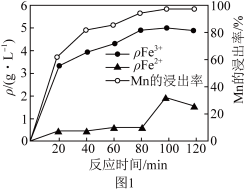
20~80min,浸出Mn元素的主要离子方程式为______ 。80~100min时,Fe2+浓度上升的原因可能是______ 。
(3)“除Fe、Cu”过程中依次加入的试剂X、Y为______ (填序号)。
A.NH3•H2O、H2O2 B.H2O2、CaCO3 C.SO2、MnCO3
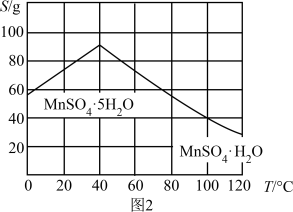
(4)硫酸锰晶体的溶解度曲线如图2,由MnSO4溶液获得MnSO4•H2O晶体的系列操作为______ 、洗涤、干燥。
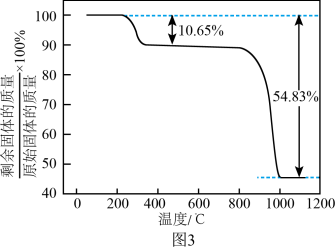
(5)“真空热解”过程中,测得固体的质量随温度变化如图3所示。需控制的温度为______ 。
(6)由MnSO4溶液制取Mn3O4的另一种方案是:向MnSO4溶液中加入氨水,产生Mn(OH)2沉淀和少量Mn2(OH)2SO4,滤出,洗净,加水打成浆,浆液边加热边持续通空气,制得Mn3O4。沉淀加热通空气过程中,7小时之前,溶液的pH=6,7小时之后迅速下降,原因是______ 。

已知:部分阳离子以氢氧化物形式完全沉淀时的pH如下:Fe3+ 3.7,Fe2+ 9.7,Cu2+ 7.4,Mn2+ 9.8
回答下列问题:
(1)“酸浸”过程中,滤渣Ⅰ的主要成分为S、
(2)“酸浸”过程中Fe2+、Fe3+的质量浓度、Mn浸出率与时间的关系如图1所示。

20~80min,浸出Mn元素的主要离子方程式为
(3)“除Fe、Cu”过程中依次加入的试剂X、Y为
A.NH3•H2O、H2O2 B.H2O2、CaCO3 C.SO2、MnCO3
(4)硫酸锰晶体的溶解度曲线如图2,由MnSO4溶液获得MnSO4•H2O晶体的系列操作为

(5)“真空热解”过程中,测得固体的质量随温度变化如图3所示。需控制的温度为

(6)由MnSO4溶液制取Mn3O4的另一种方案是:向MnSO4溶液中加入氨水,产生Mn(OH)2沉淀和少量Mn2(OH)2SO4,滤出,洗净,加水打成浆,浆液边加热边持续通空气,制得Mn3O4。沉淀加热通空气过程中,7小时之前,溶液的pH=6,7小时之后迅速下降,原因是
您最近一年使用:0次
2023-04-27更新
|
878次组卷
|
2卷引用:山东省泰安市2023届高三下学期二模考试化学试题
22-23高一下·四川·期中
名校
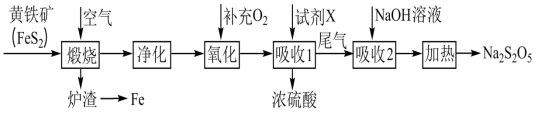
10 . 以黄铁矿(主要成分为FeS2)为原料生产硫酸,并将产出的炉渣和尾气进行资源综合利用,减轻对环境的污染,其中一种流程如下图所示。___________ 。
(2)“氧化”时,反应的化学方程式为___________ 。
(3)工业上,吸收SO3时宜选用的试剂X为___________ 。
(4)因为Na2S2O5在保存过程中发生___________ (填“氧化”或“还原”)反应,导致商品Na2S2O5中不可避免地存在Na2SO4.欲检验是否变质,可取少量样品溶于水中,___________ ,说明含有 。
。
(5)Na2S2O5可用于葡萄酒的抗氧化剂。用碘标准液可测定葡萄酒中Na2S2O5的残留量,请配平该反应的方程式:___________ 。
________S2O +________I2+_______H2O=______
+________I2+_______H2O=______ +_______I-+_______H+
+_______I-+_______H+
(6)某同学以如图所示装置用电化学原理模拟生产硫酸:________ (填“正”或“负”)极。写出通入O2的电极的电极反应式________ 。
②若此过程中转移了0.4mol电子,则理论上可以得到硫酸的质量为_____ ;溶液中的H+_____ (填“从左向右”或“从右向左”)移动。
(2)“氧化”时,反应的化学方程式为
(3)工业上,吸收SO3时宜选用的试剂X为
(4)因为Na2S2O5在保存过程中发生
 。
。(5)Na2S2O5可用于葡萄酒的抗氧化剂。用碘标准液可测定葡萄酒中Na2S2O5的残留量,请配平该反应的方程式:
________S2O
 +________I2+_______H2O=______
+________I2+_______H2O=______ +_______I-+_______H+
+_______I-+_______H+(6)某同学以如图所示装置用电化学原理模拟生产硫酸:

②若此过程中转移了0.4mol电子,则理论上可以得到硫酸的质量为
您最近一年使用:0次



