名校
1 . 二氧化氯( )是国际上公认的安全、无毒的绿色消毒剂,对酸性污水中的
)是国际上公认的安全、无毒的绿色消毒剂,对酸性污水中的 有明显的去除效果,其反应原理为:
有明显的去除效果,其反应原理为: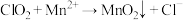 (部分反应物和产物省略、未配平),工业上可用
(部分反应物和产物省略、未配平),工业上可用 制取
制取 ,化学方程式如下:
,化学方程式如下: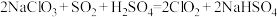 。实验室用如下方法制备饮用水消毒剂
。实验室用如下方法制备饮用水消毒剂 :
:
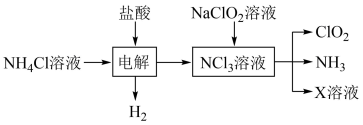
已知: 为强氧化剂,其中N元素为+3价。下列说法
为强氧化剂,其中N元素为+3价。下列说法不 正确的是
 )是国际上公认的安全、无毒的绿色消毒剂,对酸性污水中的
)是国际上公认的安全、无毒的绿色消毒剂,对酸性污水中的 有明显的去除效果,其反应原理为:
有明显的去除效果,其反应原理为: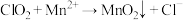 (部分反应物和产物省略、未配平),工业上可用
(部分反应物和产物省略、未配平),工业上可用 制取
制取 ,化学方程式如下:
,化学方程式如下: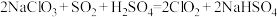 。实验室用如下方法制备饮用水消毒剂
。实验室用如下方法制备饮用水消毒剂 :
:
已知:
 为强氧化剂,其中N元素为+3价。下列说法
为强氧化剂,其中N元素为+3价。下列说法A. 的空间构型为三角锥形 的空间构型为三角锥形 |
B.电解池中总反应的化学方程式为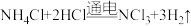 |
C.X溶液中主要存在的离子有: 、 、 、 、 |
D.饮用水制备过程中残留的 可用适量 可用适量 溶液去除 溶液去除 |
您最近一年使用:0次
2021-11-19更新
|
1315次组卷
|
4卷引用:江苏省无锡市2021-2022学年高三上学期期中教学质量调研测试化学试题
2 . 某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是___________ 。
(2)已知2个KBrO3在反应中得到10个电子生成X,则X的化学式为___________ 。
(3)根据上述反应可推知___________。
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并用单线桥法标出电子转移的方向和数目:  。
。___________
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是
(2)已知2个KBrO3在反应中得到10个电子生成X,则X的化学式为
(3)根据上述反应可推知___________。
| A.氧化性:KBrO3>H3AsO4 | B.氧化性:H3AsO4>KBrO3 |
| C.还原性:AsH3>X | D.还原性:X>AsH3 |
 。
。
您最近一年使用:0次
名校
3 . 电视剧《西游记》中仙境美仑美奂,这些神话仙境中所需的烟雾是 和
和 粉按质量比
粉按质量比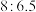 混合放于温热的石棉网上,使用时滴水数滴即产生大量的白烟。又知发生反应后有
混合放于温热的石棉网上,使用时滴水数滴即产生大量的白烟。又知发生反应后有 和水生成。有关的说法中正确的是
和水生成。有关的说法中正确的是
①水起着溶解 ,发生吸热现象以启动反应的发生的作用;②每还原
,发生吸热现象以启动反应的发生的作用;②每还原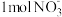 需氧化
需氧化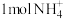 和
和 ;③成烟物质是两性氧化物小颗粒;④成烟物质是小锌粒,它由
;③成烟物质是两性氧化物小颗粒;④成烟物质是小锌粒,它由 反应放热而蒸出。
反应放热而蒸出。
 和
和 粉按质量比
粉按质量比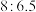 混合放于温热的石棉网上,使用时滴水数滴即产生大量的白烟。又知发生反应后有
混合放于温热的石棉网上,使用时滴水数滴即产生大量的白烟。又知发生反应后有 和水生成。有关的说法中正确的是
和水生成。有关的说法中正确的是①水起着溶解
 ,发生吸热现象以启动反应的发生的作用;②每还原
,发生吸热现象以启动反应的发生的作用;②每还原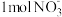 需氧化
需氧化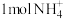 和
和 ;③成烟物质是两性氧化物小颗粒;④成烟物质是小锌粒,它由
;③成烟物质是两性氧化物小颗粒;④成烟物质是小锌粒,它由 反应放热而蒸出。
反应放热而蒸出。| A.①② | B.②③ | C.③④ | D.①④ |
您最近一年使用:0次
2021-04-17更新
|
535次组卷
|
3卷引用:江苏省天一中学2020-2021学年高一下学期期中考试(强化班)化学试题
江苏省天一中学2020-2021学年高一下学期期中考试(强化班)化学试题河北沧州泊头一中2020-2021学年高一下学期第二次月考化学试卷(已下线)第二章 单元检测-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)
名校
解题方法
4 . 含有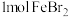 的溶液中,通入
的溶液中,通入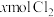 ,反应的离子方程式表示错误的是
,反应的离子方程式表示错误的是
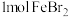 的溶液中,通入
的溶液中,通入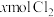 ,反应的离子方程式表示错误的是
,反应的离子方程式表示错误的是A.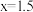 , ,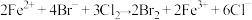 |
B.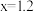 , ,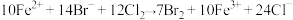 |
C. , ,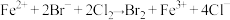 |
D. , ,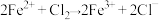 |
您最近一年使用:0次
2021-04-08更新
|
648次组卷
|
4卷引用:上海市金山区2021届高三二模化学试题
上海市金山区2021届高三二模化学试题宁夏石嘴山市第三中学2021-2022学年高三上学期期中考试化学(理)试题(已下线)三轮冲刺卷3-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(上海卷)陕西省西安市铁一中学2023-2024学年高一上学期第二次月考化学试题
19-20高三·江苏苏州·期末
名校
5 . 铁及其化合物在处理工业废水、废气过程中发挥着重要作用。
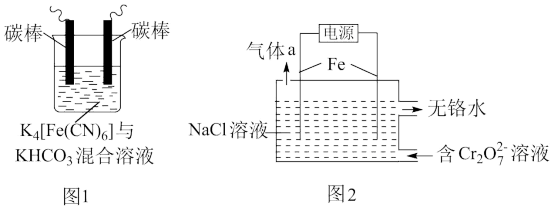
(1)用铁的化合物除硫化氢:2[Fe(CN)6]3-+ 2 +HS- =2[Fe(CN)6]4-+ 2
+HS- =2[Fe(CN)6]4-+ 2 +S↓,可通过图1使[Fe(CN)6]3-再生,电解时,阳极的电极反应式为
+S↓,可通过图1使[Fe(CN)6]3-再生,电解时,阳极的电极反应式为_______ ;电解过程中阴极区溶液的pH_______ (填“变大”、 “变小”或“不变")。
(2)以铁为电极电解除铬,如图2
已知: + H2O=2
+ H2O=2 +2H+
+2H+
氧化性: >
>
①电解过程中主要反应之一: +6Fe2++17H2O= 2Cr(OH)3↓+6Fe(OH)3↓+10H+;气体a主要成分是
+6Fe2++17H2O= 2Cr(OH)3↓+6Fe(OH)3↓+10H+;气体a主要成分是_______ 。
②电解过程中,不同pH时,通电时间与Cr元素的去除率关系如图3所示,pH=10相比pH=4,Cr元素的去除率偏低的原因可能是_______ 。
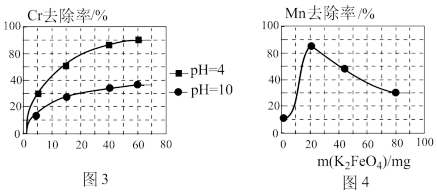
(3)高铁酸钾(K2FeO4)除锰
已知:K2FeO4具有强氧化性,极易溶于水
①在酸性条件下,能与废水中的Mn2+反应生成Fe(OH)3和MnO2沉淀来除锰,该反应的离子方程式_______ 。
②用K2FeO4处理1L 50 mg/L的含Mn2+废水,Mn元素的去除率与K2FeO4量的关系如图4所示,当K2FeO4超过20 mg时,Mn元素的去除率下降的原因可能是_______ 。

(1)用铁的化合物除硫化氢:2[Fe(CN)6]3-+ 2
 +HS- =2[Fe(CN)6]4-+ 2
+HS- =2[Fe(CN)6]4-+ 2 +S↓,可通过图1使[Fe(CN)6]3-再生,电解时,阳极的电极反应式为
+S↓,可通过图1使[Fe(CN)6]3-再生,电解时,阳极的电极反应式为(2)以铁为电极电解除铬,如图2
已知:
 + H2O=2
+ H2O=2 +2H+
+2H+氧化性:
 >
>
①电解过程中主要反应之一:
 +6Fe2++17H2O= 2Cr(OH)3↓+6Fe(OH)3↓+10H+;气体a主要成分是
+6Fe2++17H2O= 2Cr(OH)3↓+6Fe(OH)3↓+10H+;气体a主要成分是②电解过程中,不同pH时,通电时间与Cr元素的去除率关系如图3所示,pH=10相比pH=4,Cr元素的去除率偏低的原因可能是

(3)高铁酸钾(K2FeO4)除锰
已知:K2FeO4具有强氧化性,极易溶于水
①在酸性条件下,能与废水中的Mn2+反应生成Fe(OH)3和MnO2沉淀来除锰,该反应的离子方程式
②用K2FeO4处理1L 50 mg/L的含Mn2+废水,Mn元素的去除率与K2FeO4量的关系如图4所示,当K2FeO4超过20 mg时,Mn元素的去除率下降的原因可能是
您最近一年使用:0次
2021-03-25更新
|
449次组卷
|
5卷引用:2.3.1 浓度变化对化学平衡的影响-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)
(已下线)2.3.1 浓度变化对化学平衡的影响-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)湖北省武汉市蔡甸区汉阳一中2021-2022学年高二上学期12月月考化学试题(已下线)【苏州新东方】化学试卷湖北省武汉市部分重点中学2021-2022学年高二上学期12月联考化学试题江苏省常州市第一中学2023-2024学年高二上学期11月期中考试化学试题
6 . 制备高铁酸钾[K2FeO4]并用其除去土壤和废水中的有机砷(HAPA)与无机砷[+3价砷表示As(Ⅲ)]的流程如图所示:
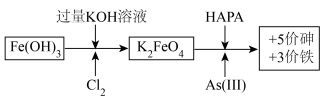
已知:酸性越强,K2FeO4越容易发生反应生成O2。
回答下列问题:
(1)生成K2FeO4的化学方程式为___ 。
(2)K2FeO4去除砷污染时作__ (填“氧化剂”或“还原剂”)。若污染物中的砷全部以Na3AsO3计,则去除全部污染时Na3AsO3与K2FeO4的物质的量之比为__ 。
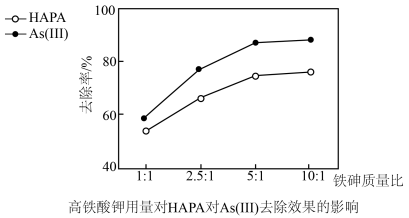
(3)氢离子浓度、高铁酸钾的用量对HAPA和As(Ⅲ)去除效果的影响如图所示。
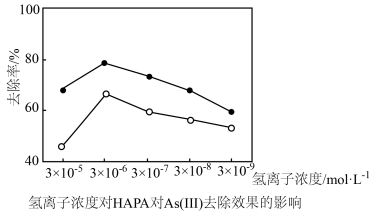
①氢离子浓度为3×10-5mol•L-1时去除率低,原因是(用离子方程式表示)__ 。
②最佳铁砷质量比为___ ,理由是__ 。

已知:酸性越强,K2FeO4越容易发生反应生成O2。
回答下列问题:
(1)生成K2FeO4的化学方程式为
(2)K2FeO4去除砷污染时作
(3)氢离子浓度、高铁酸钾的用量对HAPA和As(Ⅲ)去除效果的影响如图所示。


①氢离子浓度为3×10-5mol•L-1时去除率低,原因是(用离子方程式表示)
②最佳铁砷质量比为
您最近一年使用:0次
2021-01-28更新
|
716次组卷
|
4卷引用:山东省潍坊市2020-2021学年高一上学期期末统考化学试题
山东省潍坊市2020-2021学年高一上学期期末统考化学试题(已下线)解密06 金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密06 金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练山东省高密市第一中学2023-2024学年高一上学期1月冬学竞赛化学试题
7 . 将 通入足量
通入足量 溶液中,完全反应后再加入
溶液中,完全反应后再加入 溶液,发生的两个化学反应为①
溶液,发生的两个化学反应为①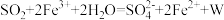 ,②
,②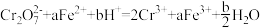 。下列有关说法正确的是
。下列有关说法正确的是
 通入足量
通入足量 溶液中,完全反应后再加入
溶液中,完全反应后再加入 溶液,发生的两个化学反应为①
溶液,发生的两个化学反应为①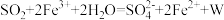 ,②
,②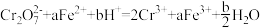 。下列有关说法正确的是
。下列有关说法正确的是A.还原性:  |
B.方程式②中,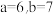 |
C. 能将 能将 氧化成 氧化成 |
D.方程式①中 为 为 |
您最近一年使用:0次
2021-01-11更新
|
581次组卷
|
2卷引用:专题4 本专题复习提升-高中化学苏教2019版必修第一册
20-21高一上·福建龙岩·阶段练习
名校
8 . 据所学知识完成以下题目:
(1)在下列反应中,HCl做还原剂的是_______ ,HCl做氧化剂的是_______ 。
①CaCO3+2HCl=CaCl2+CO2↑+H2O
②Fe+2HCl=FeCl2+H2↑
③PbO2+4HCl(浓) PbCl2+Cl2↑+2H2O
PbCl2+Cl2↑+2H2O
④KClO3+6HCl(浓) KCl+3Cl2↑+3H2O
KCl+3Cl2↑+3H2O
⑤CuO+2HCl=CuCl2+H2O
(2)在横线上补充所需的离子或分子,并配平方程式,。
①KMnO4+HCl=KCl+MnCl2+Cl2↑+H2O,_______ 。
②Mn2++ +H2O=MnO2↓+Cl2↑+___ ,
+H2O=MnO2↓+Cl2↑+___ ,_______ 。
(3)用单线桥表示下列反应中电子转移方向和数目:KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O,_______ 。
(4)钙元素是人体必需的常量元素,所有的细胞都需要钙元素。测定人体血液中钙元素的含量常用到如下两个反应:
①CaC2O4+H2SO4=H2C2O4+CaSO4
②2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
上述反应②的还原剂是____ ;若收集到44.8mL(标准状况)的CO2时,消耗氧化剂_____ mol,有_____ mol电子发生转移,相当于测出含钙元素的质量是_____ g。
(5)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、 、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:
、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:_____ 。
(1)在下列反应中,HCl做还原剂的是
①CaCO3+2HCl=CaCl2+CO2↑+H2O
②Fe+2HCl=FeCl2+H2↑
③PbO2+4HCl(浓)
 PbCl2+Cl2↑+2H2O
PbCl2+Cl2↑+2H2O④KClO3+6HCl(浓)
 KCl+3Cl2↑+3H2O
KCl+3Cl2↑+3H2O⑤CuO+2HCl=CuCl2+H2O
(2)在横线上补充所需的离子或分子,并配平方程式,。
①KMnO4+HCl=KCl+MnCl2+Cl2↑+H2O,
②Mn2++
 +H2O=MnO2↓+Cl2↑+___ ,
+H2O=MnO2↓+Cl2↑+___ ,(3)用单线桥表示下列反应中电子转移方向和数目:KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O,
(4)钙元素是人体必需的常量元素,所有的细胞都需要钙元素。测定人体血液中钙元素的含量常用到如下两个反应:
①CaC2O4+H2SO4=H2C2O4+CaSO4
②2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
上述反应②的还原剂是
(5)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、
 、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:
、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:
您最近一年使用:0次
2020-12-24更新
|
1697次组卷
|
5卷引用:解密03 氧化还原反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练
(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)专题05 氧化还原反应(限时精练)-2022届高考化学一轮复习热点题型归纳与变式训练 福建省连城县第一中学2020-2021学年高一上学期第二次月考化学试题(已下线)第一章《物质及其变化》能力提升单元检测-【帮课堂】2022-2023学年高一化学必修第一册精品讲义(人教版2019)
9 .  、NO是大气污染物。吸收
、NO是大气污染物。吸收 和NO,获得
和NO,获得 和
和 产品的流程图(图1)如下(Ce为铈元素):
产品的流程图(图1)如下(Ce为铈元素):
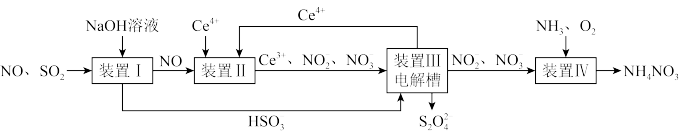
图1
(1)装置Ⅰ中生成 的离子方程式为
的离子方程式为_________________________________________________ 。
(2)各含硫微粒(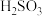 、
、 和
和 )存在于
)存在于 与NaOH溶液反应后的溶液中,它们的物质的量分数与溶液pH的关系如图2所示(常温下)。
与NaOH溶液反应后的溶液中,它们的物质的量分数与溶液pH的关系如图2所示(常温下)。
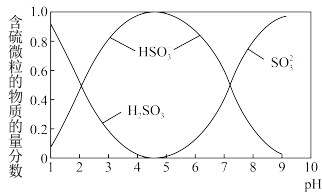
图2
①下列说法正确的是__________ (填序号)。
a. 时,溶液中
时,溶液中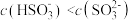
b. 时,溶液中
时,溶液中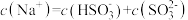
c.为获得尽可能纯的 ,可将溶液的pH控制在4~5
,可将溶液的pH控制在4~5
②向 的
的 溶液中滴加一定浓度的
溶液中滴加一定浓度的 溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因:
溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因:_____________________________________________ 。
(3)装置Ⅱ中,酸性条件下,NO被 氧化的产物主要是
氧化的产物主要是 、
、 ,写出生成
,写出生成 (无
(无 )的离子方程式:
)的离子方程式:_____________________________________________ 。
(4)已知进入装置Ⅳ的溶液中, 的浓度为
的浓度为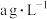 ,要使
,要使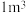 该溶液中的
该溶液中的 完全转化为
完全转化为 ,需至少向装置Ⅳ中通入标准状况下的
,需至少向装置Ⅳ中通入标准状况下的
__________ L。(用含a的代数式表示)
 、NO是大气污染物。吸收
、NO是大气污染物。吸收 和NO,获得
和NO,获得 和
和 产品的流程图(图1)如下(Ce为铈元素):
产品的流程图(图1)如下(Ce为铈元素):
图1
(1)装置Ⅰ中生成
 的离子方程式为
的离子方程式为(2)各含硫微粒(
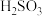 、
、 和
和 )存在于
)存在于 与NaOH溶液反应后的溶液中,它们的物质的量分数与溶液pH的关系如图2所示(常温下)。
与NaOH溶液反应后的溶液中,它们的物质的量分数与溶液pH的关系如图2所示(常温下)。
图2
①下列说法正确的是
a.
 时,溶液中
时,溶液中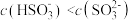
b.
 时,溶液中
时,溶液中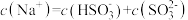
c.为获得尽可能纯的
 ,可将溶液的pH控制在4~5
,可将溶液的pH控制在4~5②向
 的
的 溶液中滴加一定浓度的
溶液中滴加一定浓度的 溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因:
溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因:(3)装置Ⅱ中,酸性条件下,NO被
 氧化的产物主要是
氧化的产物主要是 、
、 ,写出生成
,写出生成 (无
(无 )的离子方程式:
)的离子方程式:(4)已知进入装置Ⅳ的溶液中,
 的浓度为
的浓度为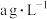 ,要使
,要使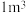 该溶液中的
该溶液中的 完全转化为
完全转化为 ,需至少向装置Ⅳ中通入标准状况下的
,需至少向装置Ⅳ中通入标准状况下的
您最近一年使用:0次
2020-10-12更新
|
530次组卷
|
3卷引用:选择性必修1(SJ)专题3专题综合检测
19-20高三·山东潍坊·阶段练习
10 . A、B、C、D是原子序数依次递增的四种短周期元素。基态A原子所含的电子只有一种运动状态;基态B原子中有三个未成对电子。A、B、C、D四种元素共同组成化合物M,M可发生如下反应:
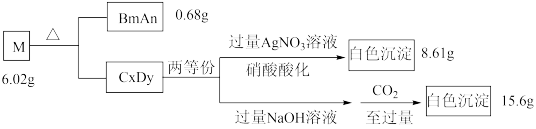
回答下列问题:
(1)B原子的价电子排布式为_______ 。实验室制备BmAn的化学方程式是_________ 。
(2)A、C、D三种元素的原子半径由大到小的顺序为_________ (用元素符号表示)。
(3)B元素的第一电离能比同周期相邻两种元素的都高;原因是____________ 。
(4) D元素的一种氧化物D2O为淡棕黄色气体,可由新制的HgO和D2发生歧化反应(氧化剂和还原剂为同一种物质的反应)制得。上述制备D2O的化学方程式为_________ 。
(5)D元素的另一种氧化物DO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaDO2、NaHSO4、NaHCO3的泡腾片,能快速溶于水,溢出大量气泡,得到DO2溶液。上述过程中,生成DO2的反应属于歧化反应,每生成1 mol DO2消耗NaDO2的量为_____ mol;若产生的“气泡”与DO2的物质的量相等,则反应过程中消耗NaDO2、NaHSO4、NaHCO3的物质的量之比为____________ 。
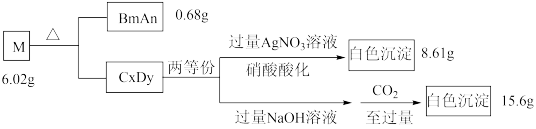
回答下列问题:
(1)B原子的价电子排布式为
(2)A、C、D三种元素的原子半径由大到小的顺序为
(3)B元素的第一电离能比同周期相邻两种元素的都高;原因是
(4) D元素的一种氧化物D2O为淡棕黄色气体,可由新制的HgO和D2发生歧化反应(氧化剂和还原剂为同一种物质的反应)制得。上述制备D2O的化学方程式为
(5)D元素的另一种氧化物DO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaDO2、NaHSO4、NaHCO3的泡腾片,能快速溶于水,溢出大量气泡,得到DO2溶液。上述过程中,生成DO2的反应属于歧化反应,每生成1 mol DO2消耗NaDO2的量为
您最近一年使用:0次



