 、NO是大气污染物。吸收
、NO是大气污染物。吸收 和NO,获得
和NO,获得 和
和 产品的流程图(图1)如下(Ce为铈元素):
产品的流程图(图1)如下(Ce为铈元素):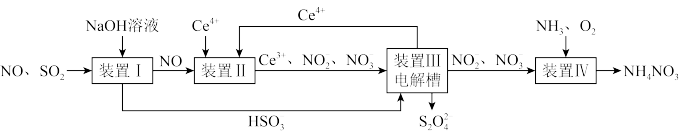
图1
(1)装置Ⅰ中生成
 的离子方程式为
的离子方程式为(2)各含硫微粒(
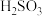 、
、 和
和 )存在于
)存在于 与NaOH溶液反应后的溶液中,它们的物质的量分数与溶液pH的关系如图2所示(常温下)。
与NaOH溶液反应后的溶液中,它们的物质的量分数与溶液pH的关系如图2所示(常温下)。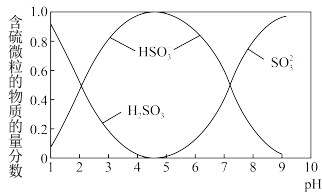
图2
①下列说法正确的是
a.
 时,溶液中
时,溶液中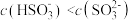
b.
 时,溶液中
时,溶液中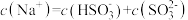
c.为获得尽可能纯的
 ,可将溶液的pH控制在4~5
,可将溶液的pH控制在4~5②向
 的
的 溶液中滴加一定浓度的
溶液中滴加一定浓度的 溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因:
溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因:(3)装置Ⅱ中,酸性条件下,NO被
 氧化的产物主要是
氧化的产物主要是 、
、 ,写出生成
,写出生成 (无
(无 )的离子方程式:
)的离子方程式:(4)已知进入装置Ⅳ的溶液中,
 的浓度为
的浓度为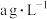 ,要使
,要使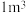 该溶液中的
该溶液中的 完全转化为
完全转化为 ,需至少向装置Ⅳ中通入标准状况下的
,需至少向装置Ⅳ中通入标准状况下的
更新时间:2020-10-12 09:46:28
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】硝酸锶可用于制造烟火及信号弹等。工业级硝酸锶 含
含 、
、 等杂质
等杂质 的提纯流程如下。
的提纯流程如下。 已知: 硝酸锶、硝酸钡不溶于浓硝酸
已知: 硝酸锶、硝酸钡不溶于浓硝酸
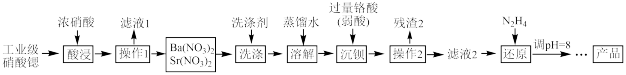
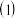 要加快“酸浸”速率所采取的措施是
要加快“酸浸”速率所采取的措施是_________  写一条即可
写一条即可 。
。
 操作1的名称是
操作1的名称是_____________ ,洗涤所用的洗涤剂是________ 。
 “滤液2”中过量的
“滤液2”中过量的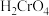 被
被 还原为
还原为 ,同时放出无污染的气体,写出发生反应的离子方程式
,同时放出无污染的气体,写出发生反应的离子方程式_________ ;氧化产物与还原产物的物质的量之比为_________ 。
 已知
已知 不溶于水,还原后调节
不溶于水,还原后调节 的目的是
的目的是________ 。
 为了测定“残渣2”中Cr元素的质量分数,进行以下实验。
为了测定“残渣2”中Cr元素的质量分数,进行以下实验。 已知:
已知: 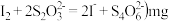 残渣
残渣
 “残渣2”中Cr元素的质量分数为
“残渣2”中Cr元素的质量分数为_______  用代数式表示
用代数式表示 。
。
 若加入的HI溶液过量太多,测定结果会是
若加入的HI溶液过量太多,测定结果会是________  填“偏高”、“偏低”或“无影响”
填“偏高”、“偏低”或“无影响” ,其原因是
,其原因是______ 。
 含
含 、
、 等杂质
等杂质 的提纯流程如下。
的提纯流程如下。 已知: 硝酸锶、硝酸钡不溶于浓硝酸
已知: 硝酸锶、硝酸钡不溶于浓硝酸
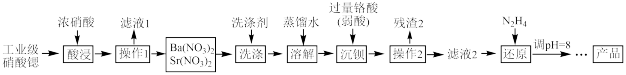
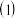 要加快“酸浸”速率所采取的措施是
要加快“酸浸”速率所采取的措施是 写一条即可
写一条即可 。
。 操作1的名称是
操作1的名称是 “滤液2”中过量的
“滤液2”中过量的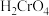 被
被 还原为
还原为 ,同时放出无污染的气体,写出发生反应的离子方程式
,同时放出无污染的气体,写出发生反应的离子方程式 已知
已知 不溶于水,还原后调节
不溶于水,还原后调节 的目的是
的目的是 为了测定“残渣2”中Cr元素的质量分数,进行以下实验。
为了测定“残渣2”中Cr元素的质量分数,进行以下实验。 已知:
已知: 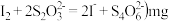 残渣
残渣
 “残渣2”中Cr元素的质量分数为
“残渣2”中Cr元素的质量分数为 用代数式表示
用代数式表示 。
。 若加入的HI溶液过量太多,测定结果会是
若加入的HI溶液过量太多,测定结果会是 填“偏高”、“偏低”或“无影响”
填“偏高”、“偏低”或“无影响” ,其原因是
,其原因是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】纳米级硒化铜 是钠离子电池的正极材料。某小组以黄铜矿粉末(主要含
是钠离子电池的正极材料。某小组以黄铜矿粉末(主要含 ,含少量
,含少量 、
、 等)为原料,在酸性条件下生物催化氧化法制备纳米级硒化铜的流程如图。
等)为原料,在酸性条件下生物催化氧化法制备纳米级硒化铜的流程如图。

请回答下列问题:
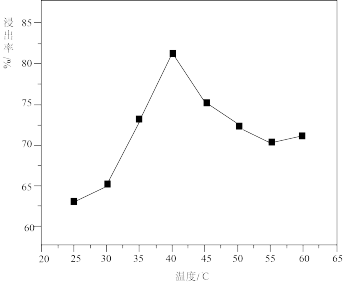
(1)“浸取”中,其他条件相同,测得温度与金属浸出率的关系如图所示。简述40℃达到峰值的原因:_______ 。
(2)写出“浸取”中 反应的离子方程式:
反应的离子方程式:_______ 。
(3)加入过量氨水时,反应分两步进行,写出 参与反应的化学方程式:
参与反应的化学方程式:_______ 。滤渣的主要成分是_______ (填化学式)。
(4)有人认为,用 或
或 代替氨水调节溶液的pH也可以达到相同的目的。请你判断此法是否可行:
代替氨水调节溶液的pH也可以达到相同的目的。请你判断此法是否可行:_______ 。若可行,需调节溶液的pH最低为_______ {若不可行,此空可不填。已知:常温下残留在溶液中的离子浓度小于 时,可认为沉淀完全,
时,可认为沉淀完全,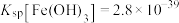 ,
,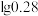 的值取-0.6}。
的值取-0.6}。
(5)在高压、加热条件下,用 还原
还原 溶液的反应中,氧化剂和还原剂的物质的量之比为
溶液的反应中,氧化剂和还原剂的物质的量之比为_______ 。
(6)已知Cu2-xSe晶胞结构如图所示,设晶胞参数为anm。
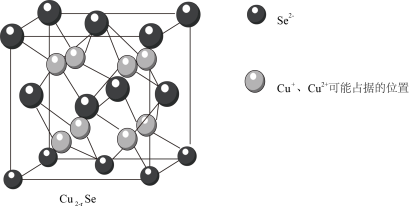
①该晶胞中 和
和 的个数比为
的个数比为_______ (用含 的代数式表示)。
的代数式表示)。
②该晶胞中 与
与 或
或 之间的最短距离为
之间的最短距离为_______  。
。
 是钠离子电池的正极材料。某小组以黄铜矿粉末(主要含
是钠离子电池的正极材料。某小组以黄铜矿粉末(主要含 ,含少量
,含少量 、
、 等)为原料,在酸性条件下生物催化氧化法制备纳米级硒化铜的流程如图。
等)为原料,在酸性条件下生物催化氧化法制备纳米级硒化铜的流程如图。
请回答下列问题:
(1)“浸取”中,其他条件相同,测得温度与金属浸出率的关系如图所示。简述40℃达到峰值的原因:

(2)写出“浸取”中
 反应的离子方程式:
反应的离子方程式:(3)加入过量氨水时,反应分两步进行,写出
 参与反应的化学方程式:
参与反应的化学方程式:(4)有人认为,用
 或
或 代替氨水调节溶液的pH也可以达到相同的目的。请你判断此法是否可行:
代替氨水调节溶液的pH也可以达到相同的目的。请你判断此法是否可行: 时,可认为沉淀完全,
时,可认为沉淀完全,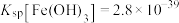 ,
,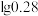 的值取-0.6}。
的值取-0.6}。(5)在高压、加热条件下,用
 还原
还原 溶液的反应中,氧化剂和还原剂的物质的量之比为
溶液的反应中,氧化剂和还原剂的物质的量之比为(6)已知Cu2-xSe晶胞结构如图所示,设晶胞参数为anm。

①该晶胞中
 和
和 的个数比为
的个数比为 的代数式表示)。
的代数式表示)。②该晶胞中
 与
与 或
或 之间的最短距离为
之间的最短距离为 。
。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】(1)磷及部分重要化合物的相互转化如图所示。
①步骤Ⅰ为白磷的工业生产方法之一,反应在1300℃的高温炉中进行,其中SiO2的作用是用于造渣(CaSiO3),焦炭的作用是_________________ 。
②不慎将白磷沾到皮肤上,可用0.2mol/L CuSO4溶液冲洗,根据步骤Ⅱ可判断,1mol/L CuSO4溶液所能氧化的白磷的物质的量为_______________ 。
(2)某液氨-液氧燃料电池示意图如图,该燃料电池的工作效率为50%,现用作电源电解500mL的饱和NaCl溶液,电解结束后,所得溶液中NaOH的浓度为0.3mol·L-1,则该过程中消耗氨气的质量为___________ 。(假设溶液电解前后体积不变)
(3)CO2用于合成甲醇反应方程式为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)如图是科学家正研发的以实现上述反应在常温常压下进行的装置。写出甲槽的电极反应
CH3OH(g)+H2O(g)如图是科学家正研发的以实现上述反应在常温常压下进行的装置。写出甲槽的电极反应_________________ 。
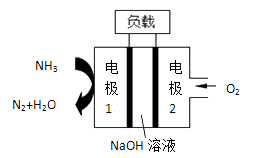
(4)下图是一种用NH3脱除烟气中NO的原理。
①该脱硝原理中,NO最终转化为H2O和_________ (填化学式)。
②当消耗2 mol NH3和0.5 molO2时,除去的NO在标准状况下的体积为__________ L。
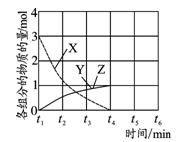
(5)NO直接催化分解(生成N2和O2)也是一种脱硝途径。在不同条件下,NO的分解产物不同。在高压下,NO在40℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如右图所示,写出NO分解的化学方程式_______________________________ 。
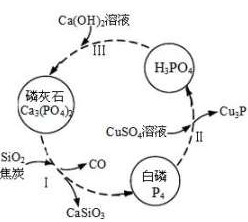
①步骤Ⅰ为白磷的工业生产方法之一,反应在1300℃的高温炉中进行,其中SiO2的作用是用于造渣(CaSiO3),焦炭的作用是
②不慎将白磷沾到皮肤上,可用0.2mol/L CuSO4溶液冲洗,根据步骤Ⅱ可判断,1mol/L CuSO4溶液所能氧化的白磷的物质的量为
(2)某液氨-液氧燃料电池示意图如图,该燃料电池的工作效率为50%,现用作电源电解500mL的饱和NaCl溶液,电解结束后,所得溶液中NaOH的浓度为0.3mol·L-1,则该过程中消耗氨气的质量为
(3)CO2用于合成甲醇反应方程式为:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)如图是科学家正研发的以实现上述反应在常温常压下进行的装置。写出甲槽的电极反应
CH3OH(g)+H2O(g)如图是科学家正研发的以实现上述反应在常温常压下进行的装置。写出甲槽的电极反应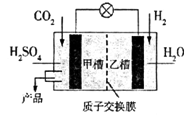
(4)下图是一种用NH3脱除烟气中NO的原理。

①该脱硝原理中,NO最终转化为H2O和
②当消耗2 mol NH3和0.5 molO2时,除去的NO在标准状况下的体积为
(5)NO直接催化分解(生成N2和O2)也是一种脱硝途径。在不同条件下,NO的分解产物不同。在高压下,NO在40℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如右图所示,写出NO分解的化学方程式
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】近年来,为应对温室气体排放问题和日益增长的能源需求问题,CO2综合利用技术作为潜在的解决方案受到了研究者的广泛关注。请按照要求回答问题
(1)CO常用于工业冶炼金属,下图是在不同温度下CO还原四种金属氧化物达平衡后气体中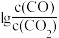 与温度(t)的关系曲线图。下列说法正确的是
与温度(t)的关系曲线图。下列说法正确的是________ 。(填序号)
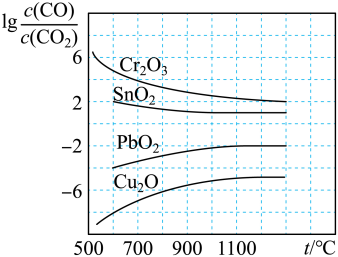
A 工业上可以通过增高反应装置来延长矿石和CO接触的时间,减少尾气中CO的含量
B CO不适宜用于工业冶炼金属铬(Cr)
C 工业冶炼金属铜(Cu)时较低的温度有利于提高CO的利用率
D CO还原PbO2的反应△H>0
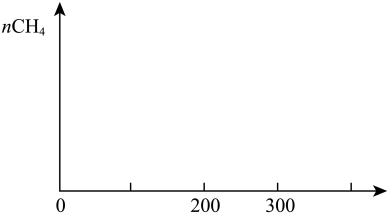
(2)一定条件下Pd-Mg/SiO2催化剂可使CO2 “甲烷化”变废为宝 ,最佳催化温度是200℃~300℃左右,超过300℃催化剂会完全失活、反应停止。向密闭容器通入v(CO2):v(H2)=1:4的反应气体,常温进料开始加热,画出生成甲烷的量随温度的变化曲线
,最佳催化温度是200℃~300℃左右,超过300℃催化剂会完全失活、反应停止。向密闭容器通入v(CO2):v(H2)=1:4的反应气体,常温进料开始加热,画出生成甲烷的量随温度的变化曲线_________ 。
(3)在载人航天器中应用电化学原理,以Pt为阳极,Pb(CO2的载体)为阴极KHCO3溶液为电解质溶液,还原消除航天器内CO2同时产生O2和新的能源CO,则阴极的电极反应式为___________ ;室温下H2CO3电离常数约为K1=4×10-7,K2=5×10-11,则0.025 mol·L-1的H2CO3溶液的pH约等于__________ (不考虑第二步电离和H2O的电离)
(1)CO常用于工业冶炼金属,下图是在不同温度下CO还原四种金属氧化物达平衡后气体中
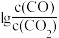 与温度(t)的关系曲线图。下列说法正确的是
与温度(t)的关系曲线图。下列说法正确的是
A 工业上可以通过增高反应装置来延长矿石和CO接触的时间,减少尾气中CO的含量
B CO不适宜用于工业冶炼金属铬(Cr)
C 工业冶炼金属铜(Cu)时较低的温度有利于提高CO的利用率
D CO还原PbO2的反应△H>0
(2)一定条件下Pd-Mg/SiO2催化剂可使CO2 “甲烷化”变废为宝
 ,最佳催化温度是200℃~300℃左右,超过300℃催化剂会完全失活、反应停止。向密闭容器通入v(CO2):v(H2)=1:4的反应气体,常温进料开始加热,画出生成甲烷的量随温度的变化曲线
,最佳催化温度是200℃~300℃左右,超过300℃催化剂会完全失活、反应停止。向密闭容器通入v(CO2):v(H2)=1:4的反应气体,常温进料开始加热,画出生成甲烷的量随温度的变化曲线
(3)在载人航天器中应用电化学原理,以Pt为阳极,Pb(CO2的载体)为阴极KHCO3溶液为电解质溶液,还原消除航天器内CO2同时产生O2和新的能源CO,则阴极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】硫及其化合物在生产生活中用途广泛,用化学反应原理研究它们的性质和用途有重要意义。回答下列问题:
(1)亚硫酰氯(SOCl2)是一种液态化合物,沸点为77℃。向盛有10 mL水的锥形瓶中小心滴加8~10滴SOCl2,观察到剧烈反应,液面上有白雾生成,并有刺激性气味气体逸出。轻轻振荡锥形瓶,白雾消失后,向溶液中滴加AgNO3溶液,有不溶于稀硝酸的白色沉淀生成。
①SOCl2与水反应的化学方程式为___________ 。
②蒸干AlCl3溶液不能得到无水AlCl3,将SOCl2与AlCl3·6H2O混合加热,可得到无水AlCl3,试解释原因:___________ 。
(2)利用反应2H2S+SO2=3S↓+2H2O可将石油气中的H2S转化为S。研究小组同学在实验室中进行如下实验:25℃,向100 mL H2S饱和溶液中缓缓通入SO2气体(气体体积换算成标准状况),测得溶液pH与通入SO2的体积关系如图所示。
已知:25℃,两种酸的电离平衡常数如下表。lg1.4=0.146
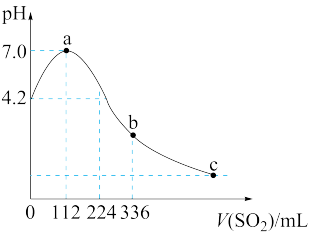
①25℃,H2S饱和溶液的物质的量浓度为___________ mol·L-1。
②理论计算b点对应溶液的pH约为___________ (忽略溶液的体积变化,计算结果保留一位小数)。而实验测定b点对应溶液的pH小于理论计算值的可能原因是___________ (用化学方程式解释)。
③c点时停止通入SO2,并向溶液中加入一定量NaHCO3固体。溶液中H2SO3溶液和NaHCO3发生主要反应的离子方程式为___________ 。
④请设计实验证明亚硫酸的酸性强于氢硫酸___________ (说明操作和现象)。
(1)亚硫酰氯(SOCl2)是一种液态化合物,沸点为77℃。向盛有10 mL水的锥形瓶中小心滴加8~10滴SOCl2,观察到剧烈反应,液面上有白雾生成,并有刺激性气味气体逸出。轻轻振荡锥形瓶,白雾消失后,向溶液中滴加AgNO3溶液,有不溶于稀硝酸的白色沉淀生成。
①SOCl2与水反应的化学方程式为
②蒸干AlCl3溶液不能得到无水AlCl3,将SOCl2与AlCl3·6H2O混合加热,可得到无水AlCl3,试解释原因:
(2)利用反应2H2S+SO2=3S↓+2H2O可将石油气中的H2S转化为S。研究小组同学在实验室中进行如下实验:25℃,向100 mL H2S饱和溶液中缓缓通入SO2气体(气体体积换算成标准状况),测得溶液pH与通入SO2的体积关系如图所示。
已知:25℃,两种酸的电离平衡常数如下表。lg1.4=0.146
| Ka1 | Ka2 | |
| H2SO3 | 1.410-2 | 6.010-8 |
| H2CO3 | 4.510-7 | 4.710-11 |

①25℃,H2S饱和溶液的物质的量浓度为
②理论计算b点对应溶液的pH约为
③c点时停止通入SO2,并向溶液中加入一定量NaHCO3固体。溶液中H2SO3溶液和NaHCO3发生主要反应的离子方程式为
④请设计实验证明亚硫酸的酸性强于氢硫酸
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】砷(As)是一种重要的非金属元素,常用于农药、杀虫剂等领域。
(1)亚砷酸( )可以用于治疗白血病,其在溶液中存在多种微粒形态。25℃向
)可以用于治疗白血病,其在溶液中存在多种微粒形态。25℃向 溶液中滴加
溶液中滴加 溶液,各种微粒物质的量分数与溶液pH关系如图所示。
溶液,各种微粒物质的量分数与溶液pH关系如图所示。
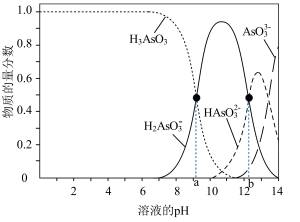
①结合化学用语解释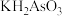 溶液显碱性的原因
溶液显碱性的原因___________ 。
②下列说法正确的是___________ (填字母)。
a.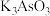 溶液:
溶液:
b.当 时,溶液中:
时,溶液中: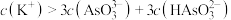
c.当 时,向该溶液中加一定量的水,则溶液中
时,向该溶液中加一定量的水,则溶液中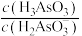 增大
增大
(2)三价砷[As(Ⅲ)]废水因其毒性很强,所以需要处理后才能排放。
①采用化学沉降法处理含砷废水。向废水中先加入适量漂白粉氧化(氧化后溶液pH约为8),再加入生石灰将砷元素转化为 沉淀。
沉淀。
资料:a.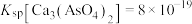 ,
, 较
较 更难溶于水,溶液中离子浓度
更难溶于水,溶液中离子浓度 ,可认为沉淀完全;
,可认为沉淀完全;
b.一定条件下,As(Ⅴ)的存在形式如下图所示:
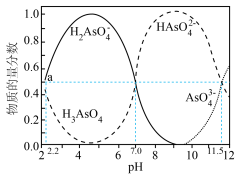
ⅰ.加入生石灰的作用是____________ 。
ⅱ.当除去 时,溶液中的
时,溶液中的 至少为
至少为___________  。
。
ⅲ.若氧化不充分,会使该方法处理后废水中的含砷量___________ (填“偏高”、“偏低”或“无影响”)。
②采用铁盐处理含砷废水。其原理是:铁盐混凝剂在溶液中产生 胶粒,其表面带有正电荷,可吸附含砷化合物。经测定不同pH条件下铁盐对含砷(Ⅲ)化合物的去除率如下图所示。
胶粒,其表面带有正电荷,可吸附含砷化合物。经测定不同pH条件下铁盐对含砷(Ⅲ)化合物的去除率如下图所示。
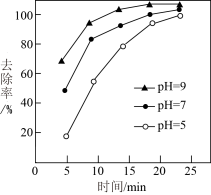
ⅰ.由图可得出的结论是___________ 。
ⅱ.10min时,不同pH溶液中砷(Ⅱ)的去除率不同,其原因是___________ 。
(1)亚砷酸(
 )可以用于治疗白血病,其在溶液中存在多种微粒形态。25℃向
)可以用于治疗白血病,其在溶液中存在多种微粒形态。25℃向 溶液中滴加
溶液中滴加 溶液,各种微粒物质的量分数与溶液pH关系如图所示。
溶液,各种微粒物质的量分数与溶液pH关系如图所示。
①结合化学用语解释
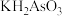 溶液显碱性的原因
溶液显碱性的原因②下列说法正确的是
a.
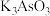 溶液:
溶液:
b.当
 时,溶液中:
时,溶液中: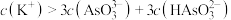
c.当
 时,向该溶液中加一定量的水,则溶液中
时,向该溶液中加一定量的水,则溶液中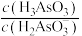 增大
增大(2)三价砷[As(Ⅲ)]废水因其毒性很强,所以需要处理后才能排放。
①采用化学沉降法处理含砷废水。向废水中先加入适量漂白粉氧化(氧化后溶液pH约为8),再加入生石灰将砷元素转化为
 沉淀。
沉淀。资料:a.
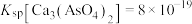 ,
, 较
较 更难溶于水,溶液中离子浓度
更难溶于水,溶液中离子浓度 ,可认为沉淀完全;
,可认为沉淀完全;b.一定条件下,As(Ⅴ)的存在形式如下图所示:

ⅰ.加入生石灰的作用是
ⅱ.当除去
 时,溶液中的
时,溶液中的 至少为
至少为 。
。ⅲ.若氧化不充分,会使该方法处理后废水中的含砷量
②采用铁盐处理含砷废水。其原理是:铁盐混凝剂在溶液中产生
 胶粒,其表面带有正电荷,可吸附含砷化合物。经测定不同pH条件下铁盐对含砷(Ⅲ)化合物的去除率如下图所示。
胶粒,其表面带有正电荷,可吸附含砷化合物。经测定不同pH条件下铁盐对含砷(Ⅲ)化合物的去除率如下图所示。
ⅰ.由图可得出的结论是
ⅱ.10min时,不同pH溶液中砷(Ⅱ)的去除率不同,其原因是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】磷的含氧酸有次磷酸(H3PO2)、亚磷酸(H3PO3)、磷酸(H3PO4)等多种,都是重要的化工原料。
(1)已知次磷酸(H3PO2)的水溶液中存在H3PO2分子,H3PO2与足量NaOH溶液充分反应,消耗的酸和碱的物质的量相等,反应的离子方程式为____ ,生成的盐属于____ (填“正盐”或“酸式盐”)。
(2)查阅资料知25℃时,亚磷酸(H3PO3)的Ka1=5×10-2,Ka2=2.5×10-7。25℃时,Na2HPO3水解反应的Kh=____ (填数值)。
(3)若用甲基橙做指示剂,用NaOH溶液滴定某浓度的H3PO3溶液,达到滴定终点时所得溶液中c(Na+)____ c(H2PO )+2c(HPO
)+2c(HPO )(填“>”、“<”或“=”)。
)(填“>”、“<”或“=”)。
(4)磷酸(H3PO4)在水溶液中各种微粒的物质的量分数δ随pH的变化曲线如图所示:
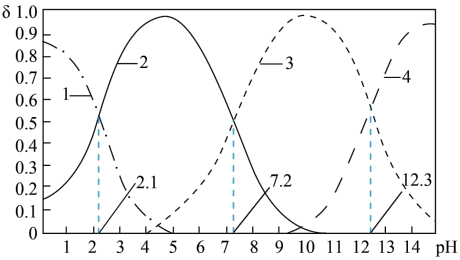
①向某浓度的磷酸溶液中滴加NaOH溶液,以酚酞为指示剂,当溶液由无色变为浅红色时,发生的主要反应的离子方程式是____ 。
②从图中推断下列说法正确的是___ 。
A.25℃时,H3PO4的第三步电离常数为10-12.3
B.Na2HPO4溶液中:c(Na+)>c(H2PO )>c(H3PO4)>c(HPO
)>c(H3PO4)>c(HPO )
)
C.Na2HPO4溶液中:c(Na+)>c(H2PO )>c(PO
)>c(PO )>c(HPO
)>c(HPO )
)
D.pH=7.2时,溶液中c(Na+)+c(H+)=3c(H2PO )+3c(PO
)+3c(PO )+c(OH-)
)+c(OH-)
(1)已知次磷酸(H3PO2)的水溶液中存在H3PO2分子,H3PO2与足量NaOH溶液充分反应,消耗的酸和碱的物质的量相等,反应的离子方程式为
(2)查阅资料知25℃时,亚磷酸(H3PO3)的Ka1=5×10-2,Ka2=2.5×10-7。25℃时,Na2HPO3水解反应的Kh=
(3)若用甲基橙做指示剂,用NaOH溶液滴定某浓度的H3PO3溶液,达到滴定终点时所得溶液中c(Na+)
 )+2c(HPO
)+2c(HPO )(填“>”、“<”或“=”)。
)(填“>”、“<”或“=”)。(4)磷酸(H3PO4)在水溶液中各种微粒的物质的量分数δ随pH的变化曲线如图所示:

①向某浓度的磷酸溶液中滴加NaOH溶液,以酚酞为指示剂,当溶液由无色变为浅红色时,发生的主要反应的离子方程式是
②从图中推断下列说法正确的是
A.25℃时,H3PO4的第三步电离常数为10-12.3
B.Na2HPO4溶液中:c(Na+)>c(H2PO
 )>c(H3PO4)>c(HPO
)>c(H3PO4)>c(HPO )
)C.Na2HPO4溶液中:c(Na+)>c(H2PO
 )>c(PO
)>c(PO )>c(HPO
)>c(HPO )
)D.pH=7.2时,溶液中c(Na+)+c(H+)=3c(H2PO
 )+3c(PO
)+3c(PO )+c(OH-)
)+c(OH-)
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】“绿水青山就是金山银山”,研究氮氧化物等大气污染物对建设美丽家乡,打造宜居环境具有重要意义。NO在空气中存在如下反应:2NO(g)+ O2(g) 2NO2(g)△H上述反应分两步完成,如下左图所示。
2NO2(g)△H上述反应分两步完成,如下左图所示。
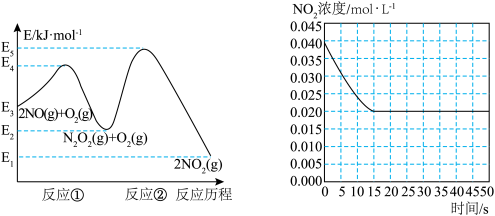
(1)写出反应①的热化学方程式(△H用含物理量E的等式表示):________ 。
(2)反应①和反应②中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g) 2NO2(g)反应速率的是
2NO2(g)反应速率的是____ (填“反应①”或“反应②”);对该反应体系升高温度,发现总反应速率变慢,其原因可能是____ (反应未使用催化剂)。
(3)某温度下一密闭容器中充入一定量的NO2,测得NO2浓度随时间变化的曲线如上图所示。前5秒内O2的平均生成速率为_______ ;该温度下反应2NO+O2 2NO2的化学平衡常数K为
2NO2的化学平衡常数K为_____ 。
(4)对于(3)中的反应体系达平衡后(压强为P1),若升高温度,再次达平衡后,混合气体的平均相对分子质量_____ (填“增大”、“减小”或“不变”);若在恒温恒容条件下,向其中充入一定量O2,再次达平衡后,测得压强为P2,c(O2)=0.09mol·L-1,则P1︰P2=___________ 。
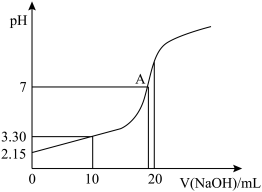
(5)水能部分吸收NO和NO2混合气体得到HNO2溶液。若向20.00mL0.10mol·L-1HNO2溶液中逐滴加入0.10mol·L-1NaOH溶液,所得pH曲线如图所示,则A点对应的溶液c(Na+)/c(HNO2)=____ 。
 2NO2(g)△H上述反应分两步完成,如下左图所示。
2NO2(g)△H上述反应分两步完成,如下左图所示。
(1)写出反应①的热化学方程式(△H用含物理量E的等式表示):
(2)反应①和反应②中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g)
 2NO2(g)反应速率的是
2NO2(g)反应速率的是(3)某温度下一密闭容器中充入一定量的NO2,测得NO2浓度随时间变化的曲线如上图所示。前5秒内O2的平均生成速率为
 2NO2的化学平衡常数K为
2NO2的化学平衡常数K为(4)对于(3)中的反应体系达平衡后(压强为P1),若升高温度,再次达平衡后,混合气体的平均相对分子质量
(5)水能部分吸收NO和NO2混合气体得到HNO2溶液。若向20.00mL0.10mol·L-1HNO2溶液中逐滴加入0.10mol·L-1NaOH溶液,所得pH曲线如图所示,则A点对应的溶液c(Na+)/c(HNO2)=

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】已知常温下部分弱电解质的电离平衡常数如表:
(1)常温下,物质的量溶度相同的三种溶液①NaF溶液②NaClO溶液③Na2CO3溶液,其pH由大到小的顺序是____ (填序号)。
(2)25℃时,pH=4的NH4Cl溶液中各离子浓度的大小关系为___ 。
(3)NaClO溶液中的电荷守恒关系为___ 。
(4)向NaClO溶液中通入少量的CO2,所发生的离子方程式为___ 。
(5)常温下,将cmol/L的氨水与0.01mol/L的盐酸等体积混合。若混合后溶液中存在c(NH )=c(Cl-),则c
)=c(Cl-),则c___ 0.01(填“大于”、“小于”、“等于”或“无法确定”),溶液显___ 性。(填“酸”、“碱”、“中”或“无法确定”)。
| 化学式 | HF | HClO | H2CO3 | NH3·H2O |
| 电离常数 | 6.8×10-4 | 4.7×10-8 | K1=4.3×10-7 K2=5.6×10-11 | Kb=1.7×10-5 |
(2)25℃时,pH=4的NH4Cl溶液中各离子浓度的大小关系为
(3)NaClO溶液中的电荷守恒关系为
(4)向NaClO溶液中通入少量的CO2,所发生的离子方程式为
(5)常温下,将cmol/L的氨水与0.01mol/L的盐酸等体积混合。若混合后溶液中存在c(NH
 )=c(Cl-),则c
)=c(Cl-),则c
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】I.下表是不同温度下水的离子积数据:
试回答以下问题:
(1)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4 mol∙L-1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=____________ 。
(2)在t2℃下,将a mol∙L-1CH3COOH溶液与b mol∙L-1NaOH溶液等体积混合反应后,溶液恰好呈中性,则该温度下CH3COOH的电离常数Ka=____________ (用a、b表示)。
II.已知:25℃下,下列反应:①Ag+(aq)+2NH3(aq) Ag(NH3)2+(aq) △H=a kJ∙mol-1 K=c;
Ag(NH3)2+(aq) △H=a kJ∙mol-1 K=c;
②2Ag+(aq)+2OH-(aq) Ag2O(s)+H2O(l) △H=b kJ∙mol-1 K=d
Ag2O(s)+H2O(l) △H=b kJ∙mol-1 K=d
(3)写出Ag2O溶于氨水(用NH3表示)生成银氨溶液[Ag(NH3)2+]的热化学方程式:_____________ ;计算25℃下,该反应的平衡常数(用c、d表示)K=____________________ 。
III.某镁盐溶液中含有杂质离子Cr3+,所含主要离子及其浓度如下表所示(H+和OH-未列出):
已知 25℃时,Ksp[Cr(OH)3]=10-32;Ksp[Mg (OH)2]=5×10-11;操作过程中溶液体积的变化忽略不计。
(4)表格中的a____________ 1.03(填“<”、“>”或“=”)。
(5)除去杂质Cr3+离子,可加入MgO调节溶液pH,理论上应调节pH的范围是_______________ 。
(6)溶液经除杂、过滤后,由滤液制取氯化镁晶体(MgCl2∙6H2O)的操作是___________________ 。
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积KW | 1×10-14 | 1×10-13 | 1×10-12 |
试回答以下问题:
(1)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4 mol∙L-1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=
(2)在t2℃下,将a mol∙L-1CH3COOH溶液与b mol∙L-1NaOH溶液等体积混合反应后,溶液恰好呈中性,则该温度下CH3COOH的电离常数Ka=
II.已知:25℃下,下列反应:①Ag+(aq)+2NH3(aq)
 Ag(NH3)2+(aq) △H=a kJ∙mol-1 K=c;
Ag(NH3)2+(aq) △H=a kJ∙mol-1 K=c;②2Ag+(aq)+2OH-(aq)
 Ag2O(s)+H2O(l) △H=b kJ∙mol-1 K=d
Ag2O(s)+H2O(l) △H=b kJ∙mol-1 K=d(3)写出Ag2O溶于氨水(用NH3表示)生成银氨溶液[Ag(NH3)2+]的热化学方程式:
III.某镁盐溶液中含有杂质离子Cr3+,所含主要离子及其浓度如下表所示(H+和OH-未列出):
| 离子 | Mg2+ | Cr3+ | Cl- |
| 浓度(mol/L) | 0.5 | 0.01 | a |
已知 25℃时,Ksp[Cr(OH)3]=10-32;Ksp[Mg (OH)2]=5×10-11;操作过程中溶液体积的变化忽略不计。
(4)表格中的a
(5)除去杂质Cr3+离子,可加入MgO调节溶液pH,理论上应调节pH的范围是
(6)溶液经除杂、过滤后,由滤液制取氯化镁晶体(MgCl2∙6H2O)的操作是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】Ⅰ.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
(1)不考虑其它组的实验结果,从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸________________________________________________________
(2)丙组实验混合溶液中离子浓度由大到小的顺序是_____________________________
(3)丁组实验所得混合溶液中由水电离出的c(OH-)=________________ mol·L-1, 混合溶液中,c(Na+)-c(A-)=_________________________ mol·L-1 (不能做近似计算)。
Ⅱ.合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g) 2NH3(g) ∆H=﹣92.4kJ•mol-1,在773 K时,分别将2 mol N2和6 mol H2充入在一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
2NH3(g) ∆H=﹣92.4kJ•mol-1,在773 K时,分别将2 mol N2和6 mol H2充入在一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
(4)从0~10min内,该反应的平均速率v(H2)=________________ ;该温度下,反应达到化学平衡时,化学平衡常数K=________________ (保留二位小数)
(5)该温度下,若向容积相同的另一容器中投入的N2、H2、NH3的浓度分别为3 mol·L-1、3 mol·L-1、3 mol·L-1,下列各项标志着该反应达到化学平衡状态的是________(填字母)。
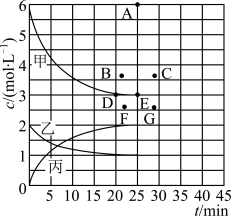
(6)该温度下,分别将2 mol N2和6 mol H2充入在一个固定容积为1 L的密闭容器中,反应达到平衡过程中,c(H2)、c(N2)、c(NH3)随时间t变化如图曲线;在此温度下,若起始充入4 mol N2和12 mol H2,则反应刚达到平衡时,表示c(H2)~t的曲线上相应的点为________
| 实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | c | 0.2 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=9 |
(2)丙组实验混合溶液中离子浓度由大到小的顺序是
(3)丁组实验所得混合溶液中由水电离出的c(OH-)=
Ⅱ.合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)
 2NH3(g) ∆H=﹣92.4kJ•mol-1,在773 K时,分别将2 mol N2和6 mol H2充入在一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
2NH3(g) ∆H=﹣92.4kJ•mol-1,在773 K时,分别将2 mol N2和6 mol H2充入在一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
(5)该温度下,若向容积相同的另一容器中投入的N2、H2、NH3的浓度分别为3 mol·L-1、3 mol·L-1、3 mol·L-1,下列各项标志着该反应达到化学平衡状态的是________(填字母)。
| A.容器内N2、H2、NH3的浓度之比为1∶3∶2 | B.3v正(N2)=v逆(H2) |
| C.容器内压强保持不变 | D.混合气体的密度保持不变 |

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】习近平主席在《中央城镇化工作会议》发出号召:“让居民望得见山、看得见水、记得住乡愁”。消除含氮、硫、氯等化合物对大气和水体的污染对建设美丽家乡,打造宜居环境具有重要意义。
(1)以 为原料,用
为原料,用 氧化制取
氧化制取 ,可提高效益,减少污染。反应为:
,可提高效益,减少污染。反应为:
 ,通过控制合适条件,分两步循环进行,可使
,通过控制合适条件,分两步循环进行,可使 转化率接近100%。原理如图所示:
转化率接近100%。原理如图所示:
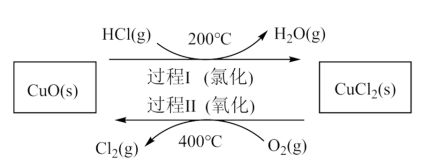
过程Ⅰ的反应为: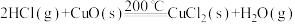
 ,过程Ⅱ反应的热化学方程式为
,过程Ⅱ反应的热化学方程式为___________ 。
(2)容积均为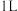 的甲、乙两个容器,其中甲为绝热容器,乙为恒温容器。相同温度下,分别充入
的甲、乙两个容器,其中甲为绝热容器,乙为恒温容器。相同温度下,分别充入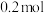 的
的 ,发生反应:
,发生反应:
 ,甲中
,甲中 的相关量随时间变化如图所示。
的相关量随时间变化如图所示。
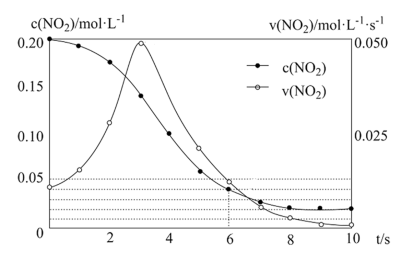
①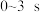 内,甲容器中
内,甲容器中 的反应速率增大的原因是
的反应速率增大的原因是___________ 。
②甲达平衡时,温度若为 ,此温度下的平衡常数
,此温度下的平衡常数
___________ 。
③平衡时,
___________ 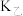 ,
,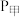
___________ 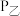 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(3)工业上可用 溶液吸收法处理
溶液吸收法处理 ,25℃时用
,25℃时用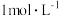 的
的 溶液吸收
溶液吸收 ,当溶液
,当溶液 时,溶液中各离子浓度的大小关系为
时,溶液中各离子浓度的大小关系为___________ 。(已知25℃时: 的电离常数
的电离常数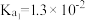 ,
,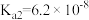 )
)
(1)以
 为原料,用
为原料,用 氧化制取
氧化制取 ,可提高效益,减少污染。反应为:
,可提高效益,减少污染。反应为:
 ,通过控制合适条件,分两步循环进行,可使
,通过控制合适条件,分两步循环进行,可使 转化率接近100%。原理如图所示:
转化率接近100%。原理如图所示:
过程Ⅰ的反应为:
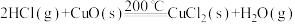
 ,过程Ⅱ反应的热化学方程式为
,过程Ⅱ反应的热化学方程式为(2)容积均为
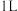 的甲、乙两个容器,其中甲为绝热容器,乙为恒温容器。相同温度下,分别充入
的甲、乙两个容器,其中甲为绝热容器,乙为恒温容器。相同温度下,分别充入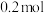 的
的 ,发生反应:
,发生反应:
 ,甲中
,甲中 的相关量随时间变化如图所示。
的相关量随时间变化如图所示。
①
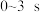 内,甲容器中
内,甲容器中 的反应速率增大的原因是
的反应速率增大的原因是②甲达平衡时,温度若为
 ,此温度下的平衡常数
,此温度下的平衡常数
③平衡时,

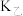 ,
,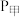
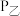 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(3)工业上可用
 溶液吸收法处理
溶液吸收法处理 ,25℃时用
,25℃时用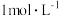 的
的 溶液吸收
溶液吸收 ,当溶液
,当溶液 时,溶液中各离子浓度的大小关系为
时,溶液中各离子浓度的大小关系为 的电离常数
的电离常数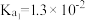 ,
,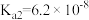 )
)
您最近一年使用:0次



