名校
解题方法
1 . 氮、硫的氧化物都会引起环境问题,越来越引起人们的重视。如图是氮、硫元素的各种价态与物质类别的对应关系:
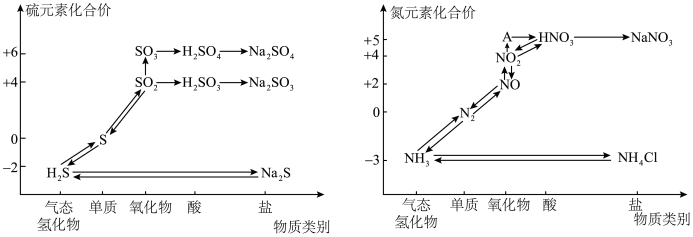
(1)根据 A 对应的化合价和物质类别,A 为___________ (写分子式),从氮元素的化合价能否发生变化的角度判断,图中既有氧化性又有还原性的含氮化合物有___________ 。
(2)氮气的结构决定了氮气能够在空气中稳定存在,实验室可用加热 NaNO2与NH4Cl 的混合溶液制备N2,请写出反应的化学方程式___________ 。
(3)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择___________ ,反应的离子方程式为___________ 。
(4)工业生产中利用氨水吸收SO2 和NO2 ,原理如图所示:
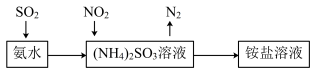
NO2 被吸收过程的离子方程式是___________ 。

(1)根据 A 对应的化合价和物质类别,A 为
(2)氮气的结构决定了氮气能够在空气中稳定存在,实验室可用加热 NaNO2与NH4Cl 的混合溶液制备N2,请写出反应的化学方程式
(3)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择
(4)工业生产中利用氨水吸收SO2 和NO2 ,原理如图所示:

NO2 被吸收过程的离子方程式是
您最近一年使用:0次
名校
2 . 某铬盐厂净化含Cr(Ⅵ)废水并提取Cr2O3的一种工艺流程如图所示。
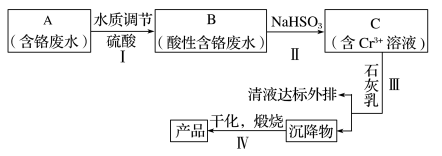
已知:Ksp[Cr(OH)3]=6.3×10-31
Ksp[Fe(OH)3]=2.8×10-39
Ksp[Fe(OH)2]=4.9×10-17
(1)步骤Ⅰ中,发生的反应为2H++2Cr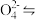 Cr2
Cr2 +H2O,B中含铬元素的离子有
+H2O,B中含铬元素的离子有_______ (填离子符号)。
(2)当清液中Cr3+的浓度≤1.5 mg·L-1时,可认为已达铬的排放标准。若测得清液的pH=5,则清液尚不符合铬的排放标准,因为此时Cr3+的浓度为_______ mg·L-1。
(3)步骤Ⅱ还可用其他物质代替NaHSO3做还原剂。
①若用FeSO4·7H2O做还原剂,反应的离子方程式为_______ ,步骤Ⅲ中参加反应的阳离子一定有_______ (填离子符号)。
②若用铁屑做还原剂,当铁的投放量相同时,经计算,C溶液的pH与c(Cr2 )的对应关系如下表所示:
)的对应关系如下表所示:
有人认为pH=6时,c(Cr2 )变小的原因是Cr2
)变小的原因是Cr2 基本上都已转化为Cr3+。这种说法是否正确,为什么?
基本上都已转化为Cr3+。这种说法是否正确,为什么?_______ 。
③用铁屑做还原剂时,为使所得产品中含铁元素杂质的含量尽可能低,需要控制的条件有_______ 。

已知:Ksp[Cr(OH)3]=6.3×10-31
Ksp[Fe(OH)3]=2.8×10-39
Ksp[Fe(OH)2]=4.9×10-17
(1)步骤Ⅰ中,发生的反应为2H++2Cr
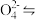 Cr2
Cr2 +H2O,B中含铬元素的离子有
+H2O,B中含铬元素的离子有(2)当清液中Cr3+的浓度≤1.5 mg·L-1时,可认为已达铬的排放标准。若测得清液的pH=5,则清液尚不符合铬的排放标准,因为此时Cr3+的浓度为
(3)步骤Ⅱ还可用其他物质代替NaHSO3做还原剂。
①若用FeSO4·7H2O做还原剂,反应的离子方程式为
②若用铁屑做还原剂,当铁的投放量相同时,经计算,C溶液的pH与c(Cr2
 )的对应关系如下表所示:
)的对应关系如下表所示:| pH | 3 | 4 | 5 | 6 |
 | 7.02×10-21 | 7.02×10-7 | 1.25×10-3 | 2.12×10-34 |
有人认为pH=6时,c(Cr2
 )变小的原因是Cr2
)变小的原因是Cr2 基本上都已转化为Cr3+。这种说法是否正确,为什么?
基本上都已转化为Cr3+。这种说法是否正确,为什么?③用铁屑做还原剂时,为使所得产品中含铁元素杂质的含量尽可能低,需要控制的条件有
您最近一年使用:0次
名校
解题方法
3 . 氮、硫的氧化物都会引起环境问题,越来越引起人们的重视。如图是氮、硫元素的各种价态与物质类别的对应关系:

(1)根据A对应的化合价和物质类别,A为_______ (写分子式),从氮元素的化合价能否发生变化的角度判断,图中既有氧化性又有还原性的含氮化合物有_______ 。
(2)氮气的结构决定了氮气能够在空气中稳定存在,写出氮气的电子式_______ 。
(3)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择_______ ,反应的离子方程式为_______ 。
(4)工业生产中利用氨水吸收SO2和NO2,原理如图所示:
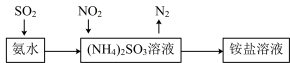
NO2被吸收过程的离子方程式是_______ 。

(1)根据A对应的化合价和物质类别,A为
(2)氮气的结构决定了氮气能够在空气中稳定存在,写出氮气的电子式
(3)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择
(4)工业生产中利用氨水吸收SO2和NO2,原理如图所示:

NO2被吸收过程的离子方程式是
您最近一年使用:0次
2021-09-07更新
|
232次组卷
|
2卷引用:湖南省长沙市长郡中学2021-2022学年高二上学期入学考试化学试题
解题方法
4 . 利用物质类别及核心元素的化合价推测物质的性质是研究化学的重要手段。硫元素的常见化合价与部分物质类别的对应关系如图。回答下列问题:

(1)将H2S与a混合,发生反应的氧化剂与还原剂的物质的量之比为_______ 。
(2)c的浓溶液能与H2S反应产生一种气体和淡黄色沉淀,写出此反应的化学方程式:_______ 。
(3)硫元素还有一种常见的价态为-1价,如硫铁矿(主要成分为FeS2)中的硫元素。FeS2可以与Fe2(SO4)3溶液发生反应:7Fe2(SO4)3+FeS2+8H2O=15FeSO4+8H2SO4,向反应后的溶液中通入空气能使Fe2(SO4)3溶液再生,写出再生反应的离子方程式:_______ 。
(4)常温下,c的浓溶液可用铁罐车或铝槽车运输,其原因是铁和铝在常温下遇到c的浓溶液会发生_______ 。
(5)若要验证木炭与c的浓溶液反应的产物中同时含有气体a和CO2,可选择以下试剂进行实验:①NaOH溶液 ②品红溶液 ③溴水 ④Ca(OH)2溶液,选择合适试剂,并安排合理的顺序_______ (填序号)。

(1)将H2S与a混合,发生反应的氧化剂与还原剂的物质的量之比为
(2)c的浓溶液能与H2S反应产生一种气体和淡黄色沉淀,写出此反应的化学方程式:
(3)硫元素还有一种常见的价态为-1价,如硫铁矿(主要成分为FeS2)中的硫元素。FeS2可以与Fe2(SO4)3溶液发生反应:7Fe2(SO4)3+FeS2+8H2O=15FeSO4+8H2SO4,向反应后的溶液中通入空气能使Fe2(SO4)3溶液再生,写出再生反应的离子方程式:
(4)常温下,c的浓溶液可用铁罐车或铝槽车运输,其原因是铁和铝在常温下遇到c的浓溶液会发生
(5)若要验证木炭与c的浓溶液反应的产物中同时含有气体a和CO2,可选择以下试剂进行实验:①NaOH溶液 ②品红溶液 ③溴水 ④Ca(OH)2溶液,选择合适试剂,并安排合理的顺序
您最近一年使用:0次
名校
解题方法
5 . 利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:
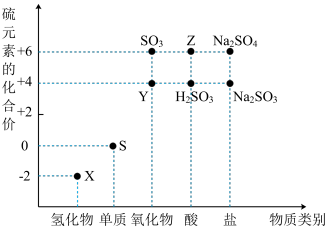
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有_______ (填化学式)。
(2)将X与Y混合,可生成淡黄色固体,该反应中氧化剂与还原剂的物质的量之比为_______ 。
(3)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为_______ 。
(4)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是_______ (填字母)。
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(5)已知Na2SO3能被K2Cr2O7氧化为Na2SO4,则24 mL 0.05 mol·L-1的Na2SO3溶液与20 mL 0.02 mol·L-1的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为_______ 。

(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有
(2)将X与Y混合,可生成淡黄色固体,该反应中氧化剂与还原剂的物质的量之比为
(3)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为
(4)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(5)已知Na2SO3能被K2Cr2O7氧化为Na2SO4,则24 mL 0.05 mol·L-1的Na2SO3溶液与20 mL 0.02 mol·L-1的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为
您最近一年使用:0次
2021-04-25更新
|
418次组卷
|
14卷引用:沪科版高中化学拓展课程第4章《离子互换反应和氧化还原反应》检测题2
沪科版高中化学拓展课程第4章《离子互换反应和氧化还原反应》检测题2湖南省衡阳县四中2022-2023学年高二上学期开学摸底考试化学试题(A卷)黑龙江省双鸭山市第一中学2023-2024学年高二上学期开学考试化学试题【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高一上学期期末考试化学试题【全国百强校】内蒙古自治区杭锦后旗奋斗中学2018-2019学年高一下学期第一次月考化学试题贵州省岑巩县第四中学2019-2020学年高一上学期期末考试化学试题贵州省施秉县一中2019-2020学年高一上学期期末考试化学试题辽宁省大连市辽宁师范大学附属中学2019-2020学年高一下学期期末考试化学试题鲁科版(2019)高一必修第一册第三章第2节 硫的转化 课时4 不同价态硫元素之间的转化酸雨及其防治高一必修第一册(苏教2019版)专题4 第二单元 硫及其化合物的相互转化 课时2 含硫物质之间的转化 氧化还原反应方程式的配平河北省安平中学2020-2021学年高一上学期12月月考化学试题山西省长治市第二中学校2020-2021学年高一下学期期中考试化学试题河北省张家口市第一中学2020-2021学年高一下学期4月月考化学试题江苏省盱眙中学2022-2023学年高一下学期6月阶段测试化学试题
名校
解题方法
6 . 某铬盐厂净化含Cr(VI)废水并提取Cr2O3的一种工艺流程如下图所示。
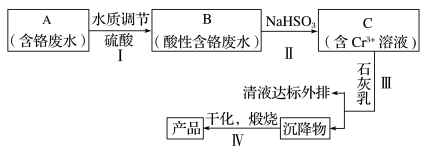
已知:Ksp[Cr(OH)3]=6.3×10-31 Ksp[Fe(OH)3]=2.6×10-39 Ksp[Fe(OH)2]=4.9×10-17
(1)步聚I中,发生的反应为:2H++2CrO42-⇌Cr2O72-+H2O,B中含铬元素的离子有___ (填离子符号).
(2)产品中除Cr2O3外还含有的主要杂质是_______ 。
(3)若测得清液pH=5,此时Cr3+的浓度=_____ mol/L。
(4)当清液中Cr3+的浓度≤1.5mg•L-1时,可认为已达铬的排放标准,上述清液是否符合铬的排放标准_______ (填“是”或“否”)
(5)步骤Ⅱ还可以用其他物质代替NaHSO3作还原剂.
①若用FeSO4•7H2O作还原剂,步骤Ⅲ中参加反应的阳离子一定有___ (填离子符号).
②若用铁屑作还原剂,当铁的投放量相同时,经计算,C溶液的pH与c( )的对应关系如下表所示。
)的对应关系如下表所示。
有人认为pH=6时,c( )变小的原因是
)变小的原因是 基本上都已转化为Cr3+.这种说法是否正确,为什么?
基本上都已转化为Cr3+.这种说法是否正确,为什么?
答:_________________________________________________________________ .
③用足量铁屑作还原剂时,为使所得产品中含铁元素杂质的含量尽可能低,需要控制的条件有___ .

已知:Ksp[Cr(OH)3]=6.3×10-31 Ksp[Fe(OH)3]=2.6×10-39 Ksp[Fe(OH)2]=4.9×10-17
(1)步聚I中,发生的反应为:2H++2CrO42-⇌Cr2O72-+H2O,B中含铬元素的离子有
(2)产品中除Cr2O3外还含有的主要杂质是
(3)若测得清液pH=5,此时Cr3+的浓度=
(4)当清液中Cr3+的浓度≤1.5mg•L-1时,可认为已达铬的排放标准,上述清液是否符合铬的排放标准
(5)步骤Ⅱ还可以用其他物质代替NaHSO3作还原剂.
①若用FeSO4•7H2O作还原剂,步骤Ⅲ中参加反应的阳离子一定有
②若用铁屑作还原剂,当铁的投放量相同时,经计算,C溶液的pH与c(
 )的对应关系如下表所示。
)的对应关系如下表所示。| pH | 3 | 4 | 5 | 6 |
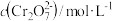 | 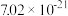 | 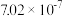 |  | 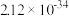 |
有人认为pH=6时,c(
 )变小的原因是
)变小的原因是 基本上都已转化为Cr3+.这种说法是否正确,为什么?
基本上都已转化为Cr3+.这种说法是否正确,为什么?答:
③用足量铁屑作还原剂时,为使所得产品中含铁元素杂质的含量尽可能低,需要控制的条件有
您最近一年使用:0次
名校
解题方法
7 . 氧化性:Br2 > Fe3+> I2,向含 a mol FeI2和 a mol BaCl2的混合溶液中缓慢通入 b mol Br2,并不断搅拌,溶液中离子的物质的量随 Br2加入的变化如图所示(不考虑盐类水解、水的电离及溶液体积变化)。则下列说法不正确的是
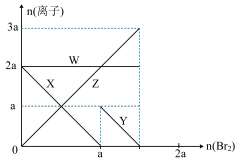

| A.离子的还原性 I-> Fe2+> Br- |
| B.四条线与溶液中离子的对应关系是: X-Fe2+、Y-I-、Z-Br-、W-Cl- |
| C.当4a =3b时,反应后的离子浓度比:c(Fe2+):c(Fe3+):c(Br-) = 1:2:8 |
| D.当3a≤2b时,发生的离子方程式:2Fe2++ 4I-+ 3Br2=2Fe3++ 2I2+6Br- |
您最近一年使用:0次
2020-04-21更新
|
307次组卷
|
2卷引用:浙江省温州市龙湾中学2019-2020学年高二下学期第1次居家月考化学试题
名校
8 . 稀土在电子、激光、核工业、超导等诸多高科技领域有广泛的应用。钪(Sc)是一种稀土金属,利用钛尾矿回收金属轨的工艺流程如图所示。回答下列问题: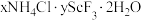 是“沉钪”过程中ScF3与氯化物形成的复盐沉淀,在强酸中部分溶解。
是“沉钪”过程中ScF3与氯化物形成的复盐沉淀,在强酸中部分溶解。
②“脱水除铵”是复盐沉淀的热分解过程。
(1)“焙烧”过程生成Sc2O3的化学方程式为_________ ,为“焙烧”过程中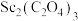 充分反应可采取的措施有
充分反应可采取的措施有__________ 。
(2)“置换”过程需要在氩气做保护气、高温条件下进行,发生反应的化学方程式为_______ 。
(3)“脱水除铵”过程中固体质量与温度的关系如图1所示,其中在380℃到400℃会有白烟冒出,保温至无烟气产生,即得到ScF3,由图象中数据计算复盐中x:z=___________ 。__________ (填“正”或“负”极),d电极上的电极反应式为__________ 。

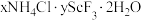 是“沉钪”过程中ScF3与氯化物形成的复盐沉淀,在强酸中部分溶解。
是“沉钪”过程中ScF3与氯化物形成的复盐沉淀,在强酸中部分溶解。②“脱水除铵”是复盐沉淀的热分解过程。
(1)“焙烧”过程生成Sc2O3的化学方程式为
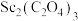 充分反应可采取的措施有
充分反应可采取的措施有(2)“置换”过程需要在氩气做保护气、高温条件下进行,发生反应的化学方程式为
(3)“脱水除铵”过程中固体质量与温度的关系如图1所示,其中在380℃到400℃会有白烟冒出,保温至无烟气产生,即得到ScF3,由图象中数据计算复盐中x:z=

您最近一年使用:0次
名校
解题方法
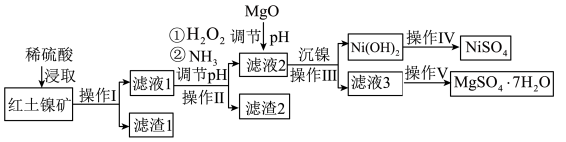
9 . 镍及其化合物在工业上有广泛用途,以某地红土镍矿(主要成分NiO、MgO、 、
、 和铁的氧化物)为原料,采用酸溶法制取
和铁的氧化物)为原料,采用酸溶法制取 和
和 ,工业流程如图所示:
,工业流程如图所示:
已知:①常温下, 易溶于水,
易溶于水, 和NiOOH不溶于水;
和NiOOH不溶于水;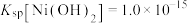 。
。
②在上述流程中,某些金属离子开始沉淀和沉淀完全时的pH如下:
回答下列问题:
(1)“滤液1”中加入 的作用是
的作用是___________ (用离子反应方程式表示)。
(2)操作Ⅱ为达到实验目的,由表中的数据判断通入 调节溶液pH的范围是
调节溶液pH的范围是___________ 。
(3)“滤液1”中是否存在 ,可用
,可用___________ 检验。
(4)“沉镍”中pH调为8.5,则滤液中 的浓度为
的浓度为___________  。
。
(5)操作V是___________ 、过滤、洗涤。
(6) 在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为
在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为___________ 。
 、
、 和铁的氧化物)为原料,采用酸溶法制取
和铁的氧化物)为原料,采用酸溶法制取 和
和 ,工业流程如图所示:
,工业流程如图所示:
已知:①常温下,
 易溶于水,
易溶于水, 和NiOOH不溶于水;
和NiOOH不溶于水;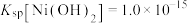 。
。②在上述流程中,某些金属离子开始沉淀和沉淀完全时的pH如下:
| 沉淀物 |  |  |  |  |  |
| 开始沉淀时的pH | 7.1 | 7.6 | 2.7 | 3.4 | 9.2 |
沉淀完全(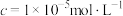 )时的pH )时的pH | 9.0 | 9.6 | 3.2 | 4.7 | 11.1 |
(1)“滤液1”中加入
 的作用是
的作用是(2)操作Ⅱ为达到实验目的,由表中的数据判断通入
 调节溶液pH的范围是
调节溶液pH的范围是(3)“滤液1”中是否存在
 ,可用
,可用(4)“沉镍”中pH调为8.5,则滤液中
 的浓度为
的浓度为 。
。(5)操作V是
(6)
 在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为
在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为
您最近一年使用:0次
10 . 硫氰化钾主要用于合成树脂、杀虫杀菌剂等,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如下图所示:
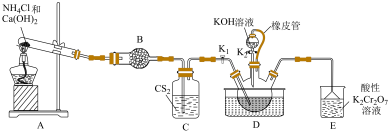
已知:① 不溶于
不溶于 ,
, 密度比水大且不溶于水;
密度比水大且不溶于水;
②三颈烧瓶内盛放: 、水和催化剂;
、水和催化剂;
③ ,该反应比较缓慢且
,该反应比较缓慢且 在高于170℃易分解。
在高于170℃易分解。
回答下列问题:
(1)装置A中发生反应的化学方程式为___________ 。
(2)装置B的仪器名称为___________ ;装置C的作用是___________ 。
(3)装置E可吸收还原性气体,防止污染环境,写出吸收 时发生反应的离子方程式
时发生反应的离子方程式___________ 。
(4)先通过过滤除去三颈烧瓶中的固体催化剂,再通过减压蒸发浓缩、___________ 、___________ 、洗涤、干燥,得到硫氰化钾晶体。
(5)测定晶体中KSCN的含量:称取10.0g样品。配成1000mL溶液后量取20.00mL溶液于锥形瓶中,加入适量稀硝酸,再加入几滴 溶液作指示剂,用
溶液作指示剂,用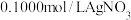 标准溶液滴定,达到滴定终点时平均消耗
标准溶液滴定,达到滴定终点时平均消耗 标准溶液20.00mL。[注:①滴定时发生的反应:
标准溶液20.00mL。[注:①滴定时发生的反应: (白色);②实验过程中不考虑SCN被硝酸氧化。]
(白色);②实验过程中不考虑SCN被硝酸氧化。]
①晶体中KSCN的质量分数为___________ (计算结果保留3位有效数字)。
②滴定前滴定管尖嘴部分有气泡,达到终点后气泡消失,则KSCN的质量分数___________ 。(填“偏大”、“偏小”或“无影响”)

已知:①
 不溶于
不溶于 ,
, 密度比水大且不溶于水;
密度比水大且不溶于水;②三颈烧瓶内盛放:
 、水和催化剂;
、水和催化剂;③
 ,该反应比较缓慢且
,该反应比较缓慢且 在高于170℃易分解。
在高于170℃易分解。回答下列问题:
(1)装置A中发生反应的化学方程式为
(2)装置B的仪器名称为
(3)装置E可吸收还原性气体,防止污染环境,写出吸收
 时发生反应的离子方程式
时发生反应的离子方程式(4)先通过过滤除去三颈烧瓶中的固体催化剂,再通过减压蒸发浓缩、
(5)测定晶体中KSCN的含量:称取10.0g样品。配成1000mL溶液后量取20.00mL溶液于锥形瓶中,加入适量稀硝酸,再加入几滴
 溶液作指示剂,用
溶液作指示剂,用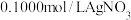 标准溶液滴定,达到滴定终点时平均消耗
标准溶液滴定,达到滴定终点时平均消耗 标准溶液20.00mL。[注:①滴定时发生的反应:
标准溶液20.00mL。[注:①滴定时发生的反应: (白色);②实验过程中不考虑SCN被硝酸氧化。]
(白色);②实验过程中不考虑SCN被硝酸氧化。]①晶体中KSCN的质量分数为
②滴定前滴定管尖嘴部分有气泡,达到终点后气泡消失,则KSCN的质量分数
您最近一年使用:0次



