1 . “协同去污,变废为宝”为处理工业废水提供了新思路。现有含 、
、 的电镀废液以及含
的电镀废液以及含 的废液。现联合处理废水,回收
的废液。现联合处理废水,回收 并生产铁红和媒染剂
并生产铁红和媒染剂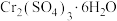 ,回收过程如下,请回答以下问题:
,回收过程如下,请回答以下问题:________ 。
(2)对于该工艺的说法错误的是________。
(3)写出铁铜废液中加入试剂1发生的离子方程式________ 。滤液与含酸性 的废液反应的离子方程式为
的废液反应的离子方程式为________ 。
(4)证明滤液已被试剂3完全氧化的实验方法是________ 。
(5)从 溶液制取
溶液制取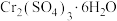 晶体的实验操作方法为蒸发浓缩、
晶体的实验操作方法为蒸发浓缩、________ 、过滤、________ 、干燥。
(6)已知 化学性质与
化学性质与 类似,若将流程中
类似,若将流程中 的溶液转化为氢氧化铬,则转化过程中发生的离子方程式为
的溶液转化为氢氧化铬,则转化过程中发生的离子方程式为________ 。
 、
、 的电镀废液以及含
的电镀废液以及含 的废液。现联合处理废水,回收
的废液。现联合处理废水,回收 并生产铁红和媒染剂
并生产铁红和媒染剂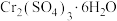 ,回收过程如下,请回答以下问题:
,回收过程如下,请回答以下问题: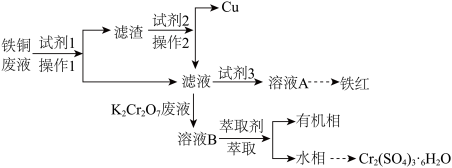
(2)对于该工艺的说法错误的是________。
| A.操作1和操作2都是过滤 |
B.试剂1是过量的 粉,试剂2是过量的 粉,试剂2是过量的 |
| C.可从有机相中提取出某成分加入到溶液A中,提高产量,剩余成分可循环利用 |
D.试剂3只能是 ,目的是将 ,目的是将 氧化成 氧化成 |
(3)写出铁铜废液中加入试剂1发生的离子方程式
 的废液反应的离子方程式为
的废液反应的离子方程式为(4)证明滤液已被试剂3完全氧化的实验方法是
(5)从
 溶液制取
溶液制取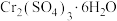 晶体的实验操作方法为蒸发浓缩、
晶体的实验操作方法为蒸发浓缩、(6)已知
 化学性质与
化学性质与 类似,若将流程中
类似,若将流程中 的溶液转化为氢氧化铬,则转化过程中发生的离子方程式为
的溶液转化为氢氧化铬,则转化过程中发生的离子方程式为
您最近一年使用:0次
解题方法
2 . 以软锰矿(含 及少量Fe、Al、Si、Ca、Mg等元素的氧化物)为原料制备高纯
及少量Fe、Al、Si、Ca、Mg等元素的氧化物)为原料制备高纯 的实验步骤如下:
的实验步骤如下:
(1)浸取。实验室浸取软锰矿的装置如图所示:
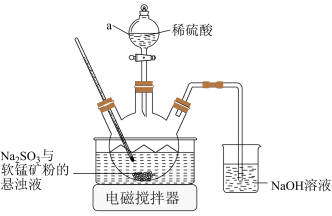
①为了提高软锰矿的浸出速率和浸取率,上述装置中采取的措施有_____ 。(答出一点即可)
②仪器a为_____ ;NaOH溶液的作用是_____ 。
③反应通常在70℃下反应,写出 转化为
转化为 的离子方程式
的离子方程式_____ 。
(2)除杂。向已经除去铁、铝、硅元素的 溶液(pH约为5)中加入NaF溶液,溶液中
溶液(pH约为5)中加入NaF溶液,溶液中 、
、 形成氟化物沉淀。但若pH太低,会显著增加NaF的用量,其原因为
形成氟化物沉淀。但若pH太低,会显著增加NaF的用量,其原因为_____ (用必要的离子方程式结合勒夏特列原理解释)。
(3)沉锰。向 溶液中缓慢滴加
溶液中缓慢滴加 溶液,过滤、洗涤、干燥,得到
溶液,过滤、洗涤、干燥,得到 固体。解释生成
固体。解释生成 固体所需要的平衡理论有
固体所需要的平衡理论有_____ 。
a、 的沉淀溶解平衡 b、
的沉淀溶解平衡 b、 的水解平衡 c、
的水解平衡 c、 的电离平衡 d、
的电离平衡 d、 的电离平衡
的电离平衡
(4)热解。将 置于热解装置中,通入足量空气,加热到450℃。将固体冷却后研成粉末,边搅拌边加入一定量稀硫酸除去少量的MnO、
置于热解装置中,通入足量空气,加热到450℃。将固体冷却后研成粉末,边搅拌边加入一定量稀硫酸除去少量的MnO、 ,加热,充分反应后过滤、洗涤、干燥,即可获得高纯
,加热,充分反应后过滤、洗涤、干燥,即可获得高纯 (已知:加热条件下
(已知:加热条件下 在酸性溶液中转化为
在酸性溶液中转化为 和
和 )。检验是否“洗涤”干净的操作方法为
)。检验是否“洗涤”干净的操作方法为_____ 。
 及少量Fe、Al、Si、Ca、Mg等元素的氧化物)为原料制备高纯
及少量Fe、Al、Si、Ca、Mg等元素的氧化物)为原料制备高纯 的实验步骤如下:
的实验步骤如下:(1)浸取。实验室浸取软锰矿的装置如图所示:

①为了提高软锰矿的浸出速率和浸取率,上述装置中采取的措施有
②仪器a为
③反应通常在70℃下反应,写出
 转化为
转化为 的离子方程式
的离子方程式(2)除杂。向已经除去铁、铝、硅元素的
 溶液(pH约为5)中加入NaF溶液,溶液中
溶液(pH约为5)中加入NaF溶液,溶液中 、
、 形成氟化物沉淀。但若pH太低,会显著增加NaF的用量,其原因为
形成氟化物沉淀。但若pH太低,会显著增加NaF的用量,其原因为(3)沉锰。向
 溶液中缓慢滴加
溶液中缓慢滴加 溶液,过滤、洗涤、干燥,得到
溶液,过滤、洗涤、干燥,得到 固体。解释生成
固体。解释生成 固体所需要的平衡理论有
固体所需要的平衡理论有a、
 的沉淀溶解平衡 b、
的沉淀溶解平衡 b、 的水解平衡 c、
的水解平衡 c、 的电离平衡 d、
的电离平衡 d、 的电离平衡
的电离平衡(4)热解。将
 置于热解装置中,通入足量空气,加热到450℃。将固体冷却后研成粉末,边搅拌边加入一定量稀硫酸除去少量的MnO、
置于热解装置中,通入足量空气,加热到450℃。将固体冷却后研成粉末,边搅拌边加入一定量稀硫酸除去少量的MnO、 ,加热,充分反应后过滤、洗涤、干燥,即可获得高纯
,加热,充分反应后过滤、洗涤、干燥,即可获得高纯 (已知:加热条件下
(已知:加热条件下 在酸性溶液中转化为
在酸性溶液中转化为 和
和 )。检验是否“洗涤”干净的操作方法为
)。检验是否“洗涤”干净的操作方法为
您最近一年使用:0次
解题方法
3 . 油画创作通常需要用到多种无机颜料。研究发现,在不同的空气湿度和光照条件下,颜料雌黄( )褪色的主要原因是发生了以下两种化学反应:
)褪色的主要原因是发生了以下两种化学反应:
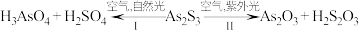
下列说法错误的是
 )褪色的主要原因是发生了以下两种化学反应:
)褪色的主要原因是发生了以下两种化学反应: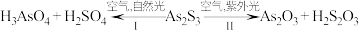
下列说法错误的是
A. 和 和 的空间构型都是正四面体形 的空间构型都是正四面体形 |
| B.反应Ⅰ和Ⅱ中均有两种氧化产物 |
C.反应Ⅰ和Ⅱ中,氧化1  转移的电子数之比为7∶3 转移的电子数之比为7∶3 |
D.反应Ⅰ和Ⅱ中,参加反应 的比值:反应Ⅰ 的比值:反应Ⅰ 反应Ⅱ 反应Ⅱ |
您最近一年使用:0次
解题方法
4 . 硒( )是动物和人体所必需的微量元素之一,某科学小组以含硒物料(主要含S、
)是动物和人体所必需的微量元素之一,某科学小组以含硒物料(主要含S、 、
、 、
、 、
、 、
、 和铜、银的化合物等)为原料提取硒,设计的流程如图:
和铜、银的化合物等)为原料提取硒,设计的流程如图:

回答下列问题:
(1)“脱硫”时,测得脱硫率随温度的变化如图。随着温度的升高,脱硫率呈上升趋势,其原因是___________ 。“脱硫”时最佳温度是___________ 。
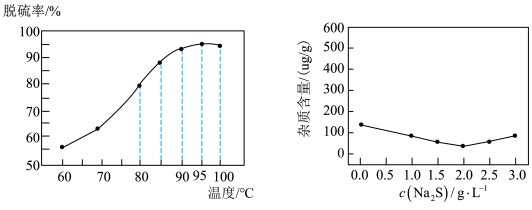
(2)“氧化浸取”中 单质被氧化为
单质被氧化为 并收集到
并收集到 气体,该过程的化学反应方程式为
气体,该过程的化学反应方程式为___________ 。“滤渣”可以被磁铁吸引,其主要成分有___________ 。
(3)“除杂”中 浓度对粗硒除杂的影响如图所示,
浓度对粗硒除杂的影响如图所示,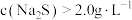 后精硒中杂质含量又上升的原因可能是
后精硒中杂质含量又上升的原因可能是___________ 。
(4)“酸化”中制取精硒的离子方程式为___________ 。
(5)实验室中可以用 还原
还原 溶液制取硒单质,请补充完整实验方案:取一定量
溶液制取硒单质,请补充完整实验方案:取一定量 溶液,在不断搅拌下向
溶液,在不断搅拌下向 溶液中缓缓通入
溶液中缓缓通入 气体,同时用
气体,同时用 溶液吸收多余的尾气,直至
溶液吸收多余的尾气,直至___________ ,干燥,得硒单质。
 )是动物和人体所必需的微量元素之一,某科学小组以含硒物料(主要含S、
)是动物和人体所必需的微量元素之一,某科学小组以含硒物料(主要含S、 、
、 、
、 、
、 、
、 和铜、银的化合物等)为原料提取硒,设计的流程如图:
和铜、银的化合物等)为原料提取硒,设计的流程如图:
回答下列问题:
(1)“脱硫”时,测得脱硫率随温度的变化如图。随着温度的升高,脱硫率呈上升趋势,其原因是

(2)“氧化浸取”中
 单质被氧化为
单质被氧化为 并收集到
并收集到 气体,该过程的化学反应方程式为
气体,该过程的化学反应方程式为(3)“除杂”中
 浓度对粗硒除杂的影响如图所示,
浓度对粗硒除杂的影响如图所示, 后精硒中杂质含量又上升的原因可能是
后精硒中杂质含量又上升的原因可能是(4)“酸化”中制取精硒的离子方程式为
(5)实验室中可以用
 还原
还原 溶液制取硒单质,请补充完整实验方案:取一定量
溶液制取硒单质,请补充完整实验方案:取一定量 溶液,在不断搅拌下向
溶液,在不断搅拌下向 溶液中缓缓通入
溶液中缓缓通入 气体,同时用
气体,同时用 溶液吸收多余的尾气,直至
溶液吸收多余的尾气,直至
您最近一年使用:0次
名校
解题方法
5 .  在催化剂上还原
在催化剂上还原 生成
生成 和
和 的机理如图所示。下列说法错误的是
的机理如图所示。下列说法错误的是
 在催化剂上还原
在催化剂上还原 生成
生成 和
和 的机理如图所示。下列说法错误的是
的机理如图所示。下列说法错误的是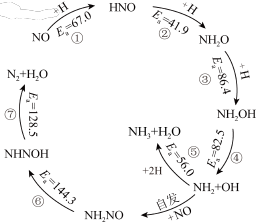
A.标准状况下,消耗  ,转移电子数可能为 ,转移电子数可能为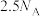 |
| B.整个反应过程中,只有极性键断裂和形成 |
C.图中生成 的五步反应中,N元素均被还原 的五步反应中,N元素均被还原 |
D.生成 的化学反应方程式为 的化学反应方程式为 |
您最近一年使用:0次
2023-05-26更新
|
343次组卷
|
3卷引用:山东省济宁市育才中学2023-2024学年高一下学期期中考试化学试卷
名校
6 . 以硫铁矿(主要成分为 ,还有少量
,还有少量 、
、 等杂质)为原料制备绿矾晶体(
等杂质)为原料制备绿矾晶体( ,
,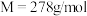 )的工艺流程如下:
)的工艺流程如下:
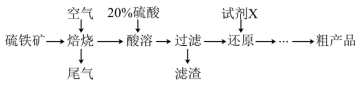
(1)滤渣的成分为___________ 。焙烧步骤中主要反应的化学方程式为___________ 。
(2)流程中省略的步骤含有①蒸发浓缩、冷却结晶②过滤③调溶液pH沉铝④洗涤、干燥,请写出正确顺序___________ (填序号,下同)。你认为获得粗产品后的母液进入___________ 操作中更合理。
(3)取 样品,加水完全溶解,滴加硫酸酸化的
样品,加水完全溶解,滴加硫酸酸化的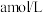
 溶液至恰好完全反应(
溶液至恰好完全反应( 被还原为
被还原为 ),消耗
),消耗 溶液
溶液 。则绿矾晶体纯度为
。则绿矾晶体纯度为___________ (可不化简)。
(4)燃料细菌脱硫法是用氧化亚铁硫杆菌(T。F)对硫铁矿进行催化脱硫,同时得到 溶液。其过程如下图所示(其中
溶液。其过程如下图所示(其中 中S的平均化合价为
中S的平均化合价为 价):
价):
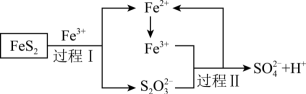
过程Ⅱ中氧化产物与还原产物的物质的量之比为___________ 。
(5) 可用于制备一种新型、高效、多功能绿色水处理剂高铁酸钠(
可用于制备一种新型、高效、多功能绿色水处理剂高铁酸钠( ),工业上有多种制备高铁酸钠方法。
),工业上有多种制备高铁酸钠方法。
①干法制备:主要反应为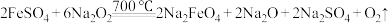 。从氧化还原反应的角度分析,
。从氧化还原反应的角度分析, 的作用为
的作用为___________ 。
②湿法制备:在碱性条件下,用 溶液和
溶液和 溶液反应制备。该反应的离子方程式为
溶液反应制备。该反应的离子方程式为___________ 。
 ,还有少量
,还有少量 、
、 等杂质)为原料制备绿矾晶体(
等杂质)为原料制备绿矾晶体( ,
,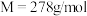 )的工艺流程如下:
)的工艺流程如下:
(1)滤渣的成分为
(2)流程中省略的步骤含有①蒸发浓缩、冷却结晶②过滤③调溶液pH沉铝④洗涤、干燥,请写出正确顺序
(3)取
 样品,加水完全溶解,滴加硫酸酸化的
样品,加水完全溶解,滴加硫酸酸化的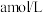
 溶液至恰好完全反应(
溶液至恰好完全反应( 被还原为
被还原为 ),消耗
),消耗 溶液
溶液 。则绿矾晶体纯度为
。则绿矾晶体纯度为(4)燃料细菌脱硫法是用氧化亚铁硫杆菌(T。F)对硫铁矿进行催化脱硫,同时得到
 溶液。其过程如下图所示(其中
溶液。其过程如下图所示(其中 中S的平均化合价为
中S的平均化合价为 价):
价):
过程Ⅱ中氧化产物与还原产物的物质的量之比为
(5)
 可用于制备一种新型、高效、多功能绿色水处理剂高铁酸钠(
可用于制备一种新型、高效、多功能绿色水处理剂高铁酸钠( ),工业上有多种制备高铁酸钠方法。
),工业上有多种制备高铁酸钠方法。①干法制备:主要反应为
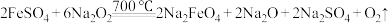 。从氧化还原反应的角度分析,
。从氧化还原反应的角度分析, 的作用为
的作用为②湿法制备:在碱性条件下,用
 溶液和
溶液和 溶液反应制备。该反应的离子方程式为
溶液反应制备。该反应的离子方程式为
您最近一年使用:0次
名校
解题方法
7 . 有氧条件下,NO在催化剂作用下可被NH3还原为N2,反应机理如图所示。下列说法错误的是
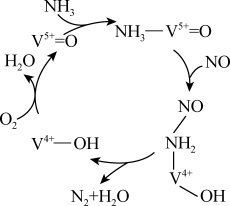
A.总的化学反应方程式为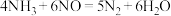 (一定条件) (一定条件) |
| B.该转化过程中,NO和O2都表现了氧化性 |
| C.V5+=O参与了反应 |
| D.反应过程中有共价键的断裂和生成 |
您最近一年使用:0次
名校
8 . 实验室利用钴渣[含 、
、 等]制备
等]制备 的流程如图所示:
的流程如图所示:

已知: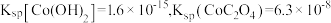
下列说法正确的是
 、
、 等]制备
等]制备 的流程如图所示:
的流程如图所示:
已知:
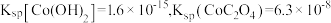
下列说法正确的是
A.“溶解还原”过程中得到的 与消耗的 与消耗的 物质的量之比为 物质的量之比为 |
B.“沉钴”时,不用 溶液是为了防止溶液碱性太强而生成 溶液是为了防止溶液碱性太强而生成 沉淀 沉淀 |
C.可以用氢氧化钠溶液检验 固体是否洗涤干净 固体是否洗涤干净 |
D.“焙烧”的方程式为 |
您最近一年使用:0次
2023-04-21更新
|
914次组卷
|
5卷引用:山东省济宁市兖州区2023-2024学年高三上学期期中考试化学试题
9 . 氧钒碱式碳酸铵晶体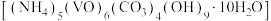 可用于制备热敏材料。以含钒废料(含有V2O3、Fe2O3、Al2O3、CuO、有机物等)来制备氧钒碱式碳酸铵晶体的一种工艺流程如下:
可用于制备热敏材料。以含钒废料(含有V2O3、Fe2O3、Al2O3、CuO、有机物等)来制备氧钒碱式碳酸铵晶体的一种工艺流程如下:

已知:含钒离子在溶液中的主要存在形式与溶液pH的关系:
(1)“焙烧”过程中除了 、
、 、
、 、
、 中的某些物质参加反应外,“焙烧”的另一个作用是
中的某些物质参加反应外,“焙烧”的另一个作用是_______ 。
(2)写出“焙烧”过程中生成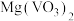 的化学方程式:
的化学方程式:_______ 。
(3)“调 ”的作用除了沉淀某些金属阳离子外,还有的作用是
”的作用除了沉淀某些金属阳离子外,还有的作用是_______ 。
(4)若“净化Ⅱ”加入过量的 ,可能导致的后果为
,可能导致的后果为_______ 。
(5)称量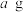 产品于锥形瓶中,先用
产品于锥形瓶中,先用 蒸馏水与
蒸馏水与 稀硫酸溶解后,再加入
稀硫酸溶解后,再加入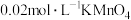 溶液至稍过量,充分反应后继续滴加1%的
溶液至稍过量,充分反应后继续滴加1%的 溶液至稍过量,再用尿素除去过量
溶液至稍过量,再用尿素除去过量 ,最后用
,最后用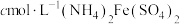 标准溶液滴定至终点,消耗标准溶液的体积为
标准溶液滴定至终点,消耗标准溶液的体积为 。(已知滴定反应为
。(已知滴定反应为 )
)
① 溶液的作用是
溶液的作用是_______ 。
②粗产品中钒的质量分数表达式为_______ (以 计)。
计)。
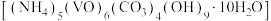 可用于制备热敏材料。以含钒废料(含有V2O3、Fe2O3、Al2O3、CuO、有机物等)来制备氧钒碱式碳酸铵晶体的一种工艺流程如下:
可用于制备热敏材料。以含钒废料(含有V2O3、Fe2O3、Al2O3、CuO、有机物等)来制备氧钒碱式碳酸铵晶体的一种工艺流程如下:
已知:含钒离子在溶液中的主要存在形式与溶液pH的关系:
| pH | 4~6 | 6~8 | 8~10 |
| 主要离子 |  |  | 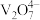 |
 、
、 、
、 、
、 中的某些物质参加反应外,“焙烧”的另一个作用是
中的某些物质参加反应外,“焙烧”的另一个作用是(2)写出“焙烧”过程中生成
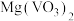 的化学方程式:
的化学方程式:(3)“调
 ”的作用除了沉淀某些金属阳离子外,还有的作用是
”的作用除了沉淀某些金属阳离子外,还有的作用是(4)若“净化Ⅱ”加入过量的
 ,可能导致的后果为
,可能导致的后果为(5)称量
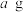 产品于锥形瓶中,先用
产品于锥形瓶中,先用 蒸馏水与
蒸馏水与 稀硫酸溶解后,再加入
稀硫酸溶解后,再加入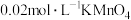 溶液至稍过量,充分反应后继续滴加1%的
溶液至稍过量,充分反应后继续滴加1%的 溶液至稍过量,再用尿素除去过量
溶液至稍过量,再用尿素除去过量 ,最后用
,最后用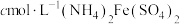 标准溶液滴定至终点,消耗标准溶液的体积为
标准溶液滴定至终点,消耗标准溶液的体积为 。(已知滴定反应为
。(已知滴定反应为 )
)①
 溶液的作用是
溶液的作用是②粗产品中钒的质量分数表达式为
 计)。
计)。
您最近一年使用:0次
2023-03-16更新
|
283次组卷
|
2卷引用:山东省济宁市泗水县2023-2024学年高三上学期期中考试化学试题
10 . 以铬铁矿(含 及少量
及少量 、
、 、MgO)为原料,可制备
、MgO)为原料,可制备 、AlOOH、
、AlOOH、 ,该工艺流程如下:
,该工艺流程如下:

(1)“过滤1”所得滤渣的主要成分 和
和_______ ,通入氧气氧化的元素为_______ 。
(2)“浸取”在350℃、高压下进行,所得浸取液的溶质主要为 、
、 、
、 ,其中生成
,其中生成 的化学方程式为
的化学方程式为_______ 。
(3)“浸取”后,“酸化”时生成AlOOH可吸附 形成沉淀,而“脱附”时两者分离,吸附与脱附的可能机理的示意图如图所示。
形成沉淀,而“脱附”时两者分离,吸附与脱附的可能机理的示意图如图所示。

①在A的作用下,吸附剂表面出现“活性吸附位”,A的化学式为_______ 。
②“脱附”时加入NaOH溶液可有效脱除AlOOH表面吸附的 ,该过程可描述为
,该过程可描述为_______ 。
③“酸化”时铝元素的浓度随pH的变化如图所示,pH太小或太大都会导致溶液中铝元素浓度偏高的原因是_______ 。

(4)测定某 溶液的浓度,准确量取10.00mL
溶液的浓度,准确量取10.00mL 溶液,加入过量K溶液,充分反应,用0.1000
溶液,加入过量K溶液,充分反应,用0.1000 的
的 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液30.00mL。实验测定原理为:
溶液30.00mL。实验测定原理为: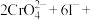
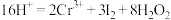 、
、 ,该溶液中
,该溶液中 物质的量浓度为
物质的量浓度为_______ 。
 及少量
及少量 、
、 、MgO)为原料,可制备
、MgO)为原料,可制备 、AlOOH、
、AlOOH、 ,该工艺流程如下:
,该工艺流程如下:
(1)“过滤1”所得滤渣的主要成分
 和
和(2)“浸取”在350℃、高压下进行,所得浸取液的溶质主要为
 、
、 、
、 ,其中生成
,其中生成 的化学方程式为
的化学方程式为(3)“浸取”后,“酸化”时生成AlOOH可吸附
 形成沉淀,而“脱附”时两者分离,吸附与脱附的可能机理的示意图如图所示。
形成沉淀,而“脱附”时两者分离,吸附与脱附的可能机理的示意图如图所示。
①在A的作用下,吸附剂表面出现“活性吸附位”,A的化学式为
②“脱附”时加入NaOH溶液可有效脱除AlOOH表面吸附的
 ,该过程可描述为
,该过程可描述为③“酸化”时铝元素的浓度随pH的变化如图所示,pH太小或太大都会导致溶液中铝元素浓度偏高的原因是

(4)测定某
 溶液的浓度,准确量取10.00mL
溶液的浓度,准确量取10.00mL 溶液,加入过量K溶液,充分反应,用0.1000
溶液,加入过量K溶液,充分反应,用0.1000 的
的 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液30.00mL。实验测定原理为:
溶液30.00mL。实验测定原理为: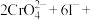
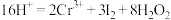 、
、 ,该溶液中
,该溶液中 物质的量浓度为
物质的量浓度为
您最近一年使用:0次



