1 . 碘化亚铜(CuI)是重要的有机催化剂。某学习小组用如图装置制备CuI,并设计实验探究其性质。已知:碘化亚铜(CuI)是白色固体,难溶于水,易与KI形成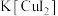 ,实验装置如图所示。
,实验装置如图所示。
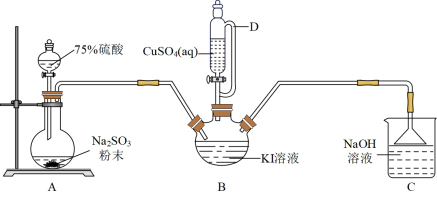
(1)仪器D的名称是___________ 。
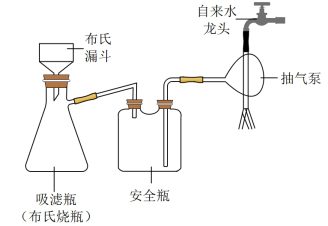
(2)实验完毕后,用如图所示装置分离CuI的突出优点是___________ 。
(3)装置B中发生反应的离子方程式是___________ 。
(4)小组同学设计下表方案对CuI的性质进行探究:
①在实验I中“加水,又生成白色沉淀”的原理是___________ 。
②根据实验Ⅱ,CuI与NaOH溶液反应的化学方程式是___________ 。
(5)测定CuI样品纯度:取agCuI样品与适量NaOH溶液充分反应后,过滤;在滤液中加入足量的酸化的双氧水,滴几滴淀粉溶液,用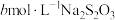 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液体积为VmL[已知:滴定反应为
溶液体积为VmL[已知:滴定反应为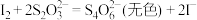 ]。该样品纯度为
]。该样品纯度为___________ (用含a、b、V的代数式表示)。如果其他操作均正确,仅滴定前盛标准液的滴定管用蒸馏水洗净后没有用标准液润洗,测得结果___________ (填“偏高”“偏低”或“无影响”)。
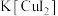 ,实验装置如图所示。
,实验装置如图所示。
(1)仪器D的名称是
(2)实验完毕后,用如图所示装置分离CuI的突出优点是

(3)装置B中发生反应的离子方程式是
(4)小组同学设计下表方案对CuI的性质进行探究:
| 实验 | 实验操作及现象 |
| I | 取少量CuI放入试管中,加入KI溶液,白色固体溶解得到无色溶液;加水,又生成白色沉淀 |
| Ⅱ | 取少量CuI放入试管中,加入NaOH溶液,振荡,产生砖红色沉淀。过滤,向所得上层清液中滴加淀粉溶液,无明显变化;将砖红色沉淀溶于稀硫酸,产生红色固体和蓝色溶液 |
②根据实验Ⅱ,CuI与NaOH溶液反应的化学方程式是
(5)测定CuI样品纯度:取agCuI样品与适量NaOH溶液充分反应后,过滤;在滤液中加入足量的酸化的双氧水,滴几滴淀粉溶液,用
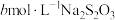 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液体积为VmL[已知:滴定反应为
溶液体积为VmL[已知:滴定反应为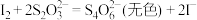 ]。该样品纯度为
]。该样品纯度为
您最近一年使用:0次
解题方法
2 . 一种从水钴矿(含 、
、 、CuO、FeO、
、CuO、FeO、 、CaO及MgO等)中浸出铜、钴的工艺流程如下:
、CaO及MgO等)中浸出铜、钴的工艺流程如下:
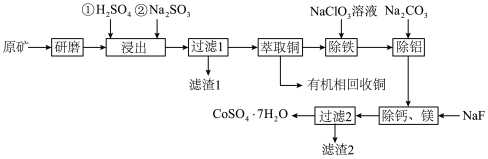
请回答下列问题:
(1)“研磨”的目的是___________ 。
(2)“浸出”时, 被浸出的化学方程式为
被浸出的化学方程式为___________ 。
(3)滤渣1的成分是___________ 。
(4)“除铁”时, 被氧化为
被氧化为 ,
, 被还原为
被还原为 ,离子方程式为
,离子方程式为___________ ;“除铝”时加入 的目的是
的目的是___________ 。
(5)已知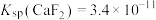 ,
,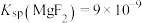 ,“除钙、镁”时,欲使
,“除钙、镁”时,欲使 、
、 除尽(离子浓度小于
除尽(离子浓度小于 ),加NaF时应控制溶液中
),加NaF时应控制溶液中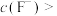
___________  。
。
(6)由“过滤2”后的母液得到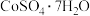 的操作是
的操作是___________ ,___________ 、过滤、洗涤、干燥。
 、
、 、CuO、FeO、
、CuO、FeO、 、CaO及MgO等)中浸出铜、钴的工艺流程如下:
、CaO及MgO等)中浸出铜、钴的工艺流程如下:
请回答下列问题:
(1)“研磨”的目的是
(2)“浸出”时,
 被浸出的化学方程式为
被浸出的化学方程式为(3)滤渣1的成分是
(4)“除铁”时,
 被氧化为
被氧化为 ,
, 被还原为
被还原为 ,离子方程式为
,离子方程式为 的目的是
的目的是(5)已知
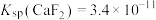 ,
,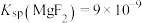 ,“除钙、镁”时,欲使
,“除钙、镁”时,欲使 、
、 除尽(离子浓度小于
除尽(离子浓度小于 ),加NaF时应控制溶液中
),加NaF时应控制溶液中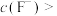
 。
。(6)由“过滤2”后的母液得到
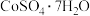 的操作是
的操作是
您最近一年使用:0次
3 . 电视节目《我在故宫修文物》展示了专家精湛的技艺和对传统文化的热爱与坚守,也让人们体会到化学方法在文物保护中的巨大作用。某博物馆修复出土铁器的过程如下:
(1)检测锈蚀产物
铁器在_____ (自然环境条件)中容易被腐蚀。
(2)分析腐蚀原理:一般认为,文物类铁器经过了电化腐蚀循环。
① 转化为
转化为
② 在自然环境中形成
在自然环境中形成 ,该物质中铁元素的化合价为
,该物质中铁元素的化合价为_____ 。
③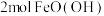 和
和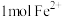 反应形成致密的
反应形成致密的 保护层,
保护层, 的作用是
的作用是_____ (填字母)。
a.氧化剂 b.还原剂 c.既不是氧化剂也不是还原剂
(3)钢铁的保护:
①钢铁的发蓝可在亚硝酸钠和硝酸钠的熔融盐中进行,也可在高温热空气及500℃以上的过热蒸气中进行,更常用的是在加有亚硝酸钠的浓苛性钠中加热,在钢铁的表面形成一层磁性氧化物的技术过程,其过程可以用如下三步化学方程式表示,则第三步化学方程式为:
a.
b.
c._____
②研究发现, 对铁的腐蚀会造成严重影响。化学修复:脱氯、还原,形成
对铁的腐蚀会造成严重影响。化学修复:脱氯、还原,形成 保护层,方法如下:将铁器浸没在盛有
保护层,方法如下:将铁器浸没在盛有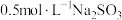 、
、 溶液的容器中,缓慢加热至60~90℃,一段时间后,取出器物,用
溶液的容器中,缓慢加热至60~90℃,一段时间后,取出器物,用 溶液洗涤至无
溶液洗涤至无 。
。
a.检测洗涤液中 的方法是
的方法是_____
b.脱氯反应: 。根据复分解反应发生的条件,比较
。根据复分解反应发生的条件,比较 与
与 溶解度的大小:
溶解度的大小:
_____ 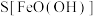 。(填>或<或=)
。(填>或<或=)
c. 还原
还原 形成
形成 的离子方程式是
的离子方程式是_____ 。
(1)检测锈蚀产物
| 主要成分的化学式 | |||
 | 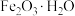 |  |  |
(2)分析腐蚀原理:一般认为,文物类铁器经过了电化腐蚀循环。
①
 转化为
转化为
②
 在自然环境中形成
在自然环境中形成 ,该物质中铁元素的化合价为
,该物质中铁元素的化合价为③
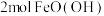 和
和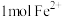 反应形成致密的
反应形成致密的 保护层,
保护层, 的作用是
的作用是a.氧化剂 b.还原剂 c.既不是氧化剂也不是还原剂
(3)钢铁的保护:
①钢铁的发蓝可在亚硝酸钠和硝酸钠的熔融盐中进行,也可在高温热空气及500℃以上的过热蒸气中进行,更常用的是在加有亚硝酸钠的浓苛性钠中加热,在钢铁的表面形成一层磁性氧化物的技术过程,其过程可以用如下三步化学方程式表示,则第三步化学方程式为:
a.

b.

c.
②研究发现,
 对铁的腐蚀会造成严重影响。化学修复:脱氯、还原,形成
对铁的腐蚀会造成严重影响。化学修复:脱氯、还原,形成 保护层,方法如下:将铁器浸没在盛有
保护层,方法如下:将铁器浸没在盛有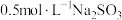 、
、 溶液的容器中,缓慢加热至60~90℃,一段时间后,取出器物,用
溶液的容器中,缓慢加热至60~90℃,一段时间后,取出器物,用 溶液洗涤至无
溶液洗涤至无 。
。a.检测洗涤液中
 的方法是
的方法是b.脱氯反应:
 。根据复分解反应发生的条件,比较
。根据复分解反应发生的条件,比较 与
与 溶解度的大小:
溶解度的大小:
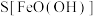 。(填>或<或=)
。(填>或<或=)c.
 还原
还原 形成
形成 的离子方程式是
的离子方程式是
您最近一年使用:0次
名校
解题方法
4 . 下图是自然界中的氮循环过程。下列有关叙述错误的是


| A.反应①、反应②及工业合成氨均属于氮的固定 |
B.反应④中,生成 至少需要提供 至少需要提供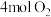 |
C.反应③的反应方程式为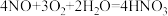 |
| D.过程中参与循环的元素有氮元素,还有氢和氧元素 |
您最近一年使用:0次
2023-12-08更新
|
280次组卷
|
3卷引用:湖北省恩施土家族苗族自治州利川市第一中学2023-2024学年高二下学期开学化学试题
5 . 氮氧化物(NOx)是严重的环境污染物,研究氮氧化物废气处理是国际环保主要方向之一。用 CH4催化还原 NOx可以消除氮氧化物的污染。
(1)在室温下,0.5 mol CH4(g)还原 NO2(g)至 N2(g),完全反应放出 477.5 kJ 的热量,该反应的热化学方程式为:_______________ 。
(2)一定温度下,向一个装有催化剂体积为 2L 的密闭容器中投入一定量的 CH4 (g)和 NO (g) 发生反应:
CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g)。
2N2(g)+CO2(g)+2H2O(g)。
①能说明该反应已经达到平衡状态的是_________(填字母)。
②5min 后该反应达到平衡,测得容器中 N2的物质的量为 0.4mol。则 8min 内用NO表示的反应速率为v(NO)=___________。
③测得反应速率和温度的关系如图甲所示,BC段反应速率降低的原因可能是___________。若该反应在一定温度下达到平衡后,将容器逐渐压缩,容器内CH4的平衡转化率为α,测定结果如图乙所示,试分析α随压强增大,开始不变,一定程度后逐渐增大的原因是________________。

(3)利用某分子筛作催化剂,NH3也可脱除废气中的 NO 和 NO2,生成两种无毒物质。其反应历程如图所示:

①该反应历程中 X 表示的物质为_____________ 、_______________ 。
②上述历程的总反应为:_____________________________________ 。
(1)在室温下,0.5 mol CH4(g)还原 NO2(g)至 N2(g),完全反应放出 477.5 kJ 的热量,该反应的热化学方程式为:
(2)一定温度下,向一个装有催化剂体积为 2L 的密闭容器中投入一定量的 CH4 (g)和 NO (g) 发生反应:
CH4(g)+4NO(g)
 2N2(g)+CO2(g)+2H2O(g)。
2N2(g)+CO2(g)+2H2O(g)。 ①能说明该反应已经达到平衡状态的是_________(填字母)。
| A.容器内气体压强保持不变 |
| B.混合气体的密度保持不变 |
| C.CH4的消耗速率等于 CO2的消耗速率 |
| D.c(CH4)和 c(CO2)的浓度比保持不变 |
②5min 后该反应达到平衡,测得容器中 N2的物质的量为 0.4mol。则 8min 内用NO表示的反应速率为v(NO)=___________。
③测得反应速率和温度的关系如图甲所示,BC段反应速率降低的原因可能是___________。若该反应在一定温度下达到平衡后,将容器逐渐压缩,容器内CH4的平衡转化率为α,测定结果如图乙所示,试分析α随压强增大,开始不变,一定程度后逐渐增大的原因是________________。

(3)利用某分子筛作催化剂,NH3也可脱除废气中的 NO 和 NO2,生成两种无毒物质。其反应历程如图所示:

①该反应历程中 X 表示的物质为
②上述历程的总反应为:
您最近一年使用:0次
6 . 乙醇在一定条件下可以转化为乙醛,乙醛可进一步被氧化成乙酸。某兴趣小组进行两组实验探究,实验装置如下图所示(装置气密性已检查)。
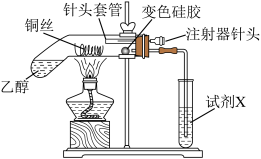
已知:变色硅胶吸收水分后会由蓝色变成粉红色。
实验Ⅰ:通过注射器针头鼓入空气的条件下进行实验。
(1)乙醛中官能团的结构简式为_______ ,下列可用于检验该官能团的试剂是_______ (填字母选项)。
a.银氨溶液 b. 溶液 c.
溶液 c. -淀粉溶液
-淀粉溶液
(2)开始实验时先加热铜网,再通过注射器针头缓慢鼓入空气,该过程中铜丝产生实验现象为_______ ,同时变色硅胶由蓝色变成粉红色,写出乙醇催化氧化的化学反应方程式_______ 。
(3)在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该反应是_______ (填“吸热”或“放热”)反应。
(4)为检验上述实验收集的产物,该小组同学继续进行如下实验并得出相应结论。
实验①~③中的结论不合理的是_______ (填序号),原因是_______ 。
实验Ⅱ:在没有鼓入空气的条件下进行实验。
(5)乙醇蒸气能发生催化氧化生成乙醛,变色硅胶不变色,则该反应的化学方程式为_______ 。

已知:变色硅胶吸收水分后会由蓝色变成粉红色。
实验Ⅰ:通过注射器针头鼓入空气的条件下进行实验。
(1)乙醛中官能团的结构简式为
a.银氨溶液 b.
 溶液 c.
溶液 c. -淀粉溶液
-淀粉溶液(2)开始实验时先加热铜网,再通过注射器针头缓慢鼓入空气,该过程中铜丝产生实验现象为
(3)在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该反应是
(4)为检验上述实验收集的产物,该小组同学继续进行如下实验并得出相应结论。
| 实验序号 | 试剂 和反应条件 和反应条件 | 现象 | 结论 |
| ① | 酸性 溶液 溶液 | 紫红色褪去 | 产物含有乙醛 |
| ② | 新制氢氧化铜悬浊液,加热 | 生成砖红色沉淀 | 产物含有乙醛 |
| ③ | 含酚酞的 溶液 溶液 | 浅红色褪去 | 产物可能含有乙酸 |
实验Ⅱ:在没有鼓入空气的条件下进行实验。
(5)乙醇蒸气能发生催化氧化生成乙醛,变色硅胶不变色,则该反应的化学方程式为
您最近一年使用:0次
7 . 下列离子方程式错误的是
A.用醋酸和淀粉 溶液检验加碘盐中的 溶液检验加碘盐中的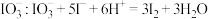 |
B. 和浓硝酸反应: 和浓硝酸反应: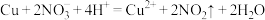 |
C. 使酸性 使酸性 溶液褪色: 溶液褪色: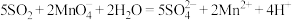 |
D.亚硝酸钠与氯化铵溶液受热反应: |
您最近一年使用:0次
名校
解题方法
8 . 镍、铬等属于宝贵的金属资源。一种回收电化学废渣中铬镍的工艺流程如下:
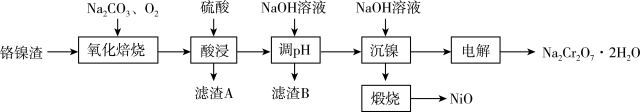
已知:
①铬镍渣中含有 、
、 、
、 、
、 、
、 等;
等;
②25℃时,部分物质的溶度积表:
③
回答下列问题:
(1)“氧化焙烧”时, 发生的化学方程式
发生的化学方程式_______ 。
(2)“酸浸”使用强力搅拌器搅拌的目的是_______ ,滤渣A主要是_______ (填化学式)。
(3)“调 ”时,若
”时,若 至少为
至少为_______ 时, 沉淀完全。(
沉淀完全。( )
)
(4)“沉镍”后,“煅烧”的化学方程式为_______ 。
(5)已知“电解”操作中的装置如下图所示。
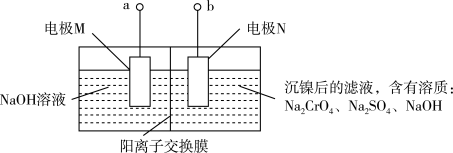
①a接电源的_______ (填“正”或“负”)极。
②电极N上的电极反应式为_______ 。

已知:
①铬镍渣中含有
 、
、 、
、 、
、 、
、 等;
等;②25℃时,部分物质的溶度积表:
| 物质 |  |  |  |  |
 | 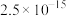 | 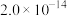 | 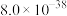 | 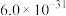 |

回答下列问题:
(1)“氧化焙烧”时,
 发生的化学方程式
发生的化学方程式(2)“酸浸”使用强力搅拌器搅拌的目的是
(3)“调
 ”时,若
”时,若 至少为
至少为 沉淀完全。(
沉淀完全。( )
)(4)“沉镍”后,“煅烧”的化学方程式为
(5)已知“电解”操作中的装置如下图所示。

①a接电源的
②电极N上的电极反应式为
您最近一年使用:0次
2023-02-02更新
|
207次组卷
|
3卷引用:湖北省孝感市部分学校2022-2023学年高二下学期收心考试(开学考试)化学试题
湖北省孝感市部分学校2022-2023学年高二下学期收心考试(开学考试)化学试题安徽省淮北市第一中学2022-2023学年高二下学期第二次月考化学试题(已下线)2023年湖南卷高考真题变式题(工业流程题)
名校
9 . 海洋中蕴含着丰富的化学元素,是人类资源的宝库。
Ⅰ.海带中含有碘元素。从海带中提取碘的实验过程如下图所示:

(1)实验步骤①会用到下列仪器中的_______ (填字母)。
a.酒精灯 b.漏斗 c.坩埚 d.泥三角
(2)步骤④中反应的离子方程式为_______ 。
(3)请设计一种检验水溶液中是否含有碘单质的方法:_______ 。
Ⅱ.镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。主要步骤如下:
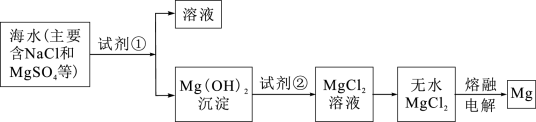
(4)为了使 转化为
转化为 ,试剂①可以选用
,试剂①可以选用_______ (填化学式)。
(5) 的电子式为
的电子式为_______ ,无水 在熔融状态下,通电后会产生Mg和
在熔融状态下,通电后会产生Mg和 ,该反应的化学方程式为
,该反应的化学方程式为_______ 。
Ⅲ.海水提溴:主要工业生产流程如下图所示。
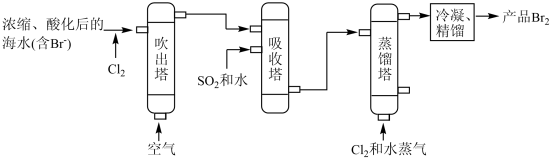
(6)海水中的 被
被 氧化的离子方程式是
氧化的离子方程式是_______ 。
(7)吸收塔中 将
将 转化为HBr的化学方程式是
转化为HBr的化学方程式是_______ 。
(8)工业上也可用 溶液吸收吹出的
溶液吸收吹出的 。补全以下化学方程式:
。补全以下化学方程式:_______ 。
_______ _______
_______ _______NaBr+_______
_______NaBr+_______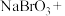 _______
_______
Ⅰ.海带中含有碘元素。从海带中提取碘的实验过程如下图所示:

(1)实验步骤①会用到下列仪器中的
a.酒精灯 b.漏斗 c.坩埚 d.泥三角
(2)步骤④中反应的离子方程式为
(3)请设计一种检验水溶液中是否含有碘单质的方法:
Ⅱ.镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。主要步骤如下:

(4)为了使
 转化为
转化为 ,试剂①可以选用
,试剂①可以选用(5)
 的电子式为
的电子式为 在熔融状态下,通电后会产生Mg和
在熔融状态下,通电后会产生Mg和 ,该反应的化学方程式为
,该反应的化学方程式为Ⅲ.海水提溴:主要工业生产流程如下图所示。

(6)海水中的
 被
被 氧化的离子方程式是
氧化的离子方程式是(7)吸收塔中
 将
将 转化为HBr的化学方程式是
转化为HBr的化学方程式是(8)工业上也可用
 溶液吸收吹出的
溶液吸收吹出的 。补全以下化学方程式:
。补全以下化学方程式:_______
 _______
_______ _______NaBr+_______
_______NaBr+_______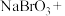 _______
_______
您最近一年使用:0次
名校
10 . CO2加氢转化为燃料是实现CO2减排的一个重要策略,我国科学家在调控CO2加氢反应的选择性方面取得新进展,其过程的示意图如下。下列分析正确的是
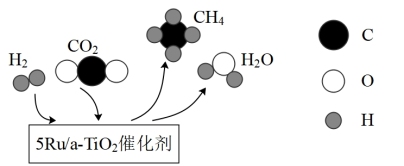

| A.该过程中,H2分子中极性键发生断裂 |
B.CO2的电子式为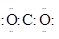 |
| C.该反应中CO2作还原剂 |
D.该反应的化学方程式为 |
您最近一年使用:0次
2022-03-18更新
|
303次组卷
|
7卷引用:湖北省孝感市重点高中教科研协作体2023-2024学年高二上学期开学考试化学试题



