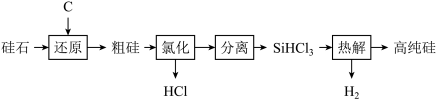
1 . 太阳能光伏产业蓬勃发展,推动了高纯硅的生产和应用。工业上以硅石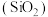 为原料制备高纯硅的工业流程如图所示。
为原料制备高纯硅的工业流程如图所示。
已知: 是常温下易挥发、遇水迅速生成其他物质的无色液体。
是常温下易挥发、遇水迅速生成其他物质的无色液体。
(1)Si在元素周期表中的位置是_______ 。
(2)“还原”需在高温条件下进行,该反应的化学方程式是_______ 。
(3)“氯化”时的还原产物是_______ (填化学式)。
(4)“氯化”、“分离”和“热解”的过程必须在无水、无氧条件下进行,理由是_______ 。
(5)该流程中能循环利用的物质是_______ (填两种)。
(6)高纯硅中常含有微量杂质,比如铁,对其进行测定的方法如下。
准确称取0.300g高纯硅样品用氢氟酸和稀硝酸溶解处理,配成100mL溶液,用羟胺 ,难电离)将
,难电离)将 还原为
还原为 后,加入邻菲啰啉形成橘红色络合物,再利用吸光度法测得吸光度为0.5(吸光度与
后,加入邻菲啰啉形成橘红色络合物,再利用吸光度法测得吸光度为0.5(吸光度与 浓度的对应关系如图)。
浓度的对应关系如图)。

①氢氟酸不能用玻璃试剂瓶保存的原因是_______ 。
②酸性条件下,羟胺与 反应生成无污染气体的反应的离子方程式为
反应生成无污染气体的反应的离子方程式为_______ 。
③高纯硅样品中铁的质量为_______ 。
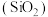 为原料制备高纯硅的工业流程如图所示。
为原料制备高纯硅的工业流程如图所示。
已知:
 是常温下易挥发、遇水迅速生成其他物质的无色液体。
是常温下易挥发、遇水迅速生成其他物质的无色液体。(1)Si在元素周期表中的位置是
(2)“还原”需在高温条件下进行,该反应的化学方程式是
(3)“氯化”时的还原产物是
(4)“氯化”、“分离”和“热解”的过程必须在无水、无氧条件下进行,理由是
(5)该流程中能循环利用的物质是
(6)高纯硅中常含有微量杂质,比如铁,对其进行测定的方法如下。
准确称取0.300g高纯硅样品用氢氟酸和稀硝酸溶解处理,配成100mL溶液,用羟胺
 ,难电离)将
,难电离)将 还原为
还原为 后,加入邻菲啰啉形成橘红色络合物,再利用吸光度法测得吸光度为0.5(吸光度与
后,加入邻菲啰啉形成橘红色络合物,再利用吸光度法测得吸光度为0.5(吸光度与 浓度的对应关系如图)。
浓度的对应关系如图)。
①氢氟酸不能用玻璃试剂瓶保存的原因是
②酸性条件下,羟胺与
 反应生成无污染气体的反应的离子方程式为
反应生成无污染气体的反应的离子方程式为③高纯硅样品中铁的质量为
您最近一年使用:0次
名校
2 . 蛇纹石是一类含水富镁硅酸盐矿物,主要成分为MgO和SiO2,含少量Fe、Ni的氧化物。可用于生产重要无机化工产品碱式碳酸镁[Mg2(OH)2CO3]。其制备流程如图所示:
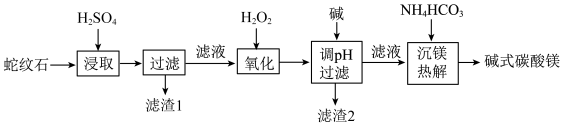
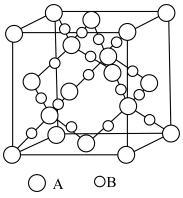
(1)滤渣1的主要成分从性质上来分,属于_______ 氧化物(填“酸性”“两性”或“碱性”),其用途很广泛,请写出一种:_______ 。如图表示该物质晶体的晶胞结构,1个该晶胞中含有_______ 个A-B键。
(2)滤渣2的主要成分是Fe(OH)3和Ni(OH)2,“氧化”过程中发现所用H2O2远高于理论用量,造成这一结果的主要原因有:①“氧化”过程中放热,温度升高加快了H2O2的分解速率、②_______ 。以下_______ (填序号)可以检验“氧化”过程已完全。
A.KSCN溶液 B.酸性KMnO4溶液 C.K3[Fe(CN)6]溶液 D.NaOH溶液
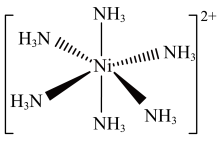
(3)Ni2+易形成[Ni(NH3)6]2+配合物,若[Ni(NH3)6]2+为正八面体构型(如图所示),则[Ni(CO)2(NH3)4]2+的结构有_______ 种。
(4)“沉镁热解”由连续的两步完成,第一步:沉镁生成正碳酸镁(MgCO3·3H2O),第二步:将正碳酸镁热解生成碱式碳酸镁。写出第一步的化学方程式:_______ 。
(5)用x吨含3MgO·2SiO2·2H2O(摩尔质量为a g/mol)为80%蛇纹石为原料,按以上流程制取[Mg2(OH)2CO3](摩尔质量为bg/mol),制得产品y吨,制取过程中镁元素的损失率为_______ ×100%(用含x、y、a、b的式子表示)。

(1)滤渣1的主要成分从性质上来分,属于

(2)滤渣2的主要成分是Fe(OH)3和Ni(OH)2,“氧化”过程中发现所用H2O2远高于理论用量,造成这一结果的主要原因有:①“氧化”过程中放热,温度升高加快了H2O2的分解速率、②
A.KSCN溶液 B.酸性KMnO4溶液 C.K3[Fe(CN)6]溶液 D.NaOH溶液
(3)Ni2+易形成[Ni(NH3)6]2+配合物,若[Ni(NH3)6]2+为正八面体构型(如图所示),则[Ni(CO)2(NH3)4]2+的结构有

(4)“沉镁热解”由连续的两步完成,第一步:沉镁生成正碳酸镁(MgCO3·3H2O),第二步:将正碳酸镁热解生成碱式碳酸镁。写出第一步的化学方程式:
(5)用x吨含3MgO·2SiO2·2H2O(摩尔质量为a g/mol)为80%蛇纹石为原料,按以上流程制取[Mg2(OH)2CO3](摩尔质量为bg/mol),制得产品y吨,制取过程中镁元素的损失率为
您最近一年使用:0次
2024-02-11更新
|
225次组卷
|
2卷引用:云南师范大学附属中学2023-2024学年高三上学期高考适应性月考卷(六)理科综合试卷
名校
解题方法
3 . 阅读下面一段材料并回答问题。
(1) 中铁元素的化合价为
中铁元素的化合价为_______ 。
(2)制备 需要在
需要在_______ (填“酸性”、“碱性”或“中性”)环境中进行。
(3)下列关于 的说法中,不正确的是
的说法中,不正确的是_______ 。
a.是强氧化性的盐 b.固体保存需要防潮
c.其消毒和净化水的原理相同 d.其净水优点有:作用快、安全性好、无异味
(4)高铁酸钠 是一种新型的净水剂,可以通过下述反应制取:
是一种新型的净水剂,可以通过下述反应制取: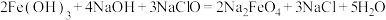 。
。
①该反应中氧化剂是_______ (用化学式表示,下同),氧化产物为_______ 。
②用单线桥法标出电子转移的方向和数目:_______ 。
| 高铁酸钾使用说明书 【化学式】  【性状】暗紫色具有金属光泽的粉末,无臭无味 【产品特点】干燥品在室温下稳定,在强碱溶液中稳定,随着pH减小,稳定性下降,与水反应放出氧气,  通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。 通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。 与水反应还能产生具有强吸附性的 与水反应还能产生具有强吸附性的 胶体,可除去水中细微的悬浮物,有净水作用 胶体,可除去水中细微的悬浮物,有净水作用【用途】主要用于饮用水消毒净化、城市生活污水和工业污水处理 【用量】消毒净化1L水投放  ,即可达到卫生标准 ,即可达到卫生标准…… |
 中铁元素的化合价为
中铁元素的化合价为(2)制备
 需要在
需要在(3)下列关于
 的说法中,不正确的是
的说法中,不正确的是a.是强氧化性的盐 b.固体保存需要防潮
c.其消毒和净化水的原理相同 d.其净水优点有:作用快、安全性好、无异味
(4)高铁酸钠
 是一种新型的净水剂,可以通过下述反应制取:
是一种新型的净水剂,可以通过下述反应制取: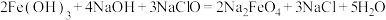 。
。①该反应中氧化剂是
②用单线桥法标出电子转移的方向和数目:
您最近一年使用:0次
4 . 亚硝酸钠(NaNO2)是一种用途广泛的工业盐,因其外观和相似容易误食中毒。亚硝酸钠加热到 320 ℃以上会分解产生 Na2O、N2和O2。其水溶液呈碱性,能与 AgNO3 液反应生成难溶于水、易溶于酸的 AgNO2。由于NaNO2有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。回答下列问题。
(1)从物质分类角度来看,NaNO2,属于___________ (填标号)。
a.酸性氧化物 b.钠盐 c.碱 d.电解质
(2)下列方法能用来区分固体 NaNO2 和 NaCl 的是___________(填标号)。
(3)处理含 NaNO2的废水方法之一如下,补充并配平该化学方程式(若系数为 1,请标注”1”) _________
______NaNO2 + ______KI+ ______=______NO↑+______I2+ ______K2SO4+ _____Na2SO4+______H2O
(4)已知 NO在常温下是无色、有毒的气体。用上述反应来处理 NaNO2 并不是最佳方法,其原因是___________ 。
(5)误食 NaNO2会导致人体血红蛋白中的 Fe2+转化为 Fe3+而中毒,该过程中 NaNO2 表现出的性质与下列___________(填标号)反应中 H2O2 表现出的性质相同。
(6)已知亚硝酸钠可以与氯化铵反应生成氮气和氯化钠,写出该反应的化学方程式,并用单线桥表示其电子转移的方向和数目:___________ 。
(1)从物质分类角度来看,NaNO2,属于
a.酸性氧化物 b.钠盐 c.碱 d.电解质
(2)下列方法能用来区分固体 NaNO2 和 NaCl 的是___________(填标号)。
| A.分别溶于水 |
| B.分别溶于水并滴加 AgNO3 溶液 |
| C.分别加强热并收集气体检验 |
| D.用筷子分别蘸取固体品尝味道 |
______NaNO2 + ______KI+ ______=______NO↑+______I2+ ______K2SO4+ _____Na2SO4+______H2O
(4)已知 NO在常温下是无色、有毒的气体。用上述反应来处理 NaNO2 并不是最佳方法,其原因是
(5)误食 NaNO2会导致人体血红蛋白中的 Fe2+转化为 Fe3+而中毒,该过程中 NaNO2 表现出的性质与下列___________(填标号)反应中 H2O2 表现出的性质相同。
A.2H2O2 2H2O+O2↑ 2H2O+O2↑ |
| B.H2O2+Cl2=2HCl+O2↑ |
| C.H2O2+H2SO4+2KI=2H2O+I2+K2SO4 |
| D.5H2O2+2KMnO4+6HCl=2MnCl2+2KCl+5O2 ↑+8H2O |
您最近一年使用:0次
2023-11-01更新
|
20次组卷
|
2卷引用:云南会泽县实验高级中学校2023-2024学年高一上学期10月月考化学试题
解题方法
5 . 硫酸羟胺[(NH3OH)2SO4]为无色晶体,易溶于水,是一种重要的化工原料,在农药、医药行业中有广泛用途。合成硫酸羟胺的流程如下:

模拟上述流程的实验装置如下(夹持装置与加热装置省略):

已知:羟胺(NH2OH)为白色片状晶体,易溶于水、甲醇等,受热易分解。
回答下列问题:
(1)三颈烧瓶中的试剂是___________ ,装置C中反应的化学方程式为___________ 。
(2)开始实验时,应最先打开___________ (填“K1”“K2”或“K3”)。
(3)流程中步骤I的化学方程式是___________ 。
(4)为分离(NH3OH)2SO4和(NH4)2SO4,向二者混合溶液中加入氨水,生成NH2OH·H2O,说明碱性较强的是___________ (填“NH2OH·H2O”或“NH3·H2O”);再加入甲醇,析出___________ (填化学式)晶体,过滤,滤液经___________ (填“常压”或“减压”)蒸馏后,加入硫酸,得到硫酸羟胺产品。
(5)测定硫酸羟胺的含量:称取一定量样品,溶于水中,移入250mL的三颈烧瓶中,加入足量硫酸铁溶液,充分反应后,煮沸10min,N2O气体全部逸出。将所得溶液冷却后,用cmol·L-1酸性高锰酸钾溶液滴定。则硫酸羟胺物质的量(n)与消耗高锰酸钾溶液的体积(VmL)的关系是n=___________ mol。

模拟上述流程的实验装置如下(夹持装置与加热装置省略):

已知:羟胺(NH2OH)为白色片状晶体,易溶于水、甲醇等,受热易分解。
回答下列问题:
(1)三颈烧瓶中的试剂是
(2)开始实验时,应最先打开
(3)流程中步骤I的化学方程式是
(4)为分离(NH3OH)2SO4和(NH4)2SO4,向二者混合溶液中加入氨水,生成NH2OH·H2O,说明碱性较强的是
(5)测定硫酸羟胺的含量:称取一定量样品,溶于水中,移入250mL的三颈烧瓶中,加入足量硫酸铁溶液,充分反应后,煮沸10min,N2O气体全部逸出。将所得溶液冷却后,用cmol·L-1酸性高锰酸钾溶液滴定。则硫酸羟胺物质的量(n)与消耗高锰酸钾溶液的体积(VmL)的关系是n=
您最近一年使用:0次
6 . 氧化还原反应在工农业生产、日常生活中具有广泛用途。
(1)吸入人体内的氧有2%转化为氧化性极强的“活性氧”,它能加速人体衰老,被称为“生命杀手”,服用含硒元素(Se)的化合物亚硒酸钠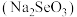 ,能消除人体内的活性氧,由此推断
,能消除人体内的活性氧,由此推断 的作用是作
的作用是作___________ (填“氧化剂”或“还原剂”)
(2) 可作为矿业废液消毒剂,有“绿色氧化剂”的美称。
可作为矿业废液消毒剂,有“绿色氧化剂”的美称。
①消除废液中的氰化物(如KCN),可经以下反应实现:KCN+H2O2+H2O═X+NH3↑,则生成物X的化学式为___________ ,H2O2被称为“绿色氧化剂”的理由是___________
②从H2O2氧元素的化合价可推测,H2O2既具有氧化性,又具有还原性。某实验小组同学设计实验探究H2O2在某强酸性反应体系中的性质。
实验I:探究H2O2的氧化性。
向含5%H2O2的酸性溶液中滴加淀粉-KI溶液,溶液变蓝。写出该反应的离子方程式___________ 。
实验Ⅱ:探究H2O2的还原性。
向含5%H2O2的溶液中滴加酸性KMnO4溶液。已知反应物和生成物共有六种粒子:
O2、 、H2O、Mn2+、H2O2、H+。
、H2O、Mn2+、H2O2、H+。
若该反应中H2O2只发生了如下过程:H2O2 O2,则该反应的离子方程式为
O2,则该反应的离子方程式为___________ 。
(3)亚硝酸钠(NaNO2)是一种工业盐,某化学兴趣小组设计实验探究NaNO2的性质,实验操作及现象如下表(已知 遇淀粉变蓝)。
遇淀粉变蓝)。
通过上述实验可知,NaNO2、KMnO4、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为___________ 。
(1)吸入人体内的氧有2%转化为氧化性极强的“活性氧”,它能加速人体衰老,被称为“生命杀手”,服用含硒元素(Se)的化合物亚硒酸钠
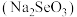 ,能消除人体内的活性氧,由此推断
,能消除人体内的活性氧,由此推断 的作用是作
的作用是作(2)
 可作为矿业废液消毒剂,有“绿色氧化剂”的美称。
可作为矿业废液消毒剂,有“绿色氧化剂”的美称。①消除废液中的氰化物(如KCN),可经以下反应实现:KCN+H2O2+H2O═X+NH3↑,则生成物X的化学式为
②从H2O2氧元素的化合价可推测,H2O2既具有氧化性,又具有还原性。某实验小组同学设计实验探究H2O2在某强酸性反应体系中的性质。
实验I:探究H2O2的氧化性。
向含5%H2O2的酸性溶液中滴加淀粉-KI溶液,溶液变蓝。写出该反应的离子方程式
实验Ⅱ:探究H2O2的还原性。
向含5%H2O2的溶液中滴加酸性KMnO4溶液。已知反应物和生成物共有六种粒子:
O2、
 、H2O、Mn2+、H2O2、H+。
、H2O、Mn2+、H2O2、H+。若该反应中H2O2只发生了如下过程:H2O2
 O2,则该反应的离子方程式为
O2,则该反应的离子方程式为(3)亚硝酸钠(NaNO2)是一种工业盐,某化学兴趣小组设计实验探究NaNO2的性质,实验操作及现象如下表(已知
 遇淀粉变蓝)。
遇淀粉变蓝)。| 实验 | 实验操作及现象或结果 |
| ① | 取5mLNaNO2溶液于试管中,加入少量KI溶液,充分反应后,再滴加淀粉溶液,溶液变蓝 |
| ② | 取2mLKMnO4溶液(先酸化好)于试管中,滴加足量的NaNO2溶液,可观察到的实验现象为溶液紫红色褪去。 |
| ③ | NaNO2固体与70%硫酸反应生成了NO和NO2两种气体 |
 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为
您最近一年使用:0次
2023-11-06更新
|
143次组卷
|
2卷引用:云南省昆明市第三中学2023-2024学年高一上学期11月期中联考化学试题
名校
7 . 工业上硝酸的制备和自然界中硝酸的生成既有相同之处,又有区别。图中路线a、b、c是工业制备硝酸的主要途径,路线Ⅰ、Ⅱ、Ⅲ是雷电固氮过程中生成硝酸的途径。
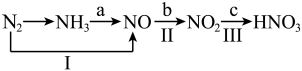
(1)N2在常温下性质很稳定,任意写出一种与此性质有关的用途:_____ 。
(2)实验室制取NH3的化学方程式为_____ 。
(3)NH3的电子式为_____ 。
(4)下列环境问题与氮的氧化物排放无关的是_____ 。
A.酸雨 B.光化学烟雾 C.臭氧层空洞 D.白色污染
(5)Ertl(获2007年诺贝尔化学奖)对合成氨机理进行深入研究,并将研究成果用于汽车尾气处理中,在催化剂存在下可将NO和CO反应转化为两种无色无毒气体,用化学反应方程式表示这个过程_____ ;氧化产物与还原产物的物质的量之比为_____ 。
(6)64.0gCu与适量的浓HNO3反应,铜全部溶解后,共收集到1molNO2和NO的混合气体,反应中消耗HNO3的物质的量是_____ 。

(1)N2在常温下性质很稳定,任意写出一种与此性质有关的用途:
(2)实验室制取NH3的化学方程式为
(3)NH3的电子式为
(4)下列环境问题与氮的氧化物排放无关的是
A.酸雨 B.光化学烟雾 C.臭氧层空洞 D.白色污染
(5)Ertl(获2007年诺贝尔化学奖)对合成氨机理进行深入研究,并将研究成果用于汽车尾气处理中,在催化剂存在下可将NO和CO反应转化为两种无色无毒气体,用化学反应方程式表示这个过程
(6)64.0gCu与适量的浓HNO3反应,铜全部溶解后,共收集到1molNO2和NO的混合气体,反应中消耗HNO3的物质的量是
您最近一年使用:0次
2021-04-29更新
|
211次组卷
|
2卷引用:云南省楚雄第一中学2022-2023学年高一下学期期末考试化学试题
名校
解题方法
8 . 硫酸肼(N2H4·H2SO4)又名硫酸联氨,在医药、染料、农业上用途广泛。回答下列问题:
已知:①Cl2与NaOH反应为放热反应,Cl2与热的NaOH溶液会生成NaClO3;
②利用尿素法生产水合肼的原理为CO(NH2)2+2NaOH+NaClO=N2H4·H2O+Na2CO3+NaCl;
③硫酸肼的制备原理为N2H4·H2O+H2SO4=N2H4·H2SO4+H2O。
I.制备NaClO溶液。实验制备装置如图1所示:

(1)图1装置试管内发生主要反应的化学方程式为_______ 。
II.尿素法生产水合肼的装置如图2所示:

(2)把I制得的NaClO溶液注入到图2装置的分液漏斗中,三颈烧瓶内装入一定量的尿素和NaOH溶液(物质的量之比1∶2.30),仪器a的名称为_______ ,采用低温(低于20℃)反应,降温的方式可采用_______ ,温度高时水合肼会被氧化成无色无味的气体,该气体在标准状况下的密度为1.25g·L−1,其反应化学方程式为_______ 。反应结束后,急速升温至108℃开始回流5min,收集108~114℃馏分。
(3)测定馏分中水合肼的含量。称取馏分6.0g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右),加水配成250mL溶液,移取25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.30mol·L−1的碘标准溶液滴定(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)。
①判断滴定终点的方法是_______ 。
②实验测得消耗碘标准溶液的平均值为20.00mL,馏分中水合肼(N2H4·H2O)的质量分数为_______ 。
III.硫酸肼的制备
(4)将水合肼转移到烧杯中,滴加一定质量98%的浓硫酸,滴加时间控制在1h左右,温度60℃以下。冷藏沉降2h,得硫酸肼沉淀。抽滤,用无水乙醇洗涤,干燥,得白色硫酸肼固体。用无水乙醇而不用水洗涤的原因是_______ 。
已知:①Cl2与NaOH反应为放热反应,Cl2与热的NaOH溶液会生成NaClO3;
②利用尿素法生产水合肼的原理为CO(NH2)2+2NaOH+NaClO=N2H4·H2O+Na2CO3+NaCl;
③硫酸肼的制备原理为N2H4·H2O+H2SO4=N2H4·H2SO4+H2O。
I.制备NaClO溶液。实验制备装置如图1所示:

(1)图1装置试管内发生主要反应的化学方程式为
II.尿素法生产水合肼的装置如图2所示:

(2)把I制得的NaClO溶液注入到图2装置的分液漏斗中,三颈烧瓶内装入一定量的尿素和NaOH溶液(物质的量之比1∶2.30),仪器a的名称为
(3)测定馏分中水合肼的含量。称取馏分6.0g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右),加水配成250mL溶液,移取25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.30mol·L−1的碘标准溶液滴定(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)。
①判断滴定终点的方法是
②实验测得消耗碘标准溶液的平均值为20.00mL,馏分中水合肼(N2H4·H2O)的质量分数为
III.硫酸肼的制备
(4)将水合肼转移到烧杯中,滴加一定质量98%的浓硫酸,滴加时间控制在1h左右,温度60℃以下。冷藏沉降2h,得硫酸肼沉淀。抽滤,用无水乙醇洗涤,干燥,得白色硫酸肼固体。用无水乙醇而不用水洗涤的原因是
您最近一年使用:0次
2021-05-14更新
|
157次组卷
|
4卷引用:云南省腾冲市第八中学2023--2024学年上学期高二第3次月考化学试卷
云南省腾冲市第八中学2023--2024学年上学期高二第3次月考化学试卷(已下线)化学-学科网2021年高三5月大联考(新课标Ⅲ卷)新疆和田地区第二中学2022-2023学年高二上学期11月期中考试化学试题湖南省宁乡市第一高级中学2021届高三第二次模拟考试化学试卷
名校
解题方法
9 . 氧化还原反应是一类重要的化学反应,在工农业生产、日常生活中都有广泛的用途。请回答下列问题。
Ⅰ.氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式: 。KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
。KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)物质(甲)为________ (填化学式)。
(2)反应中若产生5个NO分子,则转移电子的数目是________ 。
Ⅱ.亚硝酸钠(NaNO2)像食盐一样有咸味但有很强的毒性,误食NaNO2会使人中毒。已知亚硝酸钠能发生如下反应: 。
。
(1)用双线桥法标出该反应中电子转移的方向及数目:________ ,被氧化的原子与被还原的原子数目之比为__________ 。
(2)自来水中的 对人类健康会产生危害碱性条件下Al粉还原
对人类健康会产生危害碱性条件下Al粉还原 ,产物是N2,发生的反应可表示如下,完成方程式并配平。
,产物是N2,发生的反应可表示如下,完成方程式并配平。
_______ 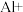
_______ 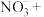
_______ =_______ 
_______ 
_______
Ⅰ.氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
 。KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
。KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。(1)物质(甲)为
(2)反应中若产生5个NO分子,则转移电子的数目是
Ⅱ.亚硝酸钠(NaNO2)像食盐一样有咸味但有很强的毒性,误食NaNO2会使人中毒。已知亚硝酸钠能发生如下反应:
 。
。(1)用双线桥法标出该反应中电子转移的方向及数目:
(2)自来水中的
 对人类健康会产生危害碱性条件下Al粉还原
对人类健康会产生危害碱性条件下Al粉还原 ,产物是N2,发生的反应可表示如下,完成方程式并配平。
,产物是N2,发生的反应可表示如下,完成方程式并配平。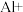
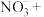


您最近一年使用:0次
2020-09-04更新
|
636次组卷
|
5卷引用:云南省龙陵县第一中学2022-2023学年高一下学期期末考试化学试题
云南省龙陵县第一中学2022-2023学年高一下学期期末考试化学试题云南省澄江市第一中学2022-2023学年高一上学期期中考试化学试题人教版(2019)高一必修第一册第一章 物质及其变化 素养拓展区高一必修第一册(苏教2019版)专题3 B 素养拓展区 过综合 专题素养综合检测(已下线)【浙江新东方】【2021.4.27】【宁波】【高一上】【高中化学】【00140】



