名校
1 . 某家用防疫用品“84消毒液”的包装说明如下,请回答下列问题:
(1)欲将“84消毒液”原液稀释配制成480mL 的溶液:
的溶液:
①稀释过程中,需要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒、___________ 。
②稀释时,需要取用___________ mL“84消毒液”原液。
③下列操作会使溶液中NaClO浓度偏高的是___________ 。
A.取用的“84消毒液”原液是久置的 B.定容操作时,俯视刻度线
C.量取“84消毒液”原液时,仰视读数 D.定容摇匀后,液面低于刻度线,再加水至刻度线
(2)利用如图装置探究84消毒液与洁厕灵(主要成分为盐酸)的反应,当注射器中的洁厕灵注入试管中时,装置内产生黄绿色气体,可观察到pH试纸的现象是___________ ,棉花团(蘸有溶液A)的其作用是___________ 。

(3)某同学设计实验探究84消毒液的漂白性。
Ⅰ、在2mL84消毒液中加入2mL水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ、在2mL84消毒液中加入2mL白醋后,放入红色纸片,观察到纸片迅速褪色
Ⅲ、在不同温度时,测得84消毒液ORP值随时间的变化曲线如图所示。
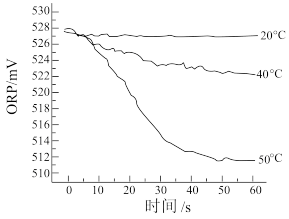
已知:ORP表示水溶液中物质的氧化性或还原性强弱。ORP值越大,氧化性越强。
①实验Ⅰ、Ⅱ现象不同的原因是为___________ 。
②实验Ⅲ中,随时间的变化ORP值不同的原因可能是___________ 。
| 【产品名称】84消毒液 【有效成分】NaClO 【规格】1000mL 【物质的量浓度】4.0  注:①按一定比例稀释后使用②不得与酸性产品(如洁厕灵)同时使用。 |
 的溶液:
的溶液:①稀释过程中,需要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒、
②稀释时,需要取用
③下列操作会使溶液中NaClO浓度偏高的是
A.取用的“84消毒液”原液是久置的 B.定容操作时,俯视刻度线
C.量取“84消毒液”原液时,仰视读数 D.定容摇匀后,液面低于刻度线,再加水至刻度线
(2)利用如图装置探究84消毒液与洁厕灵(主要成分为盐酸)的反应,当注射器中的洁厕灵注入试管中时,装置内产生黄绿色气体,可观察到pH试纸的现象是

(3)某同学设计实验探究84消毒液的漂白性。
Ⅰ、在2mL84消毒液中加入2mL水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ、在2mL84消毒液中加入2mL白醋后,放入红色纸片,观察到纸片迅速褪色
Ⅲ、在不同温度时,测得84消毒液ORP值随时间的变化曲线如图所示。

已知:ORP表示水溶液中物质的氧化性或还原性强弱。ORP值越大,氧化性越强。
①实验Ⅰ、Ⅱ现象不同的原因是为
②实验Ⅲ中,随时间的变化ORP值不同的原因可能是
您最近一年使用:0次
名校
2 . 实验是研究化学的基础。化学实验的基本操作、气体的制备、离子的检验、物质性质的探究等内容是化学实验中的重要内容。请回答下列问题:
(1)下列实验操作的装置正确的是____ (填标号)。指出不正确装置中的一处错误____ 。

A B C D
(2)实验室常用浓盐酸制取Cl2,制取时,需要加入具有___________ 性的物质(填:氧化性、还原性、酸性、碱性)。若制取氯气反应为6HCl(浓)+KClO3=3Cl2↑+KCl+3H2O,该反应中的还原产物为____ ;还原产物与氧化产物的物质的量之比为_____ 。
(3)氯气溶于水可制得氯水,氯水的成分比较复杂。
①取新制的氯水加入硝酸酸化的AgNO3溶液出现白色沉淀,证明有Cl-存在,反应的离子方程式为________ 。
②取新制的氯水加入试剂______ ,现象为___________ ,证明溶液中含有H+;
③取新制的氯水,加入几滴紫色的石蕊试液,溶液先变红后褪色,原因是______ 。
(1)下列实验操作的装置正确的是

A B C D
(2)实验室常用浓盐酸制取Cl2,制取时,需要加入具有
(3)氯气溶于水可制得氯水,氯水的成分比较复杂。
①取新制的氯水加入硝酸酸化的AgNO3溶液出现白色沉淀,证明有Cl-存在,反应的离子方程式为
②取新制的氯水加入试剂
③取新制的氯水,加入几滴紫色的石蕊试液,溶液先变红后褪色,原因是
您最近一年使用:0次
2017-11-29更新
|
147次组卷
|
2卷引用:山东省枣庄市薛城区2017-2018学年高一上学期期中考试化学试题
3 . 某研究小组在实验室制备Cl2并进行Cl2、Br2、I2性质的探究。
Ⅰ.制备Cl2并进行性质实验
(1)实验室用MnO2与浓盐酸反应制取Cl2,反应的离子方程式为______ 。
(2)用胶头滴管将新制的饱和氯水慢慢滴入含有酚酞的NaOH稀溶液中,当滴到一定量时,红色突然褪去。
①产生上述现象的原因可能有两种:a、可能是氯水中的酸和氢氧化钠发生中和反应,将氢氧化钠消耗完所致;b、______ 。
②设计实验证明红色褪去的原因是a或b:______ 。
Ⅱ.为探究Cl2、Br2、I2的氧化性强弱,设计实验如下:
【查阅资料】①Cl、Br、I原子最外层电子数都是7个,单质Cl2、Br2、I2的化学性质相似。②稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。③淀粉溶液遇I2变蓝色。
氧化性强弱探究:
【分析与解释】
(3)实验1中a试管中反应的离子方程式是______ 。
(4)①甲同学认为:实验2观察到______ 现象,得出氧化性Br2>I2;
②乙同学对上述实验进行反思,认为实验2不能充分证明氧化性Br2>I2,他补做了实验3.
补做实验3的目的是______ 。
Ⅰ.制备Cl2并进行性质实验
(1)实验室用MnO2与浓盐酸反应制取Cl2,反应的离子方程式为
(2)用胶头滴管将新制的饱和氯水慢慢滴入含有酚酞的NaOH稀溶液中,当滴到一定量时,红色突然褪去。
①产生上述现象的原因可能有两种:a、可能是氯水中的酸和氢氧化钠发生中和反应,将氢氧化钠消耗完所致;b、
②设计实验证明红色褪去的原因是a或b:
Ⅱ.为探究Cl2、Br2、I2的氧化性强弱,设计实验如下:
【查阅资料】①Cl、Br、I原子最外层电子数都是7个,单质Cl2、Br2、I2的化学性质相似。②稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。③淀粉溶液遇I2变蓝色。
氧化性强弱探究:
| 实验1 |  |
| 实验2 | 取a中的黄色溶液少许,加入KI溶液,再加入淀粉溶液 |
(3)实验1中a试管中反应的离子方程式是
(4)①甲同学认为:实验2观察到
②乙同学对上述实验进行反思,认为实验2不能充分证明氧化性Br2>I2,他补做了实验3.
| 实验3 | 另取a中的黄色溶液少许,先加入足量的NaBr固体,充分振荡,然后加入KI溶液和淀粉溶液 |
您最近一年使用:0次
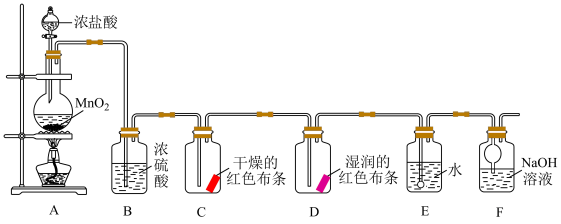
4 . 化学小组同学设计如下实验验证氯气的部分性质,并探究氯水的成分和性质。

回答下列问题:
(1)装置A中发生反应的化学方程式为_______ 。
(2)验证干燥的氯气没有漂白性的现象为_______ 。
(3)装置F的作用是_______ 。
(4)研究新制氯水的成分和性质。
以装置E的溶液进行下列实验:
资料:淀粉的特征反应——遇 变蓝色;
变蓝色; 。
。
①根据实验1可知,氧化性:
_______ (填“>”或“<”) 。
。
②实验2中证明溶液中含有_______ (填含氯微粒的分子式)。
③若用实验3证明氯水中含有氯离子,则实验操作为_______ 。
(5)同学们发现久置的氯水会失去漂白性。为探究氯水失效的原因进行实验:用强光照射盛有氯水的密闭细口瓶,并用传感器测定数据,得到如图曲线。两图中曲线变化的原因是_______ (用化学方程式表示);保存氯水的方法为_______ 。


回答下列问题:
(1)装置A中发生反应的化学方程式为
(2)验证干燥的氯气没有漂白性的现象为
(3)装置F的作用是
(4)研究新制氯水的成分和性质。
以装置E的溶液进行下列实验:
| 实验序号 | 实验1 | 实验2 | 实验3 |
| 实验操作 |  |  | |
| 实验现象 | 溶液变蓝 | 石蕊溶液先变红,后褪色 | 有白色沉淀生成 |
 变蓝色;
变蓝色; 。
。①根据实验1可知,氧化性:

 。
。②实验2中证明溶液中含有
③若用实验3证明氯水中含有氯离子,则实验操作为
(5)同学们发现久置的氯水会失去漂白性。为探究氯水失效的原因进行实验:用强光照射盛有氯水的密闭细口瓶,并用传感器测定数据,得到如图曲线。两图中曲线变化的原因是

您最近一年使用:0次
2022-11-15更新
|
99次组卷
|
2卷引用:甘肃省武威市民勤县第一中学2022-2023学年高一上学期期中考试化学试卷
5 . 化学小组同学设计如下实验验证氯气的部分性质,并探究氯水的成分和性质。
回答下列问题:
(1)装置A中发生反应的化学方程式为___________ 。
(2)验证干燥的氯气没有漂白性的现象为___________ 。
(3)装置F的作用是___________ 。
(4)研究新制氯水成分和性质。
以装置E的溶液进行下列实验
资料:淀粉的特征反应一一遇 变蓝色;
变蓝色; 。
。
①根据实验1可知,氧化性:
___________ (填“>”或“<”) 。
。
②实验2中证明溶液中含有___________ (填微粒的化学式)。
③若用实验3证明氯水中含有氯离子,则实验操作为___________ 。

回答下列问题:
(1)装置A中发生反应的化学方程式为
(2)验证干燥的氯气没有漂白性的现象为
(3)装置F的作用是
(4)研究新制氯水成分和性质。
以装置E的溶液进行下列实验
| 实验序号 | 实验1 | 实验2 | 实验3 |
| 实验现象 |  |  | |
| 实验现象 | 溶液变蓝 | 石蕊溶液先变红,后褪色 | 有白色沉淀生成 |
 变蓝色;
变蓝色; 。
。①根据实验1可知,氧化性:

 。
。②实验2中证明溶液中含有
③若用实验3证明氯水中含有氯离子,则实验操作为
您最近一年使用:0次
名校
解题方法
6 . 化学小组同学设计如下实验验证氯气的部分性质,并探究氯水的成分和性质

回答下列问题:
(1)装置A中发生反应的化学方程式为_________ 。
(2)验证干燥的氯气没有漂白性的现象为_________ 。
(3)装置F的作用是_________ 。
(4)研究新制氯水成分和性质。以装置E的溶液进行下列实验
资料:淀粉的特征反应——遇I2变蓝色; 。
。
①根据实验1可知,氧化性:
_________ (填“>”或“<”) 。
。
②实验2中证明溶液中含有_________ (填微粒的化学式)。
③若用实验3证明氯水中含有氯离子,用离子方程式表示产生该实验现象的反应:_________ 。
(5)同学们发现久置的氯水会失去漂白性。为探究氯水失效的原因进行实验:用强光照射盛有氯水的密闭广口瓶,并用传感器测定数据,得到如图曲线。两图中曲线变化的原因是_________ (用化学方程式表示);保存氯水的方法为_________ 。


回答下列问题:
(1)装置A中发生反应的化学方程式为
(2)验证干燥的氯气没有漂白性的现象为
(3)装置F的作用是
(4)研究新制氯水成分和性质。以装置E的溶液进行下列实验
| 实验序号 | 实验1 | 实验2 | 实验3 |
| 实验操作 |  |  | |
| 实验现象 | 溶液变蓝 | 石蕊溶液先变红,后褪色 | 有白色沉淀生成 |
 。
。①根据实验1可知,氧化性:

 。
。②实验2中证明溶液中含有
③若用实验3证明氯水中含有氯离子,用离子方程式表示产生该实验现象的反应:
(5)同学们发现久置的氯水会失去漂白性。为探究氯水失效的原因进行实验:用强光照射盛有氯水的密闭广口瓶,并用传感器测定数据,得到如图曲线。两图中曲线变化的原因是

您最近一年使用:0次
解题方法
7 . 某化学兴趣小组同学利用以下装置制取纯净、干燥的 并探究
并探究 及其化合物的漂白作用(Ⅳ中夹持装置已略去,a为干燥的红色纸条,b为湿润的红色纸条)。
及其化合物的漂白作用(Ⅳ中夹持装置已略去,a为干燥的红色纸条,b为湿润的红色纸条)。
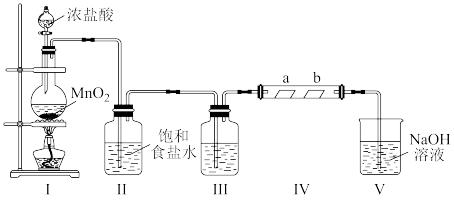
(1)装置Ⅰ可用于制取 ,写出该反应的化学方程式
,写出该反应的化学方程式_______ 。
(2)装置Ⅱ的作用是_______ ;装置Ⅲ中的试剂名称为_______ 。
(3)装置Ⅳ中a处红色纸条_______ (填“无明显变化”或“褪色”,下同),b处红色纸条_______ 。
(4)装置Ⅴ中 溶液可吸收
溶液可吸收 并制得漂白液,写出该反应的离子方程式
并制得漂白液,写出该反应的离子方程式_______ 。
(5)为探究装置Ⅴ中所得的漂白液的漂白效果和氧化性,某化学小组设计如下实验。
查阅资料可知:
ⅰ. 溶液具有氧化性,能使紫色石蕊试液先变蓝后褪色;
溶液具有氧化性,能使紫色石蕊试液先变蓝后褪色;
ⅱ.溶液的 会影响
会影响 溶液的漂白效果。
溶液的漂白效果。
具体实验操作如下:
①漂白液的有效成分是 而不是
而不是 ,因为
,因为 不稳定,不易保存。写出
不稳定,不易保存。写出 见光分解的化学方程式
见光分解的化学方程式_______ 。
②实验Ⅲ中产生的气体是 ,发生反应的离子方程式为
,发生反应的离子方程式为_______ 。
③对比实验Ⅱ和Ⅲ,溶液的
_______ (填“升高”或“降低”)会提高 的氧化性。
的氧化性。
 并探究
并探究 及其化合物的漂白作用(Ⅳ中夹持装置已略去,a为干燥的红色纸条,b为湿润的红色纸条)。
及其化合物的漂白作用(Ⅳ中夹持装置已略去,a为干燥的红色纸条,b为湿润的红色纸条)。
(1)装置Ⅰ可用于制取
 ,写出该反应的化学方程式
,写出该反应的化学方程式(2)装置Ⅱ的作用是
(3)装置Ⅳ中a处红色纸条
(4)装置Ⅴ中
 溶液可吸收
溶液可吸收 并制得漂白液,写出该反应的离子方程式
并制得漂白液,写出该反应的离子方程式(5)为探究装置Ⅴ中所得的漂白液的漂白效果和氧化性,某化学小组设计如下实验。
查阅资料可知:
ⅰ.
 溶液具有氧化性,能使紫色石蕊试液先变蓝后褪色;
溶液具有氧化性,能使紫色石蕊试液先变蓝后褪色;ⅱ.溶液的
 会影响
会影响 溶液的漂白效果。
溶液的漂白效果。具体实验操作如下:
| 实验操作 |  漂白液+石蕊试液 |  漂白液+石蕊试液 |  漂白液+石蕊试液 |
| 实验现象 | 混合后溶液的 短时间内未褪色,一段时间后蓝色褪去 短时间内未褪色,一段时间后蓝色褪去 | 混合后溶液 ,蓝色迅速褪去,无气体产生 ,蓝色迅速褪去,无气体产生 | 混合后溶液 ,蓝色迅速褪去,并产生大量气体,使湿润的淀粉 ,蓝色迅速褪去,并产生大量气体,使湿润的淀粉 试纸变蓝 试纸变蓝 |
 而不是
而不是 ,因为
,因为 不稳定,不易保存。写出
不稳定,不易保存。写出 见光分解的化学方程式
见光分解的化学方程式②实验Ⅲ中产生的气体是
 ,发生反应的离子方程式为
,发生反应的离子方程式为③对比实验Ⅱ和Ⅲ,溶液的

 的氧化性。
的氧化性。
您最近一年使用:0次
2022-01-11更新
|
165次组卷
|
2卷引用:河北省邯郸市2021-2022学年高一上学期期末考试化学试题
8 . 新制氯水中含有多种粒子,某校化学研究性学习小组的同学为探究其性质,做了如下实验:
(1) 不稳定,见光易分解生成
不稳定,见光易分解生成 和
和 。请设计实验证明有
。请设计实验证明有 生成:
生成:_______________________ 。
(2)氯气能使湿润的红色布条褪色。对于使红色布条褪色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能。请你设计实验,得出正确结论。
(1)
 不稳定,见光易分解生成
不稳定,见光易分解生成 和
和 。请设计实验证明有
。请设计实验证明有 生成:
生成:(2)氯气能使湿润的红色布条褪色。对于使红色布条褪色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能。请你设计实验,得出正确结论。
| 提出问题 | 收集资料 | 提出假设 | 验证假设 | 得出结论 |
| 氯水中哪种物质能使湿润的红色布条褪色 | ①氯气有强氧化性; ②氯气与冷水反应生成盐酸和次氯酸; ③次氯酸有强氧化性 | ① ② ③ | 实验①:把红色干布条放入充满干燥氯气的集气瓶中,布条不褪色; 实验②: 实验③:把红色布条放入稀盐酸中,布条不褪色 |
您最近一年使用:0次
2020-09-01更新
|
198次组卷
|
2卷引用:苏教版(2020)高一必修第一册专题3第一单元课时2 氯气的性质及应用
解题方法
9 . 某校化学社团活动小组同学在学习完钠、氯及其化合物后设计了如下两组探究实验。请回答下列问题:
实验一:探究钠及其化合物的性质,实验装置如图所示(已知:试管A中装入足量的NaHCO3固体,D为固定蚊香的硬纸片)。

(l)Na2O2固体呈_____ 色,其物质类别是_____ 。
(2)试管A中发生反应的化学方程式为_____ 。
(3)C处观察到的实验现象是_____ , D处观察到的实验现象是_____ ,故推测Na2O2可用于_____
实验二:对新教材中Cl2的实验室制法进行改进,验证Cl2的部分性质并收集一瓶干燥的Cl2。
查阅资料:KMnO4和KC1O3的氧化性都比MnO2强,在不加热的条件下即可与浓盐酸发生反应,从而实现制取Cl2的目的。
(4)按气流方向,装置的连接顺序为_____ (填仪器大写字母,装置不可重复使用)。

(5)实验时,装置C中所盛装的试剂名称是_____ .
(6)D中放置的试剂是_____ (化学符号)溶液,发生的离子反应为_____ ,其作用是_____ 。
实验一:探究钠及其化合物的性质,实验装置如图所示(已知:试管A中装入足量的NaHCO3固体,D为固定蚊香的硬纸片)。

(l)Na2O2固体呈
(2)试管A中发生反应的化学方程式为
(3)C处观察到的实验现象是
实验二:对新教材中Cl2的实验室制法进行改进,验证Cl2的部分性质并收集一瓶干燥的Cl2。
查阅资料:KMnO4和KC1O3的氧化性都比MnO2强,在不加热的条件下即可与浓盐酸发生反应,从而实现制取Cl2的目的。
(4)按气流方向,装置的连接顺序为

(5)实验时,装置C中所盛装的试剂名称是
(6)D中放置的试剂是
您最近一年使用:0次
10 . 某小组设计实验探究氯气性质,装置如图(夹持装置已省略)。下列叙述错误的是
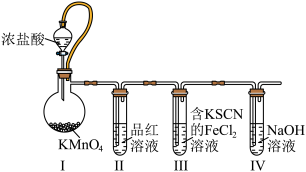

| A.I装置中浓盐酸只表现还原性,可以用Ca(ClO)2替代KMnO4 |
| B.若加热II装置中的无色溶液后,溶液仍为无色,则氯水具有永久漂白性 |
| C.若III装置中溶液变红色,则氯气表现氧化性 |
| D.IV装置用于吸收尾气中氯气 |
您最近一年使用:0次



