1 . 下列有关实验装置进行的相应实验,能达到实验目的的是
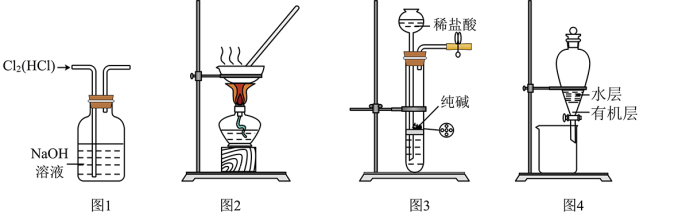

A.用图 所示装置除去 所示装置除去 中含有的少量 中含有的少量 |
B.用图 所示装置蒸干 所示装置蒸干 饱和溶液制备 饱和溶液制备 晶体 晶体 |
C.用图 所示装置制取少量纯净的 所示装置制取少量纯净的 气体 气体 |
D.用图 所示装置分离 所示装置分离 萃取碘水后已分层的有机层和水层 萃取碘水后已分层的有机层和水层 |
您最近一年使用:0次
2022-12-09更新
|
2046次组卷
|
50卷引用:山东省泰安市2017-2018学年高一上学期期末考试化学试题
山东省泰安市2017-2018学年高一上学期期末考试化学试题山东省泰安市宁阳一中2018-2019学年高一上学期阶段性考试二(12月)化学试题山东省泰安第一中学2019-2020学年高一下学期期中考试化学试题山东省泰安市宁阳一中2020-2021学年高一下学期第一次考试化学试题(已下线)2013届安徽省阜阳一中高三上学期第二次模化学试卷(已下线)2014届高考化学二轮复习 专题12化学实验基础练习卷(已下线)2014高考化学名师选择题专练 实验基础练习卷(已下线)2014年高中化学二轮创新训练上 专题12化学实验基础练习卷(已下线)2014年高考化学苏教版总复习 10-2 物质的检验、分离和提纯练习卷(已下线)2014届浙江省温州中学高三上学期期末理综化学试卷2012年普通高等学校招生全国统一考试化学(江苏卷)(已下线)2013-2014贵州省遵义四中高三第五次月考理综化学试卷(已下线)2013-2014浙江省宁波效实中学高二下学期期末考试化学试卷(已下线)2015届江西省信丰中学高三上学期第一次月考化学试卷2015届江苏省盐城市时杨中学高三第二次调研考试化学试卷2014-2015广西桂林市第十八中学高二下学期期中考试化学试卷2014-2015学年江西省南昌市二中高二下学期期末化学试卷2016届湖北省荆州中学高三上学期第一次质检化学试卷2015-2016学年山西阳泉十五中高三第一次阶段考试化学试卷2016届河南省宜阳县实验学校高三第二次月考化学试卷2016届浙江省杭州高级中学高三上学期月考(三)化学试卷2016届浙江临海台州中学高三上学期第三次统练化学试卷2016届福建省闽粤联合体高三上学期第三次联考化学试卷2016届浙江省临海市台州中学高三上学期第三次统考化学试卷2016届湖北省荆州市公安一中高三上学期12月月考化学试卷2015-2016学年湖南省怀化市高一上学期期末化学试卷2015-2016学年吉林松原油田高中高一下期初考试化学试卷2015-2016学年广西桂林十八中高一下开学测化学试卷2015-2016学年贵州省遵义航天中学高一下3月月考化学卷2015-2016学年吉林省松原市油田高中高二下期中化学试卷2016年山东省普通高中学业水平化学模拟试卷(4)2017届广西陆川中学高三上9月月考化学试卷2017届湖南省长沙市长郡中学高三上月考二化学试卷山西省忻州市第一中学2016-2017学年高一必修一:第1章从实验学化学同步练习化学试题河南省郑州市外国语学校2018届高三上学期第一次月考化学试题新疆石河子第二中学2018届高三上学期第一次月考化学试题广西桂林市2017-2018学年高二上学期期末考试化学试题湖北省襄阳市第四中学2017-2018学年高一3月月考化学试题江苏省泰州中学2017-2018学年高二下学期学业水平测试模拟(三)(必修)化学试题河北省邯郸市永年区第二中学2019届高三上学期9月月考化学试题(已下线)2018年11月7日——《每日一题》高考一轮复习 化学实验基本操作江苏省苏州市震泽中学2019-2020学年高一上学期第二次月考化学试题江苏省苏州市2019~2020学年第一学期期末高一学业质量阳光指标调研化学试题甘肃省张掖市高台县第一中学2018—2019学年高二下学期期中考试化学试题山东省潍坊市2019-2020学年高一下学期3月阶段监测化学试题(已下线)上海市奉贤区2013年高考二模化学试题陕西省延安市第一中学2019-2020学年高一下学期期中考试化学试题海南省海南枫叶国际学校2021-2022学年高三上学期第三次月考(1月)化学试题(已下线)专题11 化学实验基础(测)-2023年高考化学二轮复习讲练测(新高考专用)海南省海口市第一中学2023-2024学年高二上学期第一次月考化学试题
名校
2 . “化学——我们的生活,我们的未来”,学习化学应该明白“从生活中来,到生活中去”的道理。请填空:
(1)氯水和漂白粉都有漂白作用,也可用于水体的杀菌消毒。工业上利用氯气和石灰乳反应可制得漂白粉,其化学方程式为_______ 。
(2)漂白粉真正起消毒作用的物质是HClO。漂白粉在水中释放HClO的途径如下:
途径1:Ca(ClO)2+2H2O⇌Ca(OH)2+2HClO
途径2:漂白粉溶于水后,受空气中CO2的作用,产生有漂白、杀菌作用的次氯酸,反应的化学方程式为_______ 。
(3)游泳池水的酸碱性对漂粉精的消毒效果影响明显。
①池水碱性过强,杀毒作用会_______ (填“增强”或“减弱”)。
②池水酸性过强,会刺激眼睛和皮肤。通常加入Na2CO3、NaHCO3以降低酸性。
(4)①下列收集Cl2的正确装置是_______ 。

②将灼热的铜丝伸入盛有氯气的集气瓶中,反应现象为_______ 。
③将反应后的产物溶于水配成饱和溶液,向溶液中加入一小块金属钠,反应的方程式有_______ 。
(1)氯水和漂白粉都有漂白作用,也可用于水体的杀菌消毒。工业上利用氯气和石灰乳反应可制得漂白粉,其化学方程式为
(2)漂白粉真正起消毒作用的物质是HClO。漂白粉在水中释放HClO的途径如下:
途径1:Ca(ClO)2+2H2O⇌Ca(OH)2+2HClO
途径2:漂白粉溶于水后,受空气中CO2的作用,产生有漂白、杀菌作用的次氯酸,反应的化学方程式为
(3)游泳池水的酸碱性对漂粉精的消毒效果影响明显。
①池水碱性过强,杀毒作用会
②池水酸性过强,会刺激眼睛和皮肤。通常加入Na2CO3、NaHCO3以降低酸性。
(4)①下列收集Cl2的正确装置是

②将灼热的铜丝伸入盛有氯气的集气瓶中,反应现象为
③将反应后的产物溶于水配成饱和溶液,向溶液中加入一小块金属钠,反应的方程式有
您最近一年使用:0次
2022-10-10更新
|
213次组卷
|
2卷引用:山东省泰安市新泰第一中学东校2022-2023学年高一上学期第一次质量检测化学试题
3 . 1774年,舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体Cl2,某研究性学习小组欲探究氯气的化学性质,设计如图所示的实验装置。

已知:该装置气密性良好,铜粉放在耐高温托盘内(托盘不与氯气反应,防止硬质玻璃管炸裂)。
请回答下列问题:
(1)A中发生的化学反应方程式为_______ ;为防止铜与空气中的氧气反应,在加热之前应该进行的操作为_______ 。
(2)B装置中空试管的作用是_______ 。
(3)实验中,观察到D中颜色的变化为_______ 。
(4)当观察到E装置中AgNO3溶液中出现_______ (填实验现象)时,点燃酒精灯加热;写出AgNO3溶液中发生反应的化学方程式:_______ 、_______ 。
(5)F中氢氧化钠溶液的作用是_______ ,发生反应的离子方程式为_______ 。

已知:该装置气密性良好,铜粉放在耐高温托盘内(托盘不与氯气反应,防止硬质玻璃管炸裂)。
请回答下列问题:
(1)A中发生的化学反应方程式为
(2)B装置中空试管的作用是
(3)实验中,观察到D中颜色的变化为
(4)当观察到E装置中AgNO3溶液中出现
(5)F中氢氧化钠溶液的作用是
您最近一年使用:0次
名校
解题方法
4 . 某同学用下列装置进行有关Cl2的实验。下列说法不正确的是
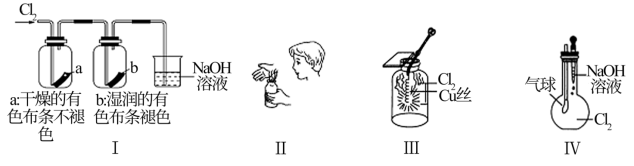

| A.Ⅰ图中:实验现象证明氯气无漂白作用,氯水有漂白作用 |
| B.Ⅱ图中:闻Cl2的气味 |
| C.Ⅲ图中:生成棕黄色的烟 |
| D.Ⅳ图中:若气球干瘪,证明Cl2可与NaOH反应 |
您最近一年使用:0次
2021-08-20更新
|
4588次组卷
|
89卷引用: 山东省泰安市2022-2023学年高一上学期期末考试化学试题
山东省泰安市2022-2023学年高一上学期期末考试化学试题山东省德州市第一中学2018-2019学年高一第一学期模块检测化学试题福建省厦门市湖滨中学2018-2019学年高一上学期期中考试化学试题福建省邵武七中2018-2019学年高一上学期期中考试化学试题第一章章末检测(1)——《高中新教材同步备课》(鲁科版 必修第一册)福建省永安市第三中学2019-2020学年高一10月月考化学试题山东省济南第一中学2019-2020学年高一10月阶段性检测化学试题山东省枣庄市第八中学东校区2019-2020学年高一10月月考化学试题福建省厦门市湖滨中学2019-2020学年高一上学期期中考试化学试题黑龙江省牡丹江市第三高级中学2019-2020学年高一上学期期末考试化学试题(已下线)【新东方】2020-53辽宁省阜新市第二高级中学2019-2020学年高一下学期期末考试化学试题(已下线)第一章章末检测(2)——《高中新教材同步备课》(鲁科版 必修第一册)人教版(2019)高一必修第一册第二章 海水中的重要元素 素养拓展区(已下线)2.2.1 氯气的性质-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)(已下线)第2章 章末检测-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)(已下线)第二章 海水中的重要元素——钠和氯(基础过关)-2020-2021学年高一化学单元测试定心卷(人教版2019必修第一册)上海市2019-2020学年高一上学期期中考试化学试题高一必修第一册(苏教2019版)专题3 B 素养拓展区 过素养 学科素养拓展训练山东省菏泽市单县第五中学2020-2021学年高一上学期第一次月考(10月)化学(希望班)试题辽宁省大连市瓦房店市实验高级中学2020-2021学年高一上学期10月月考化学试题山东省滨州市博兴县第三中学2020-2021学年高一上学期第一次月考化学试题(已下线)第一章 认识化学科学(基础过关)-2020-2021学年高一化学上学期必修第一册《单元测试定心卷》 (鲁科版2019)浙江省杭州市浙江大学附属中学2020-2021学年高一上学期10月份月测化学试题吉林省长春市长春外国语学校2020-2021学年高一上学期期中考试化学(理科)试题(已下线)【浙江新东方】14北京市第一五六中学2020—2021学年高一上学期期中测试化学试题吉林乾安县第七中学2020-2021学年高一上学期第二次质量检测化学试题湖北省沙市中学2020-2021学年高一上学期期中考试化学(选考)试题河南省郑州市第106中学2020-2021学年高一上学期9月月考化学试题山东省日照市莒县2020-2021学年高一11月模块考试化学试题福建省南平市高级中学2020-2021学年高一上学期期中考试化学试题(已下线)【浙江新东方】在线化学 (6).黑龙江省大庆市让胡路区大庆中学2020-2021学年高一上学期期中考试化学试题(已下线)【浙江新东方】71.(已下线)第四章 非金属及其化合物(能力提升)-2020-2021学年高一化学单元测试定心卷(人教版必修1)(已下线)练习2 研究物质性质的基本方法和程序-2020-2021学年【补习教材·寒假作业】高一化学(鲁科版2019)(已下线)【浙江新东方】在线化学 (24)(已下线)【浙江新东方】在线化学40专题3 第一单元 第2课时 氯气的性质及应用-高中化学苏教2019版必修第一册黑龙江省鹤岗市绥滨县第一中学2020-2021学年高一上学期期末考试化学(理)试题重庆市南坪中学2020-2021学年高一上学期期中考试化学试题广东华侨中学2020-2021学年高一上学期期中考试化学试题云南省大理州下关第一中学2020-2021学年高一3月月考化学试题新疆阿勒泰地区2018-2019学年高一上学期期末考试化学试题第2章第二节第1课时氯气的性质(课后)——课前、课中、课后同步专题精编(人教版2019必修第一册)河南省郑州市第一中学2020-2021学年高一上学期第一次月考化学试题北京市海淀区北方交通大学附属中学2019-2020学年高一上学期10月月考化学试题北京市海淀区清华大学附属中学2019-2020学年高一上学期9月月考化学试卷北京市海淀区第二十中学2019-2020学年高一上学期10月月考化学试题北京市海淀区中国地质大学附属中学2019-2020学年高一上学期9月月考化学试卷河南省南阳市南召现代中学2021-2022学年高一上学期第一次月考化学试题(已下线)易错专题15 氯气的性质-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)湖南省长郡中学2021-2022学年高一上学期期中考试化学试题河北省石家庄市第二中学2021-2022学年高一上学期期中考试化学试题山东省青岛第五十八中学2021-2022学年高一上学期期中考试化学试题云南省昆明师范专科学校附属中学2021-2022学年高一上学期期中考试化学试题福建省龙岩第一中学2021-2022学年高一上学期模块考试(期中)化学试题重庆市育才中学校2021-2022学年高一上学期期中考试化学试题 广东省东莞市第四高级中学2021-2022学年高一上学期期中考试化学试题湘赣粤名校2021-2022学年高一12月大联考化学试题甘肃省永昌县第一高级中学2021-2022学年高一上学期期中考试化学试题黑龙江省哈尔滨市第一六二中学2021-2022学年高一上学期期末考试化学试题四川省南充高级中学2021-2022学年高二上学期入学考试化学试题福建省福州高级中学2021–2022学年高一上学期半期考试化学试题宁夏石嘴山市平罗中学2021-2022学年高一上学期期末考试化学试题广东省揭阳华侨高级中学2021-2022学年高一上学期第三次阶段考试化学试题浙江省湖州市长兴县等三县2019-2020学年高一上学期期中考试化学试题 黑龙江省饶河县高级中学2021-2022学年高一上学期期中考试化学试题(已下线)2.2.2氯及其化合物-同步学习必备知识河南省中原名校2021-2022学年高二下学期第一次联考化学试题河南省南阳市2022-2023学年高一上学期第一次月考化学试题山东省单县第二中学2021-2022年高一上学期期中考试化学试题福建省宁德第一中学2022-2023学年高一上学期10月月考化学试题佛山市顺德区容山中学2022-2023学年高一上学期期中考试化学试题福建省福州第七中学2022-2023学年高一上学期期中适应性练习化学试题广东省广州市番禺区洛城中学2022-2023学年高一上学期第一次月考化学试题山东省淄博市沂源县第二中学2022-2023学年高一上学期期中考试化学试题重庆市江津第五中学校2022-2023学年高一上学期半期考试化学试题山东省邹平市第二中学20021-2022学年高一上学期第一次质量检测化学试题云南省玉龙纳西族自治县田家炳民族中学2021-2022学年高一上学期期中考试化学试题内蒙古科尔沁右翼前旗第二中学2022-2023学年高一上学期10月月考化学试题湖南省长沙市长郡中学2023-2024学年高一上学期期中考试化学试题河北省张家口市2023-2024学年高一上学期期中考试化学试题北京理工大学附属中学2023-2024学年高一上学期期中考试化学试题宁夏青铜峡市宁朔中学2023-2024学年高一上学期期中考试化学试题河北省石家庄市第二十四中学2023-2024学年高一上学期期中考试化学试题宁夏青铜峡市宁朔中学2023-2024学年高一下学期开学考试化学试题辽宁省阜新市第二高级中学2022-2023学年高一下学期期末考试化学试卷
名校
5 . 某化学实验小组利用下图所示装置制备 并进行性质验证,下列说法中正确的是
并进行性质验证,下列说法中正确的是
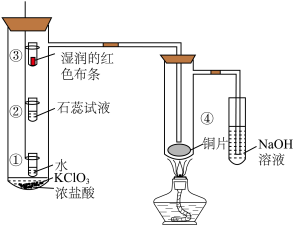
 并进行性质验证,下列说法中正确的是
并进行性质验证,下列说法中正确的是
A.①处小试管中溶液逐渐变成浅绿色说明 能溶于水 能溶于水 |
| B.②处石蕊试液先变红说明新制氯水具有酸性 |
C.③处湿润的红色布条褪色说明 具有漂白性 具有漂白性 |
D.④处出现棕黄色的烟说明 具有还原性 具有还原性 |
您最近一年使用:0次
2023-02-14更新
|
258次组卷
|
5卷引用:山东省新泰市第一中学(实验部)2023-2024学年高一上学期第二次月考化学试题
山东省新泰市第一中学(实验部)2023-2024学年高一上学期第二次月考化学试题陕西省渭南市大荔县2022-2023学年高一上学期期末考试(鲁科版)化学试题陕西省渭南市大荔县2022-2023学年高一上学期期末考试(人教版)化学试题(已下线)第02讲 氯气的性质及实验室制法-【暑假自学课】2023年新高一化学暑假精品课(鲁科版2019必修第一册)山东省青岛第三十九中学2023-2024学年高一上学期期中考试化学试卷
名校
解题方法
6 . 氯气是一种重要的化工原料,可用于制备盐酸、漂白剂和杀菌消毒剂等。
(1)1774年的舍勒用软锰矿粉末(主要成分是 )和浓盐酸混合加热制备氯气,若
)和浓盐酸混合加热制备氯气,若 和
和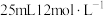 盐酸混合后缓缓加热,反应完全后向留下的溶液中加入足量
盐酸混合后缓缓加热,反应完全后向留下的溶液中加入足量 溶液,生成
溶液,生成 沉淀物质的量为_____(不考虑盐酸的挥发)
沉淀物质的量为_____(不考虑盐酸的挥发)
(2)氯化铁是一种常见的水处理剂,需要密封保存。无水氯化铁遇潮湿空气极易吸水生成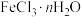 。在实验室中,可以采用下列仪器和药品制取较纯的无水氯化铁固体。
。在实验室中,可以采用下列仪器和药品制取较纯的无水氯化铁固体。

①C装置中的试剂为_____ (填试剂名称),其作用是_____ 。
②D装置的作用是_____ 。用一件仪器装填适当试剂后,也可起到C和D的作用,所装填的试剂为_____ (填干燥剂名称)。
③若D中吸收了标准状况下 L氯气,则需要消耗NaOH的质量为
L氯气,则需要消耗NaOH的质量为_____ 克。
(1)1774年的舍勒用软锰矿粉末(主要成分是
 )和浓盐酸混合加热制备氯气,若
)和浓盐酸混合加热制备氯气,若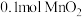 和
和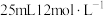 盐酸混合后缓缓加热,反应完全后向留下的溶液中加入足量
盐酸混合后缓缓加热,反应完全后向留下的溶液中加入足量 溶液,生成
溶液,生成 沉淀物质的量为_____(不考虑盐酸的挥发)
沉淀物质的量为_____(不考虑盐酸的挥发)A.等于 | B.小于 |
C.大于 ,小于 ,小于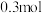 | D.以上结论都不正确 |
(2)氯化铁是一种常见的水处理剂,需要密封保存。无水氯化铁遇潮湿空气极易吸水生成
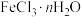 。在实验室中,可以采用下列仪器和药品制取较纯的无水氯化铁固体。
。在实验室中,可以采用下列仪器和药品制取较纯的无水氯化铁固体。
①C装置中的试剂为
②D装置的作用是
③若D中吸收了标准状况下
 L氯气,则需要消耗NaOH的质量为
L氯气,则需要消耗NaOH的质量为
您最近一年使用:0次
2023-11-23更新
|
91次组卷
|
2卷引用:山东省泰安市第一中学东校2023-2024学年高一上学期期中考试化学试题
名校
7 . NaClO2是一种高效的氧化剂和优质漂白剂,在水中溶解度较大,遇酸放出ClO2,某探究小组制备NaClO2所需装置如图所示(夹持装置略):

已知:①2ClO2+H2O2+2NaOH = 2NaClO2+O2+2H2O;
②ClO2气体极易溶于水,但不与水反应,可与碱溶液反应;纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
回答下列问题:
(1)完成该实验需要450 mL 4 mol·L-1的NaOH溶液,配制该溶液需要的玻璃仪器除烧杯、胶头滴管和量筒外,还需要_______ ,所需NaOH固体的质量为_______ 。
(2)仪器A的名称是_______ ,装置连接顺序为_______ (按气流方向,用小写字母表示,每个装置仅使用一次)。
(3)装置④中发生反应的化学方程式为_______ 。
(4)②中NaOH溶液的作用是_______ ;打开K通入足量空气的目的是_______ 。
(5)ClO2作消毒剂后转化为Cl-,则其消毒效率(以单位物质的量得到的电子数表示)是Cl2的_______ 倍。

已知:①2ClO2+H2O2+2NaOH = 2NaClO2+O2+2H2O;
②ClO2气体极易溶于水,但不与水反应,可与碱溶液反应;纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
回答下列问题:
(1)完成该实验需要450 mL 4 mol·L-1的NaOH溶液,配制该溶液需要的玻璃仪器除烧杯、胶头滴管和量筒外,还需要
(2)仪器A的名称是
(3)装置④中发生反应的化学方程式为
(4)②中NaOH溶液的作用是
(5)ClO2作消毒剂后转化为Cl-,则其消毒效率(以单位物质的量得到的电子数表示)是Cl2的
您最近一年使用:0次
2023-05-16更新
|
406次组卷
|
2卷引用:山东省泰安市新泰第一中学老校区2023-2024学年高一上学期第三次月考化学试题
名校
解题方法
8 . 下图是实验室制取、提纯氯气及研究氯气性质的装置图。请回答:

(1)盛放浓盐酸的仪器名称是_______ ,实验室制备氯气的化学反应方程式为_______ 。
(2)若要收集到干燥纯净的氯气,A、B瓶所装的试剂分别为_______ 和_______ 。
(3)E装置中通常盛放的是_______ 溶液,该装置中发生反应的离子方程式为_______ 。
(4)甲同学认为实验中存在一处具有安全隐患的地方,如何整改?_______ 。

(1)盛放浓盐酸的仪器名称是
(2)若要收集到干燥纯净的氯气,A、B瓶所装的试剂分别为
(3)E装置中通常盛放的是
(4)甲同学认为实验中存在一处具有安全隐患的地方,如何整改?
您最近一年使用:0次
名校
解题方法
9 . 二氯异氰尿酸钠[(CNO)3Cl2Na]是常用的杀菌消毒剂,常温下为白色固体,难溶于冷水。利用高浓度的NaClO溶液和异氰尿酸[(CNO) 3H3]固体制备二氯异氰尿酸钠,实验装置如下图所示(部分夹持装置略)。
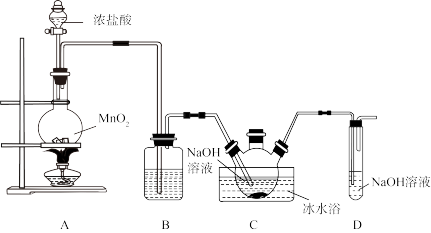
已知:①3Cl2+6NaOH 5NaCl+NaClO3+3H2O
5NaCl+NaClO3+3H2O
②2NaClO+(CNO)3H3=(CNO) 3Cl2Na+NaOH+H2O
回答下列问题:
(1)装置A中发生反应的离子方程式为_______ 。
(2)装置B中盛放的试剂为_______ ,若撤去该装置,对C中制备实验产生的影响是_______ 。
(3)三颈烧瓶液面上出现黄绿色气体时,由上口加入(CNO) 3H3固体,反应过程中仍需不断通入Cl2,原因是_______ 。
(4)装置C中冰水浴的目的是_______ 。
(5)通过下列实验可测定二氯异氰尿酸钠样品中有效氯的含量(样品中不含NaClO):
反应原理:
[(CNO)3Cl2]-+H++2H2O=(CNO)3H3+2HClO
HClO+2I-+H+=I2+Cl-+H2O
I2+2S2O =S4O
=S4O +2I-
+2I-
实验步骤:准确称取wg样品配成100mL溶液,取25.00mL于碘量瓶中,加入适量稀硫酸和过量KI溶液,暗处静置充分反应后,用0.1000 mol·L-1Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗Na2S2O3溶液VmL。
①滴定终点的现象是_______ 。
②该样品中有效氯含量的表达式为_______ 。(有效氯=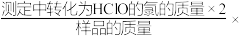 100%)。
100%)。
③若滴定前滴定管尖嘴有气泡,滴定后气泡消失,则有效氯的测定值将_______ (填“偏高”、“偏低”或“无影响”)。

已知:①3Cl2+6NaOH
 5NaCl+NaClO3+3H2O
5NaCl+NaClO3+3H2O②2NaClO+(CNO)3H3=(CNO) 3Cl2Na+NaOH+H2O
回答下列问题:
(1)装置A中发生反应的离子方程式为
(2)装置B中盛放的试剂为
(3)三颈烧瓶液面上出现黄绿色气体时,由上口加入(CNO) 3H3固体,反应过程中仍需不断通入Cl2,原因是
(4)装置C中冰水浴的目的是
(5)通过下列实验可测定二氯异氰尿酸钠样品中有效氯的含量(样品中不含NaClO):
反应原理:
[(CNO)3Cl2]-+H++2H2O=(CNO)3H3+2HClO
HClO+2I-+H+=I2+Cl-+H2O
I2+2S2O
 =S4O
=S4O +2I-
+2I-实验步骤:准确称取wg样品配成100mL溶液,取25.00mL于碘量瓶中,加入适量稀硫酸和过量KI溶液,暗处静置充分反应后,用0.1000 mol·L-1Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗Na2S2O3溶液VmL。
①滴定终点的现象是
②该样品中有效氯含量的表达式为
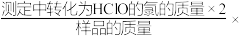 100%)。
100%)。③若滴定前滴定管尖嘴有气泡,滴定后气泡消失,则有效氯的测定值将
您最近一年使用:0次
2022-04-11更新
|
900次组卷
|
8卷引用:山东省泰安市2022届高三下学期三轮验收考试化学试题
山东省泰安市2022届高三下学期三轮验收考试化学试题山东省泰安市2022-2023学年高三上学期开学考试化学试题安徽省合肥市2022届高三第二次教学质量检测理综化学试题(已下线)必刷卷03-2022年高考化学考前信息必刷卷(全国甲卷)(已下线)化学-2022年高考押题预测卷01(辽宁卷)湖南省衡山县岳云中学2021-2022学年高三下学期期中考试化学试卷山东省济宁邹城市第二中学2022-2023学年高三9月月考化学试题甘肃省武威第六中学2022-2023学年高三上学期第三次过关考试化学试题
名校
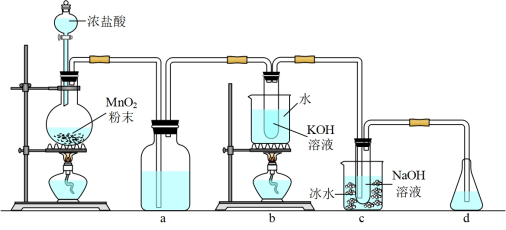
10 . 氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用如图装置(部分装置省略)制备KClO3和NaClO,探究其氧化还原性质。
回答下列问题:
(1)盛放MnO2粉末的仪器名称是_______ ,a中的试剂为_______ 。
(2)b中采用的加热方式是_______ 。c中化学反应的离子方程式是_______ ,采用冰水浴冷却的目的是_______ 。
(3)d的作用是_______ ,可选用试剂_______ (填标号)。
A.Na2S B.NaCl C.Ca(OH)2 D.H2SO4
(4)反应结束后,取出b中试管,经冷却结晶,_______ ,_______ ,干燥,得到KClO3晶体。
(5)取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1 号试管溶液颜色不变。2号试管溶液变为棕色,加入CCl4振荡,静置后CCl4层显_______ 色。可知该条件下KClO3的氧化能力_______ (填“大于”或“小于”)NaClO。
(6)84消毒液的有效成分为NaClO,不可与酸性清洁剂混用的原因是_______ (用离子方程式表示)。工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1 000 kg该溶液需消耗氯气的质量为_______ kg(保留整数)。

回答下列问题:
(1)盛放MnO2粉末的仪器名称是
(2)b中采用的加热方式是
(3)d的作用是
A.Na2S B.NaCl C.Ca(OH)2 D.H2SO4
(4)反应结束后,取出b中试管,经冷却结晶,
(5)取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1 号试管溶液颜色不变。2号试管溶液变为棕色,加入CCl4振荡,静置后CCl4层显
(6)84消毒液的有效成分为NaClO,不可与酸性清洁剂混用的原因是
您最近一年使用:0次
2021-09-06更新
|
258次组卷
|
2卷引用:山东省泰安英雄山中学2022-2023学年高三上学期第一次月考化学试题



