名校
解题方法
1 . 利用如图所示的“价-类”二维图,可以从不同角度认识含氯元素的物质的性质及其转化关系,图中甲~辛均为含氯元素的物质。回答下列问题:
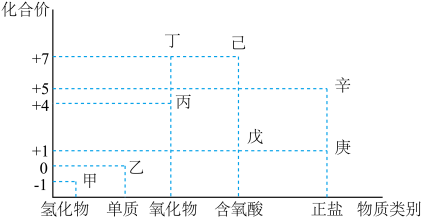
(1)丙的化学式为_____________ ;丁的化学式为_____________ 。
(2)甲、乙、丁、戊中,属于电解质的是__________________________ (填化学式);根据氯元素的化合价判断,乙____________________ (填标号)。
a.只有氧化性 b.既有氧化性又有还原性
c.只有还原性 d.既能作氧化剂又能作还原剂
(3)庚是漂白粉的有效成分,用乙制取漂白粉的化学方程式为____________________________ 。
(4)辛在 催化下受热分解可制备一种常见的气体,这种气体的化学式是
催化下受热分解可制备一种常见的气体,这种气体的化学式是______________ 。

(1)丙的化学式为
(2)甲、乙、丁、戊中,属于电解质的是
a.只有氧化性 b.既有氧化性又有还原性
c.只有还原性 d.既能作氧化剂又能作还原剂
(3)庚是漂白粉的有效成分,用乙制取漂白粉的化学方程式为
(4)辛在
 催化下受热分解可制备一种常见的气体,这种气体的化学式是
催化下受热分解可制备一种常见的气体,这种气体的化学式是
您最近一年使用:0次
2020-10-02更新
|
507次组卷
|
2卷引用:人教版(2019)高一必修第一册 第二章 海水中的重要元素 第二节 氯及其化合物 作业帮
解题方法
2 . 消毒液在我们H常生活中必不可少,请结合相关知识回答下列问题。
(1)生产消毒液是将氯气通入 溶液中,发生反应的化学方程式为
溶液中,发生反应的化学方程式为________________________ 。
(2)取少量消毒液滴加 溶液,现象是出现白色沉淀,说明消毒液中有
溶液,现象是出现白色沉淀,说明消毒液中有________ 离子。
(3)消毒液稀释后喷洒在空气中,可以生成有漂白性的物质,请写出此过程的化学方程式:__________________________ ;该物质有漂白性是因为它有强氧化性,但是它也很不稳定,请写出它分解的化学方程式:_____________________ 。
(1)生产消毒液是将氯气通入
 溶液中,发生反应的化学方程式为
溶液中,发生反应的化学方程式为(2)取少量消毒液滴加
 溶液,现象是出现白色沉淀,说明消毒液中有
溶液,现象是出现白色沉淀,说明消毒液中有(3)消毒液稀释后喷洒在空气中,可以生成有漂白性的物质,请写出此过程的化学方程式:
您最近一年使用:0次
3 . 已知漂白粉溶于水后加入少量的酸能增强漂白效果。某同学据此将少量漂白粉溶于水后,再加入浓盐酸,观察到有黄绿色气体生成。回答下列问题:
(1)写出生成黄绿色气体的化学方程式:__________________________________________ 。
(2)家庭生活中常使用“84”消毒液进行消毒。这种消毒液和某品牌洁厕净(主要成分为盐酸)__________ (填“能”或“不能”)同时使用,其原因是_________________________________ 。
(3)现设计实验由大理石、水、氯气来制取漂白粉:大理石


 漂白粉溶液
漂白粉溶液  漂白粉
漂白粉
①请写出在制取漂白粉的实验过程中发生的氧化还原反应的化学方程式:___________________________ 。
②当通入氯气较快时,反应产物为 、
、 和
和 ,已知每消耗1
,已知每消耗1
 的同时消耗1
的同时消耗1
 ,请写出此反应的化学方程式:
,请写出此反应的化学方程式:_______________________________________ 。
(1)写出生成黄绿色气体的化学方程式:
(2)家庭生活中常使用“84”消毒液进行消毒。这种消毒液和某品牌洁厕净(主要成分为盐酸)
(3)现设计实验由大理石、水、氯气来制取漂白粉:大理石


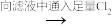 漂白粉溶液
漂白粉溶液  漂白粉
漂白粉①请写出在制取漂白粉的实验过程中发生的氧化还原反应的化学方程式:
②当通入氯气较快时,反应产物为
 、
、 和
和 ,已知每消耗1
,已知每消耗1
 的同时消耗1
的同时消耗1
 ,请写出此反应的化学方程式:
,请写出此反应的化学方程式:
您最近一年使用:0次
4 . 某校化学兴趣小组用浓盐酸与二氧化锰加热反应来制取并收集氯气,装置如下图:

(1)写出该反应的离子方程式:______________
(2)上述反应中,还原剂是________ ,若有2 mol氧化剂参加反应,转移电子的物质的量是________ mol。
(3)实验开始前,某学生对装置进行了气密性检查。方法是:连接好装置之后,用弹簧夹夹住________ 处(填“A”或“B”)橡皮管;向分液漏斗中加水并打开活塞,当加到一定量时,停止加水,静置观察。当观察到分液漏斗中______________ 时,表明该装置不漏气。
(4)兴趣小组的某些同学准备在烧杯中加入下列溶液中的一种来吸收残余氯气,你认为其中错误的是________ (填写序号)。
A 氢氧化钠溶液 B 碳酸钠溶液 C 浓硫酸

(1)写出该反应的离子方程式:
(2)上述反应中,还原剂是
(3)实验开始前,某学生对装置进行了气密性检查。方法是:连接好装置之后,用弹簧夹夹住
(4)兴趣小组的某些同学准备在烧杯中加入下列溶液中的一种来吸收残余氯气,你认为其中错误的是
A 氢氧化钠溶液 B 碳酸钠溶液 C 浓硫酸
您最近一年使用:0次
5 . 饮用水的质量关乎人类健康。回答下列问题:
(1)自来水厂用氯气杀菌、消毒,其消毒原理主要是氯气溶于水后生成了HClO,写出HClO的电子式________ 。
(2)常温下,将氯气通入稀NaOH溶液中得到漂白液(主要成分为NaClO),该反应的离子方程式为________ 。
(3)ClO2是一种黄绿色气体,被称为“第四代”饮用水消毒剂。制备ClO2的一种方法为:在平底烧瓶中加入KClO3固体、足量草酸(H2C2O4)、稀硫酸,60℃~80℃水浴加热。该反应的化学方程式为________ 。
(1)自来水厂用氯气杀菌、消毒,其消毒原理主要是氯气溶于水后生成了HClO,写出HClO的电子式
(2)常温下,将氯气通入稀NaOH溶液中得到漂白液(主要成分为NaClO),该反应的离子方程式为
(3)ClO2是一种黄绿色气体,被称为“第四代”饮用水消毒剂。制备ClO2的一种方法为:在平底烧瓶中加入KClO3固体、足量草酸(H2C2O4)、稀硫酸,60℃~80℃水浴加热。该反应的化学方程式为
您最近一年使用:0次
解题方法
6 . 某实验小组用MnO2与浓盐酸加热制取Cl2,并将得的氯气与潮湿的Ca(OH)2固体反应制取少量漂白粉,实验装置如下图:
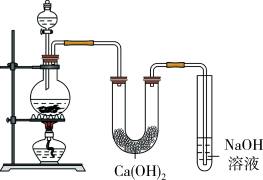
回答下列问题:
(1)漂白粉的有效成分是____________ (写化学式)。
(2)烧瓶中发生反应的化学方程式为_______________ 。
(3)温度较高时氯气与消石灰发生反应:6Cl2+6Ca(OH)2=5CaCl2+Ca(ClO3)2+6H2O,该反应中氧化剂和还原剂的物质的量之比是________ ;若反应消耗0.3molCl2,则转移的电子数为__________ 个。

回答下列问题:
(1)漂白粉的有效成分是
(2)烧瓶中发生反应的化学方程式为
(3)温度较高时氯气与消石灰发生反应:6Cl2+6Ca(OH)2=5CaCl2+Ca(ClO3)2+6H2O,该反应中氧化剂和还原剂的物质的量之比是
您最近一年使用:0次
解题方法
7 . “84消毒液”是日常生活中常用的消毒液,在抗击新冠肺炎中广泛应用。
(1)“84消毒液”的有效成分为________ ;
(2)“84消毒液”与适量硫酸混合使用可增强消毒能力,某消毒组成员欲用盐酸代替硫酸,是否可行_________ (填“是"或“否”),原因是_____________ ;
(3)Cl2是最早用于饮用水消毒的物质,ClO2是一种广谱消毒剂,等质量的Cl2和ClO2消毒效率高的是________ (填化学式);工业上ClO2常用NaClO3和Na2SO3溶液混合酸化反应制得,反应中NaClO3和Na2SO3的物质的量之比为__________ 。
(1)“84消毒液”的有效成分为
(2)“84消毒液”与适量硫酸混合使用可增强消毒能力,某消毒组成员欲用盐酸代替硫酸,是否可行
(3)Cl2是最早用于饮用水消毒的物质,ClO2是一种广谱消毒剂,等质量的Cl2和ClO2消毒效率高的是
您最近一年使用:0次
解题方法
8 . Ⅰ.工业上常用氯气与石灰乳反应制漂白粉,但Ca(OH)2与Cl2反应的氧化产物与温度有关。在足量的石灰乳中通入一定量的氯气,充分反应后生成Cl-、ClO-、ClO3-三种含氯元素的离子,其中ClO-、ClO3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示。
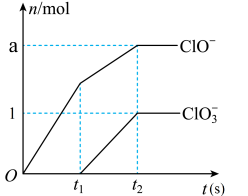
(1)常温时工业制漂白粉的化学方程式为_________________ 。
(2)t1时开始有ClO3-生成的原因是_________________ 。
(3)该石灰乳中参加反应的Ca(OH)2的物质的量是_________________ mol(用含a的代数式来表示)。
Ⅱ.过氧乙酸( )是无色透明液体,易溶于水、易挥发,见光易分解,具有强氧化性的高效消毒剂,使用过氧乙酸消毒剂时通常先用水稀释工业品过氧乙酸,然后用喷雾法对空气与地面进行消毒。
)是无色透明液体,易溶于水、易挥发,见光易分解,具有强氧化性的高效消毒剂,使用过氧乙酸消毒剂时通常先用水稀释工业品过氧乙酸,然后用喷雾法对空气与地面进行消毒。
(4)下列叙述正确的是_________________ (填字母)。
A.过氧乙酸分子中两个氧原子化合价为-1,一个氧原子化合价为-2
B.过氧乙酸溶于水能导电,属于离子化合物,也属于电解质
C.过氧乙酸包装上应贴的危险警告标签应如图所示
D.过氧乙酸应注意密闭、低温保存于棕色细口瓶中
E.过氧乙酸是一种有机物,它可以用于萃取碘水中的碘单质
(5)某学生在实验室用3.00 mol•L−1过氧乙酸配制0.15 mol•L−1过氧乙酸溶液250 mL,该生用量筒量取工业品过氧乙酸的体积为_________________ mL。
(6)如果生产过氧乙酸的原料CH3COONa中混有了SO42-,要想除掉SO42-,请选择下列试剂按照加入先后顺序填空_________________ (试剂不必选完,填序号)。
①醋酸钡溶液;②醋酸;③硝酸钡溶液;④盐酸;⑤碳酸氢钠溶液;⑥碳酸钠溶液。

(1)常温时工业制漂白粉的化学方程式为
(2)t1时开始有ClO3-生成的原因是
(3)该石灰乳中参加反应的Ca(OH)2的物质的量是
Ⅱ.过氧乙酸(
 )是无色透明液体,易溶于水、易挥发,见光易分解,具有强氧化性的高效消毒剂,使用过氧乙酸消毒剂时通常先用水稀释工业品过氧乙酸,然后用喷雾法对空气与地面进行消毒。
)是无色透明液体,易溶于水、易挥发,见光易分解,具有强氧化性的高效消毒剂,使用过氧乙酸消毒剂时通常先用水稀释工业品过氧乙酸,然后用喷雾法对空气与地面进行消毒。(4)下列叙述正确的是
A.过氧乙酸分子中两个氧原子化合价为-1,一个氧原子化合价为-2
B.过氧乙酸溶于水能导电,属于离子化合物,也属于电解质
C.过氧乙酸包装上应贴的危险警告标签应如图所示

D.过氧乙酸应注意密闭、低温保存于棕色细口瓶中
E.过氧乙酸是一种有机物,它可以用于萃取碘水中的碘单质
(5)某学生在实验室用3.00 mol•L−1过氧乙酸配制0.15 mol•L−1过氧乙酸溶液250 mL,该生用量筒量取工业品过氧乙酸的体积为
(6)如果生产过氧乙酸的原料CH3COONa中混有了SO42-,要想除掉SO42-,请选择下列试剂按照加入先后顺序填空
①醋酸钡溶液;②醋酸;③硝酸钡溶液;④盐酸;⑤碳酸氢钠溶液;⑥碳酸钠溶液。
您最近一年使用:0次
名校
解题方法
9 . 利用“价类二维图”研究物质的性质是化学研究的重要手段。如图是氯元素的化合价与部分物质类别的对应关系。
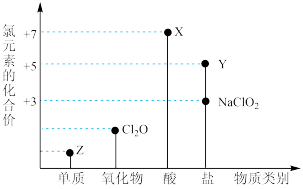
回答下列问题:
(1)X的电离方程式为_________ 。
(2)氯的某种氧化物(ClmOn)中氯、氧元素质量比为71:48,则m:n=_________ 。
(3) NaClO有较强的氧化性,所以是常用的消毒剂和漂白剂,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式_____________ 。
(4)NaClO2具有很强的氧化性,常用作消毒剂,其消毒效率是Z的___________ 倍(还原产物都为Cl-,消毒效率以单位物质的量得到的电子数表示)。
(5)Cl2O可用潮湿的Z与Na2CO3反应制取,同时生成NaHCO3,反应中Z既体现氧化性,又体现还原性,该反应的化学方程式为_____________ 。
(6)自来水中的 对人类健康产生危害。为了降低自来水中
对人类健康产生危害。为了降低自来水中 的浓度,某研究人员提出在碱性条件下用Al粉还原
的浓度,某研究人员提出在碱性条件下用Al粉还原 ,产物是N2。发生的反应可表示如下,请完成方程式的配平:
,产物是N2。发生的反应可表示如下,请完成方程式的配平:___ Al+ ____  +
+ _____ =___  +
+ _____ N2↑ + _______ H2O

回答下列问题:
(1)X的电离方程式为
(2)氯的某种氧化物(ClmOn)中氯、氧元素质量比为71:48,则m:n=
(3) NaClO有较强的氧化性,所以是常用的消毒剂和漂白剂,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式
(4)NaClO2具有很强的氧化性,常用作消毒剂,其消毒效率是Z的
(5)Cl2O可用潮湿的Z与Na2CO3反应制取,同时生成NaHCO3,反应中Z既体现氧化性,又体现还原性,该反应的化学方程式为
(6)自来水中的
 对人类健康产生危害。为了降低自来水中
对人类健康产生危害。为了降低自来水中 的浓度,某研究人员提出在碱性条件下用Al粉还原
的浓度,某研究人员提出在碱性条件下用Al粉还原 ,产物是N2。发生的反应可表示如下,请完成方程式的配平:
,产物是N2。发生的反应可表示如下,请完成方程式的配平: +
+  +
+
您最近一年使用:0次
2020-06-15更新
|
102次组卷
|
2卷引用:江西省南昌市八一中学2019-2020学年高一下学期期中考试化学试题
解题方法
10 . 化学与人类生活密切相关。请按要求,回答下列问题:
(1) 春秋末期工艺官书《考工记》中记载有“涑帛”的方法,即利用含有碳酸钠的水溶液来洗涤丝帛。请写出碳酸钠水溶液中通入CO2气体的化学方程式__________ ,将54.8g Na2CO3和NaHCO3的混合物分成等量的两份,一份溶于水后加入足量盐酸,收集到气体V L,另一份直接加热至恒重,生成气体2.24L(所有气体体积均在标准状况下测定),则原固体混合物中Na2CO3的物质的量:n(Na2CO3)=__ ,气体V=___ 。
(2)“84”消毒液在生活中使用广泛,其有效成分是次氯酸钠。可在常温下将氯气通入NaOH溶液制得,该反应的离子方程式为_______ ,若有2mol氯气参与该反应,则此时转移的电子数为___ NA。
(3)小苏打可用于治疗胃酸过多,其反应的离子方程式为______ 。
(4)长石是地表岩石最重要的造岩矿物。某种长石的化学组成KAlSi3O8则将其改写成氧化物的组合形式为_______ 。
(1) 春秋末期工艺官书《考工记》中记载有“涑帛”的方法,即利用含有碳酸钠的水溶液来洗涤丝帛。请写出碳酸钠水溶液中通入CO2气体的化学方程式
(2)“84”消毒液在生活中使用广泛,其有效成分是次氯酸钠。可在常温下将氯气通入NaOH溶液制得,该反应的离子方程式为
(3)小苏打可用于治疗胃酸过多,其反应的离子方程式为
(4)长石是地表岩石最重要的造岩矿物。某种长石的化学组成KAlSi3O8则将其改写成氧化物的组合形式为
您最近一年使用:0次



