1 . 科学的假设是实验探究的先导与价值所在。下列在假设引导下的探究肯定没有 意义的是
A.探究 与 与 反应可能生成 反应可能生成 |
B.探究Na与乙醇反应可能有 生成 生成 |
C.探究 与 与 反应可能有 反应可能有 生成 生成 |
D.探究Mg与 溶液反应产生的气体中可能含有 溶液反应产生的气体中可能含有 |
您最近一年使用:0次
2023-05-20更新
|
110次组卷
|
2卷引用:云南省曲靖市第一中学2022-2023学年高一下学期期末考试化学试题
解题方法
2 . 下列说法正确的是
A.相同条件下, 与稀盐酸反应速率比 与稀盐酸反应速率比 快 快 |
B. 能和水反应生成碱,所以是碱性氧化物 能和水反应生成碱,所以是碱性氧化物 |
C. 和 和 组成元素相同,与 组成元素相同,与 反应产物也相同 反应产物也相同 |
D. 具有强氧化性,可用作自来水的消毒剂 具有强氧化性,可用作自来水的消毒剂 |
您最近一年使用:0次
名校
3 . 化学实验是研究物质组成和探究物质性质的重要途径。
I.某澄清透明溶液(忽略水的电离),可能含有 、
、 、
、 、
、 、
、 、
、 、
、 等离子中的几种,且离子的物质的量相等(即离子数目相等),为分析其成分,取此溶液分别进行了三个实验,其操作和有关现象如图所示。请你根据上述实验推断:
等离子中的几种,且离子的物质的量相等(即离子数目相等),为分析其成分,取此溶液分别进行了三个实验,其操作和有关现象如图所示。请你根据上述实验推断:
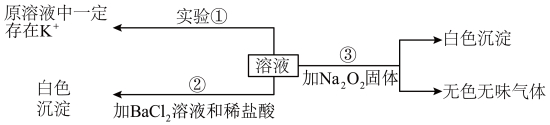
(1)实验①的焰色试验,需要透过_______ ,来观察火焰的颜色。
(2)取100mL溶液进行实验②,经足量盐酸洗涤、干燥后,得沉淀质量为2.33g。该溶液中 的物质的量浓度为
的物质的量浓度为_______ 。
(3)实验③产生的无色无味气体为_______ ,白色沉淀为_______ (填物质化学式)。原溶液中一定存在的离子有_______ 。
(4)向该溶液中加入硫酸酸化,再通入 气体,发生反应使该溶液的颜色发生变化,写出该反应的离子方程式
气体,发生反应使该溶液的颜色发生变化,写出该反应的离子方程式_______ (已知该反应中氧化剂和还原剂的个数比为2:5)。
Ⅱ. 具有强氧化性,
具有强氧化性, 具有还原性,某同学根据氧化还原反应的知识推测,
具有还原性,某同学根据氧化还原反应的知识推测, 与
与 能发生反应。为了验证此推测结果,该同学设计并进行了如图所示实验。其中装置A用锌和稀盐酸制取氢气。
能发生反应。为了验证此推测结果,该同学设计并进行了如图所示实验。其中装置A用锌和稀盐酸制取氢气。
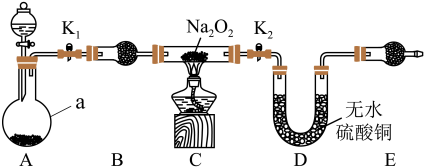
(5)仪器a的名称是_______ ,装置B的作用是_______ 。
(6)下面是实验过程中的重要操作,正确的顺序是_______。
(7)实验过程中观察到淡黄色粉末慢慢变成白色固体,无水硫酸铜未变蓝色。由此可推测出 与
与 反应生成的产物为
反应生成的产物为_______ 。
I.某澄清透明溶液(忽略水的电离),可能含有
 、
、 、
、 、
、 、
、 、
、 、
、 等离子中的几种,且离子的物质的量相等(即离子数目相等),为分析其成分,取此溶液分别进行了三个实验,其操作和有关现象如图所示。请你根据上述实验推断:
等离子中的几种,且离子的物质的量相等(即离子数目相等),为分析其成分,取此溶液分别进行了三个实验,其操作和有关现象如图所示。请你根据上述实验推断:
(1)实验①的焰色试验,需要透过
(2)取100mL溶液进行实验②,经足量盐酸洗涤、干燥后,得沉淀质量为2.33g。该溶液中
 的物质的量浓度为
的物质的量浓度为(3)实验③产生的无色无味气体为
(4)向该溶液中加入硫酸酸化,再通入
 气体,发生反应使该溶液的颜色发生变化,写出该反应的离子方程式
气体,发生反应使该溶液的颜色发生变化,写出该反应的离子方程式Ⅱ.
 具有强氧化性,
具有强氧化性, 具有还原性,某同学根据氧化还原反应的知识推测,
具有还原性,某同学根据氧化还原反应的知识推测, 与
与 能发生反应。为了验证此推测结果,该同学设计并进行了如图所示实验。其中装置A用锌和稀盐酸制取氢气。
能发生反应。为了验证此推测结果,该同学设计并进行了如图所示实验。其中装置A用锌和稀盐酸制取氢气。
(5)仪器a的名称是
(6)下面是实验过程中的重要操作,正确的顺序是_______。
A.加热至 逐渐熔化,反应一段时间 逐渐熔化,反应一段时间 | B.用小试管收集气体并检验其纯度 |
C.打开 、 、 ,通入氢气 ,通入氢气 | D.停止加热,充分冷却,关闭 、 、 |
 与
与 反应生成的产物为
反应生成的产物为
您最近一年使用:0次
2023-02-09更新
|
263次组卷
|
2卷引用:江西省萍乡市2022-2023学年高一上学期期末考试化学试题
名校
4 . 类比思想是化学学习中的重要思想,下列各项中由客观事实类比得到的结论正确的是
| 选项 | 客观事实 | 类比结论 |
| A | 电解熔融的 制备镁 制备镁 | 电解熔融的 可制备铝 可制备铝 |
| B |  与 与 溶液反应生成 溶液反应生成 |  与 与 溶液反应可生成 溶液反应可生成 |
| C |  与 与 反应生成 反应生成 和 和 |  与 与 反应生成 反应生成 和 和 |
| D |  可作净水剂 可作净水剂 |  也可作净水剂 也可作净水剂 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-02-08更新
|
303次组卷
|
4卷引用:河北省沧州市2022-2023学年高三上学期期末考试化学试题
名校
5 . SO2虽是大气污染物之一,但也是重要的工业原料。某同学在实验室设计了如下实验,对SO2的部分性质进行了探究。
I.二氧化硫的水溶性
(1) SO2易溶于水,溶于水有H2SO3生成。向SO2饱和溶液中加入NaHSO3固体,有气体冒出,原因是_______ (结合有关平衡方程式简要说明)。
II.验证SO2能否与BaCl2溶液反应
某同学设计了如图装置,且所配制的溶液均使用了无氧蒸馏水,检验SO2在无氧干扰时,是否与氯化钡反应生成沉淀。
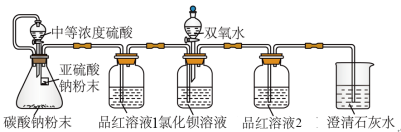
(2)加入碳酸钠粉末的目的是_______ 。
(3)当_______ 时,氯化钡溶液中没有沉淀出现,说明二氧化硫不与氯化钡溶液反应,此时滴加双氧水,出现了白色沉淀。
(4)装置中选用澄清石灰水而不用氢氧化钠溶液的目的是_______ 。
III.二氧化硫的还原性
已知SO2具有还原性,可以还原I2,也可以与Na2O2发生反应。
(5)将SO2通入装有过氧化钠的硬质试管中,将带火星的木条放在试管口处。
①若木条不复燃,则说明SO2与Na2O2反应无O2生成,可能发生反应的化学方程式为_______ 。
②若木条复燃,则说明SO2与Na2O2反应有O2生成,发生反应的化学方程式为2Na2O2+2SO2=2Na2SO3+O2。
(6)将SO2通入装有碘水(含淀粉)的洗气瓶中,若_______ ,说明还原性:SO2>I-,写出该反应的离子方程式:_______ 。
I.二氧化硫的水溶性
(1) SO2易溶于水,溶于水有H2SO3生成。向SO2饱和溶液中加入NaHSO3固体,有气体冒出,原因是
II.验证SO2能否与BaCl2溶液反应
某同学设计了如图装置,且所配制的溶液均使用了无氧蒸馏水,检验SO2在无氧干扰时,是否与氯化钡反应生成沉淀。

(2)加入碳酸钠粉末的目的是
(3)当
(4)装置中选用澄清石灰水而不用氢氧化钠溶液的目的是
III.二氧化硫的还原性
已知SO2具有还原性,可以还原I2,也可以与Na2O2发生反应。
(5)将SO2通入装有过氧化钠的硬质试管中,将带火星的木条放在试管口处。
①若木条不复燃,则说明SO2与Na2O2反应无O2生成,可能发生反应的化学方程式为
②若木条复燃,则说明SO2与Na2O2反应有O2生成,发生反应的化学方程式为2Na2O2+2SO2=2Na2SO3+O2。
(6)将SO2通入装有碘水(含淀粉)的洗气瓶中,若
您最近一年使用:0次
2022-12-31更新
|
305次组卷
|
2卷引用:广东省梅州市名校2022-2023学年高三上学期期末考试化学试题
名校
解题方法
6 . 将Na2O2分别投入到含有下列离子的溶液中,离子浓度明显减小的是
① ②I- ③
②I- ③ ④Ca2+ ⑤Cl- ⑥Na+
④Ca2+ ⑤Cl- ⑥Na+
①
 ②I- ③
②I- ③ ④Ca2+ ⑤Cl- ⑥Na+
④Ca2+ ⑤Cl- ⑥Na+| A.②③④⑤ | B.①③④⑤ | C.①②③④ | D.②③④ |
您最近一年使用:0次
2022-12-21更新
|
306次组卷
|
2卷引用:吉林省通化市梅河口市第五中学2022-2023学年高一上学期期末考试化学试题
解题方法
7 . 将过氧化钠投入FeCl2溶液中,可观察到的实验现象是
| A.无气体产生 | B.没有沉淀生成 |
| C.有红褐色沉淀生成 | D.有白色沉淀生成 |
您最近一年使用:0次
名校
解题方法
8 . 向盛有少量Na2O2的密闭容器(体积不变)中通入SO2,测定容器中O2的含量随时间变化曲线如图
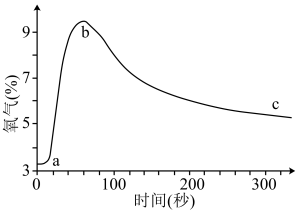
则下列说法错误的是

则下列说法错误的是
| A.ab段O2含量增加的原因:2Na2O2+2SO2=2Na2SO3+O2 |
| B.bc段O2含量缓慢降低的可能原因:反应生成O2的速率小于消耗O2的速率 |
| C.c点O2含量高于a点,则此时反应产物中含有Na2SO3 |
| D.取c点少量固体,加入BaCl2溶液有白色固体生成,证实有Na2SO4生成 |
您最近一年使用:0次
2022-10-17更新
|
187次组卷
|
3卷引用:陕西省西安交通大学附属中学2023-2024学年高一上学期期末考试化学试卷
9 . 实验小组研究SO2与Na2O2的反应。
(1)实验前分析物质的化学性质,提出假设:
假设1:SO2和CO2都是酸性氧化物。类比CO2与Na2O2的反应可知,SO2与Na2O2反应生成Na2SO3和O2;
假设2:SO2具有_______ 性,SO2与Na2O2反应生成Na2SO4。
(2)用如图所示装置进行SO2与Na2O2反应的实验。实验过程中,观察到C中淡黄色粉末逐渐变为白色,用带火星的木条靠近D中导气管口,木条复燃。

①A中反应产生SO2的化学方程式是_______ 。
②B中的试剂为_______ ,其主要作用是_______ 。
③实验证明假设_______ 正确。
(3)为检验C中是否有Na2SO4生成,设计如下方案:取少量C中反应后的白色固体溶解于水,加入BaCl2溶液,产生白色沉淀,再加入足量的稀HNO3,仍有白色沉淀不溶解,证明有Na2SO4生成。该方案是否合理?_______ (填“合理”或“不合理”)。请简要说明理由:_______ 。
(4)进一步实验证明C中反应后的固体中既有Na2SO3又有Na2SO4.从氧化还原反应的角度分析,+4价硫元素能被氧化为+6价。在上述实验条件下,+4价硫元素未完全转化为+6价,可见化学反应实际进行的情况与反应的_______ (只写一条)有关。
(1)实验前分析物质的化学性质,提出假设:
假设1:SO2和CO2都是酸性氧化物。类比CO2与Na2O2的反应可知,SO2与Na2O2反应生成Na2SO3和O2;
假设2:SO2具有
(2)用如图所示装置进行SO2与Na2O2反应的实验。实验过程中,观察到C中淡黄色粉末逐渐变为白色,用带火星的木条靠近D中导气管口,木条复燃。

①A中反应产生SO2的化学方程式是
②B中的试剂为
③实验证明假设
(3)为检验C中是否有Na2SO4生成,设计如下方案:取少量C中反应后的白色固体溶解于水,加入BaCl2溶液,产生白色沉淀,再加入足量的稀HNO3,仍有白色沉淀不溶解,证明有Na2SO4生成。该方案是否合理?
(4)进一步实验证明C中反应后的固体中既有Na2SO3又有Na2SO4.从氧化还原反应的角度分析,+4价硫元素能被氧化为+6价。在上述实验条件下,+4价硫元素未完全转化为+6价,可见化学反应实际进行的情况与反应的
您最近一年使用:0次
10 . 下列实验操作、实验现象和实验结论均正确的是
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 将少量浓硝酸分多次加入Cu和稀硫酸的混合物中 | 产生红棕色气体 | 硝酸的还原产物为 |
| B | 将少量 试样加水溶解后,滴加稀硫酸酸化,再滴加KSCN溶液 试样加水溶解后,滴加稀硫酸酸化,再滴加KSCN溶液 | 溶液变成血红色 |  试样无法确定是否变质 试样无法确定是否变质 |
| C | 向盛有 溶液的试管中加入酸化后的 溶液的试管中加入酸化后的 溶液 溶液 | 溶液变为棕黄色且出现气泡 | 生成了 和 和 |
| D | 将一定量 粉末撒在湿润的pH试纸上 粉末撒在湿润的pH试纸上 | pH试纸呈蓝色 |  呈碱性 呈碱性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次



