解题方法
1 . 以NaCl为原料,可制取Na、Na2O2、NaOH和Na2CO3等。Na2CO3可用侯氏制碱法制取,主要涉及如下反应:
(1)N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ•mol-1
2NH3(g) ΔH=-92.4kJ•mol-1
(2)NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
(3)2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
下列有关比较正确的是
(1)N2(g)+3H2(g)
 2NH3(g) ΔH=-92.4kJ•mol-1
2NH3(g) ΔH=-92.4kJ•mol-1(2)NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
(3)2NaHCO3
 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O下列有关比较正确的是
| A.键能(E):6E(N−H)>E(N≡N)+3E(H−H) | B.热稳定性:NaHCO3>Na2CO3 |
| C.同浓度溶液的pH:NaHCO3>Na2CO3 | D.沸点:NH3>H2O |
您最近一年使用:0次
2 . 将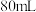 一定物质的量浓度的
一定物质的量浓度的 溶液分成A、B两等份,分别向A、B中通入物质的量不等的
溶液分成A、B两等份,分别向A、B中通入物质的量不等的 ,充分反应后,再继续向两溶液中分别逐滴加入
,充分反应后,再继续向两溶液中分别逐滴加入 的盐酸,边滴边振荡,产生的
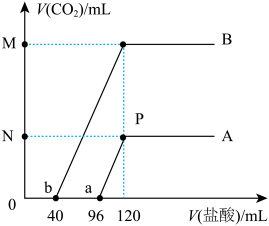
的盐酸,边滴边振荡,产生的 气体体积(假设所产生的气体全部逸出)与所加的盐酸体积之间的关系如图所示,回答下列问题:
气体体积(假设所产生的气体全部逸出)与所加的盐酸体积之间的关系如图所示,回答下列问题:
已知:①不考虑水电离出的 和
和 及
及 和
和 与水发生的反应;
与水发生的反应;
②不考虑溶液混合时引起的体积和温度的变化;
③只考虑反应过程中盐酸的酸性。
(1)由曲线A可知:
①相同状况下,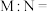
_______ 。
②P点溶液中,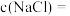
_______  (用含x的代数式表示)。
(用含x的代数式表示)。
(2)由曲线B可知:
①“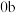 ”段发生反应的离子方程式为
”段发生反应的离子方程式为_______ 。
②向原B等份的 溶液中通入
溶液中通入 后,所得溶液中的溶质为
后,所得溶液中的溶质为_______ (填化学式),其质量之比为_______ 。
(3)若将M、N两处所产生的气体全部通入足量的某未知浓度的澄清石灰水中,所得沉淀的质量为_______ g(用含x的代数式表示,不考虑气体的逸出,下同),原 溶液中溶质的质量为
溶液中溶质的质量为_______ g。
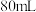 一定物质的量浓度的
一定物质的量浓度的 溶液分成A、B两等份,分别向A、B中通入物质的量不等的
溶液分成A、B两等份,分别向A、B中通入物质的量不等的 ,充分反应后,再继续向两溶液中分别逐滴加入
,充分反应后,再继续向两溶液中分别逐滴加入 的盐酸,边滴边振荡,产生的
的盐酸,边滴边振荡,产生的 气体体积(假设所产生的气体全部逸出)与所加的盐酸体积之间的关系如图所示,回答下列问题:
气体体积(假设所产生的气体全部逸出)与所加的盐酸体积之间的关系如图所示,回答下列问题:
已知:①不考虑水电离出的
 和
和 及
及 和
和 与水发生的反应;
与水发生的反应;②不考虑溶液混合时引起的体积和温度的变化;
③只考虑反应过程中盐酸的酸性。
(1)由曲线A可知:
①相同状况下,
②P点溶液中,
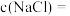
 (用含x的代数式表示)。
(用含x的代数式表示)。(2)由曲线B可知:
①“
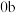 ”段发生反应的离子方程式为
”段发生反应的离子方程式为②向原B等份的
 溶液中通入
溶液中通入 后,所得溶液中的溶质为
后,所得溶液中的溶质为(3)若将M、N两处所产生的气体全部通入足量的某未知浓度的澄清石灰水中,所得沉淀的质量为
 溶液中溶质的质量为
溶液中溶质的质量为
您最近一年使用:0次
名校
解题方法
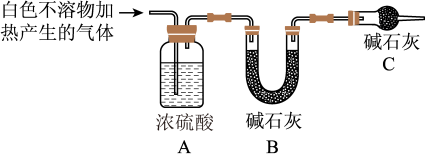
3 . Al与NaOH的水溶液能反应,而镁不反应。然而一位同学将镁条放入饱和碳酸氢钠溶液时,却观察到反应迅速发生,且有大量气体放出。查阅资料显示:①镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物;②Mg与沸水能明显发生反应。为探究反应原理,同学们设计了如下实验方案并验证产物。
【实验I】:用砂纸擦去镁条表面氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变红。
(1)提出假设
该同学对反应中产生的白色不溶物作出如下猜测:
猜测1:可能是_______ 。
猜测2:可能是 。
。
猜测3:可能是碱式碳酸镁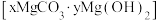 。
。
(2)设计定性实验确定产物并验证猜测:
(3)设计定量实验确定实验I的产物:称取实验I中所得干燥、纯净的白色不溶物31.0g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中。实验前后装置A增重1.8g,装置B增重13.2g,试确定白色不溶物的化学式_______ 。
(4)根据资料显示以及实验现象,有同学认为,上述反应可能就是镁分别与水、与碳酸氢钠两个直接反应的共同结果。请你分别写出这两个可能发生的化学反应的化学方程式:_______ ,_______ 。
【实验I】:用砂纸擦去镁条表面氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变红。
(1)提出假设
该同学对反应中产生的白色不溶物作出如下猜测:
猜测1:可能是
猜测2:可能是
 。
。猜测3:可能是碱式碳酸镁
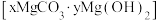 。
。(2)设计定性实验确定产物并验证猜测:
| 实验序号 | 实验 | 预期现象和结论 |
| 【实验II】 | 将实验I中收集的气体点燃 | 现象及结论 |
| 【实验III】 | 取实验I中的白色不溶物,洗涤,加入足量 |  |
| 【实验IV】 | 取实验I中的滤液,向其中加入BaCl2稀溶液 | 产生白色沉淀;溶液中存在 |

(4)根据资料显示以及实验现象,有同学认为,上述反应可能就是镁分别与水、与碳酸氢钠两个直接反应的共同结果。请你分别写出这两个可能发生的化学反应的化学方程式:
您最近一年使用:0次
2023-01-12更新
|
364次组卷
|
2卷引用:重庆市南开中学2022-2023学年高一上期期末考试化学试题
名校
解题方法
4 . 下列有关物质的性质与用途具有对应关系的是
A. 是红棕色粉末,可用作油漆的颜料 是红棕色粉末,可用作油漆的颜料 |
B. 能溶于水,可用于生产盐酸 能溶于水,可用于生产盐酸 |
C. 为白色固体,可用于游泳池杀菌消毒 为白色固体,可用于游泳池杀菌消毒 |
D. 能与碱反应,可用作焙制糕点的膨松剂 能与碱反应,可用作焙制糕点的膨松剂 |
您最近一年使用:0次
2023-01-10更新
|
310次组卷
|
4卷引用:江苏省南通市通州区2022-2023学年高一上学期期末考试化学试题
江苏省南通市通州区2022-2023学年高一上学期期末考试化学试题山东省曹县第一中学2022-2023学年高一上学期期末考试化学试题湖南省株洲市渌口区第三中学2022-2023学年高一上学期期末考试化学试题(已下线)题型02 重要元素及其化合物的性质和转化-学易金卷:备战2023-2024学年高一化学期末真题分类汇编(江苏专用)
解题方法
5 . 下列除杂质试剂和方法都正确的是(其中括号中物质为杂质)
| 选项 | 混合物(括号中物质为少量杂质) | 试剂、方法 |
| A | Na2CO3粉末( NaHCO₃) | NaOH溶液,结晶 |
| B | FeCl2(FeCl3)溶液 | 铜粉、过滤 |
| C | O2(CO2)气体 | NaOH溶液、浓H2SO4、洗气 |
| D | CuO(Al2O3)粉末 | 稀硫酸、过滤 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
6 . 我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献。联合制碱法的主要过程如图所示(部分物质已略去)。

(1)① ~ ③所涉及的操作方法中,包含过滤的是______ (填序号)。
(2)根据图,将化学方程式补充完整:NH3+CO2+______ +______ = NaHCO3 ↓+ NH4Cl
(3)煅烧NaHCO3固体的化学方程式是______ 。
(4)下列说法中,正确的是______ (填字母)。
a.CO2可循环使用
b.副产物NH4Cl可用作肥料
c.溶液B中一定含有Na+、NH 、Cl-
、Cl-
(5)若检验溶液B中是否含有氯离子,可进行的操作方法是_____________________ 。
(6)在下列方程式上写出缺少的物质并配平方程式,用双线桥分析反应①的电子转移
①___ Na2Cr2O7 + _____ HCl — ___ NaCl + ___ CrCl3 + ___ Cl2 +______________
② ___ ClO + _____ CrO
+ _____ CrO + _______ — ___ Cl- + ___ CrO
+ _______ — ___ Cl- + ___ CrO + ___H2O
+ ___H2O___________

(1)① ~ ③所涉及的操作方法中,包含过滤的是
(2)根据图,将化学方程式补充完整:NH3+CO2+
(3)煅烧NaHCO3固体的化学方程式是
(4)下列说法中,正确的是
a.CO2可循环使用
b.副产物NH4Cl可用作肥料
c.溶液B中一定含有Na+、NH
 、Cl-
、Cl-(5)若检验溶液B中是否含有氯离子,可进行的操作方法是
(6)在下列方程式上写出缺少的物质并配平方程式,用双线桥分析反应①的电子转移
①___ Na2Cr2O7 + _____ HCl — ___ NaCl + ___ CrCl3 + ___ Cl2 +___
② ___ ClO
 + _____ CrO
+ _____ CrO + _______ — ___ Cl- + ___ CrO
+ _______ — ___ Cl- + ___ CrO + ___H2O
+ ___H2O
您最近一年使用:0次
2022-11-10更新
|
275次组卷
|
2卷引用:北京市西城外国语学校2022-2023学年高一上学期期中考试化学试题
解题方法
7 . 碳酸氢钠属于抗酸药,用于碱化尿液及酸血症,也可用于胃酸过多,在潮湿空气中缓缓分解。某化学小组用如下方法对某品牌碳酸氢钠片中的含量进行了探究(可能含有少量Na2CO3,药品中不含干扰测定的物质)。
【鉴别】
a.取铂丝,用盐酸湿润后,蘸取药品粉末,在无色火焰中燃烧,火焰显黄色。
b.向本品水溶液中加盐酸产生泡沸现象。
【检查】配置药品质量分数为0.8%的水溶液,测pH为8.3。
【含量测定】小组采用滴定法进行含量测定:
I.用已准确称量的药品固体ag配制一定体积的溶液VmL。(此时主要溶质为NaHCO3和少量Na2CO3)
II.取V1mL上述溶液于锥形瓶中,加入酚酞指示剂2—3滴。
III.用1mol/L盐酸标准溶液滴定II中溶液至第一终点时,消耗盐酸溶液V2mL。 (此时溶质为NaCl和NaHCO3)
IV.再向锥形瓶内滴加2滴甲基橙,继续用HCl标准溶液滴定至第二终点,又消耗盐酸溶液V3mL。
已知:H2CO3的电离平衡常数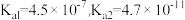 ;
;
常用的酸碱指示剂及其变色范围如下:
酚酞:pH<8.2无色、8.2<pH<10浅红色、pH>10红色
甲基橙:pH<3.1红色、3.1<pH<4.4橙色、pH>4.4黄色
(1)请写出“鉴别”中产生泡沸现象主要反应的离子反应方程式:_______ 。
(2)请结合化学用语解释“检查”中水溶液pH为8.3的主要原因(不考虑杂质影响):_______ 。
(3)“含量测定”的步骤I中配制溶液用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和_______ 。
(4)滴定过程中应选择如图所示滴定管_______ (填字母)。

(5)步骤V中第二步滴定用甲基橙滴定至终点的现象是由_______ 色变为橙色。
(6)药品中碳酸氢钠的质量分数为_______ 。(碳酸氢钠摩尔质量: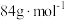 )
)
【鉴别】
a.取铂丝,用盐酸湿润后,蘸取药品粉末,在无色火焰中燃烧,火焰显黄色。
b.向本品水溶液中加盐酸产生泡沸现象。
【检查】配置药品质量分数为0.8%的水溶液,测pH为8.3。
【含量测定】小组采用滴定法进行含量测定:
I.用已准确称量的药品固体ag配制一定体积的溶液VmL。(此时主要溶质为NaHCO3和少量Na2CO3)
II.取V1mL上述溶液于锥形瓶中,加入酚酞指示剂2—3滴。
III.用1mol/L盐酸标准溶液滴定II中溶液至第一终点时,消耗盐酸溶液V2mL。 (此时溶质为NaCl和NaHCO3)
IV.再向锥形瓶内滴加2滴甲基橙,继续用HCl标准溶液滴定至第二终点,又消耗盐酸溶液V3mL。
已知:H2CO3的电离平衡常数
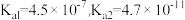 ;
;常用的酸碱指示剂及其变色范围如下:
酚酞:pH<8.2无色、8.2<pH<10浅红色、pH>10红色
甲基橙:pH<3.1红色、3.1<pH<4.4橙色、pH>4.4黄色
(1)请写出“鉴别”中产生泡沸现象主要反应的离子反应方程式:
(2)请结合化学用语解释“检查”中水溶液pH为8.3的主要原因(不考虑杂质影响):
(3)“含量测定”的步骤I中配制溶液用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和
(4)滴定过程中应选择如图所示滴定管

(5)步骤V中第二步滴定用甲基橙滴定至终点的现象是由
(6)药品中碳酸氢钠的质量分数为
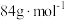 )
)
您最近一年使用:0次
名校
解题方法
8 . 取10.00 mL碳酸钠和碳酸氢钠的混合溶液,用0.1000 mol/L HCl溶液进行滴定,测得溶液的pH与加入盐酸的体积变化关系如图(假设过程中没有 逸出),则下列说法正确的是
逸出),则下列说法正确的是

 逸出),则下列说法正确的是
逸出),则下列说法正确的是
| A.原溶液可由碳酸钠、碳酸氢钠两种固体按53∶28(质量比)混合溶于适量水配制 |
B.c点时,溶液中 |
C.a~d点, |
| D.选用甲基橙作该实验的指示剂,终点时溶液由红色变成橙色,且半分钟内不复原 |
您最近一年使用:0次
名校
解题方法
9 . 已知:2Na[Al(OH)4]+CO2→2Al(OH)3↓+Na2CO3+H2O。向含2molNaOH,1molBa(OH)2,2molNa[Al(OH)4]的混合溶液中慢慢通入CO2,则通入CO2的量和生成沉淀的量关系正确的是
| 选项 | A | B | C | D |
| n(CO2)(mol) | 2 | 3 | 4 | 6 |
| n(沉淀)(mol) | 1 | 2 | 2 | 3 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-09-22更新
|
469次组卷
|
2卷引用:浙江省温州市苍南县2022年第十六届“求知杯”高一化学竞赛试题
名校
解题方法
10 . 将2molNaHCO3和一定量(不为0)的Na2O2固体混合,在加热条件下让其充分反应,150℃下所得气体仅含2种组分,则反应后固体的物质的量n(mol)的取值范围是
| A.n=1 | B.1<n<2 | C.2≤n<4 | D.n≥4 |
您最近一年使用:0次
2022-09-22更新
|
1081次组卷
|
6卷引用:浙江省温州市苍南县2022年第十六届“求知杯”高一化学竞赛试题



