名校
解题方法
1 . 阅读下列科普短文并填空:海水中含有多种盐类,如 、
、 等。目前,通过海水晒盐可制得食盐晶体和苦卤,食盐精制后可制成饱和
等。目前,通过海水晒盐可制得食盐晶体和苦卤,食盐精制后可制成饱和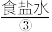 用以生产
用以生产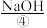 、
、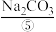 、
、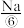 、
、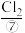 、
、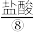 等,经过氯气氧化,热空气吹出、
等,经过氯气氧化,热空气吹出、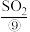 吸收等一系列操作可获得 Br2。
吸收等一系列操作可获得 Br2。
(1)上述标有序号的物质中属于电解质的是___________ (填序号, 下同);属于非电解质的是___________ ; 能导电的物质是___________ 。
(2)写出⑤溶于水的电离方程式:___________ 。 将少量的⑤溶于装有50mL蒸馏水的烧杯中后,逐滴加入⑧观察到刚开始并没有出现气泡,一段时间后出现气泡,则出现该现象的原因是___________ , 写出对应反应的离子方程式;___________ ,___________ 。
(3)海水提溴的过程中涉及的反应有2Br- +Cl2=Br2 +2Cl-, 2H2O+SO2+Br2=4H+ +2Br- +SO ,根据上述反应可判断Cl-、Br-、 SO2的还原性由强到弱的顺序为
,根据上述反应可判断Cl-、Br-、 SO2的还原性由强到弱的顺序为___________ 。
 、
、 等。目前,通过海水晒盐可制得食盐晶体和苦卤,食盐精制后可制成饱和
等。目前,通过海水晒盐可制得食盐晶体和苦卤,食盐精制后可制成饱和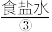 用以生产
用以生产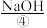 、
、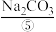 、
、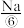 、
、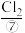 、
、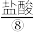 等,经过氯气氧化,热空气吹出、
等,经过氯气氧化,热空气吹出、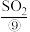 吸收等一系列操作可获得 Br2。
吸收等一系列操作可获得 Br2。(1)上述标有序号的物质中属于电解质的是
(2)写出⑤溶于水的电离方程式:
(3)海水提溴的过程中涉及的反应有2Br- +Cl2=Br2 +2Cl-, 2H2O+SO2+Br2=4H+ +2Br- +SO
 ,根据上述反应可判断Cl-、Br-、 SO2的还原性由强到弱的顺序为
,根据上述反应可判断Cl-、Br-、 SO2的还原性由强到弱的顺序为
您最近一年使用:0次
20-21高二上·江西南昌·期中
2 . 下表是25℃时某些弱酸的电离常数,其中多元弱酸分步电离。
(1)根据表中数据判断下述反应可以发生的是__ (填编号)。
①NaF+CH3COOH=CH3COONa+HF
②HF+NaHCO3=NaF+H2O+CO2↑
③CH3COOH+K2C2O4=CH3COOK+KHC2O4
(2)少量CO2通入NaClO溶液中发生反应的离子方程式为__ 。
(3)常温下在20mL0.1mol/LNa2CO3溶液中逐滴滴加40mL0.1mol/L盐酸溶液,溶液中含碳元素的三种微粒H2CO3、HCO 、CO
、CO (CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。

问答下列问题:
①各字母代表的粒子为b__ ,c___ 。
②在同一溶液中,H2CO3、HCO 、CO
、CO (填“能“或“不能”)
(填“能“或“不能”)___ 大量共存。
| 弱酸 | K | 弱酸 | K |
| HF | 3.52×10-4 | H2CO3 | K1=4.4×10-7 |
| HClO | 2.95×10-8 | K2=4.7×10-11 | |
| HCOOH | 1.765×10-4 | H2C2O4 | K1=5.4×10-2 |
| CH3COOH | 1.753×10-5 | K2=5.4×10-5 |
①NaF+CH3COOH=CH3COONa+HF
②HF+NaHCO3=NaF+H2O+CO2↑
③CH3COOH+K2C2O4=CH3COOK+KHC2O4
(2)少量CO2通入NaClO溶液中发生反应的离子方程式为
(3)常温下在20mL0.1mol/LNa2CO3溶液中逐滴滴加40mL0.1mol/L盐酸溶液,溶液中含碳元素的三种微粒H2CO3、HCO
 、CO
、CO (CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
问答下列问题:
①各字母代表的粒子为b
②在同一溶液中,H2CO3、HCO
 、CO
、CO (填“能“或“不能”)
(填“能“或“不能”)
您最近一年使用:0次
名校
解题方法
3 . 取等物质的量浓度的NaOH溶液两份,每份50ml.向其中分别通入一定量的CO2气体,随后各取溶液10ml,并分别加水稀释到100ml.分别向稀溶液后的溶液中逐滴加入0.1mol/L的盐酸,产生CO2气体的体积(标准状况)与所加入的盐酸的体积之间的关系如图(a)(b)所示(已知:向碳酸钠溶液中滴加盐酸时,刚开始滴的过程中,碳酸钠是过量的,Na2CO3+HCl=NaHCO3+NaCl ,随着过程的进行继续加盐酸,当盐酸过量时,生成的NaHCO3会与盐酸反应生成NaCl+H2O+CO2)。回答下列问题:
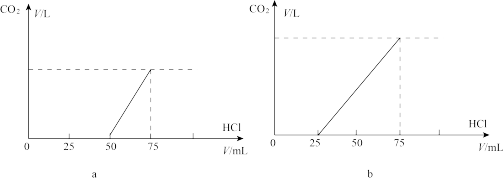
(1)在a情况下,溶质为(写化学式)________ ,其物质的量之比是________ ,标准状况下CO2气体的体积为________ 。
(2)在b情况下,溶质为(写化学式)________ ,标准状况下CO2气体的体积为________ ,原NaOH溶液的物质的量浓度为________ 。

(1)在a情况下,溶质为(写化学式)
(2)在b情况下,溶质为(写化学式)
您最近一年使用:0次
名校
解题方法
4 . 按要求答题
I.NaNO2 因外观和食盐相似,又有咸味,容易使人误食中毒。已知 NaNO2能发生反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是________ 。
(2)根据上述反应,鉴别 NaNO2 和 NaCl。可选用的物质有①水、②碘化钾淀粉试纸③淀粉、④白酒、⑤食醋,你认为必须选用的物质有________ (填序号)。
(3)请配平以下化学方程式:____Al+____NaNO3+____ NaOH= ____NaAlO2+____ N2↑+___H2O,________________ ,若反应过程中转移 5 mol 电子,则生成标准状况下 N2 的体积为_________ L。
II.向100mL1.5mol/L 的氢氧化钠溶液中缓慢通入一定量的CO2,反应后,向所得溶液中逐滴缓慢滴加一定浓度的盐酸,所得气体的体积与所加盐酸的体积(不考虑气体溶解于水)关系如图所示。

则:①氢氧化钠溶液与一定量的CO2 充分反应后的溶液中溶质为____ (写化学式)。
②盐酸的浓度为_______ 。
③B点时,产生的气体在标准状况下的体积为_______ L。
I.NaNO2 因外观和食盐相似,又有咸味,容易使人误食中毒。已知 NaNO2能发生反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是
(2)根据上述反应,鉴别 NaNO2 和 NaCl。可选用的物质有①水、②碘化钾淀粉试纸③淀粉、④白酒、⑤食醋,你认为必须选用的物质有
(3)请配平以下化学方程式:____Al+____NaNO3+____ NaOH= ____NaAlO2+____ N2↑+___H2O,
II.向100mL1.5mol/L 的氢氧化钠溶液中缓慢通入一定量的CO2,反应后,向所得溶液中逐滴缓慢滴加一定浓度的盐酸,所得气体的体积与所加盐酸的体积(不考虑气体溶解于水)关系如图所示。

则:①氢氧化钠溶液与一定量的CO2 充分反应后的溶液中溶质为
②盐酸的浓度为
③B点时,产生的气体在标准状况下的体积为
您最近一年使用:0次
2019-02-05更新
|
501次组卷
|
3卷引用:【全国百强校】江西省南昌市第二中学2018-2019学年高一上学期期末考试化学试题
5 . 称取一定质量的纯碱溶于水中,与适量的盐酸作用,下列关于盐酸的用量和气体产量的变化是(填偏大、偏小、不变)
(1)若纯碱中混有K2CO3,盐酸用量将____________ ;气体产量将_______________ 。
(2)若纯碱中混有NaHCO3,盐酸用量将___________ ;气体产量将_________________ 。
(1)若纯碱中混有K2CO3,盐酸用量将
(2)若纯碱中混有NaHCO3,盐酸用量将
您最近一年使用:0次
名校
6 . 向两份30mL同一浓度的NaOH溶液中通入CO2气体,因CO2通入量的不同,溶液的组成也不同,得到溶液M、N。若向M、N溶液中逐滴加入浓度为0.25mol·L-1盐酸,产生的气体体积v(CO2)与加入盐酸的体积v(HCl)的关系分别为如图所示两种情况A和B。
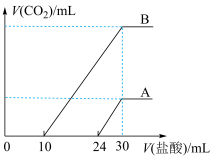
请回答下列问题:
(1)M溶液中溶质为(写化学式)___________ ,其物质的量之比是__________ 。
(2)N溶液溶质为(写化学式)____________ ,标准状况下CO2气体的体积为________ ,原NaOH溶液的物质的量浓度为_________ 。

请回答下列问题:
(1)M溶液中溶质为(写化学式)
(2)N溶液溶质为(写化学式)
您最近一年使用:0次
2017-12-27更新
|
558次组卷
|
5卷引用:江西省南昌市第二中学2017-2018学年高一上学期第三次月考化学试题
名校
7 . 请回答下列问题。
(1)碳酸氢钠俗称小苏打,其水溶液显____________ 性(填“酸”、“碱”或“中”) ;
(2)等物质的量的碳酸钠和碳酸氢钠与足量盐酸反应时生成CO2的量,前者____________ 后者(填“>”、“<”或“=”) ;
(3)除去碳酸钠固体中碳酸氢钠的方法是____________ (填“加热”或“溶解过滤”) ;
(4)若金属钠长时间在潮湿的空气中放置,最后生成的物质是_________ ;
(5)将一小块金属钠投入水中,发生反应的离子方程式为_________________________ ;
(6)铝是一种比较活泼的金属,在空气中极易被氧化而生成一种致密的氧化膜,从而保护内部的铝不再被氧化。请写出此反应的化学方程式________________ 。
(1)碳酸氢钠俗称小苏打,其水溶液显
(2)等物质的量的碳酸钠和碳酸氢钠与足量盐酸反应时生成CO2的量,前者
(3)除去碳酸钠固体中碳酸氢钠的方法是
(4)若金属钠长时间在潮湿的空气中放置,最后生成的物质是
(5)将一小块金属钠投入水中,发生反应的离子方程式为
(6)铝是一种比较活泼的金属,在空气中极易被氧化而生成一种致密的氧化膜,从而保护内部的铝不再被氧化。请写出此反应的化学方程式
您最近一年使用:0次
名校
8 . 化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
(1)从物质的分类角度看,名不符实的一种物质是__________________________ 。
(2) “三酸”与“两碱”之间均可反应,若用化学方程式表示有六个(酸过量时),若用离子方程式表示却只有两个,请写出这两个离子方程式(酸过量时):
__________________________________ ; _______________________________ 。
(3)“三酸”常用于溶解金属和金属氧化物。下列块状金属在常温时能全部溶于足量浓硝酸的是_____ (填序号)
A.Al B.Cu C.Fe D. Ag
(4)烧碱、纯碱溶液均可吸收CO2,当含0.4molNaOH的溶液吸收一定量CO2后,将溶液低温蒸干得到固体的组成可能有四种情况,分别是:①_______ ②Na2CO3 ③___________ ④NaHCO3。将得到的固体重新溶解于水,在溶液中加过量的盐酸,使其充分反应后,得到溶液所含溶质的质量为__________ g。
(1)从物质的分类角度看,名不符实的一种物质是
(2) “三酸”与“两碱”之间均可反应,若用化学方程式表示有六个(酸过量时),若用离子方程式表示却只有两个,请写出这两个离子方程式(酸过量时):
(3)“三酸”常用于溶解金属和金属氧化物。下列块状金属在常温时能全部溶于足量浓硝酸的是
A.Al B.Cu C.Fe D. Ag
(4)烧碱、纯碱溶液均可吸收CO2,当含0.4molNaOH的溶液吸收一定量CO2后,将溶液低温蒸干得到固体的组成可能有四种情况,分别是:①
您最近一年使用:0次
2017-10-07更新
|
229次组卷
|
2卷引用:江西省横峰中学、铅山一中、德兴一中2018届高三上学期第一次月考化学试题
解题方法
9 . 图表示的是往某Na2CO3溶液中滴入稀盐酸产生CO2气体的过程。

(1)写出a点以前发生反应的离子方程式:________________ 。
(2)写出a点到b点发生反应的离子方程式:________________ 。
(3)若某Na2CO3溶液中含m mol Na2CO3,向其中滴入一定量的稀盐酸,恰好使溶液中Cl-和HCO3-的物质的量之比为2:1,则滴入稀盐酸的物质的量等于____________ mol(用m表示)。

(1)写出a点以前发生反应的离子方程式:
(2)写出a点到b点发生反应的离子方程式:
(3)若某Na2CO3溶液中含m mol Na2CO3,向其中滴入一定量的稀盐酸,恰好使溶液中Cl-和HCO3-的物质的量之比为2:1,则滴入稀盐酸的物质的量等于
您最近一年使用:0次
2017-02-17更新
|
387次组卷
|
3卷引用:2016-2017学年江西省上高二中高一上月考三化学试卷
10 . 将等物质的量的Na2CO3、NaHCO3组成的混合物溶于水,配成1 L溶液,取出50 mL溶液,然后用0.05 mol/L盐酸与它反应,得到图象如下:(已知1 mol=1000 mmol)
(1)盐酸加25mL时溶液中发生反应的化学方程式________ 。
(2)原混合物中Na2CO3物质的量为________ mol。
(3)盐酸加到150 mL时,放出标准状况下气体________ mL。
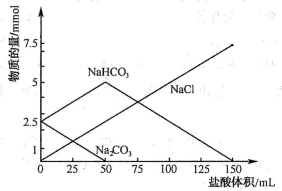
(1)盐酸加25mL时溶液中发生反应的化学方程式
(2)原混合物中Na2CO3物质的量为
(3)盐酸加到150 mL时,放出标准状况下气体
您最近一年使用:0次
2016-12-09更新
|
399次组卷
|
5卷引用:2015-2016学年江西省吉安市高一下学期期末化学试卷1
2015-2016学年江西省吉安市高一下学期期末化学试卷12015-2016学年江西省吉安市高一下学期期末化学试卷22015-2016学年新疆哈密二中高一下期末化学试卷(已下线)2018年10月12日 《每日一题》人教必修1-物质的量在化学方程式计算中的应用(已下线)2019年10月11日 《每日一题》必修1—— 物质的量在化学方程式计算中的应用



