1 . Ⅰ.某化合物M(仅含三种短周期元素)是一种储氢材料。为探究M的组成和性质,设计并完成如下实验:
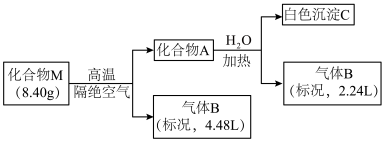
已知:化合物A仅含两种元素;气体B能使湿润的红色石蕊试纸变蓝。
请回答:(1)化合物M的组成元素是______________ (用元素符号表示)。
(2)化合物A与水反应的化学方程式是______________________ 。
(3)镁带在足量气体B中燃烧可生成化合物M和一种单质气体,该反应的化学方程式是______ 。
II.无机盐X仅由三种短周期元素组成,其相对分子质量为238,原子个数比为1︰1︰4。将23.8gX与水共热,生成一种有特殊臭味的气体单质A和某强酸的酸式盐溶液B,B的焰色反应呈黄色,在溶液B中加入足量的BaCl2溶液,产生46.6g白色沉淀。请推测并回答:
(4)单质A有很强的氧化性,可用于净化空气,饮用水消毒等。A中组成元素的简单离子结构示意图为___________________________ 。
(5)X的化学式_____________ 。
(6)实验室可通过低温电解B溶液制备X。该电解反应的化学方程式___________________ 。
(7)X氧化能力强,对环境友好,可用于脱硝、脱硫。在碱性条件下,X氧化NO的离子方程式_____________________ 。
(8)X溶液与铜反应时先慢后快。某同学认为除反应放热这一因素外,还有一种可能是反应生成的Cu2+对后续反应起催化作用,为此他设计了如下实验方案:取少量铜粉置于试管中,先加入少量CuSO4溶液,再加入X溶液,振荡,观察现象。若加入硫酸铜溶液的反应快,说明Cu2+起了催化作用,反之Cu2+不起作用。写出X与铜反应的化学方程式________ ,判断该同学设计的验证方法合理性并说明理由_________ 。

已知:化合物A仅含两种元素;气体B能使湿润的红色石蕊试纸变蓝。
请回答:(1)化合物M的组成元素是
(2)化合物A与水反应的化学方程式是
(3)镁带在足量气体B中燃烧可生成化合物M和一种单质气体,该反应的化学方程式是
II.无机盐X仅由三种短周期元素组成,其相对分子质量为238,原子个数比为1︰1︰4。将23.8gX与水共热,生成一种有特殊臭味的气体单质A和某强酸的酸式盐溶液B,B的焰色反应呈黄色,在溶液B中加入足量的BaCl2溶液,产生46.6g白色沉淀。请推测并回答:
(4)单质A有很强的氧化性,可用于净化空气,饮用水消毒等。A中组成元素的简单离子结构示意图为
(5)X的化学式
(6)实验室可通过低温电解B溶液制备X。该电解反应的化学方程式
(7)X氧化能力强,对环境友好,可用于脱硝、脱硫。在碱性条件下,X氧化NO的离子方程式
(8)X溶液与铜反应时先慢后快。某同学认为除反应放热这一因素外,还有一种可能是反应生成的Cu2+对后续反应起催化作用,为此他设计了如下实验方案:取少量铜粉置于试管中,先加入少量CuSO4溶液,再加入X溶液,振荡,观察现象。若加入硫酸铜溶液的反应快,说明Cu2+起了催化作用,反之Cu2+不起作用。写出X与铜反应的化学方程式
您最近一年使用:0次
19-20高二·浙江·期末
2 . 下列物质的性质与应用关系的描述不正确的是( )
| A.氧化镁的熔点高,是优质的耐高温材料 |
| B.钠具有强还原性,可用于制取钛、锆等金属 |
| C.氯气有强氧化性,可用氯气漂白干燥有色布条 |
D. 可与盐酸反应,小苏打可用于治疗胃病 可与盐酸反应,小苏打可用于治疗胃病 |
您最近一年使用:0次
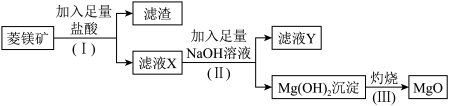
3 . 氧化镁是优质的耐高温材料。某兴趣小组利用菱镁矿(主要成分为MgCO3,还含有少量SiO2、Al2O3等杂质)设计制备氧化镁的流程如下:

(1)步骤(Ⅰ)中分离操作的名称是_______ ,所需的玻璃仪器为_______ ;
(2)步骤(Ⅰ)分离出的滤渣中主要含有_______ ,它属于_______ (填“酸性”或“碱性”)氧化物;
(3)滤液Y中的阴离子除了含 、
、 外还有
外还有_______ ;
(4)写出步骤(Ⅲ)Mg(OH)2受热分解生成MgO和H2O的化学方程式:_______ 。

(1)步骤(Ⅰ)中分离操作的名称是
(2)步骤(Ⅰ)分离出的滤渣中主要含有
(3)滤液Y中的阴离子除了含
 、
、 外还有
外还有(4)写出步骤(Ⅲ)Mg(OH)2受热分解生成MgO和H2O的化学方程式:
您最近一年使用:0次
名校
解题方法
4 . 氧化镁是优质的耐高温材料。某兴趣小组利用菱镁矿(主要成分为MgCO3,还含有少量SiO2、Al2O3等杂质)设计制备氧化镁的流程如图:
(1)步骤(Ⅰ)中分离操作的名称是___________ ;
(2)步骤(I)分离出的滤渣中主要含有_______ ,它属于______ (填“酸性”或“碱性”)氧化物;
(3)滤液Y中的阴离子除了含OH-、Cl-外还有___________ ;
(4)写出步骤(II)生成Mg(OH)2的离子方程式:_________ 。

(1)步骤(Ⅰ)中分离操作的名称是
(2)步骤(I)分离出的滤渣中主要含有
(3)滤液Y中的阴离子除了含OH-、Cl-外还有
(4)写出步骤(II)生成Mg(OH)2的离子方程式:
您最近一年使用:0次
2020-11-23更新
|
231次组卷
|
4卷引用:福建省南平市高级中学2020-2021学年高二上学期期中考试化学(会考)试题
2022·陕西西安·二模
名校
5 . 纳米氧化镁是在磁性、催化方面有许多特异功能的新材料,具有重要价值。工业以菱镁矿(主要成分为MgCO3,少量FeCO3和SiO2杂质)为原料制备纳米氧化镁工艺流程如图:
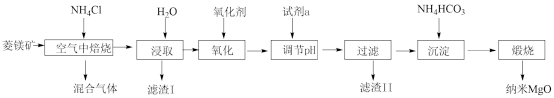
试回答下列问题:
(1)“焙烧”时生成的主要气体有___________ ;滤渣I的主要成分为___________ 。
(2)已知在该条件下金属离子开始沉淀和完全沉淀的pH如表:
上述流程中“氧化”的目的是___________ 。氧化剂常用空气或H2O2而不选用酸性KMnO4,解释其原因___________ 。
(3)试剂a可能是___________ 。
(4)资料显示煅烧MgCO3比煅烧Mg(OH)2更容易生成MgO纳米材料。“沉淀”时若将NH4HCO3更换成Na2CO3,则产生的后果是___________ 。
(5)该流程中可以循环利用的物质是___________ 。

试回答下列问题:
(1)“焙烧”时生成的主要气体有
(2)已知在该条件下金属离子开始沉淀和完全沉淀的pH如表:
| 金属离子 | Fe2+ | Fe3+ | Mg2+ |
| 开始沉淀pH | 6.3 | 1.5 | 8.9 |
| 完全沉淀pH | 8.1 | 2.8 | 10.9 |
(3)试剂a可能是
(4)资料显示煅烧MgCO3比煅烧Mg(OH)2更容易生成MgO纳米材料。“沉淀”时若将NH4HCO3更换成Na2CO3,则产生的后果是
(5)该流程中可以循环利用的物质是
您最近一年使用:0次
6 . 资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物.某同学设计了如下实验方案并验证产物、探究反应原理。
(1)提出假设
实验1:用砂纸擦去镁条表面的氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变为红.该同学对反应中产生的白色不溶物进行如下猜测:
猜测1:白色不溶物可能为_________ ;
猜测2:白色不溶物可能为MgCO3.
猜测3:白色不溶物可能是碱式碳酸镁[xMgCO3•yMg(OH)2].
(2)设计定性实验确定产物并验证猜测:
(3)为进一步确定实验1的产物,设计定量实验方案,如图所示:
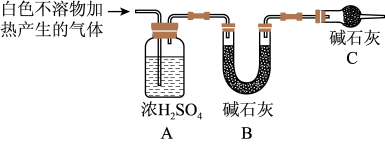
称取实验1中所得干燥、纯净的白色不溶物22.6g,充分加热至不再产生气体为止,并使分解产生的气体全部通入装置A和B中.实验后装置A增重1.8g,装置B增重8.8g,试确定白色不溶物的化学式:_________ ;(4)请结合化学用语和化学平衡移动原理解释Mg和饱和NaHCO3溶液反应产生大量气泡和白色不溶物的原因:_________ 。
(1)提出假设
实验1:用砂纸擦去镁条表面的氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变为红.该同学对反应中产生的白色不溶物进行如下猜测:
猜测1:白色不溶物可能为
猜测2:白色不溶物可能为MgCO3.
猜测3:白色不溶物可能是碱式碳酸镁[xMgCO3•yMg(OH)2].
(2)设计定性实验确定产物并验证猜测:
| 实验序号 | 实验 | 实验现象 | 结论 |
| 实验Ⅱ | 将实验Ⅰ中收集到的气体点燃 | 能安静燃烧、产生淡蓝色火焰 | 气体成分为 |
| 实验Ⅲ | 取实验Ⅰ中的白色不溶物,洗涤,加入足量 | 白色不溶物可能含有猜测2中不溶物 | |
| 实验Ⅳ | 取实验Ⅰ中的澄清液,向其中加入少量CaCl2稀溶液 | 产生白色沉淀 | 溶液中存在 |

称取实验1中所得干燥、纯净的白色不溶物22.6g,充分加热至不再产生气体为止,并使分解产生的气体全部通入装置A和B中.实验后装置A增重1.8g,装置B增重8.8g,试确定白色不溶物的化学式:
您最近一年使用:0次
2016-12-09更新
|
584次组卷
|
3卷引用:2015-2016学年陕西西藏民族学院附中高二下期末化学卷
名校
解题方法
7 . 下列有关物质的性质与用途具有对应关系的是
| A.Mg(OH)2具有碱性,可用于制胃酸中和剂 | B.H2O2是无色液体,可用作消毒剂 |
| C.FeCl3具有氧化性,可用作净水剂 | D.Mg与CO2反应生成MgO和CO |
您最近一年使用:0次
名校
8 . 卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子。以卤块为原料可制得轻质氧化镁,工艺流程如图:
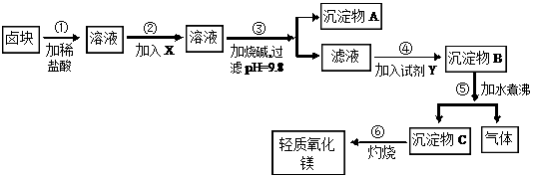
已知:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常将它氧化为Fe3+,生成Fe(OH)3沉淀除去。若要求产品尽量不含杂质,请根据表1和表2提供的资料,填写空白:
(1)在步骤②中加入的试剂X(从表2中选择)是_______ 而不是双氧水,其原因是_______________________ 。写出加入X发生反应的离子方程式_______________________ 。
(2)在步骤③中控制pH=9.8,其目的是____________________________ 。
(3)沉淀物A的成分为______________ ,试剂Y(从表2中选择)应该是_______ 。
(4)在步骤⑤中发生反应的化学方程式是________________________ 。
(5)若在实验室中完成步骤⑥,则沉淀物C必需在_______ (填仪器名称)中灼烧。

已知:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常将它氧化为Fe3+,生成Fe(OH)3沉淀除去。若要求产品尽量不含杂质,请根据表1和表2提供的资料,填写空白:
| 表1 生成氢氧化物沉淀的pH | 表2 化学试剂价格表 | ||||
| 物质 | 开始沉淀 | 沉淀完全 | 试剂 | 价格(元/吨) | |
| Fe(OH)3 | 2.7 | 3.7 | 漂液(含25.2% NaClO) | 450 | |
| Fe(OH)2 | 7.6 | 9.6 | 双氧水(含30% H2O2) | 2400 | |
| Mn(OH)2 | 8.3 | 9.8 | 烧碱(含98% NaOH) | 2100 | |
| Mg(OH)2 | 10.0 | 11.1 | 纯碱(含99.5% Na2CO3) | 600 | |
(1)在步骤②中加入的试剂X(从表2中选择)是
(2)在步骤③中控制pH=9.8,其目的是
(3)沉淀物A的成分为
(4)在步骤⑤中发生反应的化学方程式是
(5)若在实验室中完成步骤⑥,则沉淀物C必需在
您最近一年使用:0次



