1 . 下列叙述中正确的是
| A.将高温水蒸气通过炽热的铁粉,铁粉变红色 |
| B.向Fe(OH)3 胶体中滴加稀H2SO4,先出现沉淀,后沉淀溶解 |
| C.用砂纸打磨的铝条,放在酒精灯上加热至熔化,铝会滴落下来 |
| D.铝在空气中耐腐蚀,所以铝是不活泼金属 |
您最近一年使用:0次
2017-12-09更新
|
243次组卷
|
4卷引用:山西省晋中市寿阳县第一中学2019—2020学年高一上学期第二次月考化学试题
山西省晋中市寿阳县第一中学2019—2020学年高一上学期第二次月考化学试题重庆市巴蜀中学2017-2018学年高一上学期期中考试化学试题(已下线)【走进新高考】(人教版必修一)高一上学期期中复习模拟(A卷)(基础篇)01安徽省滁州市定远县育才学校2019-2020学年高一上学期期末考试(普通班)化学试题
名校
解题方法
2 . 某碳素钢锅炉内水垢的主要成分是碳酸钙、硫酸钙、氢氧化镁、铁锈;二氧化硅等。水垢会形成安全隐患,需及时清洗除去。清洗流程如下:
I.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤溶液,清水冲洗锅炉,加入稀盐酸,浸泡;
Ⅲ.向洗液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉。
已知:20℃时溶解度/g
(1)用NaOH溶解二氧化硅的化学方程式是_________
(2)在步骤Ⅱ中:①加入盐酸可除去CaCO3、Fe2O3和Mg(OH)2.写出盐酸与Mg(OH)2反应的离子方程式:___________ 。
②清洗过程中,溶解的铁锈会加速锅炉腐蚀,用离子方程式解释其原因_________
(3)步骤Ⅲ中,加入Na2SO3的目的是将步骤Ⅱ中生成的Fe3+还原成Fe2+,防止Fe3+腐蚀锅炉。写出Na2SO3和Fe3+反应的高子方程式___________ 。
(4)步骤Ⅳ中,钝化后的锅炉表面会覆盖一层致密的Fe3O4保护膜。
①如果转移的电子有2.4mol,则有________ g铁被钝化。
②钝化效果的检测一般可用滤纸浸渍配好的检测液后贴附于待测样品表面或直接将溶液涂、滴于待测表面。下面检测钝化效果的方法合理的是__________ 。
a.在炉面上滴加浓H2SO4,观察溶液出现棕黄色的时间
b.在炉面上滴加酸性CuSO4溶液,观察蓝色消失的时间
c.在炉面上滴加浓HNO3观察出现红棕色气体的时间
d.在炉面上滴加酸性K3[Fe(CN)6]溶液,观察出现蓝色沉淀的时间
I.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤溶液,清水冲洗锅炉,加入稀盐酸,浸泡;
Ⅲ.向洗液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉。
已知:20℃时溶解度/g
| CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 |
| l.4×10-3 | 2.55×10-2 | 9×10-4 | 1.1×10-2 |
(2)在步骤Ⅱ中:①加入盐酸可除去CaCO3、Fe2O3和Mg(OH)2.写出盐酸与Mg(OH)2反应的离子方程式:
②清洗过程中,溶解的铁锈会加速锅炉腐蚀,用离子方程式解释其原因
(3)步骤Ⅲ中,加入Na2SO3的目的是将步骤Ⅱ中生成的Fe3+还原成Fe2+,防止Fe3+腐蚀锅炉。写出Na2SO3和Fe3+反应的高子方程式
(4)步骤Ⅳ中,钝化后的锅炉表面会覆盖一层致密的Fe3O4保护膜。
①如果转移的电子有2.4mol,则有
②钝化效果的检测一般可用滤纸浸渍配好的检测液后贴附于待测样品表面或直接将溶液涂、滴于待测表面。下面检测钝化效果的方法合理的是
a.在炉面上滴加浓H2SO4,观察溶液出现棕黄色的时间
b.在炉面上滴加酸性CuSO4溶液,观察蓝色消失的时间
c.在炉面上滴加浓HNO3观察出现红棕色气体的时间
d.在炉面上滴加酸性K3[Fe(CN)6]溶液,观察出现蓝色沉淀的时间
您最近一年使用:0次
2012·湖北·一模
名校
3 . 已知FeS与某浓度的HNO3反应时生成Fe(NO3)3、H2SO4和某一单一的还原产物,若FeS和参与反应的HNO3的物质的量之比为1︰6,则该反应的还原产物是
| A.NO | B.NO2 | C.N2O | D.NH4NO3 |
您最近一年使用:0次
2017-11-09更新
|
568次组卷
|
6卷引用:2013届山西省平遥中学高三上学期12月质检考试化学试卷
(已下线)2013届山西省平遥中学高三上学期12月质检考试化学试卷(已下线)2012届湖北省普通高等学校招生5月适应性考试化学试卷(已下线)2012届北京市清华附中高三考前适应性训练理综化学试卷黑龙江省哈尔滨市第三中学2018届高三上学期(10月)第二次验收考试化学试题广东省清远市第一中学实验学校2020届高三第四次月考理综化学试题(已下线)上海市虹口区2014届高三三模化学试题
名校
4 . 某工厂废液中含有氯化钠、氯化铜和氯化亚铁。某课外小组要从废液中回收铜并得到铁红(主要成分Fe2O3),要求全过程不引入其他金属元素。设计实验方案如图所示,回答下列问题。
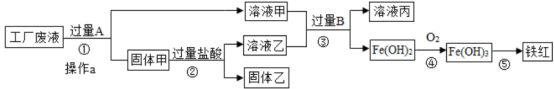
(1)加入过量A溶解后,在进行操作a时玻璃棒的作用是______________________ 。
(2)工厂废液中加入过量A的目的是______________________________ 。
(3)溶液甲中的金属离子是_____________________ (写离子符号)。
(4)步骤①②③中所发生的化学反应,其中属于置换反应的是________ (填序号)。
(5)步骤③中发生反应的化学方程式 是_____________________ 。

(1)加入过量A溶解后,在进行操作a时玻璃棒的作用是
(2)工厂废液中加入过量A的目的是
(3)溶液甲中的金属离子是
(4)步骤①②③中所发生的化学反应,其中属于置换反应的是
(5)步骤③中发生反应的化学方程式 是
您最近一年使用:0次
2017-09-21更新
|
367次组卷
|
3卷引用:山西省忻州市第一中学2017-2018学年高一上学期摸底考试化学试题
山西省忻州市第一中学2017-2018学年高一上学期摸底考试化学试题(已下线)2019年1月4日 《每日一题》人教必修1-“铝三角”与“铁三角”安徽省滁州市定远县育才学校2019-2020学年高一上学期期末考试(普通班)化学试题
名校
5 . 50 g镁、锌、铁的混合物与一定量的10%的稀硫酸恰好完全反应,将反应后的混合溶液蒸干后可得不含结晶水的固体146 g,则反应生成氢气的质量为
| A.1 g | B.2 g | C.3 g | D.4 g |
您最近一年使用:0次
名校
6 . 下列制备有关物质所设计的途径中,正确的是
A.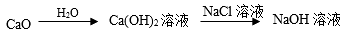 |
B. |
C. |
D.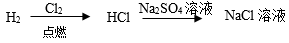 |
您最近一年使用:0次
名校
解题方法
7 . 某同学看到“利用零价铁还原NO3-脱除地下水中硝酸盐”的相关资料后,利用如下装置探究铁粉与KNO3溶液的反应。实验步骤及现象如下:

(1)通入N2并保持后续反应均在N2氛围中进行的实验目的是______________________________ 。
(2)白色物质是__________ ,用化学方程式解释其变为红褐色的原因:____________________ 。
(3)为了探究滤液的成分,该同学进一步设计了下述实验:
(i)根据以上实验现象,可以判断滤液中存在____________________ 离子。
(ii)步骤2中滴加稀硫酸后溶液会由浅绿色变成红色,请用离子方程式解释其原因____________________ 。

| 实验步骤 | 实验现象 |
| 1、打开弹簧夹,缓慢通入N2 | |
| 2、加入pH为2.5的0.01mol/L酸性KNO3溶液100mL | 铁粉部分溶解,溶液呈浅绿色; 铁粉不再溶解后,剩余铁粉表面出现少量白色物质附着。 |
| 3、反应停止后,拔掉橡胶塞,将圆底烧瓶取下 | 烧瓶内气体的颜色没有发生变化。 |
| 4、将剩余固体过滤 | 表面的白色物质变为红褐色。 |
(2)白色物质是
(3)为了探究滤液的成分,该同学进一步设计了下述实验:
| 实验步骤 | 实验现象 |
| 1、取部分滤液于试管中,向其中加入KSCN溶液 | 溶液液无变化 |
| 2、将上述溶液分为两份,一份中滴入氯气;另一份中滴加稀硫酸 | 两份溶液均变为红色 |
| 3、另取部分滤液于试管中,向其中加入浓NaOH溶液并加热,在试管口放置湿润的红色石蕊试纸。 | 有气体生成,该气体使红色石蕊试纸变蓝。 |
(ii)步骤2中滴加稀硫酸后溶液会由浅绿色变成红色,请用离子方程式解释其原因
您最近一年使用:0次
2017-08-31更新
|
512次组卷
|
5卷引用:山西省太原师范学院附属中学、太原市师苑中学校2021-2022学年高一下学期3月月考化学试题
山西省太原师范学院附属中学、太原市师苑中学校2021-2022学年高一下学期3月月考化学试题北京市师范大学附属实验中学2015-2016学年高一下学期期末考试化学试题(已下线)3.3.3 硝酸的性质 人类活动对氮循环和环境的影响练习(1)——《高中新教材同步备课》(鲁科版 必修第一册)河北省三河市第一中学2020-2021学年高一下学期第一次阶段考化学试题广东省佛山市顺德区容山中学2022-2023学年高一下学期3月月考化学试题
8 . 已知100mL某硫酸亚铁、硫酸、硫酸铁混合溶液中阳离子浓度相等,硫酸根离子总浓度为6mol/L,此溶液中还可溶解铁粉的质量为
| A.11.2g | B.16.8g | C.33.5g | D.5.6g |
您最近一年使用:0次
9 . 制印刷电路时常用FeCl3溶液腐蚀铜,向盛有FeCl3溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是
| A.烧杯中有铜无铁 | B.烧杯中有铁无铜 |
| C.烧杯中铜、铁都有 | D.烧杯中铜、铁都没有 |
您最近一年使用:0次
2017-08-24更新
|
504次组卷
|
5卷引用:山西省忻州市第一中学2016-2017学年高一必修一:3.2.3几种重要的金属化合物同步练习化学试题
名校
10 . 将铁放入下列溶液中,铁溶解而溶液质量减轻的是
| A.FeCl2溶液 | B.稀H2SO4 |
| C.热的NaOH溶液 | D.CuSO4溶液 |
您最近一年使用:0次
2017-08-24更新
|
511次组卷
|
2卷引用:山西省忻州市第一中学2016-2017学年高一必修一:3.2.3几种重要的金属化合物同步练习化学试题



