解题方法
1 . 2022年10月,世界首个电磁推进地面超高速试验设施“电磁橇'”在山东济南成功运行,它可以把超过1吨的物体在短时间内从0加速到1030公里/小时,创造了大质量超高速电磁推进技术的世界最高速度纪录。
(1)“电磁橇”的轨道材料为铁合金,其优点是_______ (写一条)。
(2)建设“电磁橇”的过程中,对铁质材料进行深加工时,可用_______ 清洗其表面的铁锈,该反应的离子方程式为_______ 。
(3)生产“电磁橇”的铁质材料时,炽热的铁水注入模具之前,模具必须进行充分的干燥处理,不能留有水,原因是_______ (用化学方程式解释),该反应的类型属于_______ 。
(1)“电磁橇”的轨道材料为铁合金,其优点是
(2)建设“电磁橇”的过程中,对铁质材料进行深加工时,可用
(3)生产“电磁橇”的铁质材料时,炽热的铁水注入模具之前,模具必须进行充分的干燥处理,不能留有水,原因是
您最近一年使用:0次
2 . 距离北京2022年冬奥会还有不到一年的时间,各项筹办工作也到了最后的冲刺阶段。冬奥会从场馆建设到场馆运行,绿色可持续的理念贯穿始终。
(1)在汽车尾气处理方面,因汽车排放的尾气中含有大量含氮氧化物而污染大气,造成产生氮的氧化物的主要原因是___ (填字母)
A.燃烧含氮化合物引起的
B.由于汽油得不充分燃烧
C.汽缸中N2被氧化生成的
请写出该反应的化学方程式___ 。
(2)在生活用水方面,延庆赛区各类建筑的节水型生活用水器具普及率达100%,并建有分散和集中污水处理设施,实现生活污水全部收集、处理后再利用。某化工厂排放的污水中含有Mg2+、Fe3+、Cu2+、Hg2+四种离子。某同学设计了从该污水中回收纯净金属铜的方案。
已知:汞会挥发。
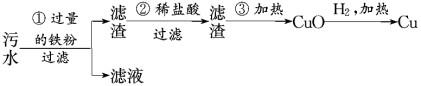
①滤液中主要含有的金属离子为___ 和___ 。
②第②步发生反应的离子方程式为___ 。
③第③步会造成的环境污染问题是___ 。
(1)在汽车尾气处理方面,因汽车排放的尾气中含有大量含氮氧化物而污染大气,造成产生氮的氧化物的主要原因是
A.燃烧含氮化合物引起的
B.由于汽油得不充分燃烧
C.汽缸中N2被氧化生成的
请写出该反应的化学方程式
(2)在生活用水方面,延庆赛区各类建筑的节水型生活用水器具普及率达100%,并建有分散和集中污水处理设施,实现生活污水全部收集、处理后再利用。某化工厂排放的污水中含有Mg2+、Fe3+、Cu2+、Hg2+四种离子。某同学设计了从该污水中回收纯净金属铜的方案。
已知:汞会挥发。

①滤液中主要含有的金属离子为
②第②步发生反应的离子方程式为
③第③步会造成的环境污染问题是
您最近一年使用:0次
解题方法
3 . 铁是应用最广泛的金属,铁的氯化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)在实验室中,FeCl2可用铁粉和___________ (填名称)反应制备。
(2)实验室在制备Fe(OH)2时必须隔绝空气,否则发生的现象是___________ ,对应的化学方程式为___________ 。
(3)红砖是用黏土高温烧结而成的,因其含有Fe2O3呈红色或棕红色而得名,常用作建筑材料。请设计一个简单实验证明红砖中含有Fe3+:___________ 。
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为:___________ 。
(1)在实验室中,FeCl2可用铁粉和
(2)实验室在制备Fe(OH)2时必须隔绝空气,否则发生的现象是
(3)红砖是用黏土高温烧结而成的,因其含有Fe2O3呈红色或棕红色而得名,常用作建筑材料。请设计一个简单实验证明红砖中含有Fe3+:
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为:
您最近一年使用:0次
解题方法
4 . 中国传统的农具、兵器曾大量使用铁,铁器的修复是文物保护的重要课题。

(1)分析腐蚀原理
一般认为,铁器腐蚀经过了如下循环:
①Fe转化为 ;
;
② 在自然环境中形成
在自然环境中形成 ,该物质中铁元素的化合价为
,该物质中铁元素的化合价为_______ ,
③ 和
和 反应形成致密的
反应形成致密的 保护层;
保护层;
④ 保护层被氧化为
保护层被氧化为 ,如此往复。写出
,如此往复。写出 保护层被氧化为
保护层被氧化为 反应的化学方程式
反应的化学方程式_______ 。
(2)铁器表面氧化层的成分有多种,性质如下:
在有氧条件下, 在含
在含 溶液中会转化为FeOCl,将相关反应的离子方程式补充完整:
溶液中会转化为FeOCl,将相关反应的离子方程式补充完整:_______
4Fe3O4+O2+ _______+
_______+ H2O=
H2O= FeOCl+
FeOCl+ _______。
_______。
(3)化学修复可以使FeOCl转化为 致密保护层:用Na2SO3和NaOH混合溶液浸泡锈蚀的铁器,一段时间后取出,再用NaOH溶液反复洗涤。
致密保护层:用Na2SO3和NaOH混合溶液浸泡锈蚀的铁器,一段时间后取出,再用NaOH溶液反复洗涤。
①FeOCl在NaOH的作用下转变为不溶于水的 ,反应的离子方程式是
,反应的离子方程式是_______ 。
②Na2SO3的作用是_______ 。
(4)在钢铁厂的生产中,炽热的铁水或钢水注入模具之前,模具必须进行_______ ,不得留有水。原因是_______ (用化学方程式表示)。

(1)分析腐蚀原理
一般认为,铁器腐蚀经过了如下循环:
①Fe转化为
 ;
;②
 在自然环境中形成
在自然环境中形成 ,该物质中铁元素的化合价为
,该物质中铁元素的化合价为③
 和
和 反应形成致密的
反应形成致密的 保护层;
保护层;④
 保护层被氧化为
保护层被氧化为 ,如此往复。写出
,如此往复。写出 保护层被氧化为
保护层被氧化为 反应的化学方程式
反应的化学方程式(2)铁器表面氧化层的成分有多种,性质如下:
| 成分 |  |  | FeOCl | |
| 性质 | 致密 | 疏松 | 疏松 |
在有氧条件下,
 在含
在含 溶液中会转化为FeOCl,将相关反应的离子方程式补充完整:
溶液中会转化为FeOCl,将相关反应的离子方程式补充完整:4Fe3O4+O2+
 _______+
_______+ H2O=
H2O= FeOCl+
FeOCl+ _______。
_______。(3)化学修复可以使FeOCl转化为
 致密保护层:用Na2SO3和NaOH混合溶液浸泡锈蚀的铁器,一段时间后取出,再用NaOH溶液反复洗涤。
致密保护层:用Na2SO3和NaOH混合溶液浸泡锈蚀的铁器,一段时间后取出,再用NaOH溶液反复洗涤。①FeOCl在NaOH的作用下转变为不溶于水的
 ,反应的离子方程式是
,反应的离子方程式是②Na2SO3的作用是
(4)在钢铁厂的生产中,炽热的铁水或钢水注入模具之前,模具必须进行
您最近一年使用:0次
5 . 依次书写下列有关反应化学方程式或离子方程式,并指出某些反应的氧化剂。
(1)铁与水蒸气反应_________________________ 氧化剂_________________
(2)二氧化硅与碳在高温下反应_______________________________ 氧化剂_________
(3)硝酸银与氯化钠反应的离子方程式______________________
(4)粗盐提纯中与氯化钡反应的相关离子方程式_____________________________________
(1)铁与水蒸气反应
(2)二氧化硅与碳在高温下反应
(3)硝酸银与氯化钠反应的离子方程式
(4)粗盐提纯中与氯化钡反应的相关离子方程式
您最近一年使用:0次
解题方法
6 . Ⅰ.Fe、Al分别与盐酸反应(结果化简成最简单整数比,否则不给分):
(1)若盐酸足量,与等物质的量的Fe、Al反应产生H2的质量之比为_____________ 。
(2)若盐酸足量,与等质量的Fe、Al反应产生H2的质量之比为_________________ 。
(3)若盐酸不足,与足量Fe、Al反应产生H2在同温同压下的体积比为___________ 。
Ⅱ.铝分别与盐酸、NaOH溶液反应(结果化简成最简单整数比,否则不给分):
(4)若盐酸、NaOH溶液足量,与等质量的两份铝反应产生H2的体积之比是_______ 。
(5)若盐酸、NaOH溶液等体积、等物质的量浓度,与足量的两份铝反应产生H2的体积之比是________ 。
(6)若HCl、NaOH溶液与足量的两份铝反应,二者产生的H2相等,则HCl和NaOH的物质的量之比是________ 。
(7)若甲、乙两烧杯中各盛有100 mL 3 mol·L-1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为V(甲):V(乙)=1:2,则加入铝粉的质量为________ g。
(1)若盐酸足量,与等物质的量的Fe、Al反应产生H2的质量之比为
(2)若盐酸足量,与等质量的Fe、Al反应产生H2的质量之比为
(3)若盐酸不足,与足量Fe、Al反应产生H2在同温同压下的体积比为
Ⅱ.铝分别与盐酸、NaOH溶液反应(结果化简成最简单整数比,否则不给分):
(4)若盐酸、NaOH溶液足量,与等质量的两份铝反应产生H2的体积之比是
(5)若盐酸、NaOH溶液等体积、等物质的量浓度,与足量的两份铝反应产生H2的体积之比是
(6)若HCl、NaOH溶液与足量的两份铝反应,二者产生的H2相等,则HCl和NaOH的物质的量之比是
(7)若甲、乙两烧杯中各盛有100 mL 3 mol·L-1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为V(甲):V(乙)=1:2,则加入铝粉的质量为
您最近一年使用:0次
名校
7 . 铁是应用最广泛的金属,铁的氯化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)请写出Fe与水蒸气反应的化学方程式:_____________ 。
(2)在实验室中,FeCl2可用铁粉和______ (填名称)反应制备。
(3)Fe3O4可用多种方法制得,其中由一种单质和一种化合物通过化合反应制备的化学方程式为______ 。
(4)红砖是用黏土高温烧结而成的,因其含有Fe2O3呈红色或棕红色而得名,常用作建筑材料。请设计一个简单实验证明红砖中含有Fe3+:_________________ 。
(5)现有一含有FeCl2 和FeCl3的混合物样品,实验测得n(Fe):n(C1)=1:2.1,则该样品中FeCl3的物质的量分数为_________ 。
(6)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为:____________ 。
(1)请写出Fe与水蒸气反应的化学方程式:
(2)在实验室中,FeCl2可用铁粉和
(3)Fe3O4可用多种方法制得,其中由一种单质和一种化合物通过化合反应制备的化学方程式为
(4)红砖是用黏土高温烧结而成的,因其含有Fe2O3呈红色或棕红色而得名,常用作建筑材料。请设计一个简单实验证明红砖中含有Fe3+:
(5)现有一含有FeCl2 和FeCl3的混合物样品,实验测得n(Fe):n(C1)=1:2.1,则该样品中FeCl3的物质的量分数为
(6)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为:
您最近一年使用:0次
8 . (1)向某NaOH溶液中投入一块Al箔,先无明显现象,随后逐渐产生气泡,则产生气泡的离子反应方程式为______ 。
(2)实验室常用还原性Fe粉与水蒸气反应的实验来研究Fe的还原性,则该反应的化学反应方程式为______
(3)Fe(OH)2制备时,采用的方法是“长滴管、液面下”的实验操作,但在实验时,由于操作不当,依旧会出现白色沉淀、灰绿色沉淀直至最终变为红褐色沉淀,写出白色沉淀最终转化为红褐色沉淀的化学反应方程式为______
(4)实验时制备Al(OH)3时,常用可溶性铝盐(如Al2(SO4)3与氨水反应进行制备。某课外小组在实验时不慎向Al2(SO4)3溶液中加入了过量NaOH溶液,最终并没有制出白色沉淀Al(OH)3,则该小组同学实验时发生的总离子反应方程式为____ 。
(2)实验室常用还原性Fe粉与水蒸气反应的实验来研究Fe的还原性,则该反应的化学反应方程式为
(3)Fe(OH)2制备时,采用的方法是“长滴管、液面下”的实验操作,但在实验时,由于操作不当,依旧会出现白色沉淀、灰绿色沉淀直至最终变为红褐色沉淀,写出白色沉淀最终转化为红褐色沉淀的化学反应方程式为
(4)实验时制备Al(OH)3时,常用可溶性铝盐(如Al2(SO4)3与氨水反应进行制备。某课外小组在实验时不慎向Al2(SO4)3溶液中加入了过量NaOH溶液,最终并没有制出白色沉淀Al(OH)3,则该小组同学实验时发生的总离子反应方程式为
您最近一年使用:0次
2017-03-01更新
|
502次组卷
|
3卷引用:山西省运城市景胜中学2019-2020学年高一12月月考化学试题
名校
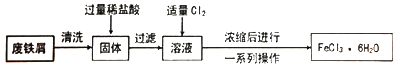
9 . 同学们在实验室里用废铁屑(含少量铜)制取FeCl3·6H2O的流程如下。
请回答下列问题。
(1)固体中加入过量稀盐酸时的现象是___________ 。
(2)溶液中通入Cl2时发生反应的化学方程式是______________ ,反应中Cl2表现出的性质是_________ ,此处的Cl2也可以用__________ 代替(填序号)。
A.H2O2 B.SO2 C.浓硫酸
(3)上述流程中由浓缩后的溶液获取FeCl3·6H2O的操作包括_____ 、过滤、洗涤。
(4)用FeCl3溶液制备Fe2O3,可向FeCl3溶液中滴加足量____________ ,然后过滤、洗涤、______ ,即可得到Fe2O3。
(5)FeCl3溶液能用作印制电路铜板的腐蚀液,FeCl3溶液与铜反应的离子方程式是______ ,反应一段时间后,取少量腐蚀液,向其中滴加_____ ,观察到_____ ,证明腐蚀液中任含Fe3+。此时腐蚀液中的金属阳离子是_______ 。

请回答下列问题。
(1)固体中加入过量稀盐酸时的现象是
(2)溶液中通入Cl2时发生反应的化学方程式是
A.H2O2 B.SO2 C.浓硫酸
(3)上述流程中由浓缩后的溶液获取FeCl3·6H2O的操作包括
(4)用FeCl3溶液制备Fe2O3,可向FeCl3溶液中滴加足量
(5)FeCl3溶液能用作印制电路铜板的腐蚀液,FeCl3溶液与铜反应的离子方程式是
您最近一年使用:0次
2017-02-27更新
|
270次组卷
|
2卷引用:2016-2017学年山西省太原市高一上学期期末考试化学试卷
10 . 铁、铜混合粉末20.0g加入到100mL 5.0 mol·L-1FeCl3溶液中,剩余固体质量为5.2g(忽略反应前后溶液体积变化)。求:
(1)反应后溶液中FeCl2的物质的量浓度_____________ mol·L-1
(2)原固体混合物中铜的质量分数是_____________
(1)反应后溶液中FeCl2的物质的量浓度
(2)原固体混合物中铜的质量分数是
您最近一年使用:0次
2017-02-23更新
|
338次组卷
|
3卷引用:山西省晋中市祁县中学校2020届高三上学期10月月考化学试题



