解题方法
1 . 如图所示,在玻璃管中放入还原铁粉和石棉绒的混合物,加热并通入水蒸气,用试管收集产生的经干燥的气体,并靠近酒精灯火焰。
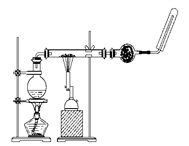
(1)所观察到的现象是____________________________________________________________ ,有关反应的化学方程式是______________
(2)干燥管内可装入的试剂是______________ ,其作用是___________________ ,干燥管还可用_____ (装置)代替。
(3)玻璃管中石棉绒的作用是______________________ 。实验开始时应先点燃____ ,实验结束时,应先熄灭_____ 。
(4)将红热的铁器浸入水中急速冷却(俗称“淬火”),在发出“嗞嗞”声响、产生大量气体的同时,铁器由红变黑,其表面黑色物质的化学式为_____________ 。

(1)所观察到的现象是
(2)干燥管内可装入的试剂是
(3)玻璃管中石棉绒的作用是
(4)将红热的铁器浸入水中急速冷却(俗称“淬火”),在发出“嗞嗞”声响、产生大量气体的同时,铁器由红变黑,其表面黑色物质的化学式为
您最近一年使用:0次
名校
2 . 某不纯铁片可能含有Mg、Al、Cu等金属杂质,取这种铁片5.6 g与足量的稀盐酸反应,得到0.2 g氢气,则该铁片中
| A.一定含金属镁 | B.一定含金属铝 |
| C.一定含金属铜 | D.一定同时含有四种金属 |
您最近一年使用:0次
2017-08-24更新
|
966次组卷
|
5卷引用:山西省忻州市第一中学2016-2017学年高一必修一:3.1.2金属的化学性质同步练习化学试题
3 . 若1.8g 某金属与足量的盐酸反应后,产生的H2在标准状况下体积为2.24L,则该金属为
| A.Al | B.Mg | C.Fe | D.Zn |
您最近一年使用:0次
名校
4 . 下列说法正确的是
| A.钠、铁均是银白色金属,熔点高,硬度大 |
| B.实验室中,通常将钠保存在四氯化碳中 |
| C.钠在空气中燃烧产生黄色火焰 |
| D.高温时,铁与水蒸气反应生成氧化铁与氢气 |
您最近一年使用:0次
2017-08-24更新
|
523次组卷
|
4卷引用:山西省忻州市第一中学2016-2017学年高一必修一:3.1.1金属的化学性质同步练习化学试题
名校
5 . 将5g含镁、锌和铁的三种金属的混和物投入到40mL稀硫酸中,恰好完全反应,产生的氢气在标况下是2.8L,则三种金属的物质的量之和为
| A.0.25mol | B.0.125mol |
| C.0.1mol | D.0.5mol |
您最近一年使用:0次
2017-08-24更新
|
1708次组卷
|
7卷引用:山西省忻州市第一中学2016-2017学年高一必修一:3 金属及其化合物 单元复习同步练习化学试题
2012·上海普陀·二模
名校
6 . 下列解释实验过程或事实的反应方程式不正确的是
A.熔融烧碱时,不能使用普通石英坩埚:SiO2+2NaOH Na2SiO3+H2O Na2SiO3+H2O |
| B.在海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+ H2O2+2H+= I2+O2↑+2H2O |
C.红热的铁丝与水接触,表面形成蓝黑色(或黑色)保护层:3Fe+ 4H2O(g) Fe3O4+4H2 Fe3O4+4H2 |
| D.“84消毒液”(有效成分NaClO)和“洁厕灵”(主要成分盐酸)混合使用放出氯气:ClO-+ Cl-+ 2H+= Cl2↑+H2O |
您最近一年使用:0次
2017-06-05更新
|
548次组卷
|
10卷引用:山西省实验中学2020届高三化学复习针对性试题集(六)
7 . (1)向某NaOH溶液中投入一块Al箔,先无明显现象,随后逐渐产生气泡,则产生气泡的离子反应方程式为______ 。
(2)实验室常用还原性Fe粉与水蒸气反应的实验来研究Fe的还原性,则该反应的化学反应方程式为______
(3)Fe(OH)2制备时,采用的方法是“长滴管、液面下”的实验操作,但在实验时,由于操作不当,依旧会出现白色沉淀、灰绿色沉淀直至最终变为红褐色沉淀,写出白色沉淀最终转化为红褐色沉淀的化学反应方程式为______
(4)实验时制备Al(OH)3时,常用可溶性铝盐(如Al2(SO4)3与氨水反应进行制备。某课外小组在实验时不慎向Al2(SO4)3溶液中加入了过量NaOH溶液,最终并没有制出白色沉淀Al(OH)3,则该小组同学实验时发生的总离子反应方程式为____ 。
(2)实验室常用还原性Fe粉与水蒸气反应的实验来研究Fe的还原性,则该反应的化学反应方程式为
(3)Fe(OH)2制备时,采用的方法是“长滴管、液面下”的实验操作,但在实验时,由于操作不当,依旧会出现白色沉淀、灰绿色沉淀直至最终变为红褐色沉淀,写出白色沉淀最终转化为红褐色沉淀的化学反应方程式为
(4)实验时制备Al(OH)3时,常用可溶性铝盐(如Al2(SO4)3与氨水反应进行制备。某课外小组在实验时不慎向Al2(SO4)3溶液中加入了过量NaOH溶液,最终并没有制出白色沉淀Al(OH)3,则该小组同学实验时发生的总离子反应方程式为
您最近一年使用:0次
2017-03-01更新
|
502次组卷
|
3卷引用:山西省运城市景胜中学2019-2020学年高一12月月考化学试题
名校
8 . 同学们在实验室里用废铁屑(含少量铜)制取FeCl3·6H2O的流程如下。
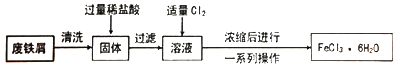
请回答下列问题。
(1)固体中加入过量稀盐酸时的现象是___________ 。
(2)溶液中通入Cl2时发生反应的化学方程式是______________ ,反应中Cl2表现出的性质是_________ ,此处的Cl2也可以用__________ 代替(填序号)。
A.H2O2 B.SO2 C.浓硫酸
(3)上述流程中由浓缩后的溶液获取FeCl3·6H2O的操作包括_____ 、过滤、洗涤。
(4)用FeCl3溶液制备Fe2O3,可向FeCl3溶液中滴加足量____________ ,然后过滤、洗涤、______ ,即可得到Fe2O3。
(5)FeCl3溶液能用作印制电路铜板的腐蚀液,FeCl3溶液与铜反应的离子方程式是______ ,反应一段时间后,取少量腐蚀液,向其中滴加_____ ,观察到_____ ,证明腐蚀液中任含Fe3+。此时腐蚀液中的金属阳离子是_______ 。

请回答下列问题。
(1)固体中加入过量稀盐酸时的现象是
(2)溶液中通入Cl2时发生反应的化学方程式是
A.H2O2 B.SO2 C.浓硫酸
(3)上述流程中由浓缩后的溶液获取FeCl3·6H2O的操作包括
(4)用FeCl3溶液制备Fe2O3,可向FeCl3溶液中滴加足量
(5)FeCl3溶液能用作印制电路铜板的腐蚀液,FeCl3溶液与铜反应的离子方程式是
您最近一年使用:0次
2017-02-27更新
|
270次组卷
|
2卷引用:2016-2017学年山西省太原市高一上学期期末考试化学试卷
名校
9 . 一定质量的铝铁合金溶于足量的NaOH溶液中,完全反应后产生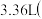 标准状况下)气体;用同样质量的铝铁合金完全溶于足量的盐酸中,在标准状况下产生
标准状况下)气体;用同样质量的铝铁合金完全溶于足量的盐酸中,在标准状况下产生 的气体,则该合金中铝、铁的物质的量之比为
的气体,则该合金中铝、铁的物质的量之比为
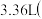 标准状况下)气体;用同样质量的铝铁合金完全溶于足量的盐酸中,在标准状况下产生
标准状况下)气体;用同样质量的铝铁合金完全溶于足量的盐酸中,在标准状况下产生 的气体,则该合金中铝、铁的物质的量之比为
的气体,则该合金中铝、铁的物质的量之比为| A.1∶1 | B.2∶5 | C.3∶2 | D.3∶5 |
您最近一年使用:0次
2017-02-24更新
|
743次组卷
|
12卷引用:山西省太原市第五中学2020-2021学年高一上学期12月阶段性检测化学试题
山西省太原市第五中学2020-2021学年高一上学期12月阶段性检测化学试题2016-2017学年安徽师大附中高一下学期入学考试理综化学试卷浙江省台州市书生中学2018-2019学年高二上学期第一次月考化学试题浙江省杭州市西湖高级中学2018-2019学年高二4月月考化学试题陕西省西安中学2019-2020学年高一12月月考化学试题高一必修第一册(苏教2019版)专题2 易错疑难集训(二)重庆市第二十九中学2020-2021学年高一上学期12月月考化学试题陕西省宝鸡市长岭中学2021-2022学年高一上学期12月月考化学试题云南省瑞丽市第一民族中学2021-2022学年高一下学期2月份开学测试化学试题陕西省西安市雁塔区第二中学2021-2022学年高一下学期第一次月考化学试题河南省驻马店市新蔡县第一高级中学2022-2023学年高三上学期11月月考化学试题海南省农垦中学2023-2024学年高一上学期期末考试化学试题(非重点班)
10 . 铁、铜混合粉末20.0g加入到100mL 5.0 mol·L-1FeCl3溶液中,剩余固体质量为5.2g(忽略反应前后溶液体积变化)。求:
(1)反应后溶液中FeCl2的物质的量浓度_____________ mol·L-1
(2)原固体混合物中铜的质量分数是_____________
(1)反应后溶液中FeCl2的物质的量浓度
(2)原固体混合物中铜的质量分数是
您最近一年使用:0次
2017-02-23更新
|
338次组卷
|
3卷引用:山西省晋中市祁县中学校2020届高三上学期10月月考化学试题



