名校
解题方法
1 . 室温下,某化学研究小组通过下列3组实验探究H2O2溶液的性质。
已知:①Cr最高价为 与
与 的反应为
的反应为 (深蓝色)。
(深蓝色)。
②H2O2溶液呈弱酸性。
根据实验操作和现象,下列有关推论错误的是
| 实验 | 实验操作和现象 |
| I | 向CrO3溶液中滴加少量0.1mol/LH2O2溶液,溶液变深蓝色 |
| II | 向2mL0.1mol/LH2O2溶液中滴加少量FeSO4溶液,溶液迅速变黄,稍后产生气体;再加入几滴KSCN溶液,溶液变红,一段时间后,溶液颜色明显变浅并逐渐褪色 |
| III | 向2mL0.01mol/LNaOH溶液中滴加少量酚酞,溶液变红,向其中滴加3~5滴0.01mol/LH2O2溶液,振荡,溶液逐渐褪色 |
 与
与 的反应为
的反应为 (深蓝色)。
(深蓝色)。②H2O2溶液呈弱酸性。
根据实验操作和现象,下列有关推论错误的是
| A.实验I中溶液变深蓝色,该反应为非氧化还原反应 |
| B.实验II中前一段溶液迅速变黄,稍后产生气体,体现了H2O2的氧化性,产生的Fe3+对H2O2分解起催化作用 |
| C.实验II中后一段溶液颜色明显变浅并逐渐褪色,说明H2O2能与KSCN反应 |
| D.实验III中溶液逐渐褪色,体现了H2O2的弱酸性 |
您最近一年使用:0次
2023-11-21更新
|
174次组卷
|
2卷引用:山东省普通高中2023-2024学年高三上学期11月联合质量测评大联考化学试题
2 . 下列实验方案、现象和结论都正确的是
| 实验方案 | 现象 | 结论 | |
| A | 往 溶液中加入Zn片 溶液中加入Zn片 | 短时间内无明显现象 |  的氧化能力比 的氧化能力比 弱 弱 |
| B | 取两份新制氯水,分别滴加 溶液和淀粉KI溶液 溶液和淀粉KI溶液 | 前者有白色沉淀,后者溶液变蓝色 | 氯气与水的反应存在限度 |
| C | 将食品脱氧剂样品中的还原铁粉溶于盐酸,滴加KSCN溶液 | 溶液呈浅绿色 | 食品脱氧剂样品中没有+3价铁 |
| D | 取少量 样品溶于蒸馏水,加足量稀盐酸,再加入足量 样品溶于蒸馏水,加足量稀盐酸,再加入足量 溶液 溶液 | 有白色沉淀生成 | 样品已经变质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
3 . 黄铁矿(主要成分为FeS2)的有效利用对环境具有重要意义。
(1)在酸性条件下催化氧化黄铁矿的物质转化关系如图所示。
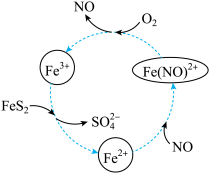
①图中转化过程的总反应中,FeS2作
②写出图中Fe3+与FeS2反应的离子方程式:
(2) Fe2+被氧化为Fe3+的过程中,控制起始时Fe2+的浓度、溶液体积和通入O2的速率不变,改变其他条件时,Fe2+被氧化的转化率随时间的变化如图所示(图中所示加入1mol是指相同微粒数)。
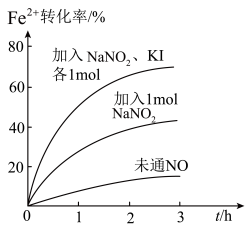
①加入NaNO2发生反应: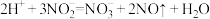 。该反应中若有6个
。该反应中若有6个 离子完全反应,转移
离子完全反应,转移
②加入NaNO2、KI发生反应: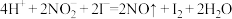 。解释图中该条件下能进一步提高单位时间内Fe2+转化率的原因:
。解释图中该条件下能进一步提高单位时间内Fe2+转化率的原因:
您最近一年使用:0次
2023-11-11更新
|
122次组卷
|
2卷引用:山东省青岛市第五十八中学2023-2024学年高一上学期10月月考化学试题
名校
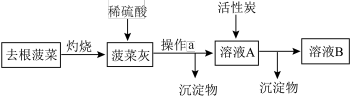
4 . 菠菜营养丰富,富含铁元素,主要以难溶的 形式存在,实验小组通过以下实验检验菠菜中的铁元素,下列说法错误的是
形式存在,实验小组通过以下实验检验菠菜中的铁元素,下列说法错误的是
 形式存在,实验小组通过以下实验检验菠菜中的铁元素,下列说法错误的是
形式存在,实验小组通过以下实验检验菠菜中的铁元素,下列说法错误的是
| A.灼烧在蒸发皿中进行 |
| B.操作a为过滤 |
| C.加入活性炭目的是吸附色素 |
D.取溶液B向其中加入适量 后,滴加KSCN溶液可检验铁元素 后,滴加KSCN溶液可检验铁元素 |
您最近一年使用:0次
2023-11-01更新
|
180次组卷
|
3卷引用:山东省滨州市沾化区实验高级中学2023-2024学年高三上学期第二次月考化学试题
名校
5 . 铁是人体不可缺少的微量元素,硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质,设计实验步骤如下:

(1)步骤①用到的玻璃仪器有___________
(2)步骤②加入氯水的目的是___________ ;若改为H2O2也能达到相同的目的,发生反应的离子方程式为___________ ;反应后所得溶液能溶解铜,写出发生反应的离子方程式___________ 。
(3)步骤④中一系列操作步骤为___________ 、洗涤、灼烧、冷却、称量。
(4)取补血剂药片研细,溶于 的硫酸中,过滤。取滤液加
的硫酸中,过滤。取滤液加___________ (填化学式)溶液,溶液变红说明该补血剂已变质。向变色后的溶液中加入橙汁,溶液红色褪去,再向褪色后的溶液中滴入FeCl3溶液,溶液又变为红色,说明橙汁中含具有___________ (填“氧化”或“还原”)性的物质。
(5)若实验无损耗,则该补血剂含铁元素的质量分数为___________ (用含m、n的式子表示)。

(1)步骤①用到的玻璃仪器有
(2)步骤②加入氯水的目的是
(3)步骤④中一系列操作步骤为
(4)取补血剂药片研细,溶于
 的硫酸中,过滤。取滤液加
的硫酸中,过滤。取滤液加(5)若实验无损耗,则该补血剂含铁元素的质量分数为
您最近一年使用:0次
名校
6 . 利用废铁屑(主要成分为Fe,还含有C、S、P等)制取高效净水剂K2FeO4,流程如图:

A.废铁屑酸溶后得到的溶液可用KSCN检验是否含有 |
B.步骤②中发生反应的离子方程式为 |
C.步骤③中每生成8.3gNa2FeO4转移 |
| D.步骤④中发生的反应类型为复分解反应 |
您最近一年使用:0次
2023-10-25更新
|
88次组卷
|
4卷引用:山东省东营市河口区第一高级中学2023-2024学年高一上学期10月月考(贯通班)化学试题
名校
7 . 5mL0.1mol·L-1FeCl3溶液与1mL0.1mol·L-1KI溶液发生反应: ,达到平衡。下列说法正确的是
,达到平衡。下列说法正确的是
 ,达到平衡。下列说法正确的是
,达到平衡。下列说法正确的是| A.加入四氯化碳,振荡,静置分层,下层为紫红色,表明该化学反应存在限度 |
| B.在溶液中加入KSCN,溶液呈血红色,表明该化学反应存在限度 |
| C.加入苯,振荡,平衡不移动 |
| D.向该平衡体系中加水,平衡逆向移动 |
您最近一年使用:0次
2023-10-17更新
|
31次组卷
|
3卷引用:山东学情2023-2024学年高二上学期10月质量检测(鲁科版)化学试题
名校
8 . A、B、C、W均为中学常见的纯净物,它们之间有如下转化关系(其他产物及反应条件已略去,反应可以在水溶液中进行)。
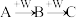
(1)若A为有刺激性气味的气体,其水溶液呈碱性;C为红棕色气体,与水反应生成一元强酸D,D具有强氧化性。
①实验室制取气体A的化学方程式___________ ;
②写出A→B的化学方程式为___________ ;
③室温时,在容积为amL的试管中充满C气体,然后倒置在水中到管内水面不再上升时为止;再通入bmLW,则管内液面又继续上升,测得试管内最后剩余气体为cmL,且该气体不支持燃烧。则a、b、c的关系是___________ 。
(2)若A、B、C的溶液均显碱性,焰色试验均呈黄色;C常作面包和糕点的发泡剂,受热分解可生成B。

向两份60mL同浓度的A溶液中通入不同体积的W气体,得到溶液M、N。向M、N溶液中逐滴加入浓度为0.25mol/L盐酸,如图所示I和Ⅱ分别为加入V(盐酸)与产生V(W)的关系。M、N两溶液中相同溶质的物质的量之比为___________ 。
(3)若W是应用最广泛的金属,写出B→C反应的离子方程式为___________ ,检验C溶液中阳离子的操作及现象___________ 。
(1)若A为有刺激性气味的气体,其水溶液呈碱性;C为红棕色气体,与水反应生成一元强酸D,D具有强氧化性。
①实验室制取气体A的化学方程式
②写出A→B的化学方程式为
③室温时,在容积为amL的试管中充满C气体,然后倒置在水中到管内水面不再上升时为止;再通入bmLW,则管内液面又继续上升,测得试管内最后剩余气体为cmL,且该气体不支持燃烧。则a、b、c的关系是
(2)若A、B、C的溶液均显碱性,焰色试验均呈黄色;C常作面包和糕点的发泡剂,受热分解可生成B。

向两份60mL同浓度的A溶液中通入不同体积的W气体,得到溶液M、N。向M、N溶液中逐滴加入浓度为0.25mol/L盐酸,如图所示I和Ⅱ分别为加入V(盐酸)与产生V(W)的关系。M、N两溶液中相同溶质的物质的量之比为
(3)若W是应用最广泛的金属,写出B→C反应的离子方程式为
您最近一年使用:0次
9 . 化学实验小组从印刷电路板废液(含FeCl3、FeCl2、CuCl2)中回收铜并重新获得FeCl3•6H2O晶体的流程如图:
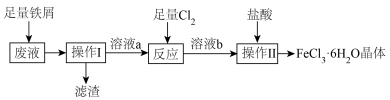
回答下列问题:
(1)检验腐蚀废液中含有Fe3+常用试剂是________ 。
(2)有同学建议,使用H2O2和盐酸代替Cl2以减少污染,则反应离子方程式________ 。
(3)甲同学用酸性KMnO4溶液检测溶液b中是否含有Fe2+。乙同学认为甲的方案不正确,理由是_______ (用离子方程式表示)。
(4)操作Ⅱ有五步:________ 、________ 、________ 、洗涤、干燥。加盐酸的目的是防止加热时溶液b与沸水的反应,写出要防止发生的反应的方程式________ 。

回答下列问题:
(1)检验腐蚀废液中含有Fe3+常用试剂是
(2)有同学建议,使用H2O2和盐酸代替Cl2以减少污染,则反应离子方程式
(3)甲同学用酸性KMnO4溶液检测溶液b中是否含有Fe2+。乙同学认为甲的方案不正确,理由是
(4)操作Ⅱ有五步:
您最近一年使用:0次
名校
10 . 工业上利用硫铁矿烧渣(主要成分为 、FeO、
、FeO、 等)为原料制备高档颜料铁红(
等)为原料制备高档颜料铁红( ),具体生产流程如下:
),具体生产流程如下:
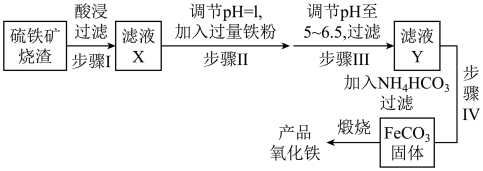
试回答下列问题:
(1)滤液X中含有的金属阳离子是___________ (填离子符号)。
(2)①步骤Ⅱ加入过量铁粉的目的是将___________ 。
②步骤Ⅲ中可选用___________ (填字母)调节溶液的pH。
a.次氯酸钙 b.氨水 c.氢氧化钠溶液 d.高锰酸钾溶液
(3)步骤Ⅳ加入 时的离子方程式:
时的离子方程式:___________ 。
(4)在空气中煅烧 生成产品氧化铁的化学方程式为
生成产品氧化铁的化学方程式为___________ 。
 、FeO、
、FeO、 等)为原料制备高档颜料铁红(
等)为原料制备高档颜料铁红( ),具体生产流程如下:
),具体生产流程如下:
试回答下列问题:
(1)滤液X中含有的金属阳离子是
(2)①步骤Ⅱ加入过量铁粉的目的是将
②步骤Ⅲ中可选用
a.次氯酸钙 b.氨水 c.氢氧化钠溶液 d.高锰酸钾溶液
(3)步骤Ⅳ加入
 时的离子方程式:
时的离子方程式:(4)在空气中煅烧
 生成产品氧化铁的化学方程式为
生成产品氧化铁的化学方程式为
您最近一年使用:0次



