名校
1 . 聚合硫酸铁[Fex(OH)y(SO4)z]是高效水处理剂(Fe为+3价)。实验室用某冶金厂的废渣(主要成分为Fe2O3、Al2O3和少量SiO2)制备聚合硫酸铁的流程如下:___________ 。
(2)不同金属离子生成氢氧化物沉淀时开始沉淀、完全沉淀的pH如下表所示:
①沉铝时应控制溶液pH的范围是___________ 。
②写出沉铝时反应的离子方程式:___________ 。
③“沉铝”前先加入铁粉进行“还原”的目的是___________ 。
(3)聚合硫酸铁[Fex(OH)y(SO4)z]的组成可通过下列实验步骤测定:
a.称取一定质量的聚合硫酸铁溶于稀盐酸中,往所得溶液中滴加BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体23.30g;
b.另称取与步骤a等质量的聚合硫酸铁溶于稀硫酸中,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并,用0.500mol·L-1的KMnO4溶液滴定至终点,消耗KMnO4溶液32.00mL。试回答:
①步骤b加入铜粉发生反应的离子方程式:___________ 。
②步骤b中KMnO4溶液滴定时发生反应的离子方程式为___________ 。
③若步骤b“洗涤”不充分,则将导致实验测得Fex(OH)y(SO4)z中y:z___________ (填“偏大”或“不变”或“偏小”)。
④通过计算确定该聚合硫酸铁的化学式___________ 。
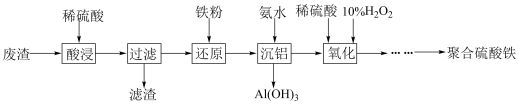
(2)不同金属离子生成氢氧化物沉淀时开始沉淀、完全沉淀的pH如下表所示:
| 金属阳离子 | Fe2+ | Fe3+ | Al3+ |
| 开始沉淀时的pH | 6.5 | 1.5 | 3.3 |
| 完全沉淀时的pH | 9.7 | 3.2 | 5.2 |
②写出沉铝时反应的离子方程式:
③“沉铝”前先加入铁粉进行“还原”的目的是
(3)聚合硫酸铁[Fex(OH)y(SO4)z]的组成可通过下列实验步骤测定:
a.称取一定质量的聚合硫酸铁溶于稀盐酸中,往所得溶液中滴加BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体23.30g;
b.另称取与步骤a等质量的聚合硫酸铁溶于稀硫酸中,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并,用0.500mol·L-1的KMnO4溶液滴定至终点,消耗KMnO4溶液32.00mL。试回答:
①步骤b加入铜粉发生反应的离子方程式:
②步骤b中KMnO4溶液滴定时发生反应的离子方程式为
③若步骤b“洗涤”不充分,则将导致实验测得Fex(OH)y(SO4)z中y:z
④通过计算确定该聚合硫酸铁的化学式
您最近一年使用:0次
解题方法
2 . 某学习小组欲利用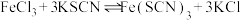 平衡体系探究影响平衡的因素,将
平衡体系探究影响平衡的因素,将
 溶液和
溶液和 溶液混合,得血红色溶液X,进行下列实验:
溶液混合,得血红色溶液X,进行下列实验:
实验Ⅰ.改变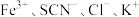 等离子浓度对平衡的影响
等离子浓度对平衡的影响
(1)取 溶液X,加入5滴
溶液X,加入5滴 溶液,得到溶液A;另取
溶液,得到溶液A;另取 溶液X,插入经砂纸打磨过的铁丝得到溶液B,A、B两溶液颜更深的是
溶液X,插入经砂纸打磨过的铁丝得到溶液B,A、B两溶液颜更深的是___________ (填A或B)。原因是:___________ 。
(2)取 溶液X,加入5滴
溶液X,加入5滴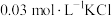 溶液,观察到溶液红色变浅,产生该现象的原因可能是:①
溶液,观察到溶液红色变浅,产生该现象的原因可能是:①___________ 对平衡产生了影响;②不直接参与平衡体系的 或
或 对平衡产生了影响。
对平衡产生了影响。
实验Ⅱ.为了探究KCl对 平衡体系的影响某学习小组同学进行如下探究:各取
平衡体系的影响某学习小组同学进行如下探究:各取 溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。
溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。
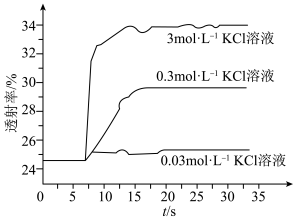
(3)上述实验可以得到以下结论:一是KCl对 平衡有影响,且KCl浓度越大,影响
平衡有影响,且KCl浓度越大,影响___________ 移动(填“正向、逆向或不”)。
(4)针对产生上述影响的可能原因,学习小组同学提出以下猜想:
猜想①: 产生的影响。
产生的影响。
猜想②: 产生的影响。
产生的影响。
猜想③:___________ 。
实验Ⅲ.探究盐对 和
和 平衡体系产生的影响资料信息:
平衡体系产生的影响资料信息:
a.溶液中的 离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。
离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。
b.在 溶液中存在反应
溶液中存在反应 。
。
(5)根据上述信息,学习小组同学各取 溶液X,分别加入5滴①去离子水、②
溶液X,分别加入5滴①去离子水、②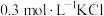 溶液、③
溶液、③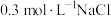 溶液、④
溶液、④ 溶液、⑤
溶液、⑤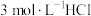 溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
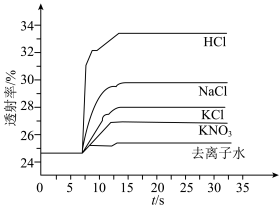
上述实验能证明阳离子盐效应影响 平衡体系的实验组是
平衡体系的实验组是___________ 。盐效应影响较大的阳离子是___________ 。
A.实验①②③ B.实验①②④ C.实验①③④
(6)已知 对平衡没有明显的影响,解释出现实验⑤现象的原因:
对平衡没有明显的影响,解释出现实验⑤现象的原因:___________ 。
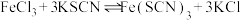 平衡体系探究影响平衡的因素,将
平衡体系探究影响平衡的因素,将
 溶液和
溶液和 溶液混合,得血红色溶液X,进行下列实验:
溶液混合,得血红色溶液X,进行下列实验:实验Ⅰ.改变
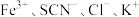 等离子浓度对平衡的影响
等离子浓度对平衡的影响(1)取
 溶液X,加入5滴
溶液X,加入5滴 溶液,得到溶液A;另取
溶液,得到溶液A;另取 溶液X,插入经砂纸打磨过的铁丝得到溶液B,A、B两溶液颜更深的是
溶液X,插入经砂纸打磨过的铁丝得到溶液B,A、B两溶液颜更深的是(2)取
 溶液X,加入5滴
溶液X,加入5滴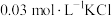 溶液,观察到溶液红色变浅,产生该现象的原因可能是:①
溶液,观察到溶液红色变浅,产生该现象的原因可能是:① 或
或 对平衡产生了影响。
对平衡产生了影响。实验Ⅱ.为了探究KCl对
 平衡体系的影响某学习小组同学进行如下探究:各取
平衡体系的影响某学习小组同学进行如下探究:各取 溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。
溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。
(3)上述实验可以得到以下结论:一是KCl对
 平衡有影响,且KCl浓度越大,影响
平衡有影响,且KCl浓度越大,影响(4)针对产生上述影响的可能原因,学习小组同学提出以下猜想:
猜想①:
 产生的影响。
产生的影响。 猜想②:
 产生的影响。
产生的影响。 猜想③:
实验Ⅲ.探究盐对
 和
和 平衡体系产生的影响资料信息:
平衡体系产生的影响资料信息:a.溶液中的
 离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。
离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。b.在
 溶液中存在反应
溶液中存在反应 。
。(5)根据上述信息,学习小组同学各取
 溶液X,分别加入5滴①去离子水、②
溶液X,分别加入5滴①去离子水、②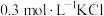 溶液、③
溶液、③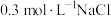 溶液、④
溶液、④ 溶液、⑤
溶液、⑤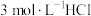 溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
上述实验能证明阳离子盐效应影响
 平衡体系的实验组是
平衡体系的实验组是A.实验①②③ B.实验①②④ C.实验①③④
(6)已知
 对平衡没有明显的影响,解释出现实验⑤现象的原因:
对平衡没有明显的影响,解释出现实验⑤现象的原因:
您最近一年使用:0次
3 . 铟是一种稀有贵金属,广泛应用于航空航天、太阳能电池等高科技领域。从高铟灰渣(主要含PbO、SiO2、FeAsO4·2H2O、In2O3)中提取铟的工艺流程如下:

已知:FeS4O6为强电解质;P2O4为磷酸二异辛酯;Ksp[In(OH)3]=1.4×10-33。回答下列问题:
(1)FeAsO4·2H2O中铁元素化合价为+3价,As的化合价为___________ 。Fe3+的价层电子排布式___________ 。
(2)“硫酸化焙烧”后金属元素均以硫酸盐的形式存在。在其他条件一定时,“水浸”铟、铁的萃取率结果如图所示,则萃取所采用的最佳条件为:萃取时间___________ ,萃取温度___________ 。
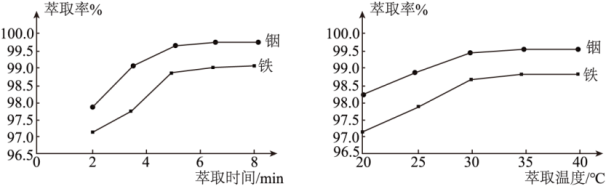
(3)“水浸”时,浸渣除了As2O3外,还含有___________ 。
(4)“还原铁”时反应的离子方程式为___________ 。
(5)“萃取除铁”时,用30%的P2O4作萃取剂时,发现当溶液pH >1.5后,铟萃取率随pH值的升高而下降,原因是___________ 。
(6)“萃取”过程中用酸(用H2A2表示)作萃取剂,使In3+进入有机相,发生反应:In3++3H2A2 In(HA2)3+3H+,平衡常数为K。已知c(H+)与萃取率(E%)的关系符合公式:
In(HA2)3+3H+,平衡常数为K。已知c(H+)与萃取率(E%)的关系符合公式: 。当pH = 2.30 时,萃取率为50%,若将萃取率提升到95%,应调节溶液的pH=
。当pH = 2.30 时,萃取率为50%,若将萃取率提升到95%,应调节溶液的pH=___________ (已知lg19 =1.28,忽略萃取剂浓度的变化,结果保留三位有效数字)。
(7)立方晶系CuInSe2的晶胞结构如图所示,晶胞参数如图。CuInSe2的相对分子质量为M,则该晶体密度ρ=___________ g·cm-3(用含M、NA的式子表示),与In原子最近且距离相等的Se原子个数为___________ 。
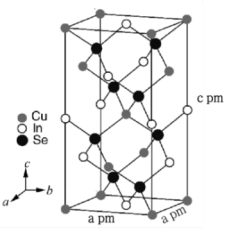

已知:FeS4O6为强电解质;P2O4为磷酸二异辛酯;Ksp[In(OH)3]=1.4×10-33。回答下列问题:
(1)FeAsO4·2H2O中铁元素化合价为+3价,As的化合价为
(2)“硫酸化焙烧”后金属元素均以硫酸盐的形式存在。在其他条件一定时,“水浸”铟、铁的萃取率结果如图所示,则萃取所采用的最佳条件为:萃取时间

(3)“水浸”时,浸渣除了As2O3外,还含有
(4)“还原铁”时反应的离子方程式为
(5)“萃取除铁”时,用30%的P2O4作萃取剂时,发现当溶液pH >1.5后,铟萃取率随pH值的升高而下降,原因是
(6)“萃取”过程中用酸(用H2A2表示)作萃取剂,使In3+进入有机相,发生反应:In3++3H2A2
 In(HA2)3+3H+,平衡常数为K。已知c(H+)与萃取率(E%)的关系符合公式:
In(HA2)3+3H+,平衡常数为K。已知c(H+)与萃取率(E%)的关系符合公式: 。当pH = 2.30 时,萃取率为50%,若将萃取率提升到95%,应调节溶液的pH=
。当pH = 2.30 时,萃取率为50%,若将萃取率提升到95%,应调节溶液的pH=(7)立方晶系CuInSe2的晶胞结构如图所示,晶胞参数如图。CuInSe2的相对分子质量为M,则该晶体密度ρ=

您最近一年使用:0次
2024-01-28更新
|
394次组卷
|
2卷引用:福建省厦门双十中学2024届高三模拟预测化学试题
4 . 三草酸合铁酸钾晶体K3[Fe(C2O4)3]·3H2O(M=491g/mol)是一种感光剂和高效的污水处理剂。
I.某研究小组同学查阅资料发现K3[Fe(C2O4)3]·3H2O加热后会分解产生CO和CO2,于是设计了如下实验进行验证。请回答:
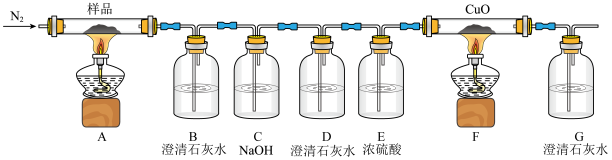
(1)C中NaOH溶液的作用为___________ ;D中澄清石灰水作用为___________ 。
(2)证明有CO产生的现象为___________ 。
(3)该装置还存在的缺陷是___________ 。
II.制备K3[Fe(C2O4)3]·3H2O的途径如下,请回答下列问题:
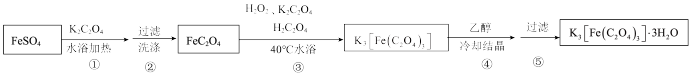
研究小组通过查阅资料得知:
a.K3[Fe(C2O4)3]·3H2O对光敏感,易溶于水,难溶于乙醇;
b.很多草酸盐(例如CaC2O4、BaC2O4)难溶于水,但能溶解于稀硝酸。
(4)步骤③中,控制水浴温度不能超过40℃的原因为___________ 。
(5)研究小组的同学对K3[Fe(C2O4)3]组成有两种看法,分别为:
甲同学:K3[Fe(C2O4)3]由K+、Fe3+、 构成;
构成;
乙同学:K3[Fe(C2O4)3]由K+、[Fe(C2O4)3]3-构成。
请设计实验,验证哪位同学的说法是正确的:___________ 。
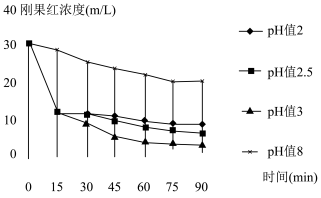
(6)K3[Fe(C2O4)3]联合H2O2体系可用于降解染料,一定浓度的该混合溶液,在不同pH条件下降解刚果红的效率如图所示,在实际应用过程中,应选择pH=___________ 。
(7)关于制备流程,下列说法正确的是___________。
(8)制得的K3[Fe(C2O4)3]·3H2O含少量FeC2O4·2H2O,为测定其纯度,进行如下实验:
步骤I:称取5.000g三草酸合铁酸钾晶体,配制成1.000L溶液,固体完全溶解。
步骤II:取20.00mL溶液,与0.1000molL-酸性KMnO4溶液反应,消耗2.46mL。
步骤III:另取20.00mL溶液,加入过量铜粉,过滤,洗涤,将滤液和洗涤液合并。
步骤IV:将合并液与0.1000mol/L酸性KMnO4溶液反应,消耗2.86mL。
已知 与
与 的反应为(未配平):
的反应为(未配平): +
+ +H+→CO2↑+Mn2++H2O
+H+→CO2↑+Mn2++H2O
①写出Fe2+与酸性KMnO4溶液反应的离子方程式:___________ 。
②研究小组制得的K3[Fe(C2O4)3]·3H2O纯度为___________ 。
I.某研究小组同学查阅资料发现K3[Fe(C2O4)3]·3H2O加热后会分解产生CO和CO2,于是设计了如下实验进行验证。请回答:

(1)C中NaOH溶液的作用为
(2)证明有CO产生的现象为
(3)该装置还存在的缺陷是
II.制备K3[Fe(C2O4)3]·3H2O的途径如下,请回答下列问题:

研究小组通过查阅资料得知:
a.K3[Fe(C2O4)3]·3H2O对光敏感,易溶于水,难溶于乙醇;
b.很多草酸盐(例如CaC2O4、BaC2O4)难溶于水,但能溶解于稀硝酸。
(4)步骤③中,控制水浴温度不能超过40℃的原因为
(5)研究小组的同学对K3[Fe(C2O4)3]组成有两种看法,分别为:
甲同学:K3[Fe(C2O4)3]由K+、Fe3+、
 构成;
构成;乙同学:K3[Fe(C2O4)3]由K+、[Fe(C2O4)3]3-构成。
请设计实验,验证哪位同学的说法是正确的:
(6)K3[Fe(C2O4)3]联合H2O2体系可用于降解染料,一定浓度的该混合溶液,在不同pH条件下降解刚果红的效率如图所示,在实际应用过程中,应选择pH=

(7)关于制备流程,下列说法正确的是___________。
| A.步骤①为复分解反应,步骤③为氧化还原反应 |
| B.步骤②判断沉淀是否洗涤干净,可以取少量最后一次洗涤液,加入氯化钡溶液,观察是否有白色沉淀产生 |
| C.步骤④,加入乙醇目的在于降低K3[Fe(C2O4)3]的溶解度,使其结晶析出 |
| D.步骤④⑤可以在日光下进行 |
(8)制得的K3[Fe(C2O4)3]·3H2O含少量FeC2O4·2H2O,为测定其纯度,进行如下实验:
步骤I:称取5.000g三草酸合铁酸钾晶体,配制成1.000L溶液,固体完全溶解。
步骤II:取20.00mL溶液,与0.1000molL-酸性KMnO4溶液反应,消耗2.46mL。
步骤III:另取20.00mL溶液,加入过量铜粉,过滤,洗涤,将滤液和洗涤液合并。
步骤IV:将合并液与0.1000mol/L酸性KMnO4溶液反应,消耗2.86mL。
已知
 与
与 的反应为(未配平):
的反应为(未配平): +
+ +H+→CO2↑+Mn2++H2O
+H+→CO2↑+Mn2++H2O①写出Fe2+与酸性KMnO4溶液反应的离子方程式:
②研究小组制得的K3[Fe(C2O4)3]·3H2O纯度为
您最近一年使用:0次
名校
5 . I.某化学兴趣小组用如图装置制备 并探究其性质。
并探究其性质。
i. 酸性条件下与
酸性条件下与 迅速反应生成S和
迅速反应生成S和
ii. 有较强的还原性
有较强的还原性
(1)装置A中a的作用是_____________________________ ;
(2)上述装置中存在一处缺陷,会干扰 和
和 性质的探究,改进的方法是
性质的探究,改进的方法是_________________ 。
(3)改进实验装置后,B中 被氧化为
被氧化为 ,写出该反应的离子方程式
,写出该反应的离子方程式_________________________ 。
(4)装置C中溶液颜色先变为血红色,一段时间后褪色。
①用离子方程式表示C中溶液变红色的原因____________________________ 、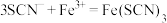 。
。
②某同学对褪色原因提出假设:
假设1: 被
被 氧化为更高价态;
氧化为更高价态;
假设2: 被
被 氧化为更高价态。
氧化为更高价态。
为进一步探究,该同学取装置C褪色后的溶液少许于试管中,加入____________________________ ,若出现____________________________ 现象,则说明假设2成立。
II.有两组化学兴趣小组同学对、 、
、 、
、 的性质及其之间的反应进行探究。回答下列问题:
的性质及其之间的反应进行探究。回答下列问题:
(5)甲组同学探究溶液 对
对 稳定性的影响,得到如图所示结果,则增强
稳定性的影响,得到如图所示结果,则增强 稳定性的措施为
稳定性的措施为______________________________ 。 与
与 的反应,进行如图所示实验:
的反应,进行如图所示实验: 与
与 反应的离子方程式为
反应的离子方程式为______________________________ 。
为了探究白色沉淀产生的原因,同学们查阅资料得知:
i. 是难溶于水的白色固体;
是难溶于水的白色固体;
ii. 的化学性质与
的化学性质与 相似;
相似;
iii.
填写实验方案:
②步骤2的空格中填写的数据为___________________ 。
③ 与
与 反应的离子方程式为
反应的离子方程式为____________________________________ 。
 并探究其性质。
并探究其性质。
i.
 酸性条件下与
酸性条件下与 迅速反应生成S和
迅速反应生成S和
ii.
 有较强的还原性
有较强的还原性(1)装置A中a的作用是
(2)上述装置中存在一处缺陷,会干扰
 和
和 性质的探究,改进的方法是
性质的探究,改进的方法是(3)改进实验装置后,B中
 被氧化为
被氧化为 ,写出该反应的离子方程式
,写出该反应的离子方程式(4)装置C中溶液颜色先变为血红色,一段时间后褪色。
①用离子方程式表示C中溶液变红色的原因
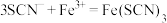 。
。②某同学对褪色原因提出假设:
假设1:
 被
被 氧化为更高价态;
氧化为更高价态;假设2:
 被
被 氧化为更高价态。
氧化为更高价态。为进一步探究,该同学取装置C褪色后的溶液少许于试管中,加入
II.有两组化学兴趣小组同学对、
 、
、 、
、 的性质及其之间的反应进行探究。回答下列问题:
的性质及其之间的反应进行探究。回答下列问题:(5)甲组同学探究溶液
 对
对 稳定性的影响,得到如图所示结果,则增强
稳定性的影响,得到如图所示结果,则增强 稳定性的措施为
稳定性的措施为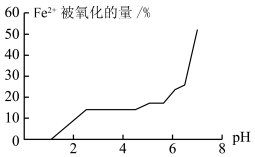
 与
与 的反应,进行如图所示实验:
的反应,进行如图所示实验:
 与
与 反应的离子方程式为
反应的离子方程式为为了探究白色沉淀产生的原因,同学们查阅资料得知:
i.
 是难溶于水的白色固体;
是难溶于水的白色固体;ii.
 的化学性质与
的化学性质与 相似;
相似;iii.

填写实验方案:
实验方案 | 实验现象 |
步骤1:取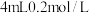 的 的 溶液,向其中滴加3滴 溶液,向其中滴加3滴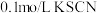 溶液 溶液 | 无明显现象 |
步骤2:取 的 的 溶液,向其中滴加3滴 溶液,向其中滴加3滴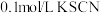 溶液 溶液 | 产生白色沉淀 |
③
 与
与 反应的离子方程式为
反应的离子方程式为
您最近一年使用:0次
2024-01-13更新
|
163次组卷
|
4卷引用:福建省厦门第一中学2023-2024学年高一上学期12月月考化学试题
名校
解题方法
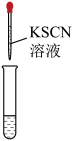
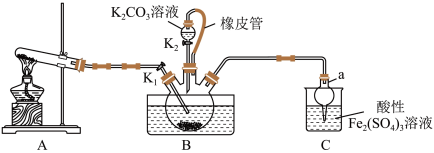
6 . 硫氰化钾(KSCN)是一种用途广泛的化工原料,常用于染料、药物的生产。实验小组设计如图实验装置模拟工业制备 KSCN 并进行相关探究实验。___________ 。
(2)装置A用于实验室制备氨气,反应的化学方程式为___________ 。
(3)装置B中,三颈烧瓶内盛放有 CS₂、水和固体催化剂,通入氨气的导管口需要浸没在 CS₂液体中,其目的是___________ (写两点)。
(4)KSCN 溶液的制备:实验开始时打开K₁,加热装置A、D,待三颈烧瓶内液体不分层后,熄灭装置A处的酒精灯,关闭K₁,移开水浴。将装置B继续加热至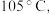 待 NH₄HS 完全分解后(
待 NH₄HS 完全分解后(  打开 K₂,缓缓滴入适量的)
打开 K₂,缓缓滴入适量的)  溶液,继续加热有气泡产生,制得KSCN 溶液,该反应的化学方程式是
溶液,继续加热有气泡产生,制得KSCN 溶液,该反应的化学方程式是___________ 。
(5)尾气处理:装置C 中仪器a的名称是___________ ,酸性Fe₂(SO₄)₃溶液用于除去尾气中两种污染性气体,其中一种气体M能使酚酞溶液变红,另一种气体N能使溶液产生淡黄色沉淀,写出除去气体N的离子方程式___________ 。
(6)过滤装置C中吸收尾气后的悬浊液,得到滤液x。取少量滤液x进行如图实验[已知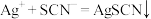 (白色)]:
(白色)]:___________ [可供选择的试剂: 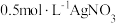 溶液、
溶液、 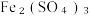 溶液、
溶液、 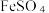 溶液、
溶液、  溶液]。
溶液]。

(2)装置A用于实验室制备氨气,反应的化学方程式为
(3)装置B中,三颈烧瓶内盛放有 CS₂、水和固体催化剂,通入氨气的导管口需要浸没在 CS₂液体中,其目的是
(4)KSCN 溶液的制备:实验开始时打开K₁,加热装置A、D,待三颈烧瓶内液体不分层后,熄灭装置A处的酒精灯,关闭K₁,移开水浴。将装置B继续加热至
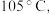 待 NH₄HS 完全分解后(
待 NH₄HS 完全分解后(  打开 K₂,缓缓滴入适量的)
打开 K₂,缓缓滴入适量的)  溶液,继续加热有气泡产生,制得KSCN 溶液,该反应的化学方程式是
溶液,继续加热有气泡产生,制得KSCN 溶液,该反应的化学方程式是(5)尾气处理:装置C 中仪器a的名称是
(6)过滤装置C中吸收尾气后的悬浊液,得到滤液x。取少量滤液x进行如图实验[已知
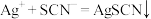 (白色)]:
(白色)]: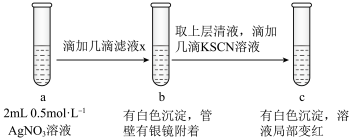
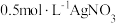 溶液、
溶液、 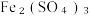 溶液、
溶液、 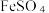 溶液、
溶液、  溶液]。
溶液]。
您最近一年使用:0次
名校
7 . 实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速反应产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

①A为氯气发生装置,其中装有浓盐酸的仪器名称为______ 。
②除杂装置B中盛装的试剂为________ 。
③C中有多个反应发生,其中生成高铁酸钾的化学反应方程式为_________ 。
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
I.由方案I中溶液变红可知a中含有______ 离子,但该离子的产生不能判断一定是K2FeO4将Cl—氧化,该离子还可能由反应_______ 产生(用离子方程式表示)。
II.方案II可证明K2FeO4氧化Cl—,用KOH溶液洗涤的目的是排除______ 的干扰。
②根据K2FeO4的制备实验得出:氧化性Cl2______ FeO (填“>”或“<”),而方案II实验表明,Cl2和FeO
(填“>”或“<”),而方案II实验表明,Cl2和FeO 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是_______ 。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速反应产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

①A为氯气发生装置,其中装有浓盐酸的仪器名称为
②除杂装置B中盛装的试剂为
③C中有多个反应发生,其中生成高铁酸钾的化学反应方程式为
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
| 方案I | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案II | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b,取少量b,滴加盐酸,有Cl2产生。 |
II.方案II可证明K2FeO4氧化Cl—,用KOH溶液洗涤的目的是排除
②根据K2FeO4的制备实验得出:氧化性Cl2
 (填“>”或“<”),而方案II实验表明,Cl2和FeO
(填“>”或“<”),而方案II实验表明,Cl2和FeO 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是
您最近一年使用:0次
名校
8 . 超细银粉在光学、生物医疗等领域有着广阔的应用前景。由含银废催化剂制备超细银粉的过程如下:

资料:①含银废催化剂成分:主要含 、
、 及少量
及少量 、
、 、
、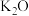 、
、 等。
等。
② 为载体,且不溶于硝酸。
为载体,且不溶于硝酸。
下列说法错误的是

资料:①含银废催化剂成分:主要含
 、
、 及少量
及少量 、
、 、
、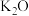 、
、 等。
等。②
 为载体,且不溶于硝酸。
为载体,且不溶于硝酸。下列说法错误的是
A.过程I中,得到的滤渣的主要成分是: 、 、 |
B.过程Ⅱ中,检验沉淀表面的 已洗涤干净的试剂可以用KSCN溶液 已洗涤干净的试剂可以用KSCN溶液 |
| C.过程Ⅳ中,发生反应的氧化剂和还原剂物质的量之比为1:4 |
| D.过程Ⅴ可以利用电能转化为化学能的装置去实现 |
您最近一年使用:0次
2023-07-29更新
|
1393次组卷
|
6卷引用:福建省莆田第六中学2023-2024学年高三上学期1月质检模拟考化学试题
福建省莆田第六中学2023-2024学年高三上学期1月质检模拟考化学试题福建省福清西山学校2023-2024学年高三上学期12月月考化学试题河北省保定市2022-2023学年高三上学期1月期末考试化学试题吉林省长春市东北师范大学附属中学2023-2024学年高三上学期9月一模化学试题(已下线)题型07 化学实验基础(选择题)-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)安徽省六安第一中学2023-2024学年高三上学期12月月考化学试题
名校
解题方法
9 . 某补铁剂的主要成分是硫酸亚铁( ),说明书中建议“本品与维生素C同服”。为探究其原理,用放置7天的
),说明书中建议“本品与维生素C同服”。为探究其原理,用放置7天的 溶液(pH略大于3)进行下列实验。
溶液(pH略大于3)进行下列实验。
资料:维生素C( )又称抗坏血酸,将溶于水,其溶液呈酸性
)又称抗坏血酸,将溶于水,其溶液呈酸性
Ⅰ.检验铁元素的价态
(1)ⅰ中观察到_____________ ,说明溶液中存在 。由ⅱ中溶液近乎无色可以推测维生素C与
。由ⅱ中溶液近乎无色可以推测维生素C与 发生了反应:
发生了反应: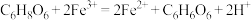 ,该反应的还原剂是
,该反应的还原剂是_____________ 。
(2)ⅰ中与 溶液滴加KSCN溶液后变浅红色相关的2个离子反应方程式为
溶液滴加KSCN溶液后变浅红色相关的2个离子反应方程式为__________ 。
(3)经分析ⅱ中检验方案不严谨,应考虑pH对反应的影响,依据是_______________ 。
Ⅱ.探究pH对ⅱ中反应的影响
补充实验如下,继续探究pH对ⅱ中反应的影响。
(4)试剂a为_____________ ,由实验现象可得结论:pH对 与SCN的显色反应有影响。
与SCN的显色反应有影响。
(5)分析实验ⅰ~ⅲ,下列说法合理的是_____________ (填序号)。
a.维生素C具有氧化性和酸性
b.同服维生素C可减缓补铁剂中 被氧化
被氧化
c.使用KSCN检验 时,宜先将溶液酸化
时,宜先将溶液酸化
 ),说明书中建议“本品与维生素C同服”。为探究其原理,用放置7天的
),说明书中建议“本品与维生素C同服”。为探究其原理,用放置7天的 溶液(pH略大于3)进行下列实验。
溶液(pH略大于3)进行下列实验。资料:维生素C(
 )又称抗坏血酸,将溶于水,其溶液呈酸性
)又称抗坏血酸,将溶于水,其溶液呈酸性Ⅰ.检验铁元素的价态
| 实验序号 | 试管中的试剂 | 实验操作及现象 |
ⅰ | 2mL放置后的 | 滴加5滴KSCN溶液后,溶液变为浅红色 | |
ⅱ | 2mL放置后的 溶液,0.1g维生素C 溶液,0.1g维生素C | 维生素C溶解,溶液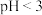 ,滴加5滴KSCN溶液后,溶液近乎无色 ,滴加5滴KSCN溶液后,溶液近乎无色 |
 。由ⅱ中溶液近乎无色可以推测维生素C与
。由ⅱ中溶液近乎无色可以推测维生素C与 发生了反应:
发生了反应: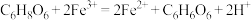 ,该反应的还原剂是
,该反应的还原剂是(2)ⅰ中与
 溶液滴加KSCN溶液后变浅红色相关的2个离子反应方程式为
溶液滴加KSCN溶液后变浅红色相关的2个离子反应方程式为(3)经分析ⅱ中检验方案不严谨,应考虑pH对反应的影响,依据是
Ⅱ.探究pH对ⅱ中反应的影响
补充实验如下,继续探究pH对ⅱ中反应的影响。
实验序号 | 试剂 | 实验操作及现象 |
ⅲ |
| 滴加5滴KSCN溶液后,溶液变为浅红色,浅红色比ⅰ中加深 |
 与SCN的显色反应有影响。
与SCN的显色反应有影响。(5)分析实验ⅰ~ⅲ,下列说法合理的是
a.维生素C具有氧化性和酸性
b.同服维生素C可减缓补铁剂中
 被氧化
被氧化c.使用KSCN检验
 时,宜先将溶液酸化
时,宜先将溶液酸化
您最近一年使用:0次
2023-04-27更新
|
307次组卷
|
2卷引用:福建省晋江市第一中学2022-2023学年高一下学期4月期中考试化学试题
10 . 硫氰化钾 是一种用途广泛的化工原料,常用于染料、药物的生产。实验小组设计如图所示的实验装置模拟工业制备
是一种用途广泛的化工原料,常用于染料、药物的生产。实验小组设计如图所示的实验装置模拟工业制备 并进行相关探究实验。
并进行相关探究实验。

已知:① 是一种不溶于水且密度大于水的非极性试剂;
是一种不溶于水且密度大于水的非极性试剂;
② 。
。
请回答下列问题:
(1) 的电子式为
的电子式为___________ 。
(2)装置A用于实验室制备氨气,该反应的化学方程式为___________ 。
(3)装置B中,三口烧瓶内盛有 、水和固体催化剂,通入氨气的导管需要插入
、水和固体催化剂,通入氨气的导管需要插入 液体中,其目的是
液体中,其目的是___________ 。
(4)待三口烧瓶内液体不再分层时,熄灭装置A处的酒精灯,关闭 ,移开水浴。将装置B继续加热至
,移开水浴。将装置B继续加热至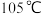 ,待
,待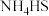 完全分解后,打开
完全分解后,打开 ,缓缓滴入适量
,缓缓滴入适量 溶液,充分反应后制得
溶液,充分反应后制得 溶液。装置C中仪器a的名称为
溶液。装置C中仪器a的名称为___________ ,装置C处的烧杯中产生淡黄色浑浊的原因是___________ (用离子方程式表示)。
(5)过滤装置C中吸收尾气后的悬浊液,得到滤液x。现取少量滤液x进行如图所示的探究实验。
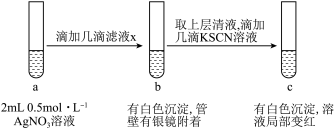
已知: 。
。
①试管b中产生银镜的原因是___________ (用离子方程式表示)。
②观察到试管c中出现上述实验现象后,用力振荡试管c,又观察到红色褪去且白色沉淀增多,结合平衡移动的知识解释其原因___________ 。
 是一种用途广泛的化工原料,常用于染料、药物的生产。实验小组设计如图所示的实验装置模拟工业制备
是一种用途广泛的化工原料,常用于染料、药物的生产。实验小组设计如图所示的实验装置模拟工业制备 并进行相关探究实验。
并进行相关探究实验。
已知:①
 是一种不溶于水且密度大于水的非极性试剂;
是一种不溶于水且密度大于水的非极性试剂;②
 。
。请回答下列问题:
(1)
 的电子式为
的电子式为(2)装置A用于实验室制备氨气,该反应的化学方程式为
(3)装置B中,三口烧瓶内盛有
 、水和固体催化剂,通入氨气的导管需要插入
、水和固体催化剂,通入氨气的导管需要插入 液体中,其目的是
液体中,其目的是(4)待三口烧瓶内液体不再分层时,熄灭装置A处的酒精灯,关闭
 ,移开水浴。将装置B继续加热至
,移开水浴。将装置B继续加热至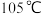 ,待
,待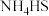 完全分解后,打开
完全分解后,打开 ,缓缓滴入适量
,缓缓滴入适量 溶液,充分反应后制得
溶液,充分反应后制得 溶液。装置C中仪器a的名称为
溶液。装置C中仪器a的名称为(5)过滤装置C中吸收尾气后的悬浊液,得到滤液x。现取少量滤液x进行如图所示的探究实验。

已知:
 。
。①试管b中产生银镜的原因是
②观察到试管c中出现上述实验现象后,用力振荡试管c,又观察到红色褪去且白色沉淀增多,结合平衡移动的知识解释其原因
您最近一年使用:0次