1 . 某化学兴趣小组探究一种硫酸盐晶体的组成,其实验过程如图所示。下列说法正确的是
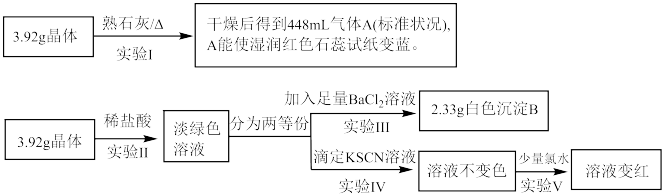
A.该硫酸盐的化学式为 |
| B.实验Ⅲ的操作包括过滤、洗涤、干燥、称量 |
C.由实验Ⅲ数据可知3.92g晶体中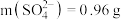 |
D.上述实验过程可证明该晶体中含有 |
您最近一年使用:0次
名校
解题方法
2 . 还原铁粉与水蒸气的反应装置如图所示。取少量反应后的固体加入稀硫酸使其完全溶解得溶液a;另取少量反应后的固体加入稀硝酸使其完全溶解,得溶液b.下列说法正确的是
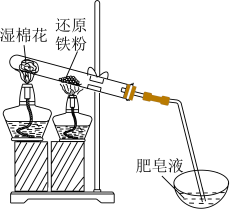
A.铁与水蒸气反应: |
B.肥皂液中产生气泡,不能证明铁与水蒸气反应生成 |
C.向溶液a中滴加 溶液,出现蓝色沉淀,说明铁粉未完全反应 溶液,出现蓝色沉淀,说明铁粉未完全反应 |
D.向溶液b中滴加 溶液,溶液变红,证实了固体中含有 溶液,溶液变红,证实了固体中含有 |
您最近一年使用:0次
2024-05-01更新
|
775次组卷
|
4卷引用:2024届河南省焦作市博爱县第一中学高三下学期三模化学试题
2024届河南省焦作市博爱县第一中学高三下学期三模化学试题北京市西城区2024届高三统一测试(一模)化学试题(已下线)化学(北京卷03)-2024年高考押题预测卷(已下线)题型6 元素及其化合物 化学实验基础(25题)-2024年高考化学常考点必杀300题(新高考通用)
3 . 根据实验操作及现象,下列结论中正确的是
| 选项 | 实验操作及现象 | 结论 |
| A | 用铂丝蘸取NaCl溶液,在酒精灯外焰上灼烧,火焰呈现黄色 | 灼烧过程中NaCl一定发生了化学变化 |
| B | 取少量某 溶液于试管中,滴入几滴KSCN溶液。溶液呈现红色 溶液于试管中,滴入几滴KSCN溶液。溶液呈现红色 | 该 溶液已经不含有 溶液已经不含有 |
| C | 在乙酸乙酯的制备实验中,将产生的蒸气导入足量的饱和碳酸钠溶液上方,充分反应后上层存在油状液体 | 该油状液体为乙酸乙酯 |
| D | 将一定量的铜片,加入试管中的某硝酸溶液中,可观察到有红棕色气体生成 | 所产生的气体中,只可能有 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
4 . 铁是人体必需的微量元素之一。黑木耳中的含铁量较高,为检验和测定干黑木耳样品中的铁元素,设计实验如下。回答下列问题:
Ⅰ.铁元素的检验

(1)“操作”是指________ ;上述流程中需要用到的仪器有托盘天平、烧杯、玻璃棒、酒精灯、漏斗,还有下图中的________ (填写仪器名称)。

(2)检验待测液中是否含有 、
、
Ⅱ.铁元素含量的测定
利用 标准溶液测定干黑木耳样品中铁元素的含量
标准溶液测定干黑木耳样品中铁元素的含量
步骤Ⅰ:取 待测液,加入过量铜粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。
待测液,加入过量铜粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。
步骤Ⅱ:向步骤Ⅰ所得的溶液中加入适量稀 溶液,用
溶液,用 的
的 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液
溶液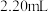 。
。
(3)步骤Ⅰ加入过量铜粉的目的是_________________________________ 。
(4)步骤Ⅱ滴加 溶液时发生反应的离子方程式为
溶液时发生反应的离子方程式为_____________________ 。
(5)用 标准溶液滴定至终点的标志是:
标准溶液滴定至终点的标志是:___________ 。
(6)黑木耳中铁的含量为________ mg/100g(即每100g黑木耳中含铁元素质量)。
(7)若步骤Ⅰ过滤后未洗涤将使测定结果________ (填“偏大”或“偏小”或“无影响”)。
Ⅰ.铁元素的检验

(1)“操作”是指

(2)检验待测液中是否含有
 、
、
| 检验试剂 | 现象 | 结论 |
| KSCN溶液 | 溶液变为红色 | 滤液中含有 |
| ① | ② | 滤液中含有 |
Ⅱ.铁元素含量的测定
利用
 标准溶液测定干黑木耳样品中铁元素的含量
标准溶液测定干黑木耳样品中铁元素的含量步骤Ⅰ:取
 待测液,加入过量铜粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。
待测液,加入过量铜粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。步骤Ⅱ:向步骤Ⅰ所得的溶液中加入适量稀
 溶液,用
溶液,用 的
的 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液
溶液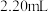 。
。(3)步骤Ⅰ加入过量铜粉的目的是
(4)步骤Ⅱ滴加
 溶液时发生反应的离子方程式为
溶液时发生反应的离子方程式为(5)用
 标准溶液滴定至终点的标志是:
标准溶液滴定至终点的标志是:(6)黑木耳中铁的含量为
(7)若步骤Ⅰ过滤后未洗涤将使测定结果
您最近一年使用:0次
2024-04-03更新
|
148次组卷
|
2卷引用:2024届河南省郑州市宇华实验学校高三下学期二模化学试题
名校
5 . H2O2是一种绿色氧化还原试剂,在化学研究中应用广泛。某研究性学习小组设计如图所示实验装置,探究影响H2O2分解反应速率的因素。
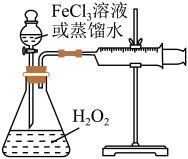
(1)①写出锥形瓶中反应的化学方程式________ 。
②设计实验方案:在不同条件下,测定_______ 。(要求所测得的数据能直接体现反应速率大小)
(2)探究影响H2O2分解反应速率的因素实验方案如下表所示,先向锥形瓶中加入质量分数为10%H2O2,再依次通过分液漏斗向锥形瓶中加入一定量的蒸馏水和FeCl3溶液,请回答问题:
①表格中a=_______ ,b=________ 。
②通过实验Ⅱ和Ⅲ探究浓度对反应速率影响。
(3)实验Ⅱ、Ⅲ中溶液颜色变深的原因是________ 。
(4)已知FeCl3溶液对H2O2的催化分解分为反应i和反应ii两步进行:
已知反应ii的离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O;
①反应i离子方程式为_______ 。
②某同学设计实验证明催化过程中有Fe2+产生:取2mLH2O2溶液于试管中,向试管中滴加2滴FeCl3溶液,再滴加2滴_______ 溶液,产生蓝色沉淀。
(5)向实验Ⅱ中反应后的溶液滴加KSCN溶液,溶液变红色,2min后溶液红色褪去;继续滴加KSCN溶液,溶液又变红色,一段时间后又褪色;此时再向溶液中滴加盐酸酸化后的BaCl2溶液,产生白色沉淀。请分析溶液红色褪去的原因______ 。

(1)①写出锥形瓶中反应的化学方程式
②设计实验方案:在不同条件下,测定
(2)探究影响H2O2分解反应速率的因素实验方案如下表所示,先向锥形瓶中加入质量分数为10%H2O2,再依次通过分液漏斗向锥形瓶中加入一定量的蒸馏水和FeCl3溶液,请回答问题:
| 实验序号 | 10%H2O2/mL | 蒸馏水/mL | 0.2mol·LFeCl3溶液/mL | 现象 |
| I | 10 | a | 0 | 无明显变化 |
| Ⅱ | 10 | b | 2 | 锥形瓶变热,溶液迅速变红棕色,并有较多气泡产生;2min时,反应变缓,溶液颜色明显变浅 |
| Ⅲ | 5 | 5 | 2 | 锥形瓶变热,溶液变棕色,开始5s后产生较少的气泡;2min时,反应速度加快 |
②通过实验Ⅱ和Ⅲ探究浓度对反应速率影响。
(3)实验Ⅱ、Ⅲ中溶液颜色变深的原因是
(4)已知FeCl3溶液对H2O2的催化分解分为反应i和反应ii两步进行:
已知反应ii的离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O;
①反应i离子方程式为
②某同学设计实验证明催化过程中有Fe2+产生:取2mLH2O2溶液于试管中,向试管中滴加2滴FeCl3溶液,再滴加2滴
(5)向实验Ⅱ中反应后的溶液滴加KSCN溶液,溶液变红色,2min后溶液红色褪去;继续滴加KSCN溶液,溶液又变红色,一段时间后又褪色;此时再向溶液中滴加盐酸酸化后的BaCl2溶液,产生白色沉淀。请分析溶液红色褪去的原因
您最近一年使用:0次
名校
解题方法
6 . 化学与生产生活密切相关,下列有关说法不正确的是
| A.某管道疏通剂主要成分是NaOH粉末和铝粉,可与“洁厕灵”混合使用提高疏通和清洁效果 |
| B.洗涤棉布衣物不容易“甩干”是因为衣物与水分子间形成了氢键 |
C.高铁酸钾( )在水处理过程中涉及的变化有:蛋白质变性、胶体聚沉、盐类水解、氧化还原反应 )在水处理过程中涉及的变化有:蛋白质变性、胶体聚沉、盐类水解、氧化还原反应 |
| D.酱油中添加少量苯甲酸钠作防腐剂 |
您最近一年使用:0次
2024-03-22更新
|
354次组卷
|
2卷引用:河南省信阳高级中学2024届高三二模(模拟测试九)理综-化学试题
名校
7 . 实验室由炼钢污泥(简称铁泥,主要成分为铁的氧化物)制备软磁性材料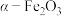 。其主要实验流程如下:
。其主要实验流程如下:
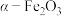 。其主要实验流程如下:
。其主要实验流程如下:
| A.酸浸:用一定浓度的硫酸浸取铁泥,能提高铁元素浸出率的措施有适当升高温度,加快搅拌速度 |
B.还原:向“酸浸”后的滤液中加入过量铁粉,可用KSCN溶液检验 是否完全还原 是否完全还原 |
C.沉铁:将提纯后的 溶液与氨水 溶液与氨水 混合溶液反应,生成 混合溶液反应,生成 沉淀的离子方程式为 沉淀的离子方程式为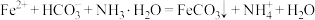 |
D.沉铁步骤中为防止生成 ,应在搅拌下向氨水 ,应在搅拌下向氨水 混合溶液中缓慢加入 混合溶液中缓慢加入 溶液 溶液 |
您最近一年使用:0次
2024-02-29更新
|
568次组卷
|
5卷引用:2024届河南省焦作市博爱县第一中学高三下学期二模化学试题
解题方法
8 . 根据实验操作及现象,得出结论正确的是
| 选项 | 实验操作及现象 | 结论 |
| A |  和稀硫酸混合产生浅黄色沉淀和刺激性气味的气体 和稀硫酸混合产生浅黄色沉淀和刺激性气味的气体 | 硫酸表现氧化性, 表现还原性 表现还原性 |
| B | 向酸性 溶液中滴加乙苯,溶液褪色 溶液中滴加乙苯,溶液褪色 | 乙苯的苯环中含有碳碳双键 |
| C | Ag与HI溶液生成黄色沉淀和无色气体 |  和 和 生成AgI,促进Ag和HI溶液发生反应生成AgI和 生成AgI,促进Ag和HI溶液发生反应生成AgI和 |
| D | 在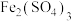 溶液中加入铜粉,溶液变蓝色 溶液中加入铜粉,溶液变蓝色 | 氧化性: , ,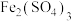 和Cu发生置换反应 和Cu发生置换反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
9 . 磷酸亚铁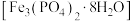 是生产锂电池的原料,能溶于强酸,不溶于水。实验室可以绿矾
是生产锂电池的原料,能溶于强酸,不溶于水。实验室可以绿矾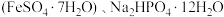 及
及 为原料制备磷酸亚铁,主要反应为
为原料制备磷酸亚铁,主要反应为 。
。
I.配制 溶液
溶液
(1)实验室常用绿矾配制 溶液,配制过程中需要用到的玻璃仪器除烧杯、量筒、容量瓶外,还有
溶液,配制过程中需要用到的玻璃仪器除烧杯、量筒、容量瓶外,还有___________ 。若实验需要配制。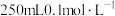 的
的 溶液,则需要称取的绿矾的质量为
溶液,则需要称取的绿矾的质量为___________ g。
Ⅱ.提纯制备晶体
(2)利用工业品十二水合磷酸氢二钠(含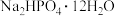 、重金属盐及有色杂质等)提纯得到
、重金属盐及有色杂质等)提纯得到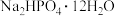 晶体。已知:
晶体。已知: 溶液
溶液 在
在 ,重金属硫化物不溶于水。请将实验步骤补充完整:
,重金属硫化物不溶于水。请将实验步骤补充完整:
将工业品溶于热水;
①___________ ;
②___________ ;
③___________ ;
冷却结晶,过滤、洗涤及干燥。
(实验中可选用的试剂: 溶液、
溶液、 溶液、
溶液、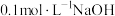 溶液、活性炭)
溶液、活性炭)
Ⅲ.合成磷酸亚铁及杂质的检验
(3)在三颈烧瓶中先加入抗坏血酸(维生素C)稀溶液作底液,然后向烧瓶中滴入 与
与 的混合溶液至
的混合溶液至 时,再滴入
时,再滴入 溶液,最终维持
溶液,最终维持 。
。
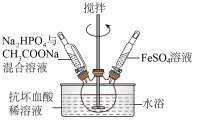
①用抗坏血酸稀溶液作底液的作用是___________ 。
②检验产品中是否混有 或
或 杂质的操作方法是
杂质的操作方法是___________ 。
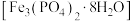 是生产锂电池的原料,能溶于强酸,不溶于水。实验室可以绿矾
是生产锂电池的原料,能溶于强酸,不溶于水。实验室可以绿矾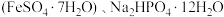 及
及 为原料制备磷酸亚铁,主要反应为
为原料制备磷酸亚铁,主要反应为 。
。I.配制
 溶液
溶液(1)实验室常用绿矾配制
 溶液,配制过程中需要用到的玻璃仪器除烧杯、量筒、容量瓶外,还有
溶液,配制过程中需要用到的玻璃仪器除烧杯、量筒、容量瓶外,还有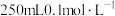 的
的 溶液,则需要称取的绿矾的质量为
溶液,则需要称取的绿矾的质量为Ⅱ.提纯制备晶体
(2)利用工业品十二水合磷酸氢二钠(含
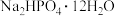 、重金属盐及有色杂质等)提纯得到
、重金属盐及有色杂质等)提纯得到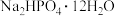 晶体。已知:
晶体。已知: 溶液
溶液 在
在 ,重金属硫化物不溶于水。请将实验步骤补充完整:
,重金属硫化物不溶于水。请将实验步骤补充完整:将工业品溶于热水;
①
②
③
冷却结晶,过滤、洗涤及干燥。
(实验中可选用的试剂:
 溶液、
溶液、 溶液、
溶液、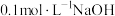 溶液、活性炭)
溶液、活性炭)Ⅲ.合成磷酸亚铁及杂质的检验
(3)在三颈烧瓶中先加入抗坏血酸(维生素C)稀溶液作底液,然后向烧瓶中滴入
 与
与 的混合溶液至
的混合溶液至 时,再滴入
时,再滴入 溶液,最终维持
溶液,最终维持 。
。
①用抗坏血酸稀溶液作底液的作用是
②检验产品中是否混有
 或
或 杂质的操作方法是
杂质的操作方法是
您最近一年使用:0次
2023-12-01更新
|
509次组卷
|
4卷引用:2024届河南省新乡市高三第一次模拟考试理科综合试题
2024届河南省新乡市高三第一次模拟考试理科综合试题(已下线)专题09 化学实验综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)河北省邯郸市六校联考2023-2024学年高二上学期11月月考化学试题陕西省西安市2023-2024学年高三上学期12月联考化学试卷
名校
10 . 化学与生产、生活密切相关,下列说法正确的是
| A.纯碱受热易分解,常用作焙制糕点的膨松剂 |
| B.氯气具有漂白性,常用作棉、麻和纸张的漂白剂 |
| C.氧化铁呈红棕色,常用作油漆、涂料的红色颜料 |
D. 溶液具有较强的氧化性,常用于刻蚀印刷电路板铜箔 溶液具有较强的氧化性,常用于刻蚀印刷电路板铜箔 |
您最近一年使用:0次
2023-12-01更新
|
278次组卷
|
4卷引用:河南省漯河市高级中学2023-2024学年高一上学期模拟预测化学试题



