解题方法
1 . 以菱镁矿(主要成分为 ,含少量
,含少量 、
、 和
和 )为原料制备高纯镁砂的工艺流程如下:
)为原料制备高纯镁砂的工艺流程如下:

已知:①相关金属离子完全沉淀(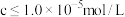 )的pH如下:
)的pH如下:
②废渣的主要成分为: 、
、 和
和
请回答:
(1)A的化学式为___________ 。
(2)为提高“浸出”效率,可采取的措施有___________ (写两条);浸出镁的离子反应方程式为___________ 。
(3) 中的大
中的大 键类型为
键类型为___________ (已知: 中含有的大
中含有的大 键类型为
键类型为 );
); 的核外电子排布式为
的核外电子排布式为___________ 。
(4)该流程中可循环使用的物质为___________ 。
(5)加入氨水的目的是沉镁,该操作不宜在较高温度下进行的原因是___________ 。
(6)若浸出液中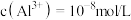 ,则
,则
___________ (已知: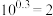 )
)
 ,含少量
,含少量 、
、 和
和 )为原料制备高纯镁砂的工艺流程如下:
)为原料制备高纯镁砂的工艺流程如下:
已知:①相关金属离子完全沉淀(
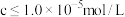 )的pH如下:
)的pH如下:| 金属离子 |  |  |  |
| 沉淀完全的pH | 2.8 | 4.7 | 10.9 |
 、
、 和
和
请回答:
(1)A的化学式为
(2)为提高“浸出”效率,可采取的措施有
(3)
 中的大
中的大 键类型为
键类型为 中含有的大
中含有的大 键类型为
键类型为 );
); 的核外电子排布式为
的核外电子排布式为(4)该流程中可循环使用的物质为
(5)加入氨水的目的是沉镁,该操作不宜在较高温度下进行的原因是
(6)若浸出液中
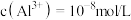 ,则
,则
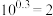 )
)
您最近一年使用:0次
名校
2 . 氧化铁红颜料跟某些油料混合,可以制成防锈油漆。以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2(难溶于稀硫酸)、Al2O3等,用硫酸渣制备铁红(Fe2O3)的过程如图,回答下列问题: 还有
还有___________ (填离子符号),写出Fe2O3与稀硫酸反应的离子方程式:___________ 。
(2)“还原”过程中加入FeS2粉的目的是将溶液中的Fe3+还原为Fe2+,而FeS2自身被氧化为H2SO4,该反应中氧化剂和还原剂的物质的量之比为___________ 。
(3)“滤渣A”是SiO2,SiO2是一种常见的酸性氧化物,与CO2类似,都可与强碱反应,写出SiO2与NaOH溶液反应的化学方程式:___________ 。
(4)“氧化”时,可观察到的实验现象为___________ 。若加入的NaOH溶液过量,则“滤液B”中的溶质除了NaOH外,还含有___________ ;若加入的NaOH溶液不足,则制得的铁红中含有的杂质为___________ (填化学式)。

 还有
还有(2)“还原”过程中加入FeS2粉的目的是将溶液中的Fe3+还原为Fe2+,而FeS2自身被氧化为H2SO4,该反应中氧化剂和还原剂的物质的量之比为
(3)“滤渣A”是SiO2,SiO2是一种常见的酸性氧化物,与CO2类似,都可与强碱反应,写出SiO2与NaOH溶液反应的化学方程式:
(4)“氧化”时,可观察到的实验现象为
您最近一年使用:0次
2022-05-06更新
|
801次组卷
|
15卷引用:湖南省怀化市沅陵县第一中学2021-2022学年高一下学期期中考试化学试题
湖南省怀化市沅陵县第一中学2021-2022学年高一下学期期中考试化学试题山西省吕梁市2021-2022学年高一上学期期末考试化学试题河北省秦皇岛市2021-2022学年高一上学期期末统一考试化学试题河北省廊坊市2021-2022学年高一上学期期末统一考试化学试题安徽省宣城中学2021-2022学年高一下学期期中考试化学试题(已下线)第05练 以简单工业流程突破金属及其化合物-2022年【暑假分层作业】高二化学(2023届一轮复习通用)湖南省长沙市实验中学2021-2022学年高一下学期入学考试化学试题湖南省衡阳市祁东县2021-2022学年高一上学期期末考试化学试题安徽省滁州市定远县育才学校2021-2022学年高一下学期5月月考化学试题湖北省襄阳市第四中学2021-2022学年高一下学期2月考试化学试题云南省楚雄州2021-2022学年高一上学期期末教育学业质量监测化学试题湖南省株洲市九方中学2022-2023学年高三上学期第四次月考化学试题湖南省长沙市实验中学2022-2023学年高一上学期期末考试化学试题河北省秦皇岛市青龙满族自治县实验中学2022-2023学年高一上学期期末考试化学试题广东省阳江市江城区部分学校2023-2024学年高一上学期期末联考化学试题
名校
解题方法
3 . 工业上以黄铁矿(主要成分为FeS2,含有少量NiS、CuS、SiO2等杂质)为原料制备K4[Fe(CN)6]•3H2O,工艺流程如图:
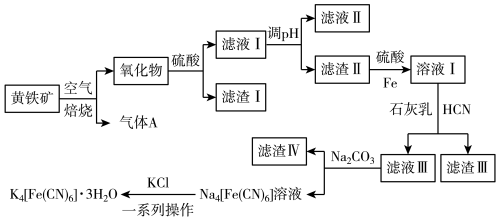
下列说法错误的是

下列说法错误的是
| A.“焙烧”时氧化产物有Fe2O3和SO2 |
| B.“调pH”分离Fe3+与Cu2+、Ni2+是利用了它们氢氧化物Ksp的不同 |
| C.“溶液Ⅰ”中主要反应的离子方程式为6OH-+6HCN+Fe2+=[Fe(CN)6]4-+6H2O |
| D.“一系列操作”为过滤、洗涤、干燥 |
您最近一年使用:0次
2022-03-22更新
|
2179次组卷
|
12卷引用:湖南省怀化市会同县第一中学2021-2022学年高三下学期第二次调研考试化学试题
湖南省怀化市会同县第一中学2021-2022学年高三下学期第二次调研考试化学试题湖南省怀化市沅陵县第二中学2021-2022学年高三下学期四月第一次调研考试化学试题山东省济南市2022届高三3月高考模拟考试(一模)化学试题湖北省枣阳市第一中学2022届高三下学期5月第三次模拟考试化学试题(已下线)专题13 物质的反应和转化-2022年高考真题模拟题分项汇编(已下线)2022年山东省高考真题变式题(不定项选择题)山东省济南第一中学2023届高三上学期开学考试化学试题湖南省湘西自治州古丈县第一中学2021-2022学年高三下学期第二次模拟化学试题湖南省邵阳市第二中学2022-2023学年高三上学期第五次月考化学试题(已下线)学科特色7 工艺流程推断(已下线)山东省济南市2022届高三3月高考模拟考试(一模)(不定项选择题)湖南省衡阳市第一中学2023届高三下学期第四次月考化学试题
4 . 北京时间2021年10月16日上午,神舟十三号航天员顺利进驻“天和”核心舱,开启为期6个月的航天飞行任务。航天员生活、工作于其中的“天和”核心舱是利用三结砷化镓太阳能电池作为其动力。一种由砷化家废料(主要成分为GaAs,含Fe2O3、SiO2等杂质)制备镓的工艺流程如图:
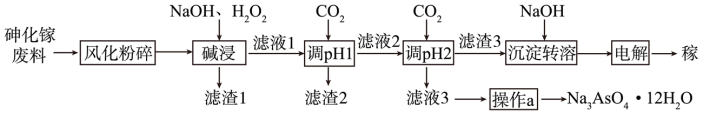
已知:①Ga在周期表中位于Al的正下方,性质与Al相似;
②离子完全沉淀的pH值: 为8,
为8,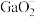 为5.5。
为5.5。
回答下列问题:
(1)“风化粉碎”的目的是_______ 。
(2)“碱浸”温度控制在70℃左右,温度不能过高或过低的原因是_______ 。
(3)“碱浸”时,GaAs中Ga以 的形式进入溶液中,该反应的离子方程式是
的形式进入溶液中,该反应的离子方程式是_______ 。
(4)“滤渣1”的成分为_______ (填化学式),“操作a”为_______ 、过滤、洗涤、干燥。
(5)“调pH1”时,不能通入过量的 ,其原因是
,其原因是_______ 。
(6)若用240kg含7.25%砷化镓的废料回收家,得到纯度为96%的镓7.0kg,则家的回收率为_______ %(保留3位有效数字)。

已知:①Ga在周期表中位于Al的正下方,性质与Al相似;
②离子完全沉淀的pH值:
 为8,
为8,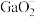 为5.5。
为5.5。回答下列问题:
(1)“风化粉碎”的目的是
(2)“碱浸”温度控制在70℃左右,温度不能过高或过低的原因是
(3)“碱浸”时,GaAs中Ga以
 的形式进入溶液中,该反应的离子方程式是
的形式进入溶液中,该反应的离子方程式是(4)“滤渣1”的成分为
(5)“调pH1”时,不能通入过量的
 ,其原因是
,其原因是(6)若用240kg含7.25%砷化镓的废料回收家,得到纯度为96%的镓7.0kg,则家的回收率为
您最近一年使用:0次
2022-03-22更新
|
873次组卷
|
3卷引用:湖南省怀化市洪江市第一中学2021-2022学年高三下学期第二次月考化学试题
名校
解题方法
5 . 比亚迪推出了基于磷酸亚铁锂技术的“刀片电池”,该电池能量密度大,安全性高。生产“刀片电池”需要用到FeSO4,某工业废料中主要含Fe2O3、Al2O3、SiO2 (其他成分与酸碱都不反应),某同学设计如下工艺流程从工业废料中回收绿矾

请回答:
(1)“碱浸”过程中,将工业废料粉碎的目的是___________ (写出一种)。
(2)“碱浸”时发生的离子方程式为___________ 。
(3)“提纯操作1”制取绿矾晶体需先加入少量稀硫酸,再经过___________ 、冷却结晶、过滤、洗涤、干燥。
(4)某同学为了验证某久置的FeSO4溶液是否变质,取少量待测液于试管中,加入2滴___________ 溶液,若观察到___________ ,则证明该溶液已经变质。
(5)称取1.390 0 g新制绿矾样品,以稀硫酸酸化,用0.040 0 mol·L-1的KMnO4标准液滴定至终点,消耗KMnO4标准液24.00 mL。该滴定反应的离子方程式为___________ ,取样样品的纯度为___________ (已知FeSO4·7H2O的摩尔质量为278 g·mol-1)。

请回答:
(1)“碱浸”过程中,将工业废料粉碎的目的是
(2)“碱浸”时发生的离子方程式为
(3)“提纯操作1”制取绿矾晶体需先加入少量稀硫酸,再经过
(4)某同学为了验证某久置的FeSO4溶液是否变质,取少量待测液于试管中,加入2滴
(5)称取1.390 0 g新制绿矾样品,以稀硫酸酸化,用0.040 0 mol·L-1的KMnO4标准液滴定至终点,消耗KMnO4标准液24.00 mL。该滴定反应的离子方程式为
您最近一年使用:0次
2022-03-08更新
|
231次组卷
|
4卷引用:湖南省怀化市铁路第一中学2021-2022学年高一下学期第一次月考化学试题
6 . 铜镉渣主要含锌、铜、铁、镉(Cd)、钻(Co)等单质。湿法炼锌产生的铜镉渣用于生产金属镉的工艺流程如图:

表中列出了相关金属离子生成氢氧化物沉淀的pH(金属离子的起始浓度为0.1mol·L-1)
(1)酸浸铜镉渣时,加快反应速率的措施有_______ (写一条)。
(2)操作Ⅲ中先加入适量H2O2,发生反应的离子方程式_______ ;再加入ZnO控制反应液的pH,pH范围为_______ ﹔选择_______ (填“铁氰化钾”或“硫氰化钾”)试剂,能证明添加的H2O2已过量。
(3)常用沉淀转化法处理含Cd2+废水,写出碳酸钙处理Cd2+的离子方程式_______ ;若反应达到平衡后溶液中c(Ca2+)=0.1mol·L-1,溶液中c(Cd2+)=_______ mol·L-1。[已知25℃,Ksp(CdCO3)=5.6×10-12,Ksp(CaCO3)=2.8×10-9]
(4)电解后的废液可用于电镀锌,电镀锌时阴极反应式为_______ 。

表中列出了相关金属离子生成氢氧化物沉淀的pH(金属离子的起始浓度为0.1mol·L-1)
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.2 | 8.0 |
| 沉淀完全的pH | 3.3 | 9.9 | 9.5 | 11.1 |
(1)酸浸铜镉渣时,加快反应速率的措施有
(2)操作Ⅲ中先加入适量H2O2,发生反应的离子方程式
(3)常用沉淀转化法处理含Cd2+废水,写出碳酸钙处理Cd2+的离子方程式
(4)电解后的废液可用于电镀锌,电镀锌时阴极反应式为
您最近一年使用:0次
名校
7 . 利用废旧镀锌铁皮制备 胶体粒子的流程图如下:
胶体粒子的流程图如下:
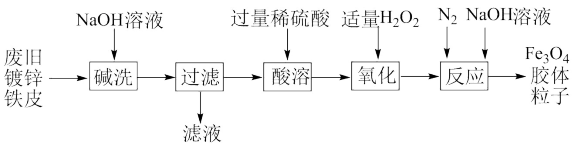
已知:镀锌铁皮就是铁皮表面镀上一层锌; 溶于强碱时生成
溶于强碱时生成 。下列有关说法正确的是
。下列有关说法正确的是
 胶体粒子的流程图如下:
胶体粒子的流程图如下:
已知:镀锌铁皮就是铁皮表面镀上一层锌;
 溶于强碱时生成
溶于强碱时生成 。下列有关说法正确的是
。下列有关说法正确的是| A.用氢氧化钠溶液处理废旧镀锌铁皮,主要目的是为了处理铁皮表面的油污 |
B.“酸溶”的离子方程式为 |
C.“氧化”后溶液中所存在的离子有: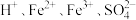 |
D.最后一步“反应”中 的作用是将部分 的作用是将部分 还原成 还原成 |
您最近一年使用:0次
2022-01-22更新
|
505次组卷
|
6卷引用:湖南省怀化市沅陵县第一中学2021-2022学年高一下学期第一次月考化学试题
解题方法
8 . 高铁酸钾(K2FeO4)具有极强的氧化性和优良的絮凝功能,是一种绿色环保多功能型水处理剂。下图是生产高铁酸钾的一种工艺流程:

已知K2FeO4的部分性质如下:
回答下列问题:
(1)写出①中反应的离子方程式______ 。
(2)②加入NaOH固体的目的是______ (填字母序号)。
A与溶液I中过量的Cl2继续反应,生成更多的NaClO
B.NaOH固体溶解时会放出较多的热量,有利于后续生成K2FeO4
C.为后续反应提供碱性环境
(3)写出④中反应的离子方程式_______ ;④中一般加铁的硝酸盐或硫酸盐而不用氯化物,原因是______ 。
(4)往溶液II中加入饱和KOH溶液,能够得到湿产品K2FeO4的原因是______ 。
(5)⑥中洗涤时,洗涤剂最好选用 (填字母序号)。
(6)该工艺流程中可循环使用的物质是______ (填化学式)。
(7)用离子方程式解释K2FeO4净水的原因______ 。

已知K2FeO4的部分性质如下:
| 溶解性 | 溶于水,微溶于浓KOH溶液,难溶于有机物 |
| 稳定性 | 温度为0-5℃或强碱性溶液中能稳定存在;酸性或中性溶液中放出O2 |
(1)写出①中反应的离子方程式
(2)②加入NaOH固体的目的是
A与溶液I中过量的Cl2继续反应,生成更多的NaClO
B.NaOH固体溶解时会放出较多的热量,有利于后续生成K2FeO4
C.为后续反应提供碱性环境
(3)写出④中反应的离子方程式
(4)往溶液II中加入饱和KOH溶液,能够得到湿产品K2FeO4的原因是
(5)⑥中洗涤时,洗涤剂最好选用 (填字母序号)。
| A.H2O | B.KOH溶液 | C.异丙醇 | D.FeCl2溶液 |
(7)用离子方程式解释K2FeO4净水的原因
您最近一年使用:0次
解题方法
9 . 铜在自然界中多以硫化物存在,氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以黄铜矿(主要成分为CuFeS2)为原料制取Cu2O的一种工艺流程如图:

常温下几种金属阳离子开始沉淀与完全沉淀时的pH如表:
(1)把矿石粉碎的目的是_______ ;为了减少炉气污染,可用炉气生产_______ (写化学式),再用于上述工艺。
(2)试剂a可选_______ (填序号);“调pH”应调控的pH范围为_______ 。
A.Cu B.CuO C.CuCO3 D.Cu(OH)2 E.Cu2 (OH)2CO3
(3)“焙烧”后,若Cu、Fe分别呈+2价+3价,写出CuFeS2与O2反应的化学方程式_______ 。
(4)“还原(90℃)”过程发生反应的离子方程式为_______ ;“操作A”包括_______ 、洗涤、隔绝空气烘干。
(5)若用10.00吨含30.00% CuFeS2的矿石生产,假设其它杂质不含铜元素,最后得到Cu2O 0.9504吨,则其产率为_______ (保留四位有效数字)。

常温下几种金属阳离子开始沉淀与完全沉淀时的pH如表:
| Fe2+ | Fe3+ | Cu 2+ | |
| 开始沉淀 | 7.5 | 2.6 | 4.8 |
| 完全沉淀 | 9.5 | 3.3 | 6.4 |
(2)试剂a可选
A.Cu B.CuO C.CuCO3 D.Cu(OH)2 E.Cu2 (OH)2CO3
(3)“焙烧”后,若Cu、Fe分别呈+2价+3价,写出CuFeS2与O2反应的化学方程式
(4)“还原(90℃)”过程发生反应的离子方程式为
(5)若用10.00吨含30.00% CuFeS2的矿石生产,假设其它杂质不含铜元素,最后得到Cu2O 0.9504吨,则其产率为
您最近一年使用:0次
10 . 工业上用CuO粉末(含Fe2O3和FeO杂质)制备纯净CuCl2·2H2O晶体,有关金属离子开始沉淀和沉淀完全时溶液的pH如下表:
制备流程如下:

(1)加入试剂A是(写化学式)___________ ,目的是_____________________________ 。
(2)加入试剂B是CuO,目的是_____________________________ 。
(3)检验滤液C中不含Fe3+的方法是___________ ,应控制溶液pH范围为__________________ 。
(4)固体C的化学式为_____________ 。
(5)写出操作D的方法__________________ 。
| 离子 | Cu2+ | Fe3+ | Fe2+ |
| 开始沉淀pH | 5.4 | 2.7 | 8.1 |
| 沉淀完全pH | 6.9 | 3.7 | 9.6 |
制备流程如下:

(1)加入试剂A是(写化学式)
(2)加入试剂B是CuO,目的是
(3)检验滤液C中不含Fe3+的方法是
(4)固体C的化学式为
(5)写出操作D的方法
您最近一年使用:0次



