1 . 为探究Cl2、Br2、Fe3+的氧化性强弱,某化学兴趣小组设计了如下实验:
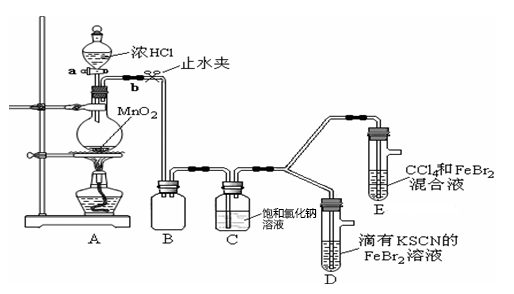
(1)①A是氯气发生装置,其反应的离子方程式是__________________________________ 。
②B装置的作用是_________________________ ,C装置的作用是_______________________ ,整套实验装置存在一处明显不足,请指出_______________________________________________________ 。
(2)用改正后的装置进行实验。实验过程如下:
继续滴入浓盐酸,D、E中均发生了新的变化:
D装置中:红色慢慢褪去。E装置中:CC14层先由无色变为橙色,后颜色逐渐变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
I:(SCN)2 性质与卤素相似,氧化性Cl2大于(SCN)2,且SCN-的电子式为
II:AgClO、AgBrO 均可溶于水
Ⅲ:Cl2 和Br2反应生成BrCl、BrCl呈红色,沸点约为5℃,与水发生水解反应
①小组同学认为D装置中红色褪去的原因是由于SCN-被Cl2氧化,但一定不是碳元素被氧化,他的理由是__________________________________________ 。
②经过实验证实了小组同学推测的合理性,请用平衡移动原理解释Cl2过量时D中溶液红色褪去的原因__________________________________________ 。
③欲探究E 中继续滴加浓盐酸后颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合化学用语解释仅产生白色沉淀的原因_________________________________________________ 。

(1)①A是氯气发生装置,其反应的离子方程式是
②B装置的作用是
(2)用改正后的装置进行实验。实验过程如下:
实验操作 | 实验现象 |
打开活塞a,向圆底烧瓶中滴入少量浓盐酸,然后关闭活塞a,点燃酒精灯 | D装置中:溶液变红 E装置中: 振荡后水层溶液变黄,CCl4无明显变化 |
D装置中:红色慢慢褪去。E装置中:CC14层先由无色变为橙色,后颜色逐渐变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
I:(SCN)2 性质与卤素相似,氧化性Cl2大于(SCN)2,且SCN-的电子式为

II:AgClO、AgBrO 均可溶于水
Ⅲ:Cl2 和Br2反应生成BrCl、BrCl呈红色,沸点约为5℃,与水发生水解反应
①小组同学认为D装置中红色褪去的原因是由于SCN-被Cl2氧化,但一定不是碳元素被氧化,他的理由是
②经过实验证实了小组同学推测的合理性,请用平衡移动原理解释Cl2过量时D中溶液红色褪去的原因
③欲探究E 中继续滴加浓盐酸后颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合化学用语解释仅产生白色沉淀的原因
您最近一年使用:0次
名校
2 . 下列有关物质的性质与用途具有对应关系的是
| A.铝具有良好导热性,可用铝罐贮运浓硝酸 |
| B.水玻璃能与酸反应,可用作生产黏合剂和防火剂 |
| C.NaNO2具有碱性,可用于使铁零件表面生成Fe3O4 |
| D.FeCl3溶液能与Cu反应,可用作铜制线路板的蚀刻剂 |
您最近一年使用:0次
2017-11-13更新
|
357次组卷
|
3卷引用:第三章 能力提升检测卷(测)——2021年高考化学一轮复习讲练测
(已下线)第三章 能力提升检测卷(测)——2021年高考化学一轮复习讲练测河南省郑州市第一中学2018届高三上学期期中考试化学试题内蒙古自治区乌兰察布市集宁一中(西校区)2021届高三上学期期中考试化学试题
3 . 中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论正确的是
| A.铁与氯气反应制氯化铁,推出铁与碘反应制碘化铁 |
| B.CO2通入到漂白粉溶液中发生CO2+Ca(ClO)2+H2O=CaCO3↓+2HClO,推出SO2通入到漂白粉溶液中发生SO2+Ca(ClO)2+H2O=CaSO3↓+2HClO |
| C.Na2O2与CO2反应生成Na2CO3和O2,推出Na2O2与SO2反应可生成Na2SO3和O2 |
| D.利用可溶性的铝盐溶液与氨水反应制Al(OH)3,推出可溶性的铁盐溶液与氨水反应制Fe(OH)3 |
您最近一年使用:0次
2016-12-09更新
|
160次组卷
|
2卷引用:2020届高三化学二轮冲刺新题专练——氯及其化合物
4 . 将1.12g铁粉加到25mL 2mol•L﹣1的氯化铁溶液中,完全反应后,其结果是
| A.溶液中n(Fe2+)与n(Fe3+)之比为6:1 |
| B.氧化产物与还原产物的物质的量之比为2:5 |
| C.铁有剩余,溶液呈浅绿色,c(Cl﹣)基本不变 |
| D.往溶液中滴加无色KSCN溶液,不变色 |
您最近一年使用:0次
2016-12-09更新
|
164次组卷
|
2卷引用:2020届高三化学无机化学二轮专题复习——铁及其化合物的相关计算2【精编24题】
5 . 某同学做了如下两个实验:
①将少量氯气通入FeI2与淀粉的混合溶液中,溶液变蓝色;
②将少量氯气通入到FeBr2与KSCN的混合溶液中溶液变红色。
由上述实验可以得出的结论是
①将少量氯气通入FeI2与淀粉的混合溶液中,溶液变蓝色;
②将少量氯气通入到FeBr2与KSCN的混合溶液中溶液变红色。
由上述实验可以得出的结论是
| A.氧化性:Cl2>Fe3+>Br2>I2 |
| B.②发生反应Fe2++Cl2=Fe3++2Cl- |
| C.实验中只有氯气发生氧化反应 |
| D.实验②发生的反应中,有一个是非氧化还原反应 |
您最近一年使用:0次
2016-12-09更新
|
235次组卷
|
2卷引用:2020届高三化学二轮冲刺新题专练——氧化还原反应的应用(选择专练)
6 . 下列有关Fe2(SO4)3溶液的叙述正确的是
| A.该溶液中,K+、Fe2+、I—、Br—可以大量共存 |
| B.用该溶液中溶解一定量铜粉,向所得溶液中再加入铁粉,若溶液中有Cu2+,则一定没有固体析出 |
| C.将该溶液蒸干,得到的固体中混有氢氧化铁 |
| D.100mL 0.1 mol/L该溶液和足量的Zn充分反应,生成1.12 gFe |
您最近一年使用:0次
2016-12-09更新
|
372次组卷
|
5卷引用:2020届高三化学无机化学二轮专题复习——铁及其化合物的相关计算2【精编24题】
7 . 下列化学反应先后顺序判断正确的是( )
| A.含有等物质的量的H+、Al3+的溶液中,逐滴加入NaOH溶液:H+、Al3+、Al(OH)3 |
| B.含有等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气: I-、Br-、Fe2+ |
| C.含有等物质的量的NaCl、Na2S的溶液中加入AgNO3溶液:NaCl、Na2S |
| D.含有等物质的量的Fe3+、Cu2+的溶液中加入铁粉:Cu2+、Fe3+ |
您最近一年使用:0次
2016-12-09更新
|
931次组卷
|
6卷引用:二轮复习 专题3 氧化还原反应 押题专练
(已下线)二轮复习 专题3 氧化还原反应 押题专练(已下线)2019高考备考二轮复习精品资料-专题3 氧化还原反应(押题专练)(已下线)专题04 离子反应(缺项配平、离子检验、离子推断、共存)-2021年高考化学必做热点专题(已下线)专题34 分类例析元素化合物综合应用试题中存在的陷阱-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)2015届湖北省七市(州)教科研协作体4月高三联合考试理综化学试卷2016届河南省三门峡市陕州中学高三上学期第二次精英对抗赛化学试卷
名校
8 . 某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
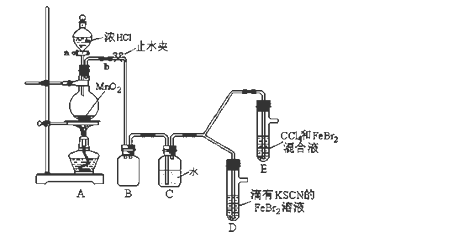
(1)①装置A中发生反应的离子方程式是_____________________ 。
②整套实验装置存在一处明显的不足,请指出_______________________ 。
(2)用改正后的装置进行实验,实验过程如下:
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化 。
D装置中:红色慢慢褪去。
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
①请用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因___________________________________________ ,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加______________ 溶液,若溶液颜色________ ,则上述解释是合理的。
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式 (离子或化学方程式不限定)解释产生白色沉淀原因__________________ 、_______________________

(1)①装置A中发生反应的离子方程式是
②整套实验装置存在一处明显的不足,请指出
(2)用改正后的装置进行实验,实验过程如下:
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。 | D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,下层CCl4层无明显变化。 | Cl2、Br2、Fe3+的氧化性由 |
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了
D装置中:红色慢慢褪去。
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
ⅰ.Fe3+ +3SCN- Fe(SCN)3 是一个可逆反应。 Fe(SCN)3 是一个可逆反应。ⅱ.(SCN)2性质与卤素单质类似。氧化性:Cl2 > (SCN)2 。 ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。 ⅳ.AgClO、AgBrO均可溶于水。 |
①请用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用
您最近一年使用:0次
2016-12-09更新
|
1550次组卷
|
5卷引用:2020届高三化学二轮复习实验题必练-铁及其化合物
13-14高三·全国·课时练习
名校
9 . 某一化工厂以废铁屑为原料制备FeCl3溶液,用作印刷电路铜板腐蚀剂,并对溶液B进行电解处理的实验流程如图:
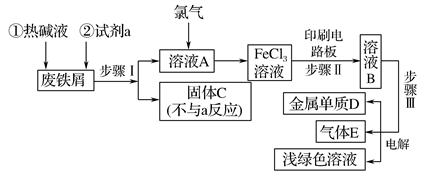
(1)试剂a应选用________ (填写名称);
(2)步骤Ⅰ用到的主要玻璃仪器有漏斗、________ (填写仪器名称);
(3)写出步骤Ⅱ中主要反应的化学方程式____________________ ;
(4)实验室制取气体E的离子方程式是________________________ ,欲对气体E进行干燥和吸收,需选用下列装置中的________ (填写序号);
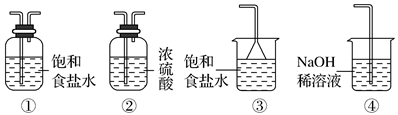
(5)如何用化学方法检验气体E?______________________________ 。

(1)试剂a应选用
(2)步骤Ⅰ用到的主要玻璃仪器有漏斗、
(3)写出步骤Ⅱ中主要反应的化学方程式
(4)实验室制取气体E的离子方程式是

(5)如何用化学方法检验气体E?
您最近一年使用:0次
2016-12-09更新
|
892次组卷
|
5卷引用:2018版化学(苏教版)高考总复习题型冲关:无机化学工艺流程
2018版化学(苏教版)高考总复习题型冲关:无机化学工艺流程(已下线)2014年高考化学苏教版总复习 10-4 化学实验方案设计与评价练习卷重庆市南开中学2019届高三上学期第一次月考化学试题吉林省靖宇县一中2020届高三上学期9月月考化学试题福建省福州市第三中学2019-2020学年上学期高三9月月考化学试题
2013·北京房山·二模
10 . 已知:①向盛有稀H2SO4试管中加入Fe粉,Fe粉完全溶解得浅绿色溶液;
②向实验①浅绿色溶液中滴加NaOH溶液,生成白色沉淀并立即变为红褐色;
③向实验②红褐色沉淀中滴加溶有淀粉的HI溶液,红褐色沉淀溶解得蓝色溶液。
下列判断正确的是
②向实验①浅绿色溶液中滴加NaOH溶液,生成白色沉淀并立即变为红褐色;
③向实验②红褐色沉淀中滴加溶有淀粉的HI溶液,红褐色沉淀溶解得蓝色溶液。
下列判断正确的是
| A.上述实验中,共涉及四个氧化还原反应 |
| B.实验可证明还原性:H+>Fe2+>OH->I- |
| C.实验②可证明溶解度:Fe(OH)3>Fe(OH)2 |
| D.实验③中,反应的离子方程式是:2Fe(OH)3+2I-+6H+=2Fe2++I2+6H2O |
您最近一年使用:0次



