解题方法
1 . 以废旧磷酸亚铁锂电池正极片( 、炭黑和铝箔等)为原料制备锰酸锂(
、炭黑和铝箔等)为原料制备锰酸锂( )的流程如图所示。
)的流程如图所示。

回答下列问题:
(1) 中Fe元素的化合价为
中Fe元素的化合价为_________ ;“放电处理”有利于锂在正极的回收,其原因是__________ 。
(2)“碱浸”中发生反应的离子方程式为________________________________ 。
(3)“浸取”中加入 的作用为
的作用为________________ ;“沉铁”过程所得滤渣为白色固体,其主要成分是________________ 。
(4)已知碳酸锂的分解温度为 。当“焙烧”温度达到
。当“焙烧”温度达到 时,开始有
时,开始有 产生,可能的原因是
产生,可能的原因是________________ ; 可以利用
可以利用 溶液与
溶液与 溶液反应制备,该反应中氧化剂与还原剂的物质的量之比为
溶液反应制备,该反应中氧化剂与还原剂的物质的量之比为_____ 。
(5)写出“焙烧”过程中生成锰酸锂的化学方程式_________________________________ 。
 、炭黑和铝箔等)为原料制备锰酸锂(
、炭黑和铝箔等)为原料制备锰酸锂( )的流程如图所示。
)的流程如图所示。
回答下列问题:
(1)
 中Fe元素的化合价为
中Fe元素的化合价为(2)“碱浸”中发生反应的离子方程式为
(3)“浸取”中加入
 的作用为
的作用为(4)已知碳酸锂的分解温度为
 。当“焙烧”温度达到
。当“焙烧”温度达到 时,开始有
时,开始有 产生,可能的原因是
产生,可能的原因是 可以利用
可以利用 溶液与
溶液与 溶液反应制备,该反应中氧化剂与还原剂的物质的量之比为
溶液反应制备,该反应中氧化剂与还原剂的物质的量之比为(5)写出“焙烧”过程中生成锰酸锂的化学方程式
您最近一年使用:0次
2020-11-24更新
|
567次组卷
|
2卷引用:山东省临沂市2021届高三上学期期中考试化学试题
2 . (1) ①已知2H2(g)+O2(g)=2H2O(g);ΔH1 = -483.6kJ·mol-1,②2H2(g)+O2(g)=2H2O(l);ΔH1 = -571.6kJ·mol-1,则氢气的热值为_____ ;
(2) CaC2是离子化合物,各原子均满足8电子稳定结构,其电子式为______ ;
(3) 在常压下,HF的沸点比HCl的沸点高。主要原因是________ 。
(4) 已知有关反应及不同温度下的平衡常数如下表:
①反应Ⅲ自发进行的条件___ (填“高温”、“低温”或“任意温度”);②500℃时,测得反应Ⅲ在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol· L−1)分别为0.8、0.1、0.3、0.15,则此时反应速率v正___ v逆(“>”、“=”或“<”)。
(5) 铅蓄电池放电时的正极反应式______
(2) CaC2是离子化合物,各原子均满足8电子稳定结构,其电子式为
(3) 在常压下,HF的沸点比HCl的沸点高。主要原因是
(4) 已知有关反应及不同温度下的平衡常数如下表:
| 化学反应 | 平衡常数 | 500℃ | 800℃ |
Ⅰ.2H2(g)+CO(g) CH3OH(g) CH3OH(g) | K1 | 2.5 | 0.15 |
Ⅱ.H2(g)+CO2(g) H2O(g)+CO(g) H2O(g)+CO(g) | K2 | 1.0 | 2.5 |
Ⅲ.3H2(g)+CO2(g) CH3OH(g)+H2O(g) CH3OH(g)+H2O(g) | K3 |
①反应Ⅲ自发进行的条件
(5) 铅蓄电池放电时的正极反应式
您最近一年使用:0次
3 . 为了防止氮氧化物对空气的污染,人们采取了很多措施。
(1)如用CH4催化还原NO2可以消除氮氧化物的污染,发生的反应如下: CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1。
N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1。
①下列有关说法正确的是_________ 。
A. 在容器中充入1mol CH4和2 mol NO2,当体系中n(CH4)/n(NO2)比值不随时间变化时,反应达到平衡状态
B. 恒温恒容时,当混合气体的密度不随时间变化时,该反应达到平衡状态
C. 体系达到平衡后,升高温度,体系中的混合气体的平均相对分子质量增大
D. 恒温恒压时,充入氩气有利于提高氮氧化物的转化率
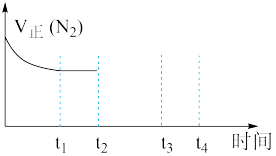
②在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态。请在如图中补充画出从t2到t4时刻v正(N2) 随时间的变化曲线:____________
(2)现有的汽车尾气处理的原理是:NO(g)+2CO(g) N2(g) +2CO2(g),通常使含适当比例的NO、CO尾气通过装有高效催化剂的处理装置。请根据以下相关数据,分析仅使用催化剂能否有效消除NO、CO尾气污染
N2(g) +2CO2(g),通常使含适当比例的NO、CO尾气通过装有高效催化剂的处理装置。请根据以下相关数据,分析仅使用催化剂能否有效消除NO、CO尾气污染___________ 。
(3)用NH3催化还原NOx也可以消除氮氧化物的污染,其反应原理为:NO(g) +NO2(g)+2NH3(g) 2N2(g) + 3H2O(g)。一定温度下,在某恒定压强为P的密闭容器中充入一定量的NO、NO2和NH3,达到平衡状态后,容器中含n(NO)=a mol,n(NO2)=2a mol,n(NH3)=2a mol,n(N2)=2b mol,且N2(g)的体积分数为1/3,请计算此时的平衡常数Kp=
2N2(g) + 3H2O(g)。一定温度下,在某恒定压强为P的密闭容器中充入一定量的NO、NO2和NH3,达到平衡状态后,容器中含n(NO)=a mol,n(NO2)=2a mol,n(NH3)=2a mol,n(N2)=2b mol,且N2(g)的体积分数为1/3,请计算此时的平衡常数Kp=_______________ 。(用只含P的式子表示,且化至最简式)。(备注:对于有气体参加的反应,可用某组分的平衡分压代替物质的量浓度计算平衡常数,记作KP。如P(NO2)为NO2的平衡分压,P(NO2)=x(NO2)P, P为平衡总压,x(NO2)为平衡体系中NO2的物质的量分数。)
(4)用间接电化学法对大气污染物NO进行无害化处理,其原理示意如图(质子膜允许H+和H2O通过),电极I发生的电极反应为_____________ 。

(1)如用CH4催化还原NO2可以消除氮氧化物的污染,发生的反应如下: CH4(g)+2NO2(g)
 N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1。
N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1。①下列有关说法正确的是
A. 在容器中充入1mol CH4和2 mol NO2,当体系中n(CH4)/n(NO2)比值不随时间变化时,反应达到平衡状态
B. 恒温恒容时,当混合气体的密度不随时间变化时,该反应达到平衡状态
C. 体系达到平衡后,升高温度,体系中的混合气体的平均相对分子质量增大
D. 恒温恒压时,充入氩气有利于提高氮氧化物的转化率
②在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态。请在如图中补充画出从t2到t4时刻v正(N2) 随时间的变化曲线:

(2)现有的汽车尾气处理的原理是:NO(g)+2CO(g)
 N2(g) +2CO2(g),通常使含适当比例的NO、CO尾气通过装有高效催化剂的处理装置。请根据以下相关数据,分析仅使用催化剂能否有效消除NO、CO尾气污染
N2(g) +2CO2(g),通常使含适当比例的NO、CO尾气通过装有高效催化剂的处理装置。请根据以下相关数据,分析仅使用催化剂能否有效消除NO、CO尾气污染| 反应 | 25℃时的平衡常数 | 焓变 |
反应I:2NO(g) N2(g)+O2(g) N2(g)+O2(g) | K1=1×1030 | ΔH=-180.5kJ/mol |
反应II:2CO2 (g) 2CO(g)+O2(g) 2CO(g)+O2(g) | K2=4×10-92 | ΔH= +566.0kJ/mol |
(3)用NH3催化还原NOx也可以消除氮氧化物的污染,其反应原理为:NO(g) +NO2(g)+2NH3(g)
 2N2(g) + 3H2O(g)。一定温度下,在某恒定压强为P的密闭容器中充入一定量的NO、NO2和NH3,达到平衡状态后,容器中含n(NO)=a mol,n(NO2)=2a mol,n(NH3)=2a mol,n(N2)=2b mol,且N2(g)的体积分数为1/3,请计算此时的平衡常数Kp=
2N2(g) + 3H2O(g)。一定温度下,在某恒定压强为P的密闭容器中充入一定量的NO、NO2和NH3,达到平衡状态后,容器中含n(NO)=a mol,n(NO2)=2a mol,n(NH3)=2a mol,n(N2)=2b mol,且N2(g)的体积分数为1/3,请计算此时的平衡常数Kp=(4)用间接电化学法对大气污染物NO进行无害化处理,其原理示意如图(质子膜允许H+和H2O通过),电极I发生的电极反应为

您最近一年使用:0次
4 . 消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。
(1)已知:① 2NO(g)+O2(g)=2NO2(g) △H1=x kJ/mol
② N2(g)+O2(g)=2NO(g) △H2=y kJ/mol
③ 4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △H3=z kJ/mol
反应④8NH3(g)+6NO2(g)=7N2(g)+12H2O(l) △H4=_______ kJ/mol
(2)水体中过量氨氮(以NH3表示)会导致水体富营养化。
①电极生物膜电解脱硝是电化学和微生物工艺的组合。电解阴极产生的有活性H原子和阳极生成的有O2,某微生物膜能利用电解产生的活性H原子将 还原为N2,工作原理如图所示。若阳极生成标准状况下4.48 L气体,理论上可除去NO2的物质的量为
还原为N2,工作原理如图所示。若阳极生成标准状况下4.48 L气体,理论上可除去NO2的物质的量为_______ mol。写出该活性原子H与 反应的离子方程式:
反应的离子方程式:_______ 。
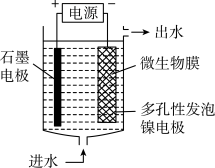
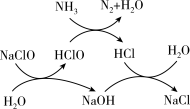
②用次氯酸钠除去氨氨的原理如图所示。写出该图示的总反应化学方程式:_______ 。该反应需控制温度,温度过高时氨氮去除率降低的原因是_______ 。
(3)NaHS可用作污水处理的沉淀剂。已知:25℃时,反应Hg2+(aq)+HS-(aq)⇌HgS(s)+H+(aq)的平衡常数K=1.75×1030,H2S 的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15,Ksp(HgS)=_______ 。
(1)已知:① 2NO(g)+O2(g)=2NO2(g) △H1=x kJ/mol
② N2(g)+O2(g)=2NO(g) △H2=y kJ/mol
③ 4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △H3=z kJ/mol
反应④8NH3(g)+6NO2(g)=7N2(g)+12H2O(l) △H4=
(2)水体中过量氨氮(以NH3表示)会导致水体富营养化。
①电极生物膜电解脱硝是电化学和微生物工艺的组合。电解阴极产生的有活性H原子和阳极生成的有O2,某微生物膜能利用电解产生的活性H原子将
 还原为N2,工作原理如图所示。若阳极生成标准状况下4.48 L气体,理论上可除去NO2的物质的量为
还原为N2,工作原理如图所示。若阳极生成标准状况下4.48 L气体,理论上可除去NO2的物质的量为 反应的离子方程式:
反应的离子方程式:
②用次氯酸钠除去氨氨的原理如图所示。写出该图示的总反应化学方程式:

(3)NaHS可用作污水处理的沉淀剂。已知:25℃时,反应Hg2+(aq)+HS-(aq)⇌HgS(s)+H+(aq)的平衡常数K=1.75×1030,H2S 的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15,Ksp(HgS)=
您最近一年使用:0次
解题方法
5 . 据文献报道:Fe(CO)5催化某反应的一种反应机理如图所示。下列叙述正确的是( )
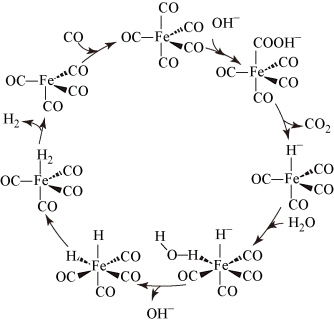

| A.该反应可消耗温室气体CO2 |
| B.OH- 作为中间产物参与了该催化循环 |
| C.该催化循环中Fe的成键数目发生了变化 |
| D.该反应可产生清洁燃料H2 |
您最近一年使用:0次
解题方法
6 . 合成氨是人类科学技术发展史上的一项重大突破,研究表明液氨是一种良好的储氢物质。
(1)研究表明金属催化剂可加速氨气的分解。某温度下,用等质量的不同金属分别催化等浓度的氨气,测得氨气分解生成氢气的初始速率(单位:mmol/min)与催化剂的对应关系如表所示。
①在不同催化剂的催化作用下,氨气分解反应的活化能最大的是______ (填写催化剂的化学式)。
②温度为T时,在恒容的密闭容器中加入2 mol NH3,此时压强为p0,用Ru催化氨气分解,若平衡时氨气的转化率为50%,则该温度下反应2NH3(g) N2(g)+3H2(g)的化学平衡常数Kp=
N2(g)+3H2(g)的化学平衡常数Kp=_____ 。(用平衡分压代替平衡浓度计算,气体分压p分=气体总压p总×体积分数)
(2)关于合成氨工艺的理解,下列说法不正确的是______ (填标号)。
A合成氨工业常采用的反应温度为500 °C左右,主要是为了节约能源
B使用初始反应速率更快的催化剂Ru,不能提高平衡时NH3的产率
C合成氨工业采用的压强为10 MPa~30 MPa,是因为常压下N2和H2的转化率不高
(3)在1 L1 mol/L盐酸中缓缓通入2 mol氨气,请在图1中画出溶液中水电离出的OH-浓度随通入氨气的物质的量变化的趋势图_______ 。

(4)电化学法合成氨:图2是用低温固体质子导体作电解质,

用Pt- CN,作阴极,催化电解H2(g)和N2(g)合成NH3的原理示意图。
①Pt—C3N4电极上产生NH3的电极反应式为_______ 。
②实验研究表明,当外加电压超过一定值后,发现阴极产物中氨气的体积分数随着电压的增大而减小,分析其可能原因:_______ 。
(1)研究表明金属催化剂可加速氨气的分解。某温度下,用等质量的不同金属分别催化等浓度的氨气,测得氨气分解生成氢气的初始速率(单位:mmol/min)与催化剂的对应关系如表所示。
| 催化剂 | Ru | Rh | Ni | Pt | Pd | Fe |
| 初始速率 | 7. 9 | 4.0 | 3.0 | 2.2 | 1.8 | 0.5 |
①在不同催化剂的催化作用下,氨气分解反应的活化能最大的是
②温度为T时,在恒容的密闭容器中加入2 mol NH3,此时压强为p0,用Ru催化氨气分解,若平衡时氨气的转化率为50%,则该温度下反应2NH3(g)
 N2(g)+3H2(g)的化学平衡常数Kp=
N2(g)+3H2(g)的化学平衡常数Kp=(2)关于合成氨工艺的理解,下列说法不正确的是
A合成氨工业常采用的反应温度为500 °C左右,主要是为了节约能源
B使用初始反应速率更快的催化剂Ru,不能提高平衡时NH3的产率
C合成氨工业采用的压强为10 MPa~30 MPa,是因为常压下N2和H2的转化率不高
(3)在1 L1 mol/L盐酸中缓缓通入2 mol氨气,请在图1中画出溶液中水电离出的OH-浓度随通入氨气的物质的量变化的趋势图

(4)电化学法合成氨:图2是用低温固体质子导体作电解质,

用Pt- CN,作阴极,催化电解H2(g)和N2(g)合成NH3的原理示意图。
①Pt—C3N4电极上产生NH3的电极反应式为
②实验研究表明,当外加电压超过一定值后,发现阴极产物中氨气的体积分数随着电压的增大而减小,分析其可能原因:
您最近一年使用:0次
7 . 二甲醚(CH3OCH3)常作为甲基化试剂用于生产硫酸二甲酯,CO2催化加氢合成二甲醚的过程中主要发生下列反应:
反应Ⅰ:CO2(g)+H2(g)⇌CO(g)+H2O(g)ΔH1=+41.2kJ·mol-1
反应Ⅱ:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g)ΔH2=-122.5kJ·mol-1
回答下列问题:
(1)2CO(g)+4H2(g)⇌CH3OCH3(g)+H2O(g)ΔH=______ ,欲提高该反应中CH3OCH3(g)的平衡产率,理论上应采取的措施是______ (填标号)。
A.低压高温B.高压低温C.高压高温D.低压低温
(2)一定温度下,在恒容密闭器容中发生反应Ⅱ,下列能判断反应达到平衡状态的有______ (填标号)。
A.v正(CO2)=2v逆(CH3OCH3)
B.气体的压强不再变化
C单位时间每消耗2molCO2,同时产生1molCH3OCH3
D.H2与H2O的物质的量之比为2:1
(3)在恒压、CO2和H2的起始量一定条件下,CO2平衡转化率和平衡时CO的选择性(CO的选择性= ×100%)随温度的变化如图。T℃时,起始投入2molCO2、6molH2,达到平衡时,反应I理论上消耗H2的物质的量为
×100%)随温度的变化如图。T℃时,起始投入2molCO2、6molH2,达到平衡时,反应I理论上消耗H2的物质的量为______ ;合成二甲醚时较适宜的温度为260℃,其原因是______ 。

(4)一定温度下,向容积为2L的恒容密闭器容中充入CO(g)和H2O(g),发生反应:CO(g)+H2O(g)⇌CO2(g)+H2(g)。CO和H2O的平衡转化率(a)与起始充入的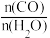 的关系如图所示:
的关系如图所示:

①a:b=______ 。
②图中表示CO变化趋势的曲线为______ (填“L1”或“L2”);该温度下,反应的平衡常数K=______ 。
反应Ⅰ:CO2(g)+H2(g)⇌CO(g)+H2O(g)ΔH1=+41.2kJ·mol-1
反应Ⅱ:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g)ΔH2=-122.5kJ·mol-1
回答下列问题:
(1)2CO(g)+4H2(g)⇌CH3OCH3(g)+H2O(g)ΔH=
A.低压高温B.高压低温C.高压高温D.低压低温
(2)一定温度下,在恒容密闭器容中发生反应Ⅱ,下列能判断反应达到平衡状态的有
A.v正(CO2)=2v逆(CH3OCH3)
B.气体的压强不再变化
C单位时间每消耗2molCO2,同时产生1molCH3OCH3
D.H2与H2O的物质的量之比为2:1
(3)在恒压、CO2和H2的起始量一定条件下,CO2平衡转化率和平衡时CO的选择性(CO的选择性=
 ×100%)随温度的变化如图。T℃时,起始投入2molCO2、6molH2,达到平衡时,反应I理论上消耗H2的物质的量为
×100%)随温度的变化如图。T℃时,起始投入2molCO2、6molH2,达到平衡时,反应I理论上消耗H2的物质的量为
(4)一定温度下,向容积为2L的恒容密闭器容中充入CO(g)和H2O(g),发生反应:CO(g)+H2O(g)⇌CO2(g)+H2(g)。CO和H2O的平衡转化率(a)与起始充入的
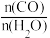 的关系如图所示:
的关系如图所示:
①a:b=
②图中表示CO变化趋势的曲线为
您最近一年使用:0次
解题方法
8 . 乙炔、乙烯均是重要的化工原料。回答下列问题:
(1)1902年,Sabatier首次发现,常压下过渡金属可以催化含有双键或叁键的气态烃的加氢反应。
①已知:C2H2(g)+H2(g)→C2H4ΔH1=—174.3kJ•mol-1 K1(300K)=3.37×1024
C2H2(g)+2H2(g)→C2H6ΔH2=—311.0kJ•mol-1 K2(300K)=1.19×1042
则反应C2H4(g)+H2(g)→C2H6的ΔH=____________ kJ•mol-1,K(300K)=____________ (保留三位有效数字)
②2010年Sheth等得出乙炔在Pd表面选择加氢的反应机理(如图)。其中吸附在Pd表面上的物种用*标注。

上述吸附反应为____________ (填“放热”或“吸热”)反应,该历程中最大能垒(活化能)为____________ kJ•mol-1,该步骤的化学方程式为____________ 。
(2)在恒容密闭容器中充入乙烯,一定条件下发生反应C2H4(g) C2H2(g)+H2(g)。
C2H2(g)+H2(g)。
①乙烯的离解率为α,平衡时容器内气体总压强为p总,则分压p(C2H4)=____________ (用p总和α表示)。
②在1000K时,该反应的Kp=2×10-3atm,平衡时容器内气体的总压强为10atm,则乙烯的离解率为____________ (精确到0.001,已知 ≈1.4)。
≈1.4)。
(3)用如图装置电解含CO2的某酸性废水溶液,阴极产物中含有乙烯。

该分离膜为____________ (填“阳”或“阴”)离子选择性交换膜;生成乙烯的电极反应式为____________ 。
(1)1902年,Sabatier首次发现,常压下过渡金属可以催化含有双键或叁键的气态烃的加氢反应。
①已知:C2H2(g)+H2(g)→C2H4ΔH1=—174.3kJ•mol-1 K1(300K)=3.37×1024
C2H2(g)+2H2(g)→C2H6ΔH2=—311.0kJ•mol-1 K2(300K)=1.19×1042
则反应C2H4(g)+H2(g)→C2H6的ΔH=
②2010年Sheth等得出乙炔在Pd表面选择加氢的反应机理(如图)。其中吸附在Pd表面上的物种用*标注。

上述吸附反应为
(2)在恒容密闭容器中充入乙烯,一定条件下发生反应C2H4(g)
 C2H2(g)+H2(g)。
C2H2(g)+H2(g)。①乙烯的离解率为α,平衡时容器内气体总压强为p总,则分压p(C2H4)=
②在1000K时,该反应的Kp=2×10-3atm,平衡时容器内气体的总压强为10atm,则乙烯的离解率为
 ≈1.4)。
≈1.4)。(3)用如图装置电解含CO2的某酸性废水溶液,阴极产物中含有乙烯。

该分离膜为
您最近一年使用:0次
解题方法
9 . 氨是最为重要的基础化工产品之一,其产量居各种化工产品的首位。合成氨方面的研究共产生了三名诺贝尔奖得主,分别是理论可行性研究、工业化研究和机理研究三个方面,这也代表了现代化学研究的三个方面。
回答下列问题:
I.合成氨反应的机理研究:N2和H2在活性铁表面催化合成NH3的机理如图所示,其中(ad)表示物种的吸附状态。

(1)根据反应历程图,写出合成氨反应的热化学方程式___________ 。
(2)合成氨经历如下五个过程:
 N2(g)+
N2(g)+ H2(g)→N(ad)+3H(ad)i
H2(g)→N(ad)+3H(ad)i
N(ad)+3H(ad)→NH(ad)+2H(ad)ii
NH(ad)+2H(ad)→NH2(ad)+H(ad)iii
NH2(ad)+H(ad)→NH3(ad)iv
NH3(ad)→NH3(g)V
下列说法正确的是___________(填选项字母)。
Ⅱ.合成氨反应的反应条件研究:实验测定不同条件下,平衡时氨气的含量与起始氢氮比[ ]之间的关系如图所示。
]之间的关系如图所示。

(3)T0___________ 420°C(填“<”“>”或“=”,下同)。
(4)a点时的转化率:a(N2)___________ a(H2)。
(5)a、b、c、d四点对应的平衡常数由大到小的顺序为___________ (用Ka、Kb、Kc、Kd表示)。
(6)b点对应的平衡常数Kb=___________ MPa-2(用体系中各物质的分压表示平衡常数,物质的分压=物质的量百分含量×容器的总压,列出计算式即可)。
Ⅲ.合成氨的工业化研究:合成氨的原料气中的杂质会影响氨的合成效率,已知某原料气中含有20%N2、40%H2、30%CO、3%Ar。
(7)在恒压条件下,单位时间通入的气体总量一定时,杂质稀有气体Ar会使N2的平衡转化率降低的原因为___________ 。
回答下列问题:
I.合成氨反应的机理研究:N2和H2在活性铁表面催化合成NH3的机理如图所示,其中(ad)表示物种的吸附状态。

(1)根据反应历程图,写出合成氨反应的热化学方程式
(2)合成氨经历如下五个过程:
 N2(g)+
N2(g)+ H2(g)→N(ad)+3H(ad)i
H2(g)→N(ad)+3H(ad)iN(ad)+3H(ad)→NH(ad)+2H(ad)ii
NH(ad)+2H(ad)→NH2(ad)+H(ad)iii
NH2(ad)+H(ad)→NH3(ad)iv
NH3(ad)→NH3(g)V
下列说法正确的是___________(填选项字母)。
| A.升高温度,过程i的反应速率减慢,过程ii的反应速率加快 |
| B.增大压强,有利于提高过程i的转化率 |
C.使用催化剂时,反应 N2(g)+ N2(g)+ H2(g)→N(g)+3H(g)ΔH<0 H2(g)→N(g)+3H(g)ΔH<0 |
Ⅱ.合成氨反应的反应条件研究:实验测定不同条件下,平衡时氨气的含量与起始氢氮比[
 ]之间的关系如图所示。
]之间的关系如图所示。
(3)T0
(4)a点时的转化率:a(N2)
(5)a、b、c、d四点对应的平衡常数由大到小的顺序为
(6)b点对应的平衡常数Kb=
Ⅲ.合成氨的工业化研究:合成氨的原料气中的杂质会影响氨的合成效率,已知某原料气中含有20%N2、40%H2、30%CO、3%Ar。
(7)在恒压条件下,单位时间通入的气体总量一定时,杂质稀有气体Ar会使N2的平衡转化率降低的原因为
您最近一年使用:0次
2020-07-26更新
|
231次组卷
|
2卷引用:河南省驻马店市2019-2020学年高二下学期期末考试化学试题
10 . 铑的配合物离子[Rh(CO)2I2]-可催化甲醇羰基化,反应过程如图所示。
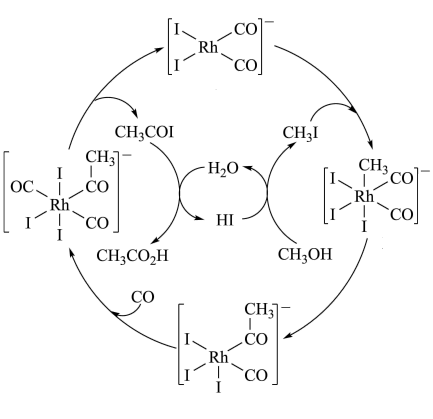
| A.CH3COI是反应中间体 |
| B.甲醇羰基化反应为CH3OH+CO=CH3CO2H |
| C.反应过程中Rh的成键数目保持不变 |
| D.存在反应CH3OH+HI=CH3I+H2O |
您最近一年使用:0次
2020-07-08更新
|
17481次组卷
|
48卷引用:2020年全国统一考试化学试题(新课标Ⅰ)
2020年全国统一考试化学试题(新课标Ⅰ)(已下线)专题07 化学反应中的能量变化-2020年高考真题和模拟题化学分项汇编(已下线)第13讲 原子结构和化学键-2021年高考化学一轮复习名师精讲练河南省郑州市巩义市第四高级中学2021届高三上学期期中考试化学试题(已下线)小题必刷21 原子结构与化学键——2021年高考化学一轮复习小题必刷(通用版)天津市和平区2020-2021学年高二下学期期末考试化学试题2020年全国卷Ⅰ理综化学高考真题变式题黑龙江省哈尔滨市第一二二中学2021-2022学年高三假期检验性考试化学试题(已下线)热点10 新信息反应机理分析-2021年高考化学专练【热点·重点·难点】(已下线)专题10 化学平衡(速率、影响因素、图像、标志、平衡压强及常数)-2021年高考化学必做热点专题(已下线)专题05 化学反应与能量——备战2021年高考化学纠错笔记(已下线)热点7 新信息反应机理分析-2021年高考化学【热点·重点·难点】专练(山东专用)(已下线)押全国卷理综第13题 反应机理图分析、能垒图分析等创新题型及阿伏伽德罗常数-备战2021年高考化学临考题号押题(课标全国卷)(已下线)课时27 微粒间作用力-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点01 物质的组成、性质和分类-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点38 烃的含氧衍生物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点01 物质的组成、性质和分类-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点38 卤代烃 醇 酚-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点39 醛 羧酸 酯-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)一轮巩固卷4-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)(已下线)专题09 反应机理—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)卷08 元素周期律-【小题小卷】冲刺2022年高考化学小题限时集训(全国卷专用)(已下线)秘籍08 反应历程探究与催化原理图象分析-备战2022年高考化学抢分秘籍(全国通用)安徽省合肥市普通高中六校联盟2021-2022学年高二下学期期中联考化学试题(已下线)押全国卷理综第13题 反应机理图分析、能垒图分析等创新题型及阿伏加德罗常数-备战2022年高考化学临考题号押题(全国卷)(已下线)查补易混易错点01 物质的组成、性质、分类及化学用语-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)专题07化学反应中的能量变化及反应机理-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题07化学反应中的能量变化及反应机理-五年(2018~2022)高考真题汇编(全国卷)北京市中国人民大学附属中学2022届高三下学期第三次适应性练习化学试题(已下线)考点01 物质的分类和转化-备战2023年高考化学一轮复习考点帮(全国通用)专题1 揭示物质结构的奥秘 ★第一~三单元综合拔高练四川省内江市第六中学2021-2022学年高二下学期入学考试(创新班)化学试题新疆岳普湖县2021-2022学年高二下学期第一次学情调研测试化学试题(已下线)第18讲 化学反应速率(讲)-2023年高考化学一轮复习讲练测(新教材新高考)黑龙江省大庆市东风中学2022-2023学年高三上学期第一次月考化学试题河南省洛阳市新安县第一高级中学2022-2023学年高三上学期入学测试(实验小班)化学试题湖南省邵阳市洞口县第一中学2021-2022学年高三下学期第三次模拟考试化学试题北京市中国人民大学附属中学2022-2023学年高三上学期统练6化学试题(已下线)广东省深圳中学2023届高三年级上学期第二次阶段测试化学试题(A卷)(已下线)专题13 反应微观机理分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第一部分 二轮专题突破 题型专攻3 化学反应历程图像分析内蒙古赤峰二中2022-2023学年高二下学期第一次月考化学试题广东省2021届高三下学期模拟预热化学试题(已下线)专题10 物质的反应及转化(已下线)热点题型训练 催化剂与反应历程(机理)广东省汕头市金山中学2023-2024学年高二上学期10月阶段考试 化学 Word版含答案(已下线)T12-物质反应及转化江苏省南京市人民中学 海安实验中学 句容三中2023-2024学年高二下学期3月月考化学试题



