名校
1 . 高一年级小村同学最近通过学习了解到:“肼”( )是一种重要的化学物质,可用作喷气式发动机燃料、火箭燃料、显影剂、抗氧剂、还原剂等。请结合数据完成下面有关“肼”的化学问题。
)是一种重要的化学物质,可用作喷气式发动机燃料、火箭燃料、显影剂、抗氧剂、还原剂等。请结合数据完成下面有关“肼”的化学问题。
(1) 属于
属于_______ 化合物(填“离子化合物”或“共价化合物”),所含化学键类型有_______ (填“离子键”或“极性键”或“非极性键”)
(2)已知①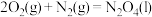
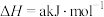
②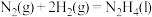
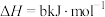
③
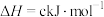
某型号火箭采用液态肼和液态 作推进剂,燃烧生成两种无污染气体。写出反应的热化学方程式
作推进剂,燃烧生成两种无污染气体。写出反应的热化学方程式________ 。
(3)液态肼可以除去水中的溶解氧,且生成物能参与大气循环。写出该反应的热化学方程式________ ,理论上每消耗64 g肼可除去标准状况下
________ L。
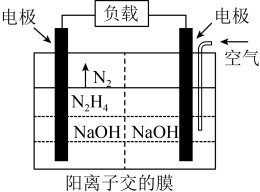
(4)科学家用肼作为燃料电池的燃料,电池结构如图所示,写出负极的电极反应式_________ 。
 )是一种重要的化学物质,可用作喷气式发动机燃料、火箭燃料、显影剂、抗氧剂、还原剂等。请结合数据完成下面有关“肼”的化学问题。
)是一种重要的化学物质,可用作喷气式发动机燃料、火箭燃料、显影剂、抗氧剂、还原剂等。请结合数据完成下面有关“肼”的化学问题。(1)
 属于
属于(2)已知①
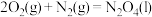
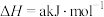
②
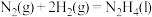
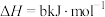
③

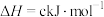
某型号火箭采用液态肼和液态
 作推进剂,燃烧生成两种无污染气体。写出反应的热化学方程式
作推进剂,燃烧生成两种无污染气体。写出反应的热化学方程式(3)液态肼可以除去水中的溶解氧,且生成物能参与大气循环。写出该反应的热化学方程式

(4)科学家用肼作为燃料电池的燃料,电池结构如图所示,写出负极的电极反应式

您最近一年使用:0次
名校
解题方法
2 . 研究 NOx、SO2、CO 等大气污染气体的处理具有重要意义。
(1)NO2、SO2的任意排放均可导致酸雨的产生。请分别写出二者产生酸雨的化学方程式_______ 、____ 。
(2)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。已知:
① CO(g) + 1/2O2(g) = CO2(g) ΔH = -283.0 kJ/mol
② S(s) + O2(g) = SO2(g) ΔH = -296.0 kJ/mol
此方法涉及的热化学方程式是___________ 。
(3)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
① CO(g) + NO2(g) = NO(g) + CO2(g) ΔH = -a kJ/mol (a>0)
② 2CO(g) + 2NO(g) = N2(g) + 2CO2(g) ΔH = -b kJ/mol (b>0)
若用标准状况下 3.36 L CO 还原 NO2 至 N2(CO完全反应)的整个过程中转移电子的物质的量为_____ mol,放出的热量为___ kJ(用含有a和b的代数式表示)。
(1)NO2、SO2的任意排放均可导致酸雨的产生。请分别写出二者产生酸雨的化学方程式
(2)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。已知:
① CO(g) + 1/2O2(g) = CO2(g) ΔH = -283.0 kJ/mol
② S(s) + O2(g) = SO2(g) ΔH = -296.0 kJ/mol
此方法涉及的热化学方程式是
(3)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
① CO(g) + NO2(g) = NO(g) + CO2(g) ΔH = -a kJ/mol (a>0)
② 2CO(g) + 2NO(g) = N2(g) + 2CO2(g) ΔH = -b kJ/mol (b>0)
若用标准状况下 3.36 L CO 还原 NO2 至 N2(CO完全反应)的整个过程中转移电子的物质的量为
您最近一年使用:0次
名校
3 . 氨在国民经济中占有重要地位。
(1)合成氨工业中,合成塔中每产生 ,做出
,做出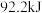 热量。
热量。
①该可逆反应,若起始时向容器内放入 和
和 ,达平衡后放出的热量为Q,则Q(填“>”、“<”或“=”)
,达平衡后放出的热量为Q,则Q(填“>”、“<”或“=”)___________ 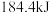 。
。
②在图中画出合成氨反应过程中焓(H)的变化示意图___________ 。
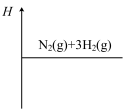
③已知:
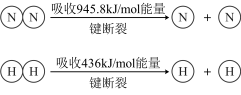
 键断裂吸收的能量约等于
键断裂吸收的能量约等于___________ kJ。
(2)二甲醚 是重要的化工原料,可用
是重要的化工原料,可用 和
和 制得,总反应的热化学方程式如下:
制得,总反应的热化学方程式如下:
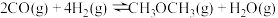
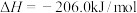
此反应工业中采用“一步法”,通过复合催化剂使下列甲醇合成和甲醇脱水反应同时进行来完成:
i甲醇合成反应:___________ (请补全)
ii甲醇脱水反应: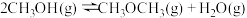 ,
,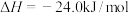
生产二甲醚的过程中存在以下副反应,与甲醇脱水反应形成竞争: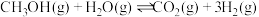 ;
;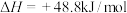
将反应物混合气按进料比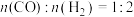 通入反应装置,选择合适的催化剂。
通入反应装置,选择合适的催化剂。
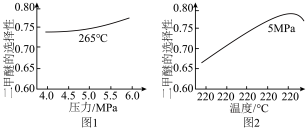
在不同温度和压强下,测得二甲醚的选择性分别如图1、图2所示。
资料:二甲醚的选择性是指转化为二甲醚的 在全部
在全部 反应物中所占的比例。
反应物中所占的比例。
①图1中,温度一定,压强增大,二甲醚选择性增大的原因是___________ 。
②图2中,温度高于265℃后,二甲醚选择性降低的原因有___________ 。
(1)合成氨工业中,合成塔中每产生
 ,做出
,做出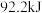 热量。
热量。①该可逆反应,若起始时向容器内放入
 和
和 ,达平衡后放出的热量为Q,则Q(填“>”、“<”或“=”)
,达平衡后放出的热量为Q,则Q(填“>”、“<”或“=”)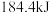 。
。②在图中画出合成氨反应过程中焓(H)的变化示意图

③已知:

 键断裂吸收的能量约等于
键断裂吸收的能量约等于(2)二甲醚
 是重要的化工原料,可用
是重要的化工原料,可用 和
和 制得,总反应的热化学方程式如下:
制得,总反应的热化学方程式如下: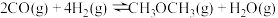
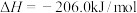
此反应工业中采用“一步法”,通过复合催化剂使下列甲醇合成和甲醇脱水反应同时进行来完成:
i甲醇合成反应:
ii甲醇脱水反应:
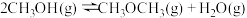 ,
,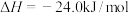
生产二甲醚的过程中存在以下副反应,与甲醇脱水反应形成竞争:
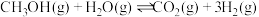 ;
;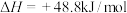
将反应物混合气按进料比
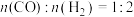 通入反应装置,选择合适的催化剂。
通入反应装置,选择合适的催化剂。在不同温度和压强下,测得二甲醚的选择性分别如图1、图2所示。

资料:二甲醚的选择性是指转化为二甲醚的
 在全部
在全部 反应物中所占的比例。
反应物中所占的比例。①图1中,温度一定,压强增大,二甲醚选择性增大的原因是
②图2中,温度高于265℃后,二甲醚选择性降低的原因有
您最近一年使用:0次
2024-01-08更新
|
86次组卷
|
2卷引用:北京市育才学校2023-2024学年高一上学期化学期中试题
名校
4 . 氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有若重要作用。
(1)如图是1molNO2(g)和ImolCO(g)反应生成1molCO2(g)和1molNO(g)过程中能量变化示意图。
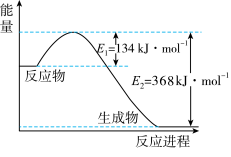
①该反应是___________ (填“吸热”或“放热”)反应。
②请写出反应的热化学方程式___________ 。
③若在反应体系中加入催化剂能使反应热___________ 。(填“增大”、“不变”或"减小")
(2)已知,可逆反应2NO2(g) N2O4(g) △H =-56.9kJ/mol,在乙烧杯中投入一定量的CaO固体,此烧杯中NO2球的红棕色会
N2O4(g) △H =-56.9kJ/mol,在乙烧杯中投入一定量的CaO固体,此烧杯中NO2球的红棕色会______ (填“变深”、“不变”或“变浅”),能量发生这种变化的原因是______ 。
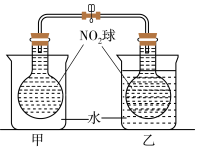
(3)肼(N2H4)是一种应用广泛的化工原料,可能量作为火箭发动机的燃料。已知断裂1mol化学键所需的能量:N≡N为942kJ、O=O为500kJ、N-N为154kJ,则断裂1molN-H键所需的能量是___________ kJ。
(1)如图是1molNO2(g)和ImolCO(g)反应生成1molCO2(g)和1molNO(g)过程中能量变化示意图。

①该反应是
②请写出反应的热化学方程式
③若在反应体系中加入催化剂能使反应热
(2)已知,可逆反应2NO2(g)
 N2O4(g) △H =-56.9kJ/mol,在乙烧杯中投入一定量的CaO固体,此烧杯中NO2球的红棕色会
N2O4(g) △H =-56.9kJ/mol,在乙烧杯中投入一定量的CaO固体,此烧杯中NO2球的红棕色会
(3)肼(N2H4)是一种应用广泛的化工原料,可能量作为火箭发动机的燃料。已知断裂1mol化学键所需的能量:N≡N为942kJ、O=O为500kJ、N-N为154kJ,则断裂1molN-H键所需的能量是

您最近一年使用:0次
名校
5 . 铜冶金技术以火法冶炼为主。
(1)火法炼铜的工艺流程如下:
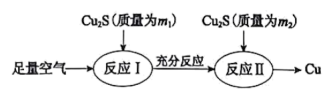
反应I:2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) △H=-768.2kJ·mol-1
反应Ⅱ:2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g) △H=+116.0 kJ·mol-1
①在反应Ⅱ中,每生成1molSO2转移电子___________ mol。
②反应Cu2S(s)+O2(g)=2Cu(s)+SO2(g)的△H=___________ kJ·mol-1 。
③理论上m1:m2=___________ 。
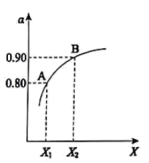
(2)炼铜的副产品SO2多用于制硫酸和石膏等化学产品。制硫酸中重要的一步反应是:2SO2(g)+O2(g) 2SO3(g) △H=-196kJ·mol-1。如图表示将2.0molSO2和1.0molO2置于1L密闭容器中,当其他条件一定时,SO2(g)的平衡转化率α随X的变化关系,X(X1、X2)代表压强或温度。X代表的物理量是
2SO3(g) △H=-196kJ·mol-1。如图表示将2.0molSO2和1.0molO2置于1L密闭容器中,当其他条件一定时,SO2(g)的平衡转化率α随X的变化关系,X(X1、X2)代表压强或温度。X代表的物理量是___________ 。A对应条件下平衡常数K=___________ 。
(3)工业硫酸中往往含有一定量SO2,测定过程如下:取mg工业硫酸配成100mL溶液,取出20.00mL溶液,加入1mL指示剂,用cmol·L-1I2标准溶液滴定,消耗的I2标准溶液VmL,工业硫酸中含有SO2的质量分数的计算式是___________ 。
(1)火法炼铜的工艺流程如下:

反应I:2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) △H=-768.2kJ·mol-1
反应Ⅱ:2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g) △H=+116.0 kJ·mol-1
①在反应Ⅱ中,每生成1molSO2转移电子
②反应Cu2S(s)+O2(g)=2Cu(s)+SO2(g)的△H=
③理论上m1:m2=
(2)炼铜的副产品SO2多用于制硫酸和石膏等化学产品。制硫酸中重要的一步反应是:2SO2(g)+O2(g)
 2SO3(g) △H=-196kJ·mol-1。如图表示将2.0molSO2和1.0molO2置于1L密闭容器中,当其他条件一定时,SO2(g)的平衡转化率α随X的变化关系,X(X1、X2)代表压强或温度。X代表的物理量是
2SO3(g) △H=-196kJ·mol-1。如图表示将2.0molSO2和1.0molO2置于1L密闭容器中,当其他条件一定时,SO2(g)的平衡转化率α随X的变化关系,X(X1、X2)代表压强或温度。X代表的物理量是
(3)工业硫酸中往往含有一定量SO2,测定过程如下:取mg工业硫酸配成100mL溶液,取出20.00mL溶液,加入1mL指示剂,用cmol·L-1I2标准溶液滴定,消耗的I2标准溶液VmL,工业硫酸中含有SO2的质量分数的计算式是
您最近一年使用:0次
6 .  加氢合成低碳烯烃技术在环境保护等方面具有重要意义。以合成
加氢合成低碳烯烃技术在环境保护等方面具有重要意义。以合成 为例,该转化分为两步进行:
为例,该转化分为两步进行:
第一步: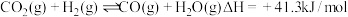
第二步: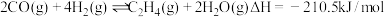
(1)第一步反应的平衡常数表达式
_____ 。
(2) 加氢合成乙烯的热化学方程式是
加氢合成乙烯的热化学方程式是_____ 。
(3)一定条件下的密闭容器中,总反应达到平衡,要提高 的转化率,可以采取的措施是
的转化率,可以采取的措施是_____ (填字母)。
a.低压 b.增大 浓度 c.加入适当催化剂 d.分离出水
浓度 c.加入适当催化剂 d.分离出水
(4)下图是其他条件一定时,反应温度对 平衡转化率影响的曲线(已知:多步递进反应中,条件不同时,反应物转化率可能由不同步骤的反应决定)。在温度高于约
平衡转化率影响的曲线(已知:多步递进反应中,条件不同时,反应物转化率可能由不同步骤的反应决定)。在温度高于约 时,
时, 的平衡转化率随着温度升高而增大的原因是
的平衡转化率随着温度升高而增大的原因是_____ 。

 加氢合成低碳烯烃技术在环境保护等方面具有重要意义。以合成
加氢合成低碳烯烃技术在环境保护等方面具有重要意义。以合成 为例,该转化分为两步进行:
为例,该转化分为两步进行:第一步:
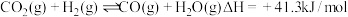
第二步:
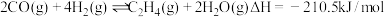
(1)第一步反应的平衡常数表达式

(2)
 加氢合成乙烯的热化学方程式是
加氢合成乙烯的热化学方程式是(3)一定条件下的密闭容器中,总反应达到平衡,要提高
 的转化率,可以采取的措施是
的转化率,可以采取的措施是a.低压 b.增大
 浓度 c.加入适当催化剂 d.分离出水
浓度 c.加入适当催化剂 d.分离出水(4)下图是其他条件一定时,反应温度对
 平衡转化率影响的曲线(已知:多步递进反应中,条件不同时,反应物转化率可能由不同步骤的反应决定)。在温度高于约
平衡转化率影响的曲线(已知:多步递进反应中,条件不同时,反应物转化率可能由不同步骤的反应决定)。在温度高于约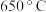 时,
时, 的平衡转化率随着温度升高而增大的原因是
的平衡转化率随着温度升高而增大的原因是
您最近一年使用:0次
名校
解题方法
7 . 化学反应伴随能量变化,获取反应能量变化有多条途径。
(1)下列反应中,属于吸热反应的是_____(填字母)。
(2)获取能量变化的途径
①通过化学键的键能计算。
已知:
计算可得:
_____ 
若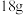 水蒸气转化为液态水放出
水蒸气转化为液态水放出 的热量,则反应
的热量,则反应 的反应热为
的反应热为_____ , 的燃烧热为
的燃烧热为_____
已知
②根据上述数据, 和
和 本身具有的能量最低的是
本身具有的能量最低的是_____
③ 的液态乙醇在氧气中完全燃烧,生成液态水和二氧化碳气体,放出
的液态乙醇在氧气中完全燃烧,生成液态水和二氧化碳气体,放出 的热量,写出该反应的热化学方程式
的热量,写出该反应的热化学方程式_____
(1)下列反应中,属于吸热反应的是_____(填字母)。
A. 与水反应 与水反应 | B.甲烷的燃烧反应 |
C. 与盐酸反应 与盐酸反应 | D.锌与盐酸反应 |
①通过化学键的键能计算。
已知:
| 化学键种类 |  |  |  |  |  |
键能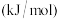 | 436 | 498 | 463.4 | 432 | 366 |

若
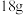 水蒸气转化为液态水放出
水蒸气转化为液态水放出 的热量,则反应
的热量,则反应 的反应热为
的反应热为 的燃烧热为
的燃烧热为已知
②根据上述数据,
 和
和 本身具有的能量最低的是
本身具有的能量最低的是③
 的液态乙醇在氧气中完全燃烧,生成液态水和二氧化碳气体,放出
的液态乙醇在氧气中完全燃烧,生成液态水和二氧化碳气体,放出 的热量,写出该反应的热化学方程式
的热量,写出该反应的热化学方程式
您最近一年使用:0次
解题方法
8 . 煤的综合利用是合理利用资源,实现“绿色发展”的重要途径。图是某煤化工产业链的一部分
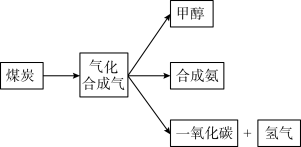
(1)已知:
a. C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1
b. 2H2(g)+O2(g)=2H2O(g) ΔH=-484.0 kJ·mol-1
c. CO(g)+ O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
①计算反应a消耗24 g C(s)时,反应放出的热量为_______ kJ。
②为加快水煤气(CO和H2混合气)的生产速率可采取措施有_______ 。
A. 将煤炭粉碎 B. 降低温度 C. 增大反应容器体积 D. 使用催化剂
③根据已知,写出 C(s)与H2O(g)反应制备水煤气的热化学方程式是_______ 。
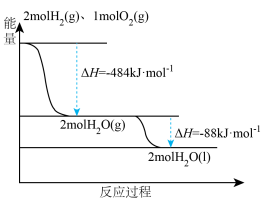
(2)煤气化后得到气体中的氢气是一种新型的绿色能源,根据如图,写出表示氢气燃烧热的热化学方程式为_______
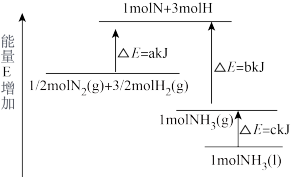
(3)工业合成氨用途广泛,其能量变化如图所示,根据图示,写出合成N2(g)和H2(g)合成液态氨的热化学方程式_______ 。

(1)已知:
a. C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1
b. 2H2(g)+O2(g)=2H2O(g) ΔH=-484.0 kJ·mol-1
c. CO(g)+
 O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1①计算反应a消耗24 g C(s)时,反应放出的热量为
②为加快水煤气(CO和H2混合气)的生产速率可采取措施有
A. 将煤炭粉碎 B. 降低温度 C. 增大反应容器体积 D. 使用催化剂
③根据已知,写出 C(s)与H2O(g)反应制备水煤气的热化学方程式是
(2)煤气化后得到气体中的氢气是一种新型的绿色能源,根据如图,写出表示氢气燃烧热的热化学方程式为

(3)工业合成氨用途广泛,其能量变化如图所示,根据图示,写出合成N2(g)和H2(g)合成液态氨的热化学方程式

您最近一年使用:0次
名校
9 . 已知:① 2H2(g) + O2(g) = 2H2O(l) ΔH = -572 kJ/mol
② 2H2 (g) + SO2 (g) S (g) + 2H2O (g) ΔH =+ 90.4 kJ/mol
S (g) + 2H2O (g) ΔH =+ 90.4 kJ/mol
③ 2H2 (g) + CO (g) CH3OH (g) ΔH =-90.8 kJ/mol
CH3OH (g) ΔH =-90.8 kJ/mol
(1)上述变化过程中放出热量的是_______ (填序号,下同),吸收热量的是_______ 。
(2)反应①热量变化为57.2kJ,转化H2的质量是_______ g。
(3)反应②2 g H2 (g) 完全反应生成硫单质时,ΔH =_______ kJ/mol。
(4)反应③2molH2和1molCO放入密闭容器中充分反应,放出的热量_______ 90.8KJ(填“大于”或“小于”或“等于”)
② 2H2 (g) + SO2 (g)
 S (g) + 2H2O (g) ΔH =+ 90.4 kJ/mol
S (g) + 2H2O (g) ΔH =+ 90.4 kJ/mol③ 2H2 (g) + CO (g)
 CH3OH (g) ΔH =-90.8 kJ/mol
CH3OH (g) ΔH =-90.8 kJ/mol(1)上述变化过程中放出热量的是
(2)反应①热量变化为57.2kJ,转化H2的质量是
(3)反应②2 g H2 (g) 完全反应生成硫单质时,ΔH =
(4)反应③2molH2和1molCO放入密闭容器中充分反应,放出的热量
您最近一年使用:0次
2022-10-12更新
|
128次组卷
|
2卷引用:北京市顺义区第一中学2022-2023学年高二上学期10月月考化学试题
解题方法
10 . 填空。
(1)已知:I.2NaOH(s)+CO2(g)=Na2CO3(s)+H2O(g) ΔH1=−127.4kJ·mol−1
II.NaOH(s)+CO2(g)=NaHCO3(s) ΔH2=−131.5kJ·mol−1
则NaHCO3晶体可制备碳酸钠的热化学方程式为:_______ 。
(2)NOx是汽车尾气中的主要污染物之一、汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:

写出该反应的△H=_______ kJ·mol−1,随温度升高,该反应化学平衡常数的变化趋势是_______ 。(填“变大”“变小”或“不变”)。
(1)已知:I.2NaOH(s)+CO2(g)=Na2CO3(s)+H2O(g) ΔH1=−127.4kJ·mol−1
II.NaOH(s)+CO2(g)=NaHCO3(s) ΔH2=−131.5kJ·mol−1
则NaHCO3晶体可制备碳酸钠的热化学方程式为:
(2)NOx是汽车尾气中的主要污染物之一、汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:

写出该反应的△H=
您最近一年使用:0次



