解题方法
1 . 游离态氮称为惰性氮,游离态氮转化为化合态氮称之为氮的活化,在氮的循环系统中,氮的过量“活化”会导致氮向大气和水体过量迁移,氮的循环平衡被打破,导致全球环境问题。
已知:SO2、CO、NH3等都可以催化还原氮氧化物生成惰性氮。
在25℃,101kPa时,
a.
b.
c.
(1)结合以上热化学方程式,写出NO与NH3反应生成惰性氮的热化学方程式_______ 。
(2)工业合成氨是氮的活化重要途径之一,在一定条件下,将N2和H2通入到体积为1L的恒容容器中,下列说法能说明该可逆反应达到平衡状态的是_______(填字母)。
(3)在合成氨工业中,为提高化学反应速率并提高原料的平衡转化率可采取的措施为_____(填字母)。
(4)在有氧条件下,新型催化剂M能催化CO与 反应生成N2,该反应的方程式为
反应生成N2,该反应的方程式为 。
。
①现向某密闭容器中充入等物质的量浓度的 和CO气体,维持恒温恒容,在催化剂作用下发生反应。相关数据如下:
和CO气体,维持恒温恒容,在催化剂作用下发生反应。相关数据如下:
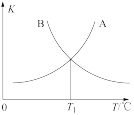
在0~5min内,以CO2的浓度变化表示的反应速率为_______ mol/(L·min),在10min时,CO的转化率为_______ 。此温度下,该反应的化学平衡常数K=_______ (保留两位有效数字)。
②该反应的正、逆反应的平衡常数(K)与温度(T)的关系如图所示,其中表示正反应的平衡常数(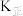 )的是
)的是_______ (填“A”或“B”),原因是_______ 。
已知:SO2、CO、NH3等都可以催化还原氮氧化物生成惰性氮。
在25℃,101kPa时,
a.

b.

c.

(1)结合以上热化学方程式,写出NO与NH3反应生成惰性氮的热化学方程式
(2)工业合成氨是氮的活化重要途径之一,在一定条件下,将N2和H2通入到体积为1L的恒容容器中,下列说法能说明该可逆反应达到平衡状态的是_______(填字母)。
| A.容器中气体密度不变 | B. |
| C.容器中压强不变 | D.N2、H2、NH3分子数之比为1:3:2 |
| A.升高温度 | B.将氨液化从体系中分离 |
| C.加入催化剂 | D.增大压强 |
 反应生成N2,该反应的方程式为
反应生成N2,该反应的方程式为 。
。①现向某密闭容器中充入等物质的量浓度的
 和CO气体,维持恒温恒容,在催化剂作用下发生反应。相关数据如下:
和CO气体,维持恒温恒容,在催化剂作用下发生反应。相关数据如下:| 0min | 5min | 10min | 15min | 20min | |
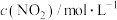 | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
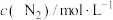 | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
②该反应的正、逆反应的平衡常数(K)与温度(T)的关系如图所示,其中表示正反应的平衡常数(
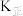 )的是
)的是
您最近一年使用:0次
解题方法
2 . 钛(Ti)被称为“未来金属”,广泛应用于国防、航空航天、材料等领域。
(1)基态钛原子的价电子排布式为_______ 。
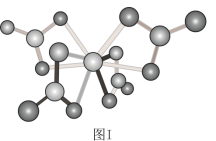
(2)钛可与高于70℃的浓硝酸发生反应,生成Ti(NO3)4.其球棍结构如图Ⅰ,Ti的配位数是_______ ,试㝍出该反应的方程式_______ 。
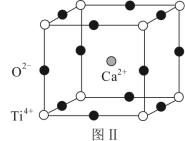
(3)钙钛矿(CaTiO3)是自然界中的一种常见矿物,其晶胞结构如图Ⅱ.设NA为阿伏加德罗常数的值,计算一个晶胞的质量为_______ g。
(4)TiCl4是由钛精矿(主要成分为TiO2制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如图:


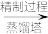
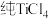
资料:TiCl4及所含杂质氯化物的性质
TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) △H1=+175.4kJ·mol-1
2C(s)+O2(g)=2CO(g) △H2=-220.9kJ·mol-1
①沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式_______ 。
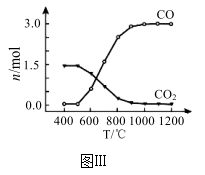
②氯化过程中CO和CO2可以相互转化,根据如图Ⅲ判断:CO2生成CO反应的△H_______ 0(填“>”“<”或“=”),判断依据_______ 。
(1)基态钛原子的价电子排布式为
(2)钛可与高于70℃的浓硝酸发生反应,生成Ti(NO3)4.其球棍结构如图Ⅰ,Ti的配位数是

(3)钙钛矿(CaTiO3)是自然界中的一种常见矿物,其晶胞结构如图Ⅱ.设NA为阿伏加德罗常数的值,计算一个晶胞的质量为

(4)TiCl4是由钛精矿(主要成分为TiO2制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如图:


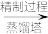
资料:TiCl4及所含杂质氯化物的性质
| 化合物 | SiCl4 | TiCl4 | AlCl3 | FeCl3 | MgCl2 |
| 沸点/℃ | 58 | 136 | 181(升华) | 316 | 1412 |
| 熔点/℃ | -69 | -25 | 193 | 304 | 714 |
| 在TiCl4中的溶解性 | 互溶 | — | 微溶 | 难溶 | |
TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) △H1=+175.4kJ·mol-1
2C(s)+O2(g)=2CO(g) △H2=-220.9kJ·mol-1
①沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式
②氯化过程中CO和CO2可以相互转化,根据如图Ⅲ判断:CO2生成CO反应的△H

您最近一年使用:0次
2022-04-09更新
|
504次组卷
|
4卷引用:天津市2022届高三下学期普通高中学业水平等级性考试模拟预测化学试题
天津市2022届高三下学期普通高中学业水平等级性考试模拟预测化学试题天津市和平区2022届高三一模化学试题(已下线)2022年辽宁省高考真题变式题(16-19)(已下线)2022年辽宁高考真题化学试题变式题(原理综合题)
3 . 用H2O2、KI和洗洁精可完成“大象牙膏”实验(短时间内产生大量泡沫),某同学依据文献资料对该实验进行探究。
(1)资料1:KI在该反应中的作用:H2O2 + I = H2O + IO
= H2O + IO ;H2O2 + IO
;H2O2 + IO = H2O + O2↑+ I
= H2O + O2↑+ I 。总反应的化学方程式是
。总反应的化学方程式是_______________________________________________ 。
(2)资料2:H2O2分解反应过程中能量变化如图所示,其中①有KI加入,②无KI加入。下列判断正确的是______ (填字母)。
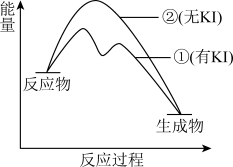
a.加入KI后改变了反应的路径
b.加入KI后改变了总反应的能量变化
c.H2O2 + I = H2O + IO
= H2O + IO 是放热反应
是放热反应
(3)实验中发现,H2O2与KI溶液混合后,产生大量气泡,溶液颜色变黄。再加入CCl4,振荡、静置,气泡明显减少。
资料3:I2也可催化H2O2的分解反应。
① 加CCl4并振荡、静置后还可观察到___________________________________ ,说明有I2生成。
② 气泡明显减少的原因可能是:
ⅰ. H2O2浓度降低;
ⅱ._________________________________________ 。
以下对照实验说明ⅰ不是主要原因:向H2O2溶液中加入KI溶液,待溶液变黄后,分成两等份于A、B两试管中。A试管加入CCl4,B试管不加CCl4,分别振荡、静置。观察到的现象是________________________ 。
(4)资料4:I + I
+ I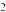
 I
I K= 640。
K= 640。
为了探究体系中含碘微粒的存在形式,进行实验:向20 mL一定浓度的H2O2溶液中加入10 mL 0.10 mol·L-1 KI溶液,达平衡后,相关微粒浓度如下:
① a =____________________ 。
② 该平衡体系中除了含有I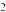 、I
、I 和I
和I 外,一定还含有其他含碘微粒,理由是
外,一定还含有其他含碘微粒,理由是_____________________ 。
(1)资料1:KI在该反应中的作用:H2O2 + I
 = H2O + IO
= H2O + IO ;H2O2 + IO
;H2O2 + IO = H2O + O2↑+ I
= H2O + O2↑+ I 。总反应的化学方程式是
。总反应的化学方程式是(2)资料2:H2O2分解反应过程中能量变化如图所示,其中①有KI加入,②无KI加入。下列判断正确的是

a.加入KI后改变了反应的路径
b.加入KI后改变了总反应的能量变化
c.H2O2 + I
 = H2O + IO
= H2O + IO 是放热反应
是放热反应(3)实验中发现,H2O2与KI溶液混合后,产生大量气泡,溶液颜色变黄。再加入CCl4,振荡、静置,气泡明显减少。
资料3:I2也可催化H2O2的分解反应。
① 加CCl4并振荡、静置后还可观察到
② 气泡明显减少的原因可能是:
ⅰ. H2O2浓度降低;
ⅱ.
以下对照实验说明ⅰ不是主要原因:向H2O2溶液中加入KI溶液,待溶液变黄后,分成两等份于A、B两试管中。A试管加入CCl4,B试管不加CCl4,分别振荡、静置。观察到的现象是
(4)资料4:I
 + I
+ I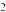
 I
I K= 640。
K= 640。为了探究体系中含碘微粒的存在形式,进行实验:向20 mL一定浓度的H2O2溶液中加入10 mL 0.10 mol·L-1 KI溶液,达平衡后,相关微粒浓度如下:
| 微粒 | I | I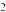 | I |
| 浓度/ (mol·L-1) | 2.5×10-3 | a | 4.0×10-3 |
② 该平衡体系中除了含有I
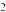 、I
、I 和I
和I 外,一定还含有其他含碘微粒,理由是
外,一定还含有其他含碘微粒,理由是
您最近一年使用:0次
2020-01-23更新
|
356次组卷
|
11卷引用:北京市2020普通高中学业水平考试等级性抽样测试化学试题
北京市2020普通高中学业水平考试等级性抽样测试化学试题2020年北京新高考试测化学试题北京市海淀区清华大学附属中学2020届高三下学期统一测试化学试题(已下线)易错11 影响化学反应速率的因素-备战2021年高考化学一轮复习易错题内蒙古赤峰二中2021-2022学年高三上学期第一次月考化学试题(已下线)第20讲 化学反应速率(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第七章 化学反应速率与化学平衡 第40练 化学反应速率北京师范大学附中2019-2020学年高二上学期期中考试化学试题湖北省武汉市武昌区武汉中学2019-2020学年高二上学期化学(人教版选修4)期末复习试题:专题19 大题综合训练北京市第十四中学2021-2022学年高二上学期期中考试化学试题浙江省嘉兴市第一中学2022-2023学年高二上学期期中检测化学试题
名校
解题方法
4 . AlN新型材料应用前景广泛,其制备与性质研究成为热点。
相关数据如下:
(1)AlN的制备。
① 化学气相沉积法。
Ⅰ.一定温度下,以AlCl3气体和NH3为原料制备AlN,反应的化学方程式是____________________ 。
Ⅱ.上述反应适宜的温度范围是______ ℃(填字母)。
a.75~100 b.600~1100 c.2000~2300
② 铝粉直接氮化法。
Al与N2可直接化合为AlN固体,AlN能将Al包裹,反应难以继续进行。控制温度,在Al粉中均匀掺入适量Mg粉,可使Al几乎全部转化为AlN固体。该过程发生的反应有:__________________ 、_________ 和2Al + N2  2AlN。
2AlN。
③碳热还原法。
以Al2O3、C(石墨)和N2为原料,在高温下制备AlN。
已知:ⅰ. 2Al2O3(s) ⇌ 4Al(g) + 3O2(g) ∆H 1 =+3351 kJ·mol-1
ⅱ. 2C(石墨,s) + O2(g) = 2CO(g) ∆H 2 =-221 kJ·mol-1
ⅲ. 2Al(g) + N2(g) = 2AlN(s) ∆H 3 =-318 kJ·mol-1
运用平衡移动原理分析反应ⅱ对反应ⅰ的可能影响:______________________________________ 。
(2)AlN的性质。AlN粉末可发生水解。相同条件下,不同粒径的AlN粉末水解时溶液pH的变化如图所示。
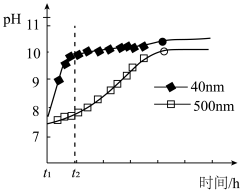
① AlN粉末水解的化学方程式是____________________________________ 。
② 解释t1-t2时间内两条曲线差异的可能原因:_______________________________ 。
(3)AlN含量检测。向a g AlN样品中加入足量浓NaOH溶液,然后通入水蒸气将NH3全部蒸出,将NH3用过量的v1 mL c1 mol·L-1 H2SO4溶液吸收完全,剩余的H2SO4用v2 mL c2 mol·L-1 NaOH溶液恰好中和,则样品中AlN的质量分数是________________________________ 。
相关数据如下:
| 物质 | 熔点/℃ | 沸点/℃ | 与N2反应温度/℃ | 相应化合物分解温度/℃ |
| Al | 660 | 2467 | >800 | AlN:>2000 (>1400升华) AlCl3:(>181升华) |
| Mg | 649 | 1090 | >300 | Mg3N2:>800 |
① 化学气相沉积法。
Ⅰ.一定温度下,以AlCl3气体和NH3为原料制备AlN,反应的化学方程式是
Ⅱ.上述反应适宜的温度范围是
a.75~100 b.600~1100 c.2000~2300
② 铝粉直接氮化法。
Al与N2可直接化合为AlN固体,AlN能将Al包裹,反应难以继续进行。控制温度,在Al粉中均匀掺入适量Mg粉,可使Al几乎全部转化为AlN固体。该过程发生的反应有:
 2AlN。
2AlN。③碳热还原法。
以Al2O3、C(石墨)和N2为原料,在高温下制备AlN。
已知:ⅰ. 2Al2O3(s) ⇌ 4Al(g) + 3O2(g) ∆H 1 =+3351 kJ·mol-1
ⅱ. 2C(石墨,s) + O2(g) = 2CO(g) ∆H 2 =-221 kJ·mol-1
ⅲ. 2Al(g) + N2(g) = 2AlN(s) ∆H 3 =-318 kJ·mol-1
运用平衡移动原理分析反应ⅱ对反应ⅰ的可能影响:
(2)AlN的性质。AlN粉末可发生水解。相同条件下,不同粒径的AlN粉末水解时溶液pH的变化如图所示。

① AlN粉末水解的化学方程式是
② 解释t1-t2时间内两条曲线差异的可能原因:
(3)AlN含量检测。向a g AlN样品中加入足量浓NaOH溶液,然后通入水蒸气将NH3全部蒸出,将NH3用过量的v1 mL c1 mol·L-1 H2SO4溶液吸收完全,剩余的H2SO4用v2 mL c2 mol·L-1 NaOH溶液恰好中和,则样品中AlN的质量分数是
您最近一年使用:0次
2020-01-23更新
|
325次组卷
|
4卷引用:北京市2020普通高中学业水平考试等级性抽样测试化学试题
5 . 偏二甲肼( )、肼(
)、肼( )和四氧化二氧(
)和四氧化二氧( )可作为运载火箭的推进剂。
)可作为运载火箭的推进剂。
(1)已知: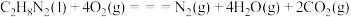



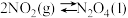

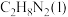 和
和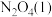 反应生成
反应生成 、
、 和
和 并放出大量热,写出该反应的热化学方程式(
并放出大量热,写出该反应的热化学方程式( 用含
用含 、
、 、
、 的代数式表示)
的代数式表示)__________ 。该反应______ (填“是”或“不是”)自发反应,判断的理由是_______ 。
(2)肼( )也可用于新型环保燃料电池中,燃料电池的工作原理示意图如图1所示,该燃料电池的负极反应式为
)也可用于新型环保燃料电池中,燃料电池的工作原理示意图如图1所示,该燃料电池的负极反应式为_________________________________ 。
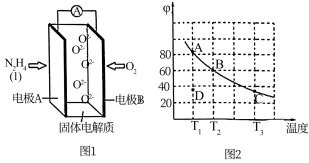
(3)将4molN2O4放入2 L,恒容密闭容器中发生反应N2O4(g) 2NO2(g),平衡体系中N2O4的体积分数(
2NO2(g),平衡体系中N2O4的体积分数(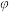 )随温度的变化如图2所示
)随温度的变化如图2所示
①D点v(正)________ v(逆)(填“>”“=”或“<”)。
②A、B、C点中平衡常数K的值最大的是________ 点。 时,N2O4的平衡转化率为
时,N2O4的平衡转化率为________ ;若达平衡时间为5 s,则此时间内的 平均反应速率为
平均反应速率为________ 。
③若其条件不变,在 原平衡基础上,再加入一定量
原平衡基础上,再加入一定量 ,达到新平衡时,与原平衡相比,NO2的体积分数
,达到新平衡时,与原平衡相比,NO2的体积分数________ (填“增大”“不变”或“减小”)。
 )、肼(
)、肼( )和四氧化二氧(
)和四氧化二氧( )可作为运载火箭的推进剂。
)可作为运载火箭的推进剂。(1)已知:
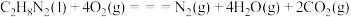



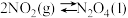

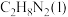 和
和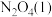 反应生成
反应生成 、
、 和
和 并放出大量热,写出该反应的热化学方程式(
并放出大量热,写出该反应的热化学方程式( 用含
用含 、
、 、
、 的代数式表示)
的代数式表示)(2)肼(
 )也可用于新型环保燃料电池中,燃料电池的工作原理示意图如图1所示,该燃料电池的负极反应式为
)也可用于新型环保燃料电池中,燃料电池的工作原理示意图如图1所示,该燃料电池的负极反应式为
(3)将4molN2O4放入2 L,恒容密闭容器中发生反应N2O4(g)
 2NO2(g),平衡体系中N2O4的体积分数(
2NO2(g),平衡体系中N2O4的体积分数(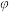 )随温度的变化如图2所示
)随温度的变化如图2所示①D点v(正)
②A、B、C点中平衡常数K的值最大的是
 时,N2O4的平衡转化率为
时,N2O4的平衡转化率为 平均反应速率为
平均反应速率为③若其条件不变,在
 原平衡基础上,再加入一定量
原平衡基础上,再加入一定量 ,达到新平衡时,与原平衡相比,NO2的体积分数
,达到新平衡时,与原平衡相比,NO2的体积分数
您最近一年使用:0次
2020-01-10更新
|
429次组卷
|
5卷引用:2020年天津市学业水平等级考适应性测试化学试题



