游离态氮称为惰性氮,游离态氮转化为化合态氮称之为氮的活化,在氮的循环系统中,氮的过量“活化”会导致氮向大气和水体过量迁移,氮的循环平衡被打破,导致全球环境问题。
已知:SO2、CO、NH3等都可以催化还原氮氧化物生成惰性氮。
在25℃,101kPa时,
a.
b.
c.
(1)结合以上热化学方程式,写出NO与NH3反应生成惰性氮的热化学方程式_______ 。
(2)工业合成氨是氮的活化重要途径之一,在一定条件下,将N2和H2通入到体积为1L的恒容容器中,下列说法能说明该可逆反应达到平衡状态的是_______(填字母)。
(3)在合成氨工业中,为提高化学反应速率并提高原料的平衡转化率可采取的措施为_____(填字母)。
(4)在有氧条件下,新型催化剂M能催化CO与 反应生成N2,该反应的方程式为
反应生成N2,该反应的方程式为 。
。
①现向某密闭容器中充入等物质的量浓度的 和CO气体,维持恒温恒容,在催化剂作用下发生反应。相关数据如下:
和CO气体,维持恒温恒容,在催化剂作用下发生反应。相关数据如下:
在0~5min内,以CO2的浓度变化表示的反应速率为_______ mol/(L·min),在10min时,CO的转化率为_______ 。此温度下,该反应的化学平衡常数K=_______ (保留两位有效数字)。
②该反应的正、逆反应的平衡常数(K)与温度(T)的关系如图所示,其中表示正反应的平衡常数(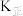 )的是
)的是_______ (填“A”或“B”),原因是_______ 。
已知:SO2、CO、NH3等都可以催化还原氮氧化物生成惰性氮。
在25℃,101kPa时,
a.

b.

c.

(1)结合以上热化学方程式,写出NO与NH3反应生成惰性氮的热化学方程式
(2)工业合成氨是氮的活化重要途径之一,在一定条件下,将N2和H2通入到体积为1L的恒容容器中,下列说法能说明该可逆反应达到平衡状态的是_______(填字母)。
| A.容器中气体密度不变 | B. |
| C.容器中压强不变 | D.N2、H2、NH3分子数之比为1:3:2 |
| A.升高温度 | B.将氨液化从体系中分离 |
| C.加入催化剂 | D.增大压强 |
 反应生成N2,该反应的方程式为
反应生成N2,该反应的方程式为 。
。①现向某密闭容器中充入等物质的量浓度的
 和CO气体,维持恒温恒容,在催化剂作用下发生反应。相关数据如下:
和CO气体,维持恒温恒容,在催化剂作用下发生反应。相关数据如下:| 0min | 5min | 10min | 15min | 20min | |
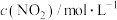 | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
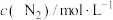 | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
②该反应的正、逆反应的平衡常数(K)与温度(T)的关系如图所示,其中表示正反应的平衡常数(
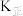 )的是
)的是
更新时间:2022-08-24 18:06:18
|
相似题推荐
【推荐1】工业上,根据氢气来源将氢气分三类:绿氢、蓝氢和灰氢。电解水制得的氢为绿氢,用天然气制得的氢为蓝氢,用煤炭制得的氢为灰氢。
(1)制灰氢时每生成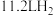 (标准状况)吸收的热量为65.7kJ,写出制备灰氢(氧化产物为CO)的热化学方程式:
(标准状况)吸收的热量为65.7kJ,写出制备灰氢(氧化产物为CO)的热化学方程式:_______ 。
(2)一定温度下,向刚性密闭容器中充入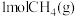 和
和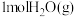 ,初始总压强为20kPa,发生下列反应制备蓝氢。
,初始总压强为20kPa,发生下列反应制备蓝氢。
反应1:
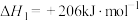
反应2:
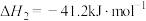
①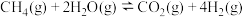

_______  。
。
②达到平衡时, 的转化率为50%,
的转化率为50%, 为0.1mol。此温度下,反应2的平衡常数
为0.1mol。此温度下,反应2的平衡常数
_______ 。(提示:分压=总压×物质的量分数)
(3)在体积可变的密闭容器中充入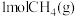 和
和 ,同时发生(2)中的反应1和反应2,测得平衡时体系中
,同时发生(2)中的反应1和反应2,测得平衡时体系中 体积分数与温度、压强关系如图所示。
体积分数与温度、压强关系如图所示。
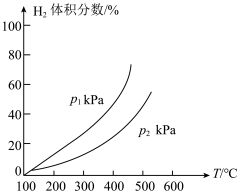
①
_______ (填“>”“<”或“=”) 。
。
②随着温度升高,曲线斜率增大的主要原因是_______ 。
(4)一种脱除和利用蓝氢中 的方法示意图如下:
的方法示意图如下:
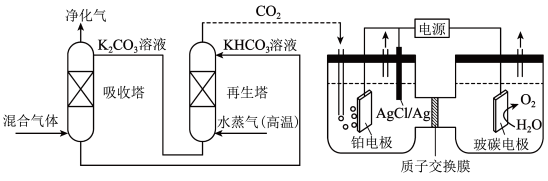
①再生塔中通入水蒸气(高温)的目的是_______ 。
②某温度下,吸收塔中 溶液吸收一定量的
溶液吸收一定量的 后,
后, ,则该溶液的
,则该溶液的
_______ 。(该温度下 的
的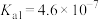 ,
,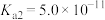 )
)
③利用电化学原理,将 电催化还原为
电催化还原为 ,阴极的电极反应式为
,阴极的电极反应式为_______ 。
(1)制灰氢时每生成
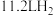 (标准状况)吸收的热量为65.7kJ,写出制备灰氢(氧化产物为CO)的热化学方程式:
(标准状况)吸收的热量为65.7kJ,写出制备灰氢(氧化产物为CO)的热化学方程式:(2)一定温度下,向刚性密闭容器中充入
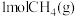 和
和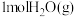 ,初始总压强为20kPa,发生下列反应制备蓝氢。
,初始总压强为20kPa,发生下列反应制备蓝氢。反应1:

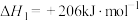
反应2:

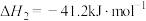
①
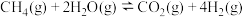

 。
。②达到平衡时,
 的转化率为50%,
的转化率为50%, 为0.1mol。此温度下,反应2的平衡常数
为0.1mol。此温度下,反应2的平衡常数
(3)在体积可变的密闭容器中充入
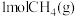 和
和 ,同时发生(2)中的反应1和反应2,测得平衡时体系中
,同时发生(2)中的反应1和反应2,测得平衡时体系中 体积分数与温度、压强关系如图所示。
体积分数与温度、压强关系如图所示。
①

 。
。②随着温度升高,曲线斜率增大的主要原因是
(4)一种脱除和利用蓝氢中
 的方法示意图如下:
的方法示意图如下:
①再生塔中通入水蒸气(高温)的目的是
②某温度下,吸收塔中
 溶液吸收一定量的
溶液吸收一定量的 后,
后, ,则该溶液的
,则该溶液的
 的
的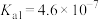 ,
,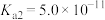 )
)③利用电化学原理,将
 电催化还原为
电催化还原为 ,阴极的电极反应式为
,阴极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】近年来我国大力加强温室气体 催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。回答下列问题:
催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。回答下列问题:
(1)已知:
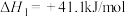


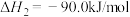

写出 催化氢化合成甲醇的热化学方程式:
催化氢化合成甲醇的热化学方程式:___________ ;并用 、
、 表示此反应的化学平衡常数
表示此反应的化学平衡常数
___________ 。
(2)为提高 的产率,理论上应采用的条件是
的产率,理论上应采用的条件是___________ (填字母)。
a.高温、高压 b.低温、低压 c.高温、低压 d.低温、高压
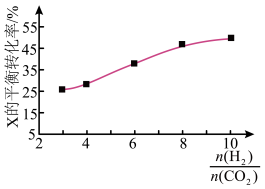
(3)在250℃时,在某恒容密闭容器中进行由 催化氢化合成
催化氢化合成 的反应,如图为不同投料比[
的反应,如图为不同投料比[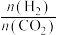 ]时某反应物X的平衡转化率的变化曲线。则反应物X是
]时某反应物X的平衡转化率的变化曲线。则反应物X是___________ (填“ ”或“
”或“ ”)。
”)。
(4)在250℃时,在 的恒容密闭容器中加入
的恒容密闭容器中加入
 、
、
 及催化剂,
及催化剂, 时反应达到平衡,测得
时反应达到平衡,测得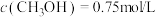 。
。
①前 内
内 的平均反应速率
的平均反应速率
___________  。
。
②化学平衡常数
___________ (用分数表示)。
③下列描述中能说明上述反应已达平衡的是___________ (填字母)。
a.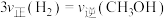
b.单位时间内生成
 的同时生成
的同时生成

c.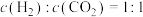
d.容器中气体的平均相对分子质量不随时间而变化
④催化剂和反应条件与反应物的转化率和产物的选择性高度相关。控制相同投料比和相同反应时间,得到如下表四组实验数据。
根据上表所给数据,用 生产甲醇的最优条件为
生产甲醇的最优条件为___________ (填实验编号)。
 催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。回答下列问题:
催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。回答下列问题:(1)已知:

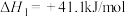


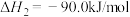

写出
 催化氢化合成甲醇的热化学方程式:
催化氢化合成甲醇的热化学方程式: 、
、 表示此反应的化学平衡常数
表示此反应的化学平衡常数
(2)为提高
 的产率,理论上应采用的条件是
的产率,理论上应采用的条件是a.高温、高压 b.低温、低压 c.高温、低压 d.低温、高压
(3)在250℃时,在某恒容密闭容器中进行由
 催化氢化合成
催化氢化合成 的反应,如图为不同投料比[
的反应,如图为不同投料比[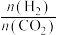 ]时某反应物X的平衡转化率的变化曲线。则反应物X是
]时某反应物X的平衡转化率的变化曲线。则反应物X是 ”或“
”或“ ”)。
”)。
(4)在250℃时,在
 的恒容密闭容器中加入
的恒容密闭容器中加入
 、
、
 及催化剂,
及催化剂, 时反应达到平衡,测得
时反应达到平衡,测得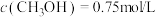 。
。①前
 内
内 的平均反应速率
的平均反应速率
 。
。②化学平衡常数

③下列描述中能说明上述反应已达平衡的是
a.
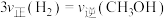
b.单位时间内生成

 的同时生成
的同时生成

c.
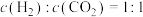
d.容器中气体的平均相对分子质量不随时间而变化
④催化剂和反应条件与反应物的转化率和产物的选择性高度相关。控制相同投料比和相同反应时间,得到如下表四组实验数据。
| 实验编号 | 温度/K | 催化剂 |  的转化率/% 的转化率/% | 甲醇的选择性/% |
| A | 543 |  纳米棒 纳米棒 | 12.3 | 42.3 |
| B | 543 |  纳米片 纳米片 | 11.9 | 72.7 |
| C | 553 |  纳米棒 纳米棒 | 15.3 | 39.1 |
| D | 553 |  纳米片 纳米片 | 12.0 | 70.6 |
 生产甲醇的最优条件为
生产甲醇的最优条件为
您最近一年使用:0次
【推荐3】能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)在25℃、101kPa时,16gCH4完全燃烧生成液态水时放出的热量是890.31kJ,则CH4燃烧的热化学方程式为_______ 。
(2)已知:C(s)+O2(g)=CO2(g);ΔH1=-437.3kJ·mol-1
H2(g)+ O2(g)=H2O(g);ΔH2=-285.8kJ·mol-1
O2(g)=H2O(g);ΔH2=-285.8kJ·mol-1
CO(g)+ O2(g)=CO2(g);ΔH3=-283.0kJ·mol-1
O2(g)=CO2(g);ΔH3=-283.0kJ·mol-1
则煤气化反应C(s)+H2O(g)=CO(g)+H2(g)的焓变ΔH=_______ kJ·mol-1。
(3)熔融盐燃料电池具有高的发电效率,因而受到重视。可用熔融的碳酸盐作电解质,向负极充入燃料气CH4,用空气与CO2的混合气作为正极的助燃气,以石墨为电极材料,制得燃料电池。工作过程中, 移向
移向_______ 极(填“正”或“负”),已知CH4发生的电极反应式为CH4+4 -8e-=5CO2+2H2O,则另一极的电极反应方程式为:
-8e-=5CO2+2H2O,则另一极的电极反应方程式为:_______ 。
(4)利用上述燃料电池,按下图所示装置进行电解,A、B、C、D均为铂电极,甲槽AlCl3溶液200mL,乙槽CuSO4溶液200mL。
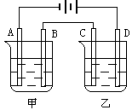
写出甲槽内电解的离子方程式_______ ;当C极析出0.64g物质时,B极产物在标准状况下的体积为_______ mL,乙杯溶液中的pH为_______ (假如电解前后溶液体积不变)。电解后若使乙池内溶液完全复原,可向其中加入_______ (选填字母标号)
A.Cu(OH)2 B.CuO C.CuCO3 D.Cu2(OH)2CO3
(1)在25℃、101kPa时,16gCH4完全燃烧生成液态水时放出的热量是890.31kJ,则CH4燃烧的热化学方程式为
(2)已知:C(s)+O2(g)=CO2(g);ΔH1=-437.3kJ·mol-1
H2(g)+
 O2(g)=H2O(g);ΔH2=-285.8kJ·mol-1
O2(g)=H2O(g);ΔH2=-285.8kJ·mol-1CO(g)+
 O2(g)=CO2(g);ΔH3=-283.0kJ·mol-1
O2(g)=CO2(g);ΔH3=-283.0kJ·mol-1则煤气化反应C(s)+H2O(g)=CO(g)+H2(g)的焓变ΔH=
(3)熔融盐燃料电池具有高的发电效率,因而受到重视。可用熔融的碳酸盐作电解质,向负极充入燃料气CH4,用空气与CO2的混合气作为正极的助燃气,以石墨为电极材料,制得燃料电池。工作过程中,
 移向
移向 -8e-=5CO2+2H2O,则另一极的电极反应方程式为:
-8e-=5CO2+2H2O,则另一极的电极反应方程式为:(4)利用上述燃料电池,按下图所示装置进行电解,A、B、C、D均为铂电极,甲槽AlCl3溶液200mL,乙槽CuSO4溶液200mL。

写出甲槽内电解的离子方程式
A.Cu(OH)2 B.CuO C.CuCO3 D.Cu2(OH)2CO3
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】甲醇是一种重要的化工原料,工业上利用CO2和H2在一定条件下反应合成甲醇。
(1)已知:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-1275.6kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ·mol-1
③H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式_______________________ 。
(2)在容积为1L的密闭容器中,投入1molCO和2molH2,在不同条件下发生反应:CO(g)+2H2(g) CH3OH(g)。实验测得平衡时甲醇的物质的量随温度、压强变化如图1所示:
CH3OH(g)。实验测得平衡时甲醇的物质的量随温度、压强变化如图1所示:
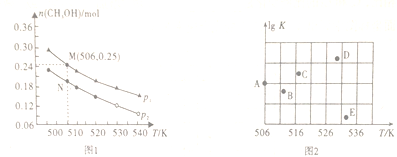
①该反应的△H_____ 0(填“>”、“<”或“=”),判断理由是_______________ 。
②M点时,CO的转化率为________ 。506K时该反应的平衡常数K=________ (保留三位小数)。
③某同学绘制的压强为p时,不同温度下上述反应的平衡常数的对数值(lgK)如图2所示。A、B、C、D、E五点中能正确表示该反应的lgK与温度(T)的关系的点为____________ 。
④下列叙述能说明反应CO(g)+2H2(g) CH3OH(g)达到平衡状态的是
CH3OH(g)达到平衡状态的是________ (填序号)。
A.单位时间内生成2molH2的同时消耗1molCO
B.反应过程中c(CO):c(CH3OH)=1:1
C.恒温恒容时,混合气体的密度保持不变
D.绝热恒容时,反应的平衡常数不再变化
(1)已知:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-1275.6kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ·mol-1
③H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式
(2)在容积为1L的密闭容器中,投入1molCO和2molH2,在不同条件下发生反应:CO(g)+2H2(g)
 CH3OH(g)。实验测得平衡时甲醇的物质的量随温度、压强变化如图1所示:
CH3OH(g)。实验测得平衡时甲醇的物质的量随温度、压强变化如图1所示:
①该反应的△H
②M点时,CO的转化率为
③某同学绘制的压强为p时,不同温度下上述反应的平衡常数的对数值(lgK)如图2所示。A、B、C、D、E五点中能正确表示该反应的lgK与温度(T)的关系的点为
④下列叙述能说明反应CO(g)+2H2(g)
 CH3OH(g)达到平衡状态的是
CH3OH(g)达到平衡状态的是A.单位时间内生成2molH2的同时消耗1molCO
B.反应过程中c(CO):c(CH3OH)=1:1
C.恒温恒容时,混合气体的密度保持不变
D.绝热恒容时,反应的平衡常数不再变化
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】
(1)合成氨是人类科技发展史上的一项重大突破。已知:25℃时,合成氨反应的热化学方程式为:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ/mol。请回答下列问题:
2NH3(g) ΔH=-92.4kJ/mol。请回答下列问题:
①其他条件不变时,升高温度,化学反应速率______ (填“增大”或“减小”);
②25℃时,取1mol N2和3mol H2置于2L的密闭容器中,在催化剂存在下进行反应,达到平衡时放出的热量________
A.大于92.4 kJ
B.等于92.4 kJ
C.小于92.4 kJ
③一定条件下,上述反应达到化学平衡状态的标志是_______ ;
A.N2、H2、NH3的浓度相等
B.容器内压强不再变化
C.单位时间内消耗amol N2,同时生成2amol NH3
④25℃时,上述反应平衡常数的表达式为:K=_________________ 。
(2)如图是电解NaCl溶液的示意图。请回答下列问题:
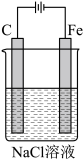
①石墨电极上的反应式为______________ ;
②电解一段时间后,溶液的pH_________ (填“增大”、“减小”或“不变”)。
(3)水溶液中的离子平衡是化学反应原理的重要内容。请回答下列问题:
①常温下,0.1mol/LCH3COONa溶液呈______ (填“酸”、“碱”或“中”)性,溶液中c(Na+)_______ c(CH3COO-)(填“>”、“<”或“=”);
②常温下,在浓度均为0.1mol/L的盐酸和NH4Cl溶液中,水的电离程度大小关系是:0.1mol/L盐酸______ 0.1mol/LNH4Cl溶液(填“>”、“<”或“=”);
③已知:20℃时,Ksp(AgCl)=1.1×10-10,Ksp(AgBr)=2.0×10-13。将AgCl和AgBr的饱和溶液等体积混合,再逐滴加入足量浓AgNO3溶液,充分反应后,生成沉淀量的关系是:m(AgCl)_______ m(AgBr)(填“>”、“<”或“=”)。
(1)合成氨是人类科技发展史上的一项重大突破。已知:25℃时,合成氨反应的热化学方程式为:N2(g)+3H2(g)
 2NH3(g) ΔH=-92.4kJ/mol。请回答下列问题:
2NH3(g) ΔH=-92.4kJ/mol。请回答下列问题:①其他条件不变时,升高温度,化学反应速率
②25℃时,取1mol N2和3mol H2置于2L的密闭容器中,在催化剂存在下进行反应,达到平衡时放出的热量
A.大于92.4 kJ
B.等于92.4 kJ
C.小于92.4 kJ
③一定条件下,上述反应达到化学平衡状态的标志是
A.N2、H2、NH3的浓度相等
B.容器内压强不再变化
C.单位时间内消耗amol N2,同时生成2amol NH3
④25℃时,上述反应平衡常数的表达式为:K=
(2)如图是电解NaCl溶液的示意图。请回答下列问题:

①石墨电极上的反应式为
②电解一段时间后,溶液的pH
(3)水溶液中的离子平衡是化学反应原理的重要内容。请回答下列问题:
①常温下,0.1mol/LCH3COONa溶液呈
②常温下,在浓度均为0.1mol/L的盐酸和NH4Cl溶液中,水的电离程度大小关系是:0.1mol/L盐酸
③已知:20℃时,Ksp(AgCl)=1.1×10-10,Ksp(AgBr)=2.0×10-13。将AgCl和AgBr的饱和溶液等体积混合,再逐滴加入足量浓AgNO3溶液,充分反应后,生成沉淀量的关系是:m(AgCl)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】Ⅰ.结合表回答下列问题(均为常温下的数据):
请回答下列问题:
(1)同浓度的CH3COO-、 、
、 ,
, 、ClO-中结合H+的能力最强的是
、ClO-中结合H+的能力最强的是___________ 。
(2)常温下0.1 mol/L的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是___________ (填字母)。
A. B.
B. C.
C. D.c(OH-)
D.c(OH-)
(3)取等体积物质的量浓度相等的CH3COOH、HClO两溶液,别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(CH3COOH)___________ V(HClO)(填“>”、“<”或“=”)。
Ⅱ.(4)工业废水中常含有一定量的 和
和 ,它们会对人体及生态系统产生很大的伤害,必须进行处理。还原沉淀法是常用的一种方法。
,它们会对人体及生态系统产生很大的伤害,必须进行处理。还原沉淀法是常用的一种方法。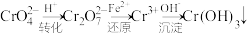 ,转化沉淀转化过程中存在平衡,
,转化沉淀转化过程中存在平衡, 能说明反应到达平衡状态的
能说明反应到达平衡状态的___________ 。
A. 和
和 的浓度相同 B.
的浓度相同 B.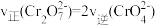
C.溶液的pH值保持不变 D.溶液颜色保持不变
Ⅲ.根据Ⅰ中弱酸的电离平衡常数:
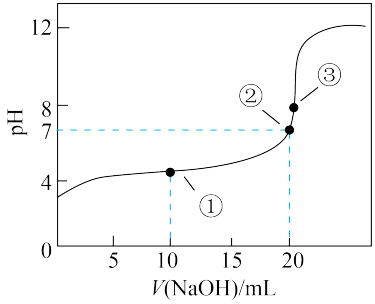
(5)常温下,用0.200 mol/L NaOH溶液滴定20.00 mL某未知浓度的H2C2O4溶液,滴定曲线如图,③点所示溶液中:2c(C2O42-)+2c(HC2O4-)+2c(H2C2O4)=c(Na+)。点①所示溶液中该草酸溶液中离子浓度大小关系为___________ 。点③所示溶液中溶质成分为___________ (用化学式表示)。
(6)以下反应的离子方程式书写正确的是___________ 。
A.次氯酸钠溶液吸收少量二氧化硫:ClO-+SO2+H2O=HClO+SO
B.漂白液生效的原理:ClO-+CO2+H2O=HClO+HCO
C.Na2CO3溶液吸收少量SO2:2CO + SO2+H2O=SO
+ SO2+H2O=SO +2HCO
+2HCO
| 化学式 | CH3COOH | H2SO3 | HClO | H2CO3 | H2C2O4 |
| 电离平衡常数 | K=1.8×10-5 | K1=1.2×10-2 K2=6.6×10-8 | K=3.0×10-8 | K1=4.4×10-7 K2=4.7×10-11 | K1=5.4×10-2 K2=5.4×10-5 |
请回答下列问题:
(1)同浓度的CH3COO-、
 、
、 ,
, 、ClO-中结合H+的能力最强的是
、ClO-中结合H+的能力最强的是(2)常温下0.1 mol/L的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是
A.
 B.
B. C.
C. D.c(OH-)
D.c(OH-)(3)取等体积物质的量浓度相等的CH3COOH、HClO两溶液,别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(CH3COOH)
Ⅱ.(4)工业废水中常含有一定量的
 和
和 ,它们会对人体及生态系统产生很大的伤害,必须进行处理。还原沉淀法是常用的一种方法。
,它们会对人体及生态系统产生很大的伤害,必须进行处理。还原沉淀法是常用的一种方法。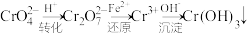 ,转化沉淀转化过程中存在平衡,
,转化沉淀转化过程中存在平衡, 能说明反应到达平衡状态的
能说明反应到达平衡状态的A.
 和
和 的浓度相同 B.
的浓度相同 B.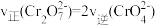
C.溶液的pH值保持不变 D.溶液颜色保持不变
Ⅲ.根据Ⅰ中弱酸的电离平衡常数:
(5)常温下,用0.200 mol/L NaOH溶液滴定20.00 mL某未知浓度的H2C2O4溶液,滴定曲线如图,③点所示溶液中:2c(C2O42-)+2c(HC2O4-)+2c(H2C2O4)=c(Na+)。点①所示溶液中该草酸溶液中离子浓度大小关系为

(6)以下反应的离子方程式书写正确的是
A.次氯酸钠溶液吸收少量二氧化硫:ClO-+SO2+H2O=HClO+SO

B.漂白液生效的原理:ClO-+CO2+H2O=HClO+HCO

C.Na2CO3溶液吸收少量SO2:2CO
 + SO2+H2O=SO
+ SO2+H2O=SO +2HCO
+2HCO
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】工业原料气中含有CO、氧硫化碳(COS)等有毒气体,它们能使催化剂中毒和大气污染。使用这样的原料气时需要进行净化处理。
I. CO的处理。硝酸的工业尾气中含有大量的氮氧化物,在一定条件下用氮氧化物处理CO能使有毒气体都变为环境友好型物质。已知有下列反应:
①2CO(g)+O2(g)= 2CO2(g) △H=-566 kJ/mol
②N2(g)+O2(g)= 2NO(g) △H=+181 kJ/mol
(1)请写出用NO处理CO反应的热化学方程式___________ 。
下列措施中能够增大该反应有毒气体平衡转化率的是__________ (填字母标号)。
a 增大反应体系的压强 b 使用优质催化剂
c 适当降低温度 d 增大NO的浓度
II.氧硫化碳(COS)的脱硫处理。在一定条件下用水蒸气与氧硫化碳反应是常用的脱硫方法,其热化学方程式为:COS(g)+H2O(g) H2S(g)+CO2(g) △H=-35 kJ/mol
H2S(g)+CO2(g) △H=-35 kJ/mol
(2)向容积为2 L的密闭容器中加入等物质的量的水蒸气和氧硫化碳,在一定条件发生上述脱硫反应,反应开始时压强为P(MPa),测得一定时间内COS(g)和CO2(g)的物质的量变化如下表所示:
①0~5 min内以COS(g)表示的反应速率v(COS)=________ mol/(L·min)。
②由表中数据变化判断T1_____ T2(填“>”、“<"或“=”)。理由为____________
③T1℃时,平衡常数Kp=_______ (以分压表示,分压=总压×物质的量分数)
若30 min时,保持T2℃不变,向该容器中再加入该反应的四种物质各2 mol,则此时化学平衡______ 移动( 填"向正反应方向”、“向逆反应方向”或“不")。
I. CO的处理。硝酸的工业尾气中含有大量的氮氧化物,在一定条件下用氮氧化物处理CO能使有毒气体都变为环境友好型物质。已知有下列反应:
①2CO(g)+O2(g)= 2CO2(g) △H=-566 kJ/mol
②N2(g)+O2(g)= 2NO(g) △H=+181 kJ/mol
(1)请写出用NO处理CO反应的热化学方程式
下列措施中能够增大该反应有毒气体平衡转化率的是
a 增大反应体系的压强 b 使用优质催化剂
c 适当降低温度 d 增大NO的浓度
II.氧硫化碳(COS)的脱硫处理。在一定条件下用水蒸气与氧硫化碳反应是常用的脱硫方法,其热化学方程式为:COS(g)+H2O(g)
 H2S(g)+CO2(g) △H=-35 kJ/mol
H2S(g)+CO2(g) △H=-35 kJ/mol(2)向容积为2 L的密闭容器中加入等物质的量的水蒸气和氧硫化碳,在一定条件发生上述脱硫反应,反应开始时压强为P(MPa),测得一定时间内COS(g)和CO2(g)的物质的量变化如下表所示:
| 物质的量/mol | T1/℃ | T2/℃ | |||||
| 0min | 5min | 10min | 15min | 20min | 25min | 30min | |
| COS(g) | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
| CO2(g) | 0 | 0.84 | 1.20 | 1.20 | 1.50 | 1.60 | 1.60 |
②由表中数据变化判断T1
③T1℃时,平衡常数Kp=
若30 min时,保持T2℃不变,向该容器中再加入该反应的四种物质各2 mol,则此时化学平衡
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】碳、氮、硫是中学化学重要的非金属元素,在工农业生产中有广泛的应用。
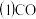 与镍反应会造成含镍催化剂的中毒。为防止镍催化剂中毒,工业上常用
与镍反应会造成含镍催化剂的中毒。为防止镍催化剂中毒,工业上常用 将CO氧化,二氧化硫转化为单质硫。
将CO氧化,二氧化硫转化为单质硫。
已知:
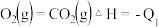

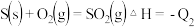

则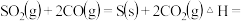
______  ;
;
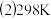 时,在2L密闭容器中发生可逆反应:
时,在2L密闭容器中发生可逆反应: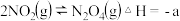

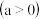 ,
, 的物质的量浓度随时间变化如图所示。达平衡时,
的物质的量浓度随时间变化如图所示。达平衡时, 的浓度为
的浓度为 的2倍,回答下列问题。
的2倍,回答下列问题。
 时,该反应的平衡常数为
时,该反应的平衡常数为 精确到小数点后两位
精确到小数点后两位 
______ 。
 在温度为
在温度为 、
、 时,平衡体系中
时,平衡体系中 的体积分数随压强变化曲线如图所示。
的体积分数随压强变化曲线如图所示。
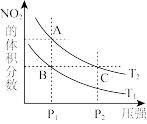
下列说法正确的是______
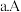 、C两点的反应速率:
、C两点的反应速率:
 、C两点气体的颜色:A深,C浅
、C两点气体的颜色:A深,C浅
 由状态B到状态A,可以用加热的方法
由状态B到状态A,可以用加热的方法
 若反应在398K进行,某时刻测得
若反应在398K进行,某时刻测得 ,
,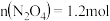 ,则此时
,则此时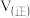
______ 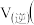 填“
填“ ”、“
”、“ ”或“
”或“ ”
”
 在分析试剂、电子工业中用途广泛。现向100mL
在分析试剂、电子工业中用途广泛。现向100mL 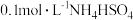 溶液中滴加
溶液中滴加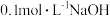 溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,
溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,

 水的电离程度最大的是
水的电离程度最大的是______ ;
 其溶液中
其溶液中 的数值最接近
的数值最接近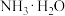 的电离常数K数值的是
的电离常数K数值的是______ 。
 与镍反应会造成含镍催化剂的中毒。为防止镍催化剂中毒,工业上常用
与镍反应会造成含镍催化剂的中毒。为防止镍催化剂中毒,工业上常用 将CO氧化,二氧化硫转化为单质硫。
将CO氧化,二氧化硫转化为单质硫。已知:

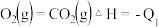

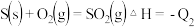

则
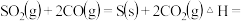
 ;
;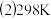 时,在2L密闭容器中发生可逆反应:
时,在2L密闭容器中发生可逆反应: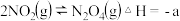

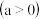 ,
, 的物质的量浓度随时间变化如图所示。达平衡时,
的物质的量浓度随时间变化如图所示。达平衡时, 的浓度为
的浓度为 的2倍,回答下列问题。
的2倍,回答下列问题。
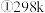 时,该反应的平衡常数为
时,该反应的平衡常数为 精确到小数点后两位
精确到小数点后两位 
 在温度为
在温度为 、
、 时,平衡体系中
时,平衡体系中 的体积分数随压强变化曲线如图所示。
的体积分数随压强变化曲线如图所示。
下列说法正确的是
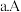 、C两点的反应速率:
、C两点的反应速率:
 、C两点气体的颜色:A深,C浅
、C两点气体的颜色:A深,C浅 由状态B到状态A,可以用加热的方法
由状态B到状态A,可以用加热的方法 若反应在398K进行,某时刻测得
若反应在398K进行,某时刻测得 ,
,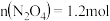 ,则此时
,则此时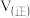
 填“
填“ ”、“
”、“ ”或“
”或“ ”
”
 在分析试剂、电子工业中用途广泛。现向100mL
在分析试剂、电子工业中用途广泛。现向100mL 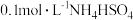 溶液中滴加
溶液中滴加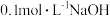 溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,
溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,
 水的电离程度最大的是
水的电离程度最大的是 其溶液中
其溶液中 的数值最接近
的数值最接近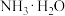 的电离常数K数值的是
的电离常数K数值的是
您最近一年使用:0次
【推荐3】二氧化碳的固定和转化是世界性的课题,对促进低碳社会的构建具有重要意义。某课题组利用 为原料将其转化成各种有机物,从而实现碳的循环再利用。
为原料将其转化成各种有机物,从而实现碳的循环再利用。
(1)以 为原料合成乙烯,其反应的过程分两步进行:
为原料合成乙烯,其反应的过程分两步进行:
①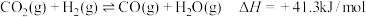
②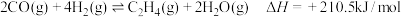
 加氢合成乙烯的热化学方程式为
加氢合成乙烯的热化学方程式为_______ 。
(2)以 为原料催化加氢合成乙醇,其反应原理为:
为原料催化加氢合成乙醇,其反应原理为: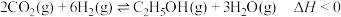 。向密闭容器中充入
。向密闭容器中充入 和
和 如图1为平衡时
如图1为平衡时 的体积分数与温度、压强的关系。
的体积分数与温度、压强的关系。
①温度
_______  (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。
②某温度下,反应达到平衡状态X点,若在X点对反应容器降温,同时缩小体积使体系压强增大,重新达到平衡状态时, 的体积分数可能是图中A~F点中的
的体积分数可能是图中A~F点中的_______ (填字母)点。
③在 温度下,压强恒定为
温度下,压强恒定为 ,反应达到平衡状态时的压强平衡常数
,反应达到平衡状态时的压强平衡常数
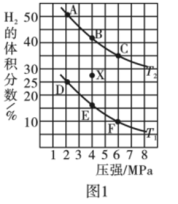
_______  (
( 是以分压表示的平衡常数,分压=总压×物质的量分数)。
是以分压表示的平衡常数,分压=总压×物质的量分数)。
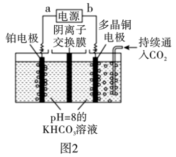
(3)二氧化碳甲烷化技术是一种对二氧化碳循环再利用的技术。用如图2装置电解二氧化碳制取甲烷,温度控制在10℃左右,持续通入二氧化碳,电解过程中 物质的量基本不变。阴极的电极反应式为
物质的量基本不变。阴极的电极反应式为_______ ;阳极产生的气体是_______ 。
 为原料将其转化成各种有机物,从而实现碳的循环再利用。
为原料将其转化成各种有机物,从而实现碳的循环再利用。(1)以
 为原料合成乙烯,其反应的过程分两步进行:
为原料合成乙烯,其反应的过程分两步进行:①
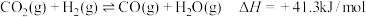
②
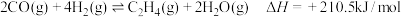
 加氢合成乙烯的热化学方程式为
加氢合成乙烯的热化学方程式为(2)以
 为原料催化加氢合成乙醇,其反应原理为:
为原料催化加氢合成乙醇,其反应原理为: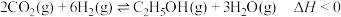 。向密闭容器中充入
。向密闭容器中充入 和
和 如图1为平衡时
如图1为平衡时 的体积分数与温度、压强的关系。
的体积分数与温度、压强的关系。
①温度

 (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。②某温度下,反应达到平衡状态X点,若在X点对反应容器降温,同时缩小体积使体系压强增大,重新达到平衡状态时,
 的体积分数可能是图中A~F点中的
的体积分数可能是图中A~F点中的③在
 温度下,压强恒定为
温度下,压强恒定为 ,反应达到平衡状态时的压强平衡常数
,反应达到平衡状态时的压强平衡常数
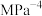 (
( 是以分压表示的平衡常数,分压=总压×物质的量分数)。
是以分压表示的平衡常数,分压=总压×物质的量分数)。(3)二氧化碳甲烷化技术是一种对二氧化碳循环再利用的技术。用如图2装置电解二氧化碳制取甲烷,温度控制在10℃左右,持续通入二氧化碳,电解过程中
 物质的量基本不变。阴极的电极反应式为
物质的量基本不变。阴极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】氯气是一种重要的化工原料,在生产和生活中应用十分广泛。地康法制取氯气的反应为:4HCl(g)+O2(g) 2Cl2(g)+2H2O(g)△H= -120kJ/mol 该反应分两步进行,其基本原理如下图所示:
2Cl2(g)+2H2O(g)△H= -120kJ/mol 该反应分两步进行,其基本原理如下图所示:
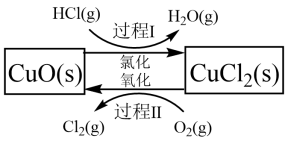
过程 I 的反应为, 2HCl(g)+CuO(s) CuCl2(s)+H2O(g)△H= -132kJ/mol
CuCl2(s)+H2O(g)△H= -132kJ/mol
(1)该原理中起到催化剂作用物质的化学式为_______________________ ;
(2)过程 II 反应的热化学方程式为____________________ ;
(3)压强为p1时,地康法中HCl 的平衡转化率aHCl 随温度变化曲线如图。
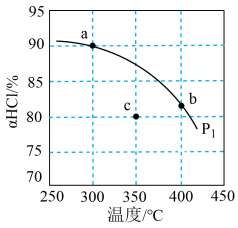
①比较 a、b 两点的平衡常数大小 K(a)=_______________ K(b)(填“>”“<”或“=”),解释原因为________________ ;
②c 点表示投料不变, 350℃、压强为p2时,地康法中HCl 的平衡转化率,则p2_________________ p1(填“>”“<”或“=”)。
 2Cl2(g)+2H2O(g)△H= -120kJ/mol 该反应分两步进行,其基本原理如下图所示:
2Cl2(g)+2H2O(g)△H= -120kJ/mol 该反应分两步进行,其基本原理如下图所示:
过程 I 的反应为, 2HCl(g)+CuO(s)
 CuCl2(s)+H2O(g)△H= -132kJ/mol
CuCl2(s)+H2O(g)△H= -132kJ/mol(1)该原理中起到催化剂作用物质的化学式为
(2)过程 II 反应的热化学方程式为
(3)压强为p1时,地康法中HCl 的平衡转化率aHCl 随温度变化曲线如图。

①比较 a、b 两点的平衡常数大小 K(a)=
②c 点表示投料不变, 350℃、压强为p2时,地康法中HCl 的平衡转化率,则p2
您最近一年使用:0次
【推荐2】乙烯是有机合成工业重要的原料,由乙烷制取乙烯是常见的方法。已知乙烷热裂解法制取乙烯的反应为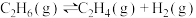
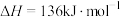 。
。
(1)一定温度下,在乙烷热裂解制取乙烯时,向体系中充入一定量惰性气体,保持体系的总压强为100kPa,测得平衡时各组分的体积分数如下表所示:
该温度下反应的平衡常数
_______ kPa,(用物质的平衡分压代替平衡浓度,平衡分压=总压强X体积分数)
(2)利用膜分离技术可以实现边反应边分离出生成的 。在容积为1L的恒容密闭容器中充入1mol乙烷,测得不同氢气移出率α[
。在容积为1L的恒容密闭容器中充入1mol乙烷,测得不同氢气移出率α[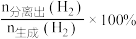 ]条件下,乙烷的平衡转化率与和温度的关系如图-1所示。
]条件下,乙烷的平衡转化率与和温度的关系如图-1所示。
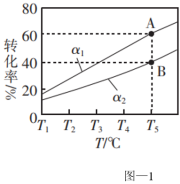
①α1_______ (填“>”、“<”或“=”) α2。
②若A点时平衡常数K=0.8,则α1=_______ 。
(3)以 和
和 为原料可以协同制取
为原料可以协同制取 和CO,发生的反应如下:
和CO,发生的反应如下:
反应1: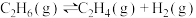
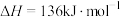
反应2:
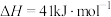
①已知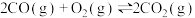
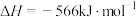 。
。
则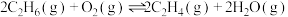 的
的
_______  。
。
②0.1MPa时,按物质的量之比为1:1向密闭容器中充入 和
和 的混合气体,反应相同时间,测得
的混合气体,反应相同时间,测得 和
和 的转化率与温度的关系如图-2所示。X代表的物质是
的转化率与温度的关系如图-2所示。X代表的物质是_______ 。750~820℃时,随着温度的升高,容器中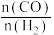 的值的变化情况是
的值的变化情况是_______ 。
③乙烷热裂解时,会产生积碳,以 和
和 为原料协同制取
为原料协同制取 和CO会减少积碳的产生,原因是
和CO会减少积碳的产生,原因是_______ 。
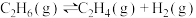
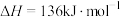 。
。(1)一定温度下,在乙烷热裂解制取乙烯时,向体系中充入一定量惰性气体,保持体系的总压强为100kPa,测得平衡时各组分的体积分数如下表所示:
| 物质 |  |  |  |
| 体积分数 | 5% | 20% | 20% |

(2)利用膜分离技术可以实现边反应边分离出生成的
 。在容积为1L的恒容密闭容器中充入1mol乙烷,测得不同氢气移出率α[
。在容积为1L的恒容密闭容器中充入1mol乙烷,测得不同氢气移出率α[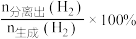 ]条件下,乙烷的平衡转化率与和温度的关系如图-1所示。
]条件下,乙烷的平衡转化率与和温度的关系如图-1所示。
①α1
②若A点时平衡常数K=0.8,则α1=
(3)以
 和
和 为原料可以协同制取
为原料可以协同制取 和CO,发生的反应如下:
和CO,发生的反应如下:反应1:
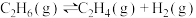
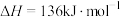
反应2:

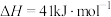
①已知
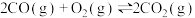
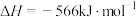 。
。则
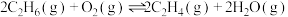 的
的
 。
。②0.1MPa时,按物质的量之比为1:1向密闭容器中充入
 和
和 的混合气体,反应相同时间,测得
的混合气体,反应相同时间,测得 和
和 的转化率与温度的关系如图-2所示。X代表的物质是
的转化率与温度的关系如图-2所示。X代表的物质是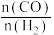 的值的变化情况是
的值的变化情况是
③乙烷热裂解时,会产生积碳,以
 和
和 为原料协同制取
为原料协同制取 和CO会减少积碳的产生,原因是
和CO会减少积碳的产生,原因是
您最近一年使用:0次
【推荐3】习近平总书记近日对制止餐饮浪费作出重要指示。氨的合成对解决粮食危机有着重要意义。目前该研究领域已经催生了三位诺贝尔化学奖得主。
(1)德国化学家哈伯对研究“N2(g)+3H2(g) 2NH3(g)”反应贡献巨大,1918年荣获诺贝尔化学奖,已知该反应在298 K时,△H=-92.2 kJ/mol,Kc=4.1×106(mol/L)-2,若从平衡常数角度分析,反应限度已经较大,但为何化工生产中还需要使用催化剂:
2NH3(g)”反应贡献巨大,1918年荣获诺贝尔化学奖,已知该反应在298 K时,△H=-92.2 kJ/mol,Kc=4.1×106(mol/L)-2,若从平衡常数角度分析,反应限度已经较大,但为何化工生产中还需要使用催化剂:_________ 。
(2)合成氨反应在催化剂作用下的反应历程为(*表示吸附态):
第一步 N2(g)→2N*;H2(g)→2H*(慢反应)
第二步 N*+H* NH*;NH*+H*
NH*;NH*+H* NH2*;NH2* +H*
NH2*;NH2* +H* NH3*;(快反应)
NH3*;(快反应)
第三步 NH3* NH3(g) (快反应)
NH3(g) (快反应)
比较第一步反应的活化能E1与第二步反应的活化能E2的大小:E1__________ E2(填“>”、“<”或“=”),判断理由是_______________________ 。
(3)2007年,德国科学家埃特尔发现了合成氨催化机理,开创了表面动力学的研究。研究发现,常温恒压密闭容器中,N2在催化剂表面可以与水发生反应:2N2(g)+6H2O(l) 4NH3(g)+3O2(g)
4NH3(g)+3O2(g)
①下列各项能够作为判断该反应一定达到平衡的依据是___________ (填标号)。
A.容器中N2(g)、NH3(g)、O2(g)的浓度之比为2:4:3
B.N2与NH3浓度之比恒定不变
C.v(N2)正=2v(NH3)逆
D.混合气体中氨气的质量分数不变
E.压强保持不变
②平衡后若分别改变下列一个条件,可以使N2转化率增大的是___________ (填标号)
A.转移掉部分O2 B.转移掉部分NH3
C.适当增加H2O(l)的量 D.增加N2的量
(4)向一个恒温恒压容器充入1 mol N2和3 mol H2模拟合成氨反应,下图为不同温度下平衡时混合物中氨气的体积分数与总压强(p)的关系图。
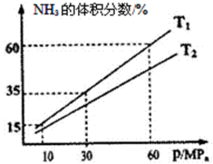
若体系在T1、60MPa下达到平衡。
①此时平衡常数Kp_______ (MPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;计算结果保留3位小数)。
②T1_____________ T2(填“>”、“<”或“=”)。
(1)德国化学家哈伯对研究“N2(g)+3H2(g)
 2NH3(g)”反应贡献巨大,1918年荣获诺贝尔化学奖,已知该反应在298 K时,△H=-92.2 kJ/mol,Kc=4.1×106(mol/L)-2,若从平衡常数角度分析,反应限度已经较大,但为何化工生产中还需要使用催化剂:
2NH3(g)”反应贡献巨大,1918年荣获诺贝尔化学奖,已知该反应在298 K时,△H=-92.2 kJ/mol,Kc=4.1×106(mol/L)-2,若从平衡常数角度分析,反应限度已经较大,但为何化工生产中还需要使用催化剂:(2)合成氨反应在催化剂作用下的反应历程为(*表示吸附态):
第一步 N2(g)→2N*;H2(g)→2H*(慢反应)
第二步 N*+H*
 NH*;NH*+H*
NH*;NH*+H* NH2*;NH2* +H*
NH2*;NH2* +H* NH3*;(快反应)
NH3*;(快反应)第三步 NH3*
 NH3(g) (快反应)
NH3(g) (快反应)比较第一步反应的活化能E1与第二步反应的活化能E2的大小:E1
(3)2007年,德国科学家埃特尔发现了合成氨催化机理,开创了表面动力学的研究。研究发现,常温恒压密闭容器中,N2在催化剂表面可以与水发生反应:2N2(g)+6H2O(l)
 4NH3(g)+3O2(g)
4NH3(g)+3O2(g)①下列各项能够作为判断该反应一定达到平衡的依据是
A.容器中N2(g)、NH3(g)、O2(g)的浓度之比为2:4:3
B.N2与NH3浓度之比恒定不变
C.v(N2)正=2v(NH3)逆
D.混合气体中氨气的质量分数不变
E.压强保持不变
②平衡后若分别改变下列一个条件,可以使N2转化率增大的是
A.转移掉部分O2 B.转移掉部分NH3
C.适当增加H2O(l)的量 D.增加N2的量
(4)向一个恒温恒压容器充入1 mol N2和3 mol H2模拟合成氨反应,下图为不同温度下平衡时混合物中氨气的体积分数与总压强(p)的关系图。

若体系在T1、60MPa下达到平衡。
①此时平衡常数Kp
②T1
您最近一年使用:0次



