钛(Ti)被称为“未来金属”,广泛应用于国防、航空航天、材料等领域。
(1)基态钛原子的价电子排布式为_______ 。
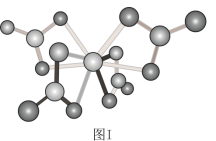
(2)钛可与高于70℃的浓硝酸发生反应,生成Ti(NO3)4.其球棍结构如图Ⅰ,Ti的配位数是_______ ,试㝍出该反应的方程式_______ 。
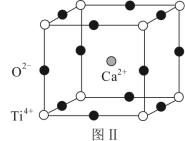
(3)钙钛矿(CaTiO3)是自然界中的一种常见矿物,其晶胞结构如图Ⅱ.设NA为阿伏加德罗常数的值,计算一个晶胞的质量为_______ g。
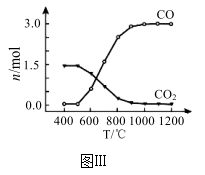
(4)TiCl4是由钛精矿(主要成分为TiO2制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如图:


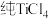
资料:TiCl4及所含杂质氯化物的性质
TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) △H1=+175.4kJ·mol-1
2C(s)+O2(g)=2CO(g) △H2=-220.9kJ·mol-1
①沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式_______ 。
②氯化过程中CO和CO2可以相互转化,根据如图Ⅲ判断:CO2生成CO反应的△H_______ 0(填“>”“<”或“=”),判断依据_______ 。
(1)基态钛原子的价电子排布式为
(2)钛可与高于70℃的浓硝酸发生反应,生成Ti(NO3)4.其球棍结构如图Ⅰ,Ti的配位数是

(3)钙钛矿(CaTiO3)是自然界中的一种常见矿物,其晶胞结构如图Ⅱ.设NA为阿伏加德罗常数的值,计算一个晶胞的质量为

(4)TiCl4是由钛精矿(主要成分为TiO2制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如图:


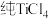
资料:TiCl4及所含杂质氯化物的性质
| 化合物 | SiCl4 | TiCl4 | AlCl3 | FeCl3 | MgCl2 |
| 沸点/℃ | 58 | 136 | 181(升华) | 316 | 1412 |
| 熔点/℃ | -69 | -25 | 193 | 304 | 714 |
| 在TiCl4中的溶解性 | 互溶 | — | 微溶 | 难溶 | |
TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) △H1=+175.4kJ·mol-1
2C(s)+O2(g)=2CO(g) △H2=-220.9kJ·mol-1
①沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式
②氯化过程中CO和CO2可以相互转化,根据如图Ⅲ判断:CO2生成CO反应的△H

2022·天津和平·一模 查看更多[4]
(已下线)2022年辽宁高考真题化学试题变式题(原理综合题)(已下线)2022年辽宁省高考真题变式题(16-19)天津市2022届高三下学期普通高中学业水平等级性考试模拟预测化学试题天津市和平区2022届高三一模化学试题
更新时间:2022-04-09 22:07:54
|
相似题推荐
【推荐1】二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
请回答下列问题:
(1)煤的气化的主要化学反应方程式为:___________________________ 。
(2)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:________________________________________ 。
(3)利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g) CH3OH(g);ΔH = -90.8 kJ·mol-1
CH3OH(g);ΔH = -90.8 kJ·mol-1
② 2CH3OH(g) CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
③ CO(g) + H2O(g) CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g) CH3OCH3(g) + CO2 (g)的ΔH=
CH3OCH3(g) + CO2 (g)的ΔH= ___________ ;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________ (填字母代号)
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
(4)已知反应②2CH3OH(g) CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
① 比较此时正、逆反应速率的大小:v正______ v逆 (填“>”、“<”或“=”)。
② 若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH) =_________ ;该时间内反应速率v(CH3OH) = __________ 。达到平衡时甲醇的转化率α(CH3OH)= _________
请回答下列问题:
(1)煤的气化的主要化学反应方程式为:
(2)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:
(3)利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g)
 CH3OH(g);ΔH = -90.8 kJ·mol-1
CH3OH(g);ΔH = -90.8 kJ·mol-1 ② 2CH3OH(g)
 CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1 ③ CO(g) + H2O(g)
 CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1 总反应:3H2(g) + 3CO(g)
 CH3OCH3(g) + CO2 (g)的ΔH=
CH3OCH3(g) + CO2 (g)的ΔH= 一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
(4)已知反应②2CH3OH(g)
 CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
① 比较此时正、逆反应速率的大小:v正
② 若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH) =
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】以钛铁矿(主要成分 ,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如下,其中钛铁矿与浓硫酸发生反应的化学方程式为:
,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如下,其中钛铁矿与浓硫酸发生反应的化学方程式为: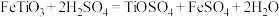 。
。
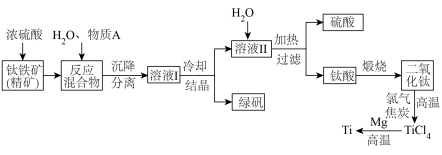
回答下列问题:
(1)钛铁矿和浓硫酸反应属于___________ (选填“氧化还原反应”或“非氧化还原反应”)。
(2)上述生产流程中加入物质A的目的是防止 被氧化,物质A是
被氧化,物质A是___________ ,上述制备 的过程中,所得到的副产物和可回收利用的物质分别是
的过程中,所得到的副产物和可回收利用的物质分别是___________ 、___________ 。
(3)反应 在Ar气氛中进行的理由是
在Ar气氛中进行的理由是___________ 。
(4)由二氧化钛制取四氯化钛所涉及的反应有:
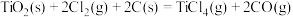
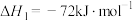

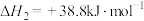

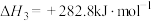
反应 的
的
___________ 。
 ,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如下,其中钛铁矿与浓硫酸发生反应的化学方程式为:
,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如下,其中钛铁矿与浓硫酸发生反应的化学方程式为: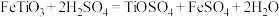 。
。
回答下列问题:
(1)钛铁矿和浓硫酸反应属于
(2)上述生产流程中加入物质A的目的是防止
 被氧化,物质A是
被氧化,物质A是 的过程中,所得到的副产物和可回收利用的物质分别是
的过程中,所得到的副产物和可回收利用的物质分别是(3)反应
 在Ar气氛中进行的理由是
在Ar气氛中进行的理由是(4)由二氧化钛制取四氯化钛所涉及的反应有:
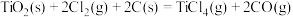
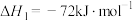

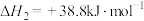

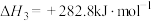
反应
 的
的
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】Deacon直接氧化法可将HC1转化为Cl2,提高效益,减少污染,反应原理为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。
(1)Deacon直接氧化法可按下列催化过程进行:
2CuCl2(s)=2CuCl(s)+Cl2(g) △H1=+166 kJ·mol-1
2CuCl(s)+O2(g)=2CuO(s)+Cl2(g) △H2=-40kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) △H3=-121 kJ·mol-1
则上述总反应的热化学方程式为___________ 。
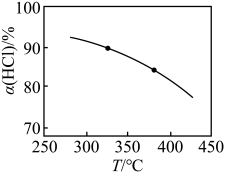
(2)在一刚性容器中,当进料浓度比c(HCl):c(O2)=5:1时,实验测得HCl平衡转化率随温度变化的a(HCl)—T曲线如图所示:
①一定温度下,下列选项表明该反应一定达到平衡状态的是 ___________ (填标号)。
A.HCl与O2的物质的量之比不改变
B.HCl与Cl2的物质的量之比等于2:1
C.容器内的压强不再改变
D.断裂n mol H-Cl键的同时形成 n mol H-O键
②250℃、400℃两点的平衡常数K250℃___________ K400℃(填“>”“<”或“=”)。在相同容器中若进料浓度比c(HCl):c(O2)=1:1时,所得转化率a(HCl)比之前___________ (填“大”、“小”或“等于”)。
③温度不变时,进一步提高HCl的转化率的方法是___________ (任写一种)。
(3)若在绝热的刚性容器中投入原料比为n(HCl):n(O2)=1:1的反应混合物,起始时总物质的量为8mol,测得反应过程中c(Cl2)的数据如下:
①2.0~6.0 min内以O2表示的反应速率为___________ 。
②实验发现产生Cl2的速率先增大后减小,分析其原因:___________ 。
③若在恒温的刚性容器中完成这个反应,15min时候测得Cl2产率为50%,问反应前后的压强之比:___________ 。
(1)Deacon直接氧化法可按下列催化过程进行:
2CuCl2(s)=2CuCl(s)+Cl2(g) △H1=+166 kJ·mol-1
2CuCl(s)+O2(g)=2CuO(s)+Cl2(g) △H2=-40kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) △H3=-121 kJ·mol-1
则上述总反应的热化学方程式为
(2)在一刚性容器中,当进料浓度比c(HCl):c(O2)=5:1时,实验测得HCl平衡转化率随温度变化的a(HCl)—T曲线如图所示:

| 平衡时HCl转化率a | 93% | 90% | 87% | 85% | 82% |
| T ℃ | 250 | 300 | 350 | 400 | 450 |
A.HCl与O2的物质的量之比不改变
B.HCl与Cl2的物质的量之比等于2:1
C.容器内的压强不再改变
D.断裂n mol H-Cl键的同时形成 n mol H-O键
②250℃、400℃两点的平衡常数K250℃
③温度不变时,进一步提高HCl的转化率的方法是
(3)若在绝热的刚性容器中投入原料比为n(HCl):n(O2)=1:1的反应混合物,起始时总物质的量为8mol,测得反应过程中c(Cl2)的数据如下:
| t/min | 0 | 2.0 | 4.0 | 6.0 | 8.0 | 10.0 |
| c(Cl2)/10-1mol·L-1 | 0 | 1.5 | 5.4 | 6.5 | 7.4 | 8.0 |
②实验发现产生Cl2的速率先增大后减小,分析其原因:
③若在恒温的刚性容器中完成这个反应,15min时候测得Cl2产率为50%,问反应前后的压强之比:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】I、有科学家经过研究发现,用CO2和H2在210~290℃,催化剂条件下可转化生成甲醇蒸汽和水蒸气。
①230℃,向容器中投入0.5molCO2和1.5molH2,当转化率达80%时放出热量19.6kJ能量,写出该反应的热化学方程式_________ 。

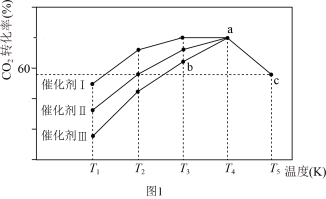
②一定条件下,往2L恒容密闭容器中充入 1.0molCO2 和 3.0molH2,在不同催化剂作用下,相同时间内 CO2 的转化率 随温度变化如图所示:催化剂效果最佳的是催化剂______ (填“I、Ⅱ、Ⅲ)。b点v(正) ____ v(逆) (填>、< 、=) 。此反应在a点时已达平衡状态, a点的转化率比c点高的原因是 _______ 。已知容器内的起始压强 为100kPa,则图中c点对应温度下反应的平衡常数Kp=________ 。(保留两位有效数字) (Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。
II、汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。
(1)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如图所示(Ce为铈元素)。
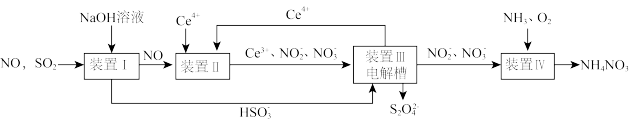
装置Ⅱ中,酸性条件下NO被Ce4+氧化的产物主要是NO3-和NO2-,请写出生成NO3-和NO2-物质的量之比为2∶1时的离子方程式:________________________ 。
(2)装置Ⅲ的作用之一是用质子交换膜电解槽电解使得Ce4+再生,再生时生成的Ce4+在电解槽的____ (填“阳极”或“阴极”),同时在另一极生成S2O42-的电极反应式为_________ 。
(3)已知进入装置Ⅳ的溶液中NO2-的浓度为a g·L-1,要使1.5 m3该溶液中的NO2-完全转化为NH4NO3,至少需向装置Ⅳ中通入标准状况下的氧气__________ L(用含a代数式表示,结果保留整数,否则不给分 )。
①230℃,向容器中投入0.5molCO2和1.5molH2,当转化率达80%时放出热量19.6kJ能量,写出该反应的热化学方程式


②一定条件下,往2L恒容密闭容器中充入 1.0molCO2 和 3.0molH2,在不同催化剂作用下,
II、汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。
(1)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如图所示(Ce为铈元素)。

装置Ⅱ中,酸性条件下NO被Ce4+氧化的产物主要是NO3-和NO2-,请写出生成NO3-和NO2-物质的量之比为2∶1时的离子方程式:
(2)装置Ⅲ的作用之一是用质子交换膜电解槽电解使得Ce4+再生,再生时生成的Ce4+在电解槽的
(3)已知进入装置Ⅳ的溶液中NO2-的浓度为a g·L-1,要使1.5 m3该溶液中的NO2-完全转化为NH4NO3,至少需向装置Ⅳ中通入标准状况下的氧气
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】铅铬黄是一种颜料,主要成分是铬酸铅 (摩尔质量323g/mol)。现以
(摩尔质量323g/mol)。现以 和
和 等为原料制备该物质,并测定产物纯度。
等为原料制备该物质,并测定产物纯度。
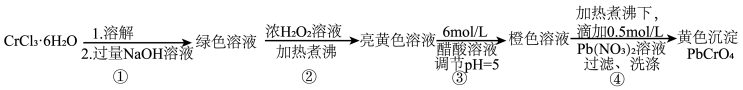
回答下列问题:
(1)已知 不溶于水,具有两性。第①步所得绿色溶液中的有色离子是
不溶于水,具有两性。第①步所得绿色溶液中的有色离子是_______ 。
(2)第②步生成了 ,写出该步骤的离子方程式
,写出该步骤的离子方程式_______ 。为了使 反应充分而不剩余,以下方案中最合理的是
反应充分而不剩余,以下方案中最合理的是_______ (填序号)。
A.首先加热绿色溶液,然后将一定量 浓溶液滴入其中
浓溶液滴入其中
B.首先加热 浓溶液,然后转入热的绿色溶液中
浓溶液,然后转入热的绿色溶液中
C.首先将一定量 浓溶液滴入绿色溶液中,然后加热煮沸
浓溶液滴入绿色溶液中,然后加热煮沸
(3)第③步调节pH=5的目的是为了将 转化为
转化为_______ (填写离子符号),并且防止在碱性条件下_______ 形成沉淀。
(4)由于铬酸铅的溶解度比重铬酸铅的小的多,在第④步中逐滴滴加 溶液后,产生
溶液后,产生 黄色沉淀,此时为了提高铅铬黄的产率,可补加少最NaOH溶液,请用化学平衡移动原理加以解释:
黄色沉淀,此时为了提高铅铬黄的产率,可补加少最NaOH溶液,请用化学平衡移动原理加以解释:_______ 。
(5)测定铅铬黄的纯度:取mg铅铭黄样品用盐酸酸化溶解,加足量KI将其还原为 ,再用
,再用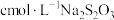 标准溶液滴定至淡黄绿色,发生反应
标准溶液滴定至淡黄绿色,发生反应 。加入淀粉指示剂,继续滴定,当溶液蓝色褪去,且30s不变色,即为终点。测得平均消耗标准溶液体积为VmL。此铅铬黄样品的质量分数w=
。加入淀粉指示剂,继续滴定,当溶液蓝色褪去,且30s不变色,即为终点。测得平均消耗标准溶液体积为VmL。此铅铬黄样品的质量分数w=_______ (用含c、m和V的式子表示)。
 (摩尔质量323g/mol)。现以
(摩尔质量323g/mol)。现以 和
和 等为原料制备该物质,并测定产物纯度。
等为原料制备该物质,并测定产物纯度。
回答下列问题:
(1)已知
 不溶于水,具有两性。第①步所得绿色溶液中的有色离子是
不溶于水,具有两性。第①步所得绿色溶液中的有色离子是(2)第②步生成了
 ,写出该步骤的离子方程式
,写出该步骤的离子方程式 反应充分而不剩余,以下方案中最合理的是
反应充分而不剩余,以下方案中最合理的是A.首先加热绿色溶液,然后将一定量
 浓溶液滴入其中
浓溶液滴入其中B.首先加热
 浓溶液,然后转入热的绿色溶液中
浓溶液,然后转入热的绿色溶液中C.首先将一定量
 浓溶液滴入绿色溶液中,然后加热煮沸
浓溶液滴入绿色溶液中,然后加热煮沸(3)第③步调节pH=5的目的是为了将
 转化为
转化为(4)由于铬酸铅的溶解度比重铬酸铅的小的多,在第④步中逐滴滴加
 溶液后,产生
溶液后,产生 黄色沉淀,此时为了提高铅铬黄的产率,可补加少最NaOH溶液,请用化学平衡移动原理加以解释:
黄色沉淀,此时为了提高铅铬黄的产率,可补加少最NaOH溶液,请用化学平衡移动原理加以解释:(5)测定铅铬黄的纯度:取mg铅铭黄样品用盐酸酸化溶解,加足量KI将其还原为
 ,再用
,再用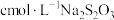 标准溶液滴定至淡黄绿色,发生反应
标准溶液滴定至淡黄绿色,发生反应 。加入淀粉指示剂,继续滴定,当溶液蓝色褪去,且30s不变色,即为终点。测得平均消耗标准溶液体积为VmL。此铅铬黄样品的质量分数w=
。加入淀粉指示剂,继续滴定,当溶液蓝色褪去,且30s不变色,即为终点。测得平均消耗标准溶液体积为VmL。此铅铬黄样品的质量分数w=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】I.将0.40mol N2O4气体充入2L固定容积的密闭容器中发生如下反应:
N2O4(g) 2NO2(g)△H。在Tl℃和T2℃时,测得NO2的物质的量随时间变化如下图所示:
2NO2(g)△H。在Tl℃和T2℃时,测得NO2的物质的量随时间变化如下图所示:
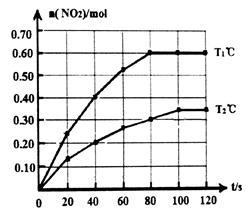
(1)Tl℃时,40s~80s内用N2O4表示该反应的平均反应速率为_________________ mol/(L·s)。
(2)△H___________ O(填>、<或=)。
(3)改变条件重新达到平衡时,要使 的比值变小,可采取的措施有
的比值变小,可采取的措施有__________ (填序号)。
a.增大N2O4的起始浓度 b.升高温度
c.向混合气体中通入NO2 d.使用高效催化剂
II.已知:常温下,HCN的电离常数为Ka=5×10-10。
(4)有浓度相同的HCN和NaCN的混合溶液。
①通过计算说明该溶液的酸碱性_____________________________________________ 。
②该溶液中各离子的浓度由大到小的顺序是___________________________________ 。
(5)常温下,向某浓度的HCN溶液中逐滴加入NaOH溶液至溶液呈中性。
①该过程溶液中水的电离程度的变化为______________ 。
②若混合溶液中c(Na+)=a mol/L,则c(HCN)=_________ mol/L。
N2O4(g)
 2NO2(g)△H。在Tl℃和T2℃时,测得NO2的物质的量随时间变化如下图所示:
2NO2(g)△H。在Tl℃和T2℃时,测得NO2的物质的量随时间变化如下图所示:
(1)Tl℃时,40s~80s内用N2O4表示该反应的平均反应速率为
(2)△H
(3)改变条件重新达到平衡时,要使
 的比值变小,可采取的措施有
的比值变小,可采取的措施有a.增大N2O4的起始浓度 b.升高温度
c.向混合气体中通入NO2 d.使用高效催化剂
II.已知:常温下,HCN的电离常数为Ka=5×10-10。
(4)有浓度相同的HCN和NaCN的混合溶液。
①通过计算说明该溶液的酸碱性
②该溶液中各离子的浓度由大到小的顺序是
(5)常温下,向某浓度的HCN溶液中逐滴加入NaOH溶液至溶液呈中性。
①该过程溶液中水的电离程度的变化为
②若混合溶液中c(Na+)=a mol/L,则c(HCN)=
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】二氧化硅是制造玻璃、石英玻璃、水玻璃、光导纤维、光学仪器、工艺品和耐火材料的原料,是科学研究的重要材料。
(1)Si原子中,能量最高的电子的电子云在空间有_______ 个伸展方向。
(2)原子核外的电子有两种相反的自旋状态,若一种自旋状态用“ ”表示,与之相反的用“
”表示,与之相反的用“ ”表示,称为电子的自旋磁量子数。对于Si原子,其电子自旋磁量子数的代数和为
”表示,称为电子的自旋磁量子数。对于Si原子,其电子自旋磁量子数的代数和为_______ 。
铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有 、
、 、CaO、MgO、
、CaO、MgO、 等氧化物。
等氧化物。
(3)O原子的最外层电子排布式为_______ ;上述元素中,与Fe原子最外层电子数目相同的元素的元素符号为_______ 。
(4)上述氧化物所涉及的元素中,处于元素周期表中副族的元素有_______ 种。
(5)原子失去电子需要吸收能量,吸收的能量越高,则表示电子越难以失去,请比较,失去第三个电子所需要的能量,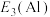
_______ 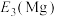 (填“>”或“<”),原因是
(填“>”或“<”),原因是_______ 。
(1)Si原子中,能量最高的电子的电子云在空间有
(2)原子核外的电子有两种相反的自旋状态,若一种自旋状态用“
 ”表示,与之相反的用“
”表示,与之相反的用“ ”表示,称为电子的自旋磁量子数。对于Si原子,其电子自旋磁量子数的代数和为
”表示,称为电子的自旋磁量子数。对于Si原子,其电子自旋磁量子数的代数和为铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有
 、
、 、CaO、MgO、
、CaO、MgO、 等氧化物。
等氧化物。(3)O原子的最外层电子排布式为
(4)上述氧化物所涉及的元素中,处于元素周期表中副族的元素有
(5)原子失去电子需要吸收能量,吸收的能量越高,则表示电子越难以失去,请比较,失去第三个电子所需要的能量,
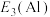
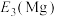 (填“>”或“<”),原因是
(填“>”或“<”),原因是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】
(1)Na位于元素周期表第________ 周期第_______ 族;S的基态原子核外有_______ 个未成对电子;Si的基态原子核外电子排布式为_______ 。
(2)Cu+基态核外电子排布式为________ 。
(3)基态铁原子有_______ 个未成对电子,Fe3+的电子排布式为___________ 。
(4)31Ga基态原子的核外电子排布式是___________ 。
(5)铝原子核外电子云有______ 种不同的伸展方向,有______ 种不同运动状态的电子。
(1)Na位于元素周期表第
(2)Cu+基态核外电子排布式为
(3)基态铁原子有
(4)31Ga基态原子的核外电子排布式是
(5)铝原子核外电子云有
您最近一年使用:0次
【推荐3】[化学——选修3:物质结构与性质]铬元素在地壳中含量占第21位,是一种重要的金属。回答下列问题:
(1)基态铬原子的价电子排布式为_________________ ,根据价层电子判断铬元素中最高价态为___________ 价。铬元素的第二电离能________ 锰元素的第二电离能(填“>”“<”填“=”)。
(2)无水氯化亚铬(CrCl2)的制备方法为在500℃时用含HCl的H2气流还原CrCl3,该过程涉及到的反应原理为____________________________________________ (用化学方程式表示)。
已知:氯化亚铬的熔点为820~824℃,则其晶体类型为___________ 晶体。二价铬还能与乙酸根形成配合物,在乙酸根中碳原子的杂化形式为___________
(3)已知CrO5中铬元素为最高价态,画出其结构式:______________________
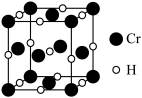
(4)Cr元素与H元素形成化合物的晶胞结构如图所示,则该化合物的化学式为___________ 。已知:该晶胞的边长为437.6 pm,NA表示阿伏加 德罗常数的值,则晶体的密度为____ g/cm3(列出计算式即可)。
(1)基态铬原子的价电子排布式为
(2)无水氯化亚铬(CrCl2)的制备方法为在500℃时用含HCl的H2气流还原CrCl3,该过程涉及到的反应原理为
已知:氯化亚铬的熔点为820~824℃,则其晶体类型为
(3)已知CrO5中铬元素为最高价态,画出其结构式:

(4)Cr元素与H元素形成化合物的晶胞结构如图所示,则该化合物的化学式为
您最近一年使用:0次



