名校
解题方法
1 . 在加热、加压条件下,利用金属锰的水热反应可将CO2转化为甲酸(HCOOH),转化关系示意图如下:
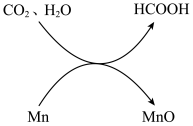
(1)HCOOH的官能团是羧基。HCOOH分子中与碳原子形成共价键的原子的数目是_______ 。
(2)转化过程可认为分两步反应进行:
反应I. Mn + H2O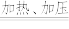 MnO + H2↑; 反应Ⅱ. ……
MnO + H2↑; 反应Ⅱ. ……
写出加热、加压条件下反应Ⅱ的化学方程式:_______ 。
(3)反应一段时间后,生成HCOOH的速率增大,可能的原因是_______ (填字母)。
A.反应放热使温度升高
B.反应I得到的MnO对HCOOH的生成有催化作用
C.H2能将MnO转化为MnO2

(1)HCOOH的官能团是羧基。HCOOH分子中与碳原子形成共价键的原子的数目是
(2)转化过程可认为分两步反应进行:
反应I. Mn + H2O
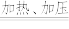 MnO + H2↑; 反应Ⅱ. ……
MnO + H2↑; 反应Ⅱ. ……写出加热、加压条件下反应Ⅱ的化学方程式:
(3)反应一段时间后,生成HCOOH的速率增大,可能的原因是
A.反应放热使温度升高
B.反应I得到的MnO对HCOOH的生成有催化作用
C.H2能将MnO转化为MnO2
您最近一年使用:0次
名校
2 . 将CH4和CO2重整转化为合成气一直是减少温室气体排放的研究方向之一,涉及如下反应:
主反应:CH4(g)+CO2(g)⇌2CO(g)+2H2(g)
积碳反应:CH4(g)⇌C(s)+2H2(g) =+75 kJ/mol
=+75 kJ/mol
回答问题(1)~(3):
(1)已知:2CO(g)⇌CO2(g)+C(s) =-172 kJ/mol, 则
=-172 kJ/mol, 则 =
=_______ kJ/mol
(2)恒温恒容密闭容器中仅发生主反应,能说明反应达到平衡状态的是________.(填标号)
(3)在体积为5L恒容密闭容器中充入2.0mol CH4和4.0molCO2,500℃下仅发生主反应,CH4、CO2的物质的量随时间变化如下表所示:
①CO2在 0~30 min 内的平均反应速率v(CO2)= ___________ 。
②主反应的平衡常数表达式为_____________ 。
③若在60min 时再充入2.0 mol CH4,达到新平衡后CH4的转化率减小,此时平衡常数K_______ (填“增大”、“减小”或“不变”)
④ 若相同条件下改为充入4.0 mol CH4和 8.0 mol CO2反应,平衡后CH4的转化率______ 90%(填“<”、“=”或“>”)。
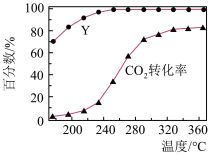
(4)CO2催化加H2可以制备CH4,保持反应气中CO2与 H2的体积比为 1∶4,以40 mL·min-1的流速通过催化剂,甲烷化过程中,含碳产物CH4的物质的量百分数(Y)及CO2的转化率随温度的变化如图所示。320℃时CO2反应速率为__________ mL·min-1。
主反应:CH4(g)+CO2(g)⇌2CO(g)+2H2(g)

积碳反应:CH4(g)⇌C(s)+2H2(g)
 =+75 kJ/mol
=+75 kJ/mol回答问题(1)~(3):
(1)已知:2CO(g)⇌CO2(g)+C(s)
 =-172 kJ/mol, 则
=-172 kJ/mol, 则 =
=(2)恒温恒容密闭容器中仅发生主反应,能说明反应达到平衡状态的是________.(填标号)
| A.容器内的压强不再变化 | B.c (CH4):c(CO2): c (CO): c (H2)=1:1:2:2 |
| C.混合气体的密度不再变化 | D.断开4molC-H键同时断开2molH-H键 |
| 时间/min 反应物 | 0 | 15 | 30 | 45 | 60 | 75 |
| n(CH4)/mol | 2.0 | 1.3 | 0.8 | 0.4 | 0.2 | 0.2 |
| n(CO2)/mol | 4.0 | 3.3 | 2.8 | 2.4 | 2.2 | 2.2 |
②主反应的平衡常数表达式为
③若在60min 时再充入2.0 mol CH4,达到新平衡后CH4的转化率减小,此时平衡常数K
④ 若相同条件下改为充入4.0 mol CH4和 8.0 mol CO2反应,平衡后CH4的转化率
(4)CO2催化加H2可以制备CH4,保持反应气中CO2与 H2的体积比为 1∶4,以40 mL·min-1的流速通过催化剂,甲烷化过程中,含碳产物CH4的物质的量百分数(Y)及CO2的转化率随温度的变化如图所示。320℃时CO2反应速率为

您最近一年使用:0次
2022-11-27更新
|
173次组卷
|
2卷引用:广东省佛山市南海区2022-2023学年高二上学期学业水平测试化学试题
名校
解题方法
3 . I.锂电池有广阔的应用前景。用“循环电沉积”法处理某种锂电池,可使其中的Li电极表面生成只允许Li+通过的Li2CO3和C保护层,工作原理如图1,具体操作如下。
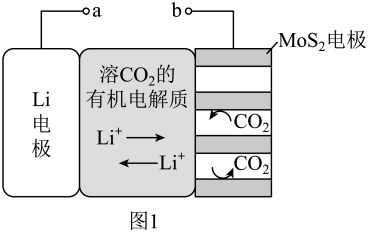
i.将表面洁净的Li电极和MoS2电极浸在溶有CO2的有机电解质溶液中。
ii.0~5min,a端连接电源正极,b端连接电源负极,电解,MoS2电极上生成Li2CO3和C。
iii.5~10min,a端连接电源负极,b端连接电源正极,电解,MoS2电极上消耗Li2CO3和C,Li电极上生成Li2CO3和C。
步骤ii和步骤iii为1个电沉积循环。
iv.重复步骤ii和步骤iii的操作,继续完成9个电沉积循环。
(1)步骤ii内电路中的Li+的迁移方向为____ 。
a.由Li电极向MoS2电极迁移 b.由MoS2电极向Li电极迁移
(2)已知下列反应的热化学方程式。
2Li(s)+2CO2(g)=Li2CO3(s)+CO(g) ΔH1=-539kJ•mol-1
CO2(g)+C(s)=2CO(g) ΔH2=+172kJ•mol-1
步骤ii电解总反应的热化学方程式为____ 。
(3)步骤iii中,Li电极的电极反应式为____ 。
(4)Li2CO3和C只有在MoS2的催化作用下才能发生步骤iii的电极反应,反应历程中的能量变化如图。下列说法正确的是____ (填字母)。

a.反应历程中存在碳氧键的断裂和形成
b.反应历程中涉及电子转移的变化均释放能量
c.MoS2催化剂通过降低电极反应的活化能使反应速率增大
II.如图为青铜器在潮湿环境中发生的电化学腐蚀的示意图。

(5)①腐蚀过程中,负极是____ (填“a”“b”或“c”)。
②环境中的Cl-扩散到孔口,并与正极产物和负极产物作用生成多孔铜锈Cu2(OH)3Cl,其离子方程式为_____ 。
③若生成4.29gCu2(OH)3Cl,则理论上消耗氧气的体积为____ L(标准状况)。

i.将表面洁净的Li电极和MoS2电极浸在溶有CO2的有机电解质溶液中。
ii.0~5min,a端连接电源正极,b端连接电源负极,电解,MoS2电极上生成Li2CO3和C。
iii.5~10min,a端连接电源负极,b端连接电源正极,电解,MoS2电极上消耗Li2CO3和C,Li电极上生成Li2CO3和C。
步骤ii和步骤iii为1个电沉积循环。
iv.重复步骤ii和步骤iii的操作,继续完成9个电沉积循环。
(1)步骤ii内电路中的Li+的迁移方向为
a.由Li电极向MoS2电极迁移 b.由MoS2电极向Li电极迁移
(2)已知下列反应的热化学方程式。
2Li(s)+2CO2(g)=Li2CO3(s)+CO(g) ΔH1=-539kJ•mol-1
CO2(g)+C(s)=2CO(g) ΔH2=+172kJ•mol-1
步骤ii电解总反应的热化学方程式为
(3)步骤iii中,Li电极的电极反应式为
(4)Li2CO3和C只有在MoS2的催化作用下才能发生步骤iii的电极反应,反应历程中的能量变化如图。下列说法正确的是

a.反应历程中存在碳氧键的断裂和形成
b.反应历程中涉及电子转移的变化均释放能量
c.MoS2催化剂通过降低电极反应的活化能使反应速率增大
II.如图为青铜器在潮湿环境中发生的电化学腐蚀的示意图。

(5)①腐蚀过程中,负极是
②环境中的Cl-扩散到孔口,并与正极产物和负极产物作用生成多孔铜锈Cu2(OH)3Cl,其离子方程式为
③若生成4.29gCu2(OH)3Cl,则理论上消耗氧气的体积为
您最近一年使用:0次
2022-10-19更新
|
211次组卷
|
2卷引用:山东省2022-2023学年高二上学期学业水平测试化学试题
4 . 回答下列问题:
(1)一种工业制备甲醇的反应为CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H
CH3OH(g)+H2O(g) △H
已知:①CO(g)+H2O(g) CO2(g)+H2(g) △H1=-40.9kJ·mol-1
CO2(g)+H2(g) △H1=-40.9kJ·mol-1
②CO(g)+2H2(g) CH3OH(g) △H2=-90.4kJ·mol-1
CH3OH(g) △H2=-90.4kJ·mol-1
试计算制备反应的△H=____ 。
(2)对于反应CO2(g)+3H2(g) CH3OH(g)+H2O(g),已知:v正=k正p(CO2)·p3(H2),v逆=k逆p(CH3OH)·p(H2O)。k正、k逆分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。在540K,按初始投料比n(CO2):n(H2)=3:1、n(CO2):n(H2)=1:1、n(CO2):n(H2)=1:3,得到不同压强条件下H2的平衡转化率关系如图1:
CH3OH(g)+H2O(g),已知:v正=k正p(CO2)·p3(H2),v逆=k逆p(CH3OH)·p(H2O)。k正、k逆分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。在540K,按初始投料比n(CO2):n(H2)=3:1、n(CO2):n(H2)=1:1、n(CO2):n(H2)=1:3,得到不同压强条件下H2的平衡转化率关系如图1:
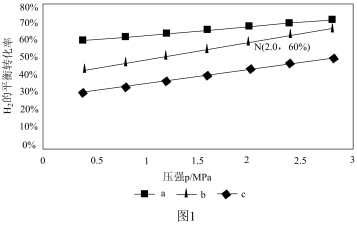
①比较a、b、c各曲线所表示的投料比大小顺序为____ (用字母表示)。
②点N在线b上,计算540K的压强平衡常数Kp=____ (用平衡分压计算)。
③540K条件下,某容器测得某时刻p(CO2)=0.2MPa,p(CH3OH)=p(H2O)=0.1MPa,p(H2)=0.4MPa,此时。v正:v逆=____ 。
(3)甲醇催化可制取丙烯的反应为:3CH3OH(g) C3H6(g)+3H2O(g),反应的Arrhenius经验公式的实验数据如图2中曲线a所示,已知Arrhenius经验公式为Rlnk=-
C3H6(g)+3H2O(g),反应的Arrhenius经验公式的实验数据如图2中曲线a所示,已知Arrhenius经验公式为Rlnk=-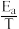 +C(Ea为活化能,k为速率常数,R和C为常数)。该反应的活化能Ea=
+C(Ea为活化能,k为速率常数,R和C为常数)。该反应的活化能Ea=____ kJ·mol-1。
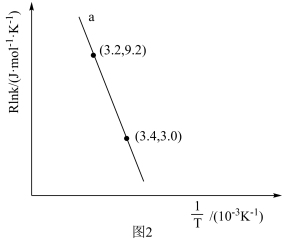
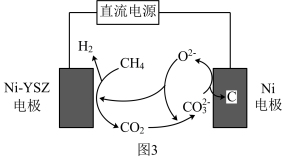
(4)甲烷蒸汽重整工业制氢面临着大量的“碳排放”,我国科技工作者发明了一种电化学分解甲烷的方法,其电化学反应原理如图3所示。请写出Ni-YSZ电极上发生的电极反应方程式:____ 。
(1)一种工业制备甲醇的反应为CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H
CH3OH(g)+H2O(g) △H已知:①CO(g)+H2O(g)
 CO2(g)+H2(g) △H1=-40.9kJ·mol-1
CO2(g)+H2(g) △H1=-40.9kJ·mol-1②CO(g)+2H2(g)
 CH3OH(g) △H2=-90.4kJ·mol-1
CH3OH(g) △H2=-90.4kJ·mol-1试计算制备反应的△H=
(2)对于反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),已知:v正=k正p(CO2)·p3(H2),v逆=k逆p(CH3OH)·p(H2O)。k正、k逆分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。在540K,按初始投料比n(CO2):n(H2)=3:1、n(CO2):n(H2)=1:1、n(CO2):n(H2)=1:3,得到不同压强条件下H2的平衡转化率关系如图1:
CH3OH(g)+H2O(g),已知:v正=k正p(CO2)·p3(H2),v逆=k逆p(CH3OH)·p(H2O)。k正、k逆分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。在540K,按初始投料比n(CO2):n(H2)=3:1、n(CO2):n(H2)=1:1、n(CO2):n(H2)=1:3,得到不同压强条件下H2的平衡转化率关系如图1:
①比较a、b、c各曲线所表示的投料比大小顺序为
②点N在线b上,计算540K的压强平衡常数Kp=
③540K条件下,某容器测得某时刻p(CO2)=0.2MPa,p(CH3OH)=p(H2O)=0.1MPa,p(H2)=0.4MPa,此时。v正:v逆=
(3)甲醇催化可制取丙烯的反应为:3CH3OH(g)
 C3H6(g)+3H2O(g),反应的Arrhenius经验公式的实验数据如图2中曲线a所示,已知Arrhenius经验公式为Rlnk=-
C3H6(g)+3H2O(g),反应的Arrhenius经验公式的实验数据如图2中曲线a所示,已知Arrhenius经验公式为Rlnk=-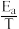 +C(Ea为活化能,k为速率常数,R和C为常数)。该反应的活化能Ea=
+C(Ea为活化能,k为速率常数,R和C为常数)。该反应的活化能Ea=
(4)甲烷蒸汽重整工业制氢面临着大量的“碳排放”,我国科技工作者发明了一种电化学分解甲烷的方法,其电化学反应原理如图3所示。请写出Ni-YSZ电极上发生的电极反应方程式:

您最近一年使用:0次
5 . 氨气广泛应用于化工、轻工、化肥、制药、合成纤维等领域,合成氨工业极大地影响了人类的发展历程。
(1)工业上用氨和二氧化碳为原料,在一定条件下合成尿素CO(NH2)2,已知:
①2NH3(g)+CO2(g)=NH2COONH4(s) ΔH = -159.5kJ/mol
②NH2COONH4(s)=CO(NH2)2(s)+H2O(g) ΔH = +116.5kJ/mol
③H2O(l)=H2O(g) ΔH = +44.0kJ/mol
写出氨气与二氧化碳生成尿素和液态水的热化学反应方程式__________ 。
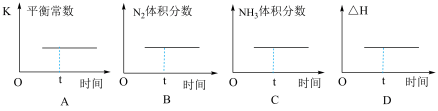
(2)已知反应N2(g)+3H2(g)⇌2NH3(g) ΔH <0,一定温度下,将N2和H2以物质的量之比为1∶1充入盛有催化剂的密闭容器,下列图象t时刻一定处于平衡状态的是______ 。
(3)200℃时,将N2(g)和H2(g)以物质的量之比为1∶3充入恒压容器中,容器内起始压强为P0,达到平衡时N2的转化率为50%,则该反应的平衡常数KP=___________ (用含有P0的式子表示。KP为分压平衡常数,气体分压=气体总压强×该气体的体积分数)
(4)某温度下,将一定量的NH3充入盛有催化剂的恒容容器中,一段时间达到平衡后,升高温度,当再次达到平衡时,N2的分压增大,原因是_________ 。
(5)我国科学家利用密度泛函理论筛选出合成氨的优良催化剂——担载单原子钼的缺陷硼氮单层材料,反应历程如图:
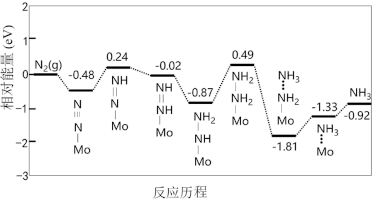
该反应历程中需要吸收能量的最大能垒(活化能)E=__________ eV。
(6)中科院大连化物所应用混合导体透氧膜制备氨合成气和液体燃料合成气,工作原理如图所示,请写出膜Ⅰ侧H2O发生的电极反应方程式:_________ 。

(7)25℃时,将2a mol/L的稀氨水与a mol/L的盐酸等体积混合后,试比较下列关系的大小(填“<”“>”或“=”):c(NH ) + c(H+)
) + c(H+)____ c(NH3∙H2O) + c(OH-) (NH3∙H2O的Kb=1.8×10-5)
(1)工业上用氨和二氧化碳为原料,在一定条件下合成尿素CO(NH2)2,已知:
①2NH3(g)+CO2(g)=NH2COONH4(s) ΔH = -159.5kJ/mol
②NH2COONH4(s)=CO(NH2)2(s)+H2O(g) ΔH = +116.5kJ/mol
③H2O(l)=H2O(g) ΔH = +44.0kJ/mol
写出氨气与二氧化碳生成尿素和液态水的热化学反应方程式
(2)已知反应N2(g)+3H2(g)⇌2NH3(g) ΔH <0,一定温度下,将N2和H2以物质的量之比为1∶1充入盛有催化剂的密闭容器,下列图象t时刻一定处于平衡状态的是

(3)200℃时,将N2(g)和H2(g)以物质的量之比为1∶3充入恒压容器中,容器内起始压强为P0,达到平衡时N2的转化率为50%,则该反应的平衡常数KP=
(4)某温度下,将一定量的NH3充入盛有催化剂的恒容容器中,一段时间达到平衡后,升高温度,当再次达到平衡时,N2的分压增大,原因是
(5)我国科学家利用密度泛函理论筛选出合成氨的优良催化剂——担载单原子钼的缺陷硼氮单层材料,反应历程如图:

该反应历程中需要吸收能量的最大能垒(活化能)E=
(6)中科院大连化物所应用混合导体透氧膜制备氨合成气和液体燃料合成气,工作原理如图所示,请写出膜Ⅰ侧H2O发生的电极反应方程式:

(7)25℃时,将2a mol/L的稀氨水与a mol/L的盐酸等体积混合后,试比较下列关系的大小(填“<”“>”或“=”):c(NH
 ) + c(H+)
) + c(H+)
您最近一年使用:0次
名校
6 . (1)乙基叔丁基醚(以ETBE表示)是一种性能优良的高辛烷值汽油调和剂。用乙醇与异丁烯(以IB表示)在催化剂HZSM-5催化下合成ETBE,反应的化学方程式为:C2H5OH(g)+IB(g)=ETBE(g) △H。回答下列问题:
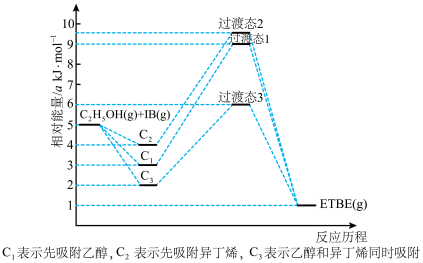
反应物被催化剂HZSM-5吸附的顺序与反应历程的关系如图所示,该反应的△H=__________ kJ·mol-1。反应历程的最优途径是________ (填C1、C2或C3)。
(2)开发清洁能源是当今化工研究的一个热点问题。二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3。工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
反应ⅰ:CO(g)+2H2(g)⇌CH3OH(g) ΔH1=-99kJ·mol−1
反应ⅱ:2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol−1
反应ⅲ:CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH3=-41.2kJ·mol−1
①在该条件下,若反应1的起始浓度分别为:c(CO)=0.6mol·L−1,c(H2)=1.4mol·L−1,8min后达到平衡,CO的转化率为50%,则8min内H2的平均反应速率为__________ 。
②在t℃时,反应2的平衡常数为400,此温度下,在1L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
此时刻v正___ v逆(填“>”“<”或“=”),平衡时c(CH3OCH3)的物质的量浓度是___ 。
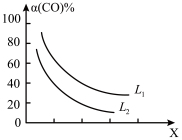
③催化反应室的总反应3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g),CO的平衡转化率α(CO)与温度、压强的关系如图所示,图中X代表___ (填“温度”或“压强”),且L1___ L2(填“>”“<”或“=”)。
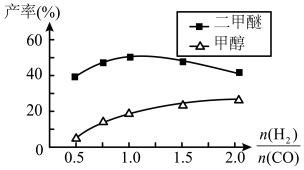
④在催化剂的作用下同时进行三个反应,发现随着起始投料比 的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因:
的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因:______________ 。

反应物被催化剂HZSM-5吸附的顺序与反应历程的关系如图所示,该反应的△H=
(2)开发清洁能源是当今化工研究的一个热点问题。二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3。工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
反应ⅰ:CO(g)+2H2(g)⇌CH3OH(g) ΔH1=-99kJ·mol−1
反应ⅱ:2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol−1
反应ⅲ:CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH3=-41.2kJ·mol−1
①在该条件下,若反应1的起始浓度分别为:c(CO)=0.6mol·L−1,c(H2)=1.4mol·L−1,8min后达到平衡,CO的转化率为50%,则8min内H2的平均反应速率为
②在t℃时,反应2的平衡常数为400,此温度下,在1L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| c(mol·L−1) | 0.46 | 1.0 | 1.0 |
③催化反应室的总反应3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g),CO的平衡转化率α(CO)与温度、压强的关系如图所示,图中X代表

④在催化剂的作用下同时进行三个反应,发现随着起始投料比
 的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因:
的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因:
您最近一年使用:0次
2020-05-13更新
|
229次组卷
|
3卷引用:山东省2022-2023学年高二上学期学业水平测试化学试题
7 . (1)已知: 25℃、101 kPa时,
I.H2(g) + O2(g) = H2O(g) △H1 =- 241.8kJ/mol
O2(g) = H2O(g) △H1 =- 241.8kJ/mol
II.H2(g) + O2(g) = H2O(l) △H2 =-2858kJ/mol
O2(g) = H2O(l) △H2 =-2858kJ/mol
试回答下列问题:
①能表示氢气燃烧热的热化学方程式为____ (填“I” 或“II”)
②H2O(g) = H2O(l) △H =___ kJ/mol。
(2)已知: 25℃、101 kPa时,CO(g) + H2O(g) CO2(g) + H2(g) △H = -41.0 kJ/mol。将1molCO和Imol H2O(g)置于1L的密闭容器中,在一定条件下反应达到平衡。试回答下列问题:
CO2(g) + H2(g) △H = -41.0 kJ/mol。将1molCO和Imol H2O(g)置于1L的密闭容器中,在一定条件下反应达到平衡。试回答下列问题:
①放出的热量___ 41.0kJ(填“>”、“<”或“=”);
②该反应的平衡常数表达式K =__
③其他条件不变时,升高温度,c(H2)将__
A 大 B 小 C 变
(3)常温下,现有0.1mol/L FeCl3溶液:
①该溶液呈___ (填“酸性”、 “碱性”或“中性");
②为沉淀Fe3+,加入定量氨水调节pH,当c(Fe3+)= 4.0×10-5mol/L时,溶液的pH=__ ( 已知Ksp[Fe(OH)3]= 4.0×10-38)。
(4)如图是电解CuSO4溶液的装置示意图。a、b是电源的两极,x、y都是石墨电极。通电一段时间后,y极上有气泡产生。试回答下列问题:①电源的正极是__ (填 “a”或“b”);②有关溶液变化的描述正确的是______ ;

A.pH降低
B.SO42-浓度减小
C.Cu2+浓度增大
③x极的电极反应式为________
I.H2(g) +
 O2(g) = H2O(g) △H1 =- 241.8kJ/mol
O2(g) = H2O(g) △H1 =- 241.8kJ/molII.H2(g) +
 O2(g) = H2O(l) △H2 =-2858kJ/mol
O2(g) = H2O(l) △H2 =-2858kJ/mol试回答下列问题:
①能表示氢气燃烧热的热化学方程式为
②H2O(g) = H2O(l) △H =
(2)已知: 25℃、101 kPa时,CO(g) + H2O(g)
 CO2(g) + H2(g) △H = -41.0 kJ/mol。将1molCO和Imol H2O(g)置于1L的密闭容器中,在一定条件下反应达到平衡。试回答下列问题:
CO2(g) + H2(g) △H = -41.0 kJ/mol。将1molCO和Imol H2O(g)置于1L的密闭容器中,在一定条件下反应达到平衡。试回答下列问题:①放出的热量
②该反应的平衡常数表达式K =
③其他条件不变时,升高温度,c(H2)将
A 大 B 小 C 变
(3)常温下,现有0.1mol/L FeCl3溶液:
①该溶液呈
②为沉淀Fe3+,加入定量氨水调节pH,当c(Fe3+)= 4.0×10-5mol/L时,溶液的pH=
(4)如图是电解CuSO4溶液的装置示意图。a、b是电源的两极,x、y都是石墨电极。通电一段时间后,y极上有气泡产生。试回答下列问题:①电源的正极是

A.pH降低
B.SO42-浓度减小
C.Cu2+浓度增大
③x极的电极反应式为
您最近一年使用:0次
2019高三·天津·学业考试
8 . 偏二甲肼( )、肼(
)、肼( )和四氧化二氧(
)和四氧化二氧( )可作为运载火箭的推进剂。
)可作为运载火箭的推进剂。
(1)已知: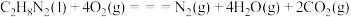



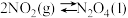

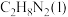 和
和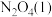 反应生成
反应生成 、
、 和
和 并放出大量热,写出该反应的热化学方程式(
并放出大量热,写出该反应的热化学方程式( 用含
用含 、
、 、
、 的代数式表示)
的代数式表示)__________ 。该反应______ (填“是”或“不是”)自发反应,判断的理由是_______ 。
(2)肼( )也可用于新型环保燃料电池中,燃料电池的工作原理示意图如图1所示,该燃料电池的负极反应式为
)也可用于新型环保燃料电池中,燃料电池的工作原理示意图如图1所示,该燃料电池的负极反应式为_________________________________ 。
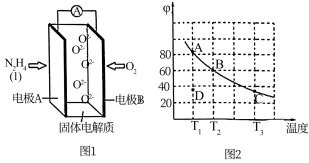
(3)将4molN2O4放入2 L,恒容密闭容器中发生反应N2O4(g) 2NO2(g),平衡体系中N2O4的体积分数(
2NO2(g),平衡体系中N2O4的体积分数(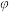 )随温度的变化如图2所示
)随温度的变化如图2所示
①D点v(正)________ v(逆)(填“>”“=”或“<”)。
②A、B、C点中平衡常数K的值最大的是________ 点。 时,N2O4的平衡转化率为
时,N2O4的平衡转化率为________ ;若达平衡时间为5 s,则此时间内的 平均反应速率为
平均反应速率为________ 。
③若其条件不变,在 原平衡基础上,再加入一定量
原平衡基础上,再加入一定量 ,达到新平衡时,与原平衡相比,NO2的体积分数
,达到新平衡时,与原平衡相比,NO2的体积分数________ (填“增大”“不变”或“减小”)。
 )、肼(
)、肼( )和四氧化二氧(
)和四氧化二氧( )可作为运载火箭的推进剂。
)可作为运载火箭的推进剂。(1)已知:
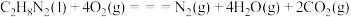



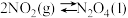

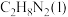 和
和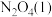 反应生成
反应生成 、
、 和
和 并放出大量热,写出该反应的热化学方程式(
并放出大量热,写出该反应的热化学方程式( 用含
用含 、
、 、
、 的代数式表示)
的代数式表示)(2)肼(
 )也可用于新型环保燃料电池中,燃料电池的工作原理示意图如图1所示,该燃料电池的负极反应式为
)也可用于新型环保燃料电池中,燃料电池的工作原理示意图如图1所示,该燃料电池的负极反应式为
(3)将4molN2O4放入2 L,恒容密闭容器中发生反应N2O4(g)
 2NO2(g),平衡体系中N2O4的体积分数(
2NO2(g),平衡体系中N2O4的体积分数(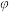 )随温度的变化如图2所示
)随温度的变化如图2所示①D点v(正)
②A、B、C点中平衡常数K的值最大的是
 时,N2O4的平衡转化率为
时,N2O4的平衡转化率为 平均反应速率为
平均反应速率为③若其条件不变,在
 原平衡基础上,再加入一定量
原平衡基础上,再加入一定量 ,达到新平衡时,与原平衡相比,NO2的体积分数
,达到新平衡时,与原平衡相比,NO2的体积分数
您最近一年使用:0次
2020-01-10更新
|
429次组卷
|
5卷引用:天津市2020年学业水平等级考适应性测试化学试题
2014高三·全国·专题练习
名校
解题方法
9 . 甲烷作为一种新能源在化学领域应用广泛,请回答下列问题。
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=260 kJ·mol-1
已知:2CO(g)+O2(g)===2CO2(g)
ΔH=-566 kJ·mol-1。
则CH4与O2反应生成CO和H2的热化学方程式为_________________________________ 。
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
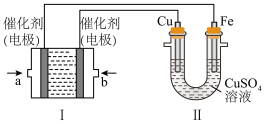
①a处应通入________ (填“CH4”或“O2”),b处电极上发生的电极反应式是__________________________________ 。
②电镀结束后,装置Ⅰ中溶液的pH________ (填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度________ 。
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有________ (忽略水解)。
④在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗甲烷________ L(标准状况下)。
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=260 kJ·mol-1
已知:2CO(g)+O2(g)===2CO2(g)
ΔH=-566 kJ·mol-1。
则CH4与O2反应生成CO和H2的热化学方程式为
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。

①a处应通入
②电镀结束后,装置Ⅰ中溶液的pH
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有
④在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗甲烷
您最近一年使用:0次
2018-10-02更新
|
348次组卷
|
10卷引用:2014年高中化学苏教版选修四模块综合检测练习卷
(已下线)2014年高中化学苏教版选修四模块综合检测练习卷2015-2016学年湖北孝感高级中学高二上期中测试化学试卷2015-2016学年福建师大附中高二下期中化学试卷河北省蠡县中学2018-2019学年高二上学期第一次(8月)月考化学试题河北省保定市蠡县中学2018-2019学年高二上学期9月月考化学试题福建省莆田市仙游县枫亭中学2019-2020学年高二上学期期中考试(选考)化学试题河北省邯郸市永年区第一中学2020-2021学年高二上学期10月月考化学试题山东省威海市第二中学2023-2024学年高二上学期第一次月考(实验班)化学试题(已下线)2014年高中化学二轮创新训练上 专题8电化学原理练习卷贵州省三都水族自治县高级中学2019-2020学年高三上学期期末考试理综化学试题
名校
解题方法
10 . “低碳经济”正成为科学家研究的主要课题,为了减少空气中的温室气体,并且充分利用二氧化碳资源,科学家们设想了一系列捕捉和封存二氧化碳的方法。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) ΔH=-76.0kJ·mol-1
①上述反应中每生成1molFe3O4,转移电子的物质的量为_______ mol。
②已知:C(s)+2H2O(g)=CO2(g)+2H2(g) △H=+113.4kJ·mol-1,则反应:3FeO(s)+H2O(g)=Fe3O4(s)+H2(g)的△H=__________ 。
(2)用氨水捕集烟气中的CO2生成铵盐是减少CO2排放的可行措施之一。
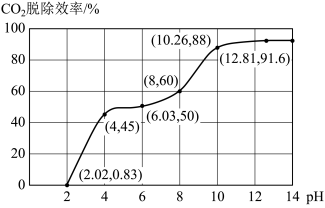
①分别用不同pH的吸收剂吸收烟气中的CO2,CO2脱除效率与吸收剂的pH关系如图所示,若烟气中CO2的含量(体积分数)为12%,烟气通入氨水的流量为0.052 m3·h-1(标准状况),用pH为12.81的氨水吸收烟气30min,脱除的CO2的物质的量最多为____________ (精确到0.01)。
②通常情况下温度升高,CO2脱除效率提高,但高于40℃时,脱除CO2效率降低的主要原因是______________ 。
(3)一定条件下,Pd-Mg/SiO2催化剂可使CO2“甲烷化”从而变废为宝,其反应机理如图所示,回答下列问题:
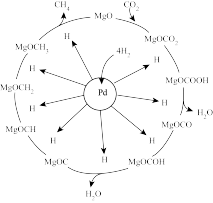
① 该反应的化学方程式为________________ ;反应过程中碳元素的化合价为-2价的中间体是_________ 。
② 向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2:0.2mol·L-1、H2:0.8mol·L-1、CH4:0.8mol·L-1、H2O:1.6mol·L-1,CO2的平衡转化率为_________________ ;300℃时上述反应的平衡常数K=___________________ 。
③已知该反应正反应放热,现有两个相同恒容绝热(与外界无热量交换)密闭容器Ⅰ、Ⅱ,在Ⅰ中充入1molCO2和4molH2,在Ⅱ中充入1molCH4和2molH2O(g),300℃下开始反应。达到平衡时,下列说法正确的是________ (填字母):
A.容器Ⅰ、Ⅱ中正反应速率相同
B.容器Ⅰ、Ⅱ中CH4的物质的量分数相同
C.容器Ⅰ中CO2的物质的量比容器Ⅱ中的多
D.容器Ⅰ中CO2的转化率与容器Ⅱ中CH4的转化率之和小于1。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) ΔH=-76.0kJ·mol-1
①上述反应中每生成1molFe3O4,转移电子的物质的量为
②已知:C(s)+2H2O(g)=CO2(g)+2H2(g) △H=+113.4kJ·mol-1,则反应:3FeO(s)+H2O(g)=Fe3O4(s)+H2(g)的△H=
(2)用氨水捕集烟气中的CO2生成铵盐是减少CO2排放的可行措施之一。
①分别用不同pH的吸收剂吸收烟气中的CO2,CO2脱除效率与吸收剂的pH关系如图所示,若烟气中CO2的含量(体积分数)为12%,烟气通入氨水的流量为0.052 m3·h-1(标准状况),用pH为12.81的氨水吸收烟气30min,脱除的CO2的物质的量最多为

②通常情况下温度升高,CO2脱除效率提高,但高于40℃时,脱除CO2效率降低的主要原因是
(3)一定条件下,Pd-Mg/SiO2催化剂可使CO2“甲烷化”从而变废为宝,其反应机理如图所示,回答下列问题:

① 该反应的化学方程式为
② 向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2:0.2mol·L-1、H2:0.8mol·L-1、CH4:0.8mol·L-1、H2O:1.6mol·L-1,CO2的平衡转化率为
③已知该反应正反应放热,现有两个相同恒容绝热(与外界无热量交换)密闭容器Ⅰ、Ⅱ,在Ⅰ中充入1molCO2和4molH2,在Ⅱ中充入1molCH4和2molH2O(g),300℃下开始反应。达到平衡时,下列说法正确的是
A.容器Ⅰ、Ⅱ中正反应速率相同
B.容器Ⅰ、Ⅱ中CH4的物质的量分数相同
C.容器Ⅰ中CO2的物质的量比容器Ⅱ中的多
D.容器Ⅰ中CO2的转化率与容器Ⅱ中CH4的转化率之和小于1。
您最近一年使用:0次
2018-04-13更新
|
367次组卷
|
3卷引用:2017-2018学年人教版选修4化学平衡之平衡状态的判断习题专项训练题



