将CH4和CO2重整转化为合成气一直是减少温室气体排放的研究方向之一,涉及如下反应:
主反应:CH4(g)+CO2(g)⇌2CO(g)+2H2(g)
积碳反应:CH4(g)⇌C(s)+2H2(g) =+75 kJ/mol
=+75 kJ/mol
回答问题(1)~(3):
(1)已知:2CO(g)⇌CO2(g)+C(s) =-172 kJ/mol, 则
=-172 kJ/mol, 则 =
=_______ kJ/mol
(2)恒温恒容密闭容器中仅发生主反应,能说明反应达到平衡状态的是________.(填标号)
(3)在体积为5L恒容密闭容器中充入2.0mol CH4和4.0molCO2,500℃下仅发生主反应,CH4、CO2的物质的量随时间变化如下表所示:
①CO2在 0~30 min 内的平均反应速率v(CO2)= ___________ 。
②主反应的平衡常数表达式为_____________ 。
③若在60min 时再充入2.0 mol CH4,达到新平衡后CH4的转化率减小,此时平衡常数K_______ (填“增大”、“减小”或“不变”)
④ 若相同条件下改为充入4.0 mol CH4和 8.0 mol CO2反应,平衡后CH4的转化率______ 90%(填“<”、“=”或“>”)。
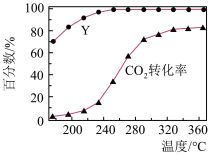
(4)CO2催化加H2可以制备CH4,保持反应气中CO2与 H2的体积比为 1∶4,以40 mL·min-1的流速通过催化剂,甲烷化过程中,含碳产物CH4的物质的量百分数(Y)及CO2的转化率随温度的变化如图所示。320℃时CO2反应速率为__________ mL·min-1。
主反应:CH4(g)+CO2(g)⇌2CO(g)+2H2(g)

积碳反应:CH4(g)⇌C(s)+2H2(g)
 =+75 kJ/mol
=+75 kJ/mol回答问题(1)~(3):
(1)已知:2CO(g)⇌CO2(g)+C(s)
 =-172 kJ/mol, 则
=-172 kJ/mol, 则 =
=(2)恒温恒容密闭容器中仅发生主反应,能说明反应达到平衡状态的是________.(填标号)
| A.容器内的压强不再变化 | B.c (CH4):c(CO2): c (CO): c (H2)=1:1:2:2 |
| C.混合气体的密度不再变化 | D.断开4molC-H键同时断开2molH-H键 |
| 时间/min 反应物 | 0 | 15 | 30 | 45 | 60 | 75 |
| n(CH4)/mol | 2.0 | 1.3 | 0.8 | 0.4 | 0.2 | 0.2 |
| n(CO2)/mol | 4.0 | 3.3 | 2.8 | 2.4 | 2.2 | 2.2 |
②主反应的平衡常数表达式为
③若在60min 时再充入2.0 mol CH4,达到新平衡后CH4的转化率减小,此时平衡常数K
④ 若相同条件下改为充入4.0 mol CH4和 8.0 mol CO2反应,平衡后CH4的转化率
(4)CO2催化加H2可以制备CH4,保持反应气中CO2与 H2的体积比为 1∶4,以40 mL·min-1的流速通过催化剂,甲烷化过程中,含碳产物CH4的物质的量百分数(Y)及CO2的转化率随温度的变化如图所示。320℃时CO2反应速率为

更新时间:2022-11-27 09:45:22
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】Ⅰ.蕴藏在海底的可燃冰是高压下形成外观像冰的甲烷水合物固体,被称之为“未来能源”。对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物,如:
CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) △H1 =-574 kJ·mol-1 K1
4NO(g)+CO2(g)+2H2O(g) △H1 =-574 kJ·mol-1 K1
CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g) △H2 =-1160 kJ·mol-1 K2
2N2(g)+CO2(g)+2H2O(g) △H2 =-1160 kJ·mol-1 K2
则CH4(g)将NO2(g)还原为N2(g)的热化学方程式为___________ ,且该反应的平衡常数K=___________ (用含K1、K2的代数式表示)。
Ⅱ.水煤气是重要燃料和化工原料,可用水蒸气通过炽热的碳层制得:C (s) + H2O(g) CO (g) +H2 (g) △H=+131.3 kJ•mol-1
CO (g) +H2 (g) △H=+131.3 kJ•mol-1
(1) 该反应的化学平衡常数表达式K=___________ ,若某温度下,K值的大小为0.5,此时向体积为1L的密闭容器中加入1mol H2O(g)和足量C(s),H2O(g)的平衡转化率为 ___________ ;
(2) 对于该反应,一定可以提高平衡体系中H2的百分含量,又能加快化学反应速率的措施是___________ ;
a.升高温度 b.增大水蒸气的浓度 c.加入催化剂 d.降低压强
(3) 上述反应达到平衡后,移走体系中部分C(s),平衡___________ ,将产生的CO全部移走,平衡___________ (以上两空选填“向左移”、“向右移”、“不移动”);
(4) 上述反应在t0时刻达到平衡(如下图),若在t1时刻改变某一条件,请在下图中继续画出t1时刻之后升高温度反应速率(ν)随时间的变化趋势___________ 。

CH4(g)+4NO2(g)
 4NO(g)+CO2(g)+2H2O(g) △H1 =-574 kJ·mol-1 K1
4NO(g)+CO2(g)+2H2O(g) △H1 =-574 kJ·mol-1 K1CH4(g)+4NO(g)
 2N2(g)+CO2(g)+2H2O(g) △H2 =-1160 kJ·mol-1 K2
2N2(g)+CO2(g)+2H2O(g) △H2 =-1160 kJ·mol-1 K2则CH4(g)将NO2(g)还原为N2(g)的热化学方程式为
Ⅱ.水煤气是重要燃料和化工原料,可用水蒸气通过炽热的碳层制得:C (s) + H2O(g)
 CO (g) +H2 (g) △H=+131.3 kJ•mol-1
CO (g) +H2 (g) △H=+131.3 kJ•mol-1(1) 该反应的化学平衡常数表达式K=
(2) 对于该反应,一定可以提高平衡体系中H2的百分含量,又能加快化学反应速率的措施是
a.升高温度 b.增大水蒸气的浓度 c.加入催化剂 d.降低压强
(3) 上述反应达到平衡后,移走体系中部分C(s),平衡
(4) 上述反应在t0时刻达到平衡(如下图),若在t1时刻改变某一条件,请在下图中继续画出t1时刻之后升高温度反应速率(ν)随时间的变化趋势

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】对甲烷和CO2的高效利用不仅能缓解大气变暖,而且对日益枯竭的石油资源也有一定的补充作用,甲烷临氧耦合CO2重整反应有:
反应(i):2CH4(g)+O2(g) 2CO(g)+4H2(g) △H=-71.4kJ•mol-1
2CO(g)+4H2(g) △H=-71.4kJ•mol-1
反应(ii):CH4(g)+CO2(g) 2CO(g)+2H2(g) △H=+247.0kJ•mol-1
2CO(g)+2H2(g) △H=+247.0kJ•mol-1
(1)写出表示CO燃烧热的热化学方程式:_____ 。
(2)在两个体积均为2L的恒容密闭容器中,起始时按表中相应的量加入物质,在相同温度下进行反应(ii):CH4(g)+CO2(g) 2CO(g)+2H2(g)(不发生其它反应),CO2的平衡转化率如下表所示:
2CO(g)+2H2(g)(不发生其它反应),CO2的平衡转化率如下表所示:
①下列能说明反应达到平衡状态是_____ 。
A.v正(CH4)=2v逆(CO)
B.容器内各物质的浓度满足c(CH4)·c(CO2)=c2(CO)·c2(H2)
C.容器内混合气体的总压强不再变化
D.容器内混合气体密度保持不变
②若容器Ⅰ内反应从开始到平衡所用的时间为tmin,则tmin内该反应的平均反应速率为:v(H2)=____ (用含t的表达式表示)。
③达到平衡时,容器Ⅰ、Ⅱ内CO的物质的量的关系满足:2n(CO)Ⅰ___ n(CO)Ⅱ(填“>”、“=”或“<”)。
(3)将CH4(g)和O2(g)以物质的量比为4:3充入盛有催化剂的恒容密闭容器内,发生上述反应(i):2CH4(g)+O2(g) 2CO(g)+4H2(g),测得CO的体积分数[ψ(CO)]与温度(T)的关系如图如示。
2CO(g)+4H2(g),测得CO的体积分数[ψ(CO)]与温度(T)的关系如图如示。
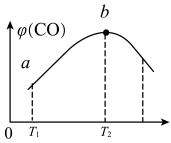
①T2℃时,CO体积分数最大的原因是____ 。
②若T2℃时,容器内起始压强为P0,平衡时CO的体积分数为20%,则反应的平衡常数KP=___ (用平衡分压强代替平衡浓度计算,分压=总压×物质的量分数)。
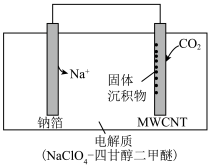
(4)2016年我国科研人员根据反应Na+CO2→Na2CO3+C(未配平)研制出一种室温“可呼吸”Na-CO2电池。放电时该电池“吸入”CO2,充电时“呼出”CO2。其放电时的工作原理如图所示,已知吸收的全部CO2中,有 转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面,写出放电时正极的电极反应式:
转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面,写出放电时正极的电极反应式:___ 。
反应(i):2CH4(g)+O2(g)
 2CO(g)+4H2(g) △H=-71.4kJ•mol-1
2CO(g)+4H2(g) △H=-71.4kJ•mol-1反应(ii):CH4(g)+CO2(g)
 2CO(g)+2H2(g) △H=+247.0kJ•mol-1
2CO(g)+2H2(g) △H=+247.0kJ•mol-1(1)写出表示CO燃烧热的热化学方程式:
(2)在两个体积均为2L的恒容密闭容器中,起始时按表中相应的量加入物质,在相同温度下进行反应(ii):CH4(g)+CO2(g)
 2CO(g)+2H2(g)(不发生其它反应),CO2的平衡转化率如下表所示:
2CO(g)+2H2(g)(不发生其它反应),CO2的平衡转化率如下表所示:| 起始物质的量(n)/mol | CO2的平衡转化率 | ||||
| CH4 | CO2 | CO | H2 | ||
| Ⅰ | 0.1 | 0.1 | 0 | 0 | 50% |
| Ⅱ | 0.1 | 0.1 | 0.2 | 0.2 | / |
①下列能说明反应达到平衡状态是
A.v正(CH4)=2v逆(CO)
B.容器内各物质的浓度满足c(CH4)·c(CO2)=c2(CO)·c2(H2)
C.容器内混合气体的总压强不再变化
D.容器内混合气体密度保持不变
②若容器Ⅰ内反应从开始到平衡所用的时间为tmin,则tmin内该反应的平均反应速率为:v(H2)=
③达到平衡时,容器Ⅰ、Ⅱ内CO的物质的量的关系满足:2n(CO)Ⅰ
(3)将CH4(g)和O2(g)以物质的量比为4:3充入盛有催化剂的恒容密闭容器内,发生上述反应(i):2CH4(g)+O2(g)
 2CO(g)+4H2(g),测得CO的体积分数[ψ(CO)]与温度(T)的关系如图如示。
2CO(g)+4H2(g),测得CO的体积分数[ψ(CO)]与温度(T)的关系如图如示。
①T2℃时,CO体积分数最大的原因是
②若T2℃时,容器内起始压强为P0,平衡时CO的体积分数为20%,则反应的平衡常数KP=
(4)2016年我国科研人员根据反应Na+CO2→Na2CO3+C(未配平)研制出一种室温“可呼吸”Na-CO2电池。放电时该电池“吸入”CO2,充电时“呼出”CO2。其放电时的工作原理如图所示,已知吸收的全部CO2中,有
 转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面,写出放电时正极的电极反应式:
转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面,写出放电时正极的电极反应式:
您最近一年使用:0次
【推荐3】氨是最重要的化工产品之一,其生产方法也在逐渐改进中,各国科学家均在为提高氨的产量,降低能耗作各种有益的探究;氨在工业上有广泛用途。
(1)合成氨用的H2可以CH4为原料制得。已知相关的化学键键能数据如下:
则CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式__________ 。
(2)近年有人将电磁场直接加在氮气与氢气反应的容器内,在较低的温度和压强条件下合成氨,获得了较好的产率。从化学反应本质角度分析,电磁场对合成氨反应的作用是___ 。
(3)在425℃、A12O3作催化剂,甲醇与氨气反应可以制得(CH3)2NH。(CH3)2NH显弱碱性,与盐酸反应生成(CH3)2NH2Cl,溶液中各离子浓度由小到大的顺序为___ 。
(4)直接供氨式碱性燃料电池的电池反应式4NH3+3O2=2N2+6H2O,负极电极反应式为___ 。
(5)如图,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率,反应原理为:NO(g)+NO2(g)+2NH3(g)⇌2N2(g)+3H2O(g)。(注:脱氮率即氮氧化物转化率)
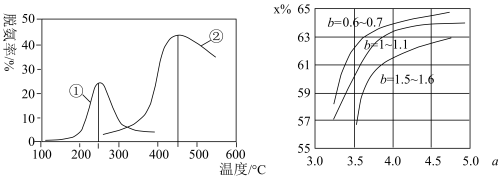
①对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则上述反应的表达式KP=_______ 。
②以下说法正确的是_________ 。
A.上述反应的正反应为吸热反应
B.相同条件下,改变压强对脱氮率没有影响
C.催化剂①、②分别适合于250℃和450℃左右脱氮
D.曲线①、②最高点表示此时平衡转化率最高
(6)氨气制取尿素的合成塔中发生反应:2NH3(g)+CO2(g)⇌CO(NH2)2(l)+H2O(g)。图中为合成塔中不同氨碳比a和水碳比b时二氧化碳转化率(x%),a宜控制在4.0左右,理由是__________ 。
(1)合成氨用的H2可以CH4为原料制得。已知相关的化学键键能数据如下:
| 化学键 | H—H | C—O | C≡O | H—O | C—H |
| E/(kJ·mol-1) | 436 | 351 | 1076 | 463 | 413 |
则CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式
(2)近年有人将电磁场直接加在氮气与氢气反应的容器内,在较低的温度和压强条件下合成氨,获得了较好的产率。从化学反应本质角度分析,电磁场对合成氨反应的作用是
(3)在425℃、A12O3作催化剂,甲醇与氨气反应可以制得(CH3)2NH。(CH3)2NH显弱碱性,与盐酸反应生成(CH3)2NH2Cl,溶液中各离子浓度由小到大的顺序为
(4)直接供氨式碱性燃料电池的电池反应式4NH3+3O2=2N2+6H2O,负极电极反应式为
(5)如图,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率,反应原理为:NO(g)+NO2(g)+2NH3(g)⇌2N2(g)+3H2O(g)。(注:脱氮率即氮氧化物转化率)

①对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则上述反应的表达式KP=
②以下说法正确的是
A.上述反应的正反应为吸热反应
B.相同条件下,改变压强对脱氮率没有影响
C.催化剂①、②分别适合于250℃和450℃左右脱氮
D.曲线①、②最高点表示此时平衡转化率最高
(6)氨气制取尿素的合成塔中发生反应:2NH3(g)+CO2(g)⇌CO(NH2)2(l)+H2O(g)。图中为合成塔中不同氨碳比a和水碳比b时二氧化碳转化率(x%),a宜控制在4.0左右,理由是
您最近一年使用:0次
【推荐1】一氧化碳可用于制甲酸钠,也可以在冶金工业中作还原剂,还可以作气体燃料,如水煤气(一氧化碳和氢气等气体的混合物)。在恒温恒容密闭容器中发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g)。请回答下列问题:
CO2(g)+H2(g)。请回答下列问题:
(1)加快该反应速率的措施是___ (写两条)。
(2)已知化学键的键能(E)数据如下表:
由此计算生成1mol CO2___ (吸收或放出)能量___ kJ。
(3)判断该反应达到平衡的依据是__ 。
A.正、逆反应速率都为零
B.容器内压强不再变化
C.CO、H2O、CO2、H2的浓度都不再发生变化
D.单位时间内生成1molH2,同时生成1mol CO
(4)若该容器的容积为2L,加入0.2mol的CO和0.2mol的H2O(g),在一定条件下发生反应,反应中CO2的浓度随时间变化情况如图所示:
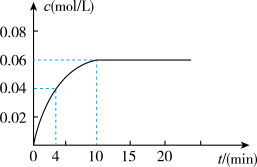
①反应到4min时,H2O(g)的转化率=___ 。
②根据该图数据,反应开始至达到平衡时,CO的平均反应速率v(CO)=___ ;反应达平衡时,H2的体积分数=__ 。
 CO2(g)+H2(g)。请回答下列问题:
CO2(g)+H2(g)。请回答下列问题:(1)加快该反应速率的措施是
(2)已知化学键的键能(E)数据如下表:
| 化学键 | H-H | C=O | C≡O(CO) | H-O |
| E/(kJ/mol) | 436 | 750 | 1076 | 463 |
由此计算生成1mol CO2
(3)判断该反应达到平衡的依据是
A.正、逆反应速率都为零
B.容器内压强不再变化
C.CO、H2O、CO2、H2的浓度都不再发生变化
D.单位时间内生成1molH2,同时生成1mol CO
(4)若该容器的容积为2L,加入0.2mol的CO和0.2mol的H2O(g),在一定条件下发生反应,反应中CO2的浓度随时间变化情况如图所示:

①反应到4min时,H2O(g)的转化率=
②根据该图数据,反应开始至达到平衡时,CO的平均反应速率v(CO)=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】I.向某浓度的盐酸中加入一定量的纯净CaCO3,产生气体的体积随时间的变化曲线如图所示,已知随着反应的进行,反应体系温度逐渐升高(气体体积均在标准状况下测定)。
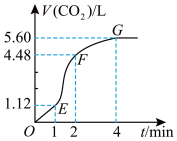
(1)CaCO3与盐酸的反应是____ (填“吸热”或“放热”)反应。
(2)EF段的化学反应速率v(CO2)=____ mol·min-1。
(3)为了加快上述反应的速率,欲向该溶液中加入下列物质,你认为可行的是____ 。
II.某温度下,在2L的密闭容器中,三种物质的物质的量随时间变化的曲线如图所示(已知X、Y、Z均为气体)。
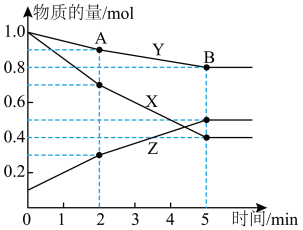
(4)反应的化学方程式为____ 。
(5)下列各项中能说明上述反应达到化学平衡状态的是____ (填字母)。
a.混合气体的密度不变 b.混合气体的平均相对分子质量不变
c.X的浓度保持不变 d.生成1molZ和同时消耗1.5molX
(6)图中A点的正反应速率v正(Y)____ (填“大于”、“小于”或“等于”)B点的逆反应速率v逆(Y)。
(7)达到平衡时X的转化率为____ ,平衡时混合气体中Z的体积分数为____ (保留两位有效数字)。

(1)CaCO3与盐酸的反应是
(2)EF段的化学反应速率v(CO2)=
(3)为了加快上述反应的速率,欲向该溶液中加入下列物质,你认为可行的是
| A.蒸馏水 | B.氯化钾固体 | C.氯化钠溶液 | D.浓盐酸 |
II.某温度下,在2L的密闭容器中,三种物质的物质的量随时间变化的曲线如图所示(已知X、Y、Z均为气体)。

(4)反应的化学方程式为
(5)下列各项中能说明上述反应达到化学平衡状态的是
a.混合气体的密度不变 b.混合气体的平均相对分子质量不变
c.X的浓度保持不变 d.生成1molZ和同时消耗1.5molX
(6)图中A点的正反应速率v正(Y)
(7)达到平衡时X的转化率为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】仔细阅读下列问题,完成下列问题
(1)一定条件下,在体积为10L的密闭容器中,A、B、C三种气体的物质的量 随时间
随时间 的变化如图1所示。已知达到平衡后,降低温度,A的体积分数将减小。
的变化如图1所示。已知达到平衡后,降低温度,A的体积分数将减小。
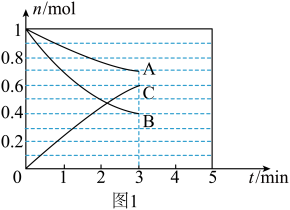
①该反应的化学方程式为___________ ,此反应平衡常数表达式为
___________ 。
②该反应的
___________ 0(填“>”“<”或“=”)。
③该反应的反应速率v随时间t的变化关系如图2所示:根据图2判断,在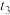 时刻改变的外界条件是
时刻改变的外界条件是___________ 。在恒温恒容密闭容器中发生该反应,下列能作为达到平衡状态的判断依据是___________ (填标号)。
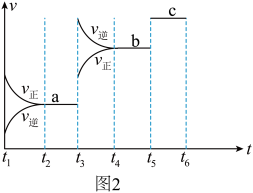
a.体系压强不变 b.A的消耗速率等于B的生成速率气体
c.气体的密度保持不变 d.气体的平均摩尔质量保持不变
(2)消除含氮、硫、氯等化合物对大气和水体的污染对建设美丽家乡,打造宜居环境具有重要意义。 和
和 是常见的环境污染气体,汽车尾气中
是常见的环境污染气体,汽车尾气中 、
、 在一定条件下可以发生反应:
在一定条件下可以发生反应: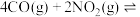
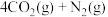
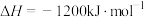 ,在一定温度下,向容积固定为
,在一定温度下,向容积固定为 的密闭容器中充入一定量的
的密闭容器中充入一定量的 和
和 ,
, 的物质的量随时间的变化曲线如图所示。
的物质的量随时间的变化曲线如图所示。
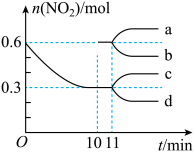
①从反应开始到 的平衡状态,
的平衡状态, 的平均反应速率为
的平均反应速率为___________ 。从 起,其他条件不变,压缩容器的容积为
起,其他条件不变,压缩容器的容积为 ,则
,则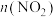 的变化曲线可能为图中的
的变化曲线可能为图中的___________ (填字母)。
②对于该反应,温度不同(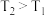 )、其他条件相同时,下列图像表示正确的是
)、其他条件相同时,下列图像表示正确的是___________ (填序号)。
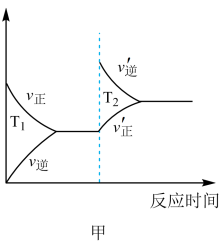

(1)一定条件下,在体积为10L的密闭容器中,A、B、C三种气体的物质的量
 随时间
随时间 的变化如图1所示。已知达到平衡后,降低温度,A的体积分数将减小。
的变化如图1所示。已知达到平衡后,降低温度,A的体积分数将减小。
①该反应的化学方程式为

②该反应的

③该反应的反应速率v随时间t的变化关系如图2所示:根据图2判断,在
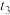 时刻改变的外界条件是
时刻改变的外界条件是
a.体系压强不变 b.A的消耗速率等于B的生成速率气体
c.气体的密度保持不变 d.气体的平均摩尔质量保持不变
(2)消除含氮、硫、氯等化合物对大气和水体的污染对建设美丽家乡,打造宜居环境具有重要意义。
 和
和 是常见的环境污染气体,汽车尾气中
是常见的环境污染气体,汽车尾气中 、
、 在一定条件下可以发生反应:
在一定条件下可以发生反应: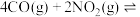
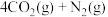
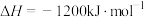 ,在一定温度下,向容积固定为
,在一定温度下,向容积固定为 的密闭容器中充入一定量的
的密闭容器中充入一定量的 和
和 ,
, 的物质的量随时间的变化曲线如图所示。
的物质的量随时间的变化曲线如图所示。
①从反应开始到
 的平衡状态,
的平衡状态, 的平均反应速率为
的平均反应速率为 起,其他条件不变,压缩容器的容积为
起,其他条件不变,压缩容器的容积为 ,则
,则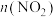 的变化曲线可能为图中的
的变化曲线可能为图中的②对于该反应,温度不同(
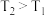 )、其他条件相同时,下列图像表示正确的是
)、其他条件相同时,下列图像表示正确的是

您最近一年使用:0次
【推荐1】完成下列问题。
(1)已知:①N2(g)+O2(g) 2NO(g) △H1=+180kJ•mol-1
2NO(g) △H1=+180kJ•mol-1
②C(s)+O2(g)=CO2(g) △H2=-393kJ•mol-1
③2C(s)+O2(g)=2CO(g) △H3=-221kJ•mol-1
若某反应的平衡常数表达式为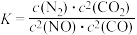 ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:______ 。
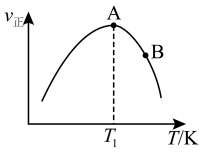
(2)欲研究在某催化剂作用下2CO(g)+2NO(g) N2(g)+2CO2(g)的反应速率与温度的关系,在其他条件相同时,改变反应温度,测得经过相同时间时该反应的正反应速率如图所示,A、B两点对应温度下正反应速率变化的原因可能是
N2(g)+2CO2(g)的反应速率与温度的关系,在其他条件相同时,改变反应温度,测得经过相同时间时该反应的正反应速率如图所示,A、B两点对应温度下正反应速率变化的原因可能是______ ,A、B两点对应温度下该反应的活化能Ea(A)______ Ea(B)(填“>”或“<”)。
(3)设 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。在某温度下,原料组成n(CO):n(NO)=1:1,初始总压为100kPa的恒容密闭容器中进行上述反应,体系达到平衡时N2的分压为20kPa,则该反应的相对压力平衡常数
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。在某温度下,原料组成n(CO):n(NO)=1:1,初始总压为100kPa的恒容密闭容器中进行上述反应,体系达到平衡时N2的分压为20kPa,则该反应的相对压力平衡常数 =
=___________ 。
(4)用NH3可以消除NO污染:4NH3(g)+6NO(g) 5N2(g)+6H2O(1),该反应速率v正=k正•c4(NH3)•c6(NO),v逆=K逆•c5(N2),若将9molNH3和11molNO投入真空容器中恒温恒容(温度298K、体积为10L)进行反应,已知该条件下k正=6.4×102(mol/L)-9•s-1,当平衡时NH3转化率为
5N2(g)+6H2O(1),该反应速率v正=k正•c4(NH3)•c6(NO),v逆=K逆•c5(N2),若将9molNH3和11molNO投入真空容器中恒温恒容(温度298K、体积为10L)进行反应,已知该条件下k正=6.4×102(mol/L)-9•s-1,当平衡时NH3转化率为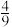 ,v逆=
,v逆=___________ mol•L-1•s-1。
(1)已知:①N2(g)+O2(g)
 2NO(g) △H1=+180kJ•mol-1
2NO(g) △H1=+180kJ•mol-1②C(s)+O2(g)=CO2(g) △H2=-393kJ•mol-1
③2C(s)+O2(g)=2CO(g) △H3=-221kJ•mol-1
若某反应的平衡常数表达式为
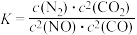 ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:(2)欲研究在某催化剂作用下2CO(g)+2NO(g)
 N2(g)+2CO2(g)的反应速率与温度的关系,在其他条件相同时,改变反应温度,测得经过相同时间时该反应的正反应速率如图所示,A、B两点对应温度下正反应速率变化的原因可能是
N2(g)+2CO2(g)的反应速率与温度的关系,在其他条件相同时,改变反应温度,测得经过相同时间时该反应的正反应速率如图所示,A、B两点对应温度下正反应速率变化的原因可能是
(3)设
 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。在某温度下,原料组成n(CO):n(NO)=1:1,初始总压为100kPa的恒容密闭容器中进行上述反应,体系达到平衡时N2的分压为20kPa,则该反应的相对压力平衡常数
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。在某温度下,原料组成n(CO):n(NO)=1:1,初始总压为100kPa的恒容密闭容器中进行上述反应,体系达到平衡时N2的分压为20kPa,则该反应的相对压力平衡常数 =
=(4)用NH3可以消除NO污染:4NH3(g)+6NO(g)
 5N2(g)+6H2O(1),该反应速率v正=k正•c4(NH3)•c6(NO),v逆=K逆•c5(N2),若将9molNH3和11molNO投入真空容器中恒温恒容(温度298K、体积为10L)进行反应,已知该条件下k正=6.4×102(mol/L)-9•s-1,当平衡时NH3转化率为
5N2(g)+6H2O(1),该反应速率v正=k正•c4(NH3)•c6(NO),v逆=K逆•c5(N2),若将9molNH3和11molNO投入真空容器中恒温恒容(温度298K、体积为10L)进行反应,已知该条件下k正=6.4×102(mol/L)-9•s-1,当平衡时NH3转化率为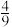 ,v逆=
,v逆=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳,回答下列问题:
(1)250℃、100 kPa时二氧化碳加氢制甲醇的反应一般认为通过两个步骤来实现,能量变化过程如图所示。
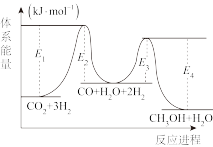
总反应的焓变△H=___________ kJ·mol-1,写出决速步反应的热化学方程式___________ 。
(2)合成总反应在起始物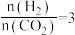 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在t=250°C下的x(CH3OH)~p、在p=5×105 Pa下的x(CH3OH)~t如图所示。
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在t=250°C下的x(CH3OH)~p、在p=5×105 Pa下的x(CH3OH)~t如图所示。

①用各物质的平衡分压表示总反应的平衡常数表达式Kp=___________ 。
②图中对应等压过程的曲线是___________ ,判断的理由是___________ 。
③当x(CH3OH)=0.10时,CO2的平衡转化率α=___________ 。
④A、B、C、D、E中可能表示220℃、6×105Pa时的平衡状态的点是___________ ,C、D两点的平衡常数分别是KC、KD,KC___________ KD(填“>”“<”或“=”)。
(1)250℃、100 kPa时二氧化碳加氢制甲醇的反应一般认为通过两个步骤来实现,能量变化过程如图所示。

总反应的焓变△H=
(2)合成总反应在起始物
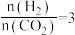 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在t=250°C下的x(CH3OH)~p、在p=5×105 Pa下的x(CH3OH)~t如图所示。
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在t=250°C下的x(CH3OH)~p、在p=5×105 Pa下的x(CH3OH)~t如图所示。
①用各物质的平衡分压表示总反应的平衡常数表达式Kp=
②图中对应等压过程的曲线是
③当x(CH3OH)=0.10时,CO2的平衡转化率α=
④A、B、C、D、E中可能表示220℃、6×105Pa时的平衡状态的点是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】回答下列问题:
(1)化学反应中伴随着能量变化。下列属于吸热反应的是____ (填序号)。
a.燃烧CO b.C与CO2反应
c.铝和稀盐酸反应 d.液态水变为水蒸气
(2)氨气中氢含量高,是一种优良的小分子储氢载体,且胺全、易储运。
相关化学键的键能数据
则:①2NH3(g) N2(g)+3H2(g) △H=
N2(g)+3H2(g) △H=____ kJ·mol-1。
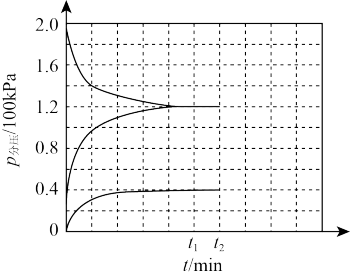
②某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下,将0.1 mol NH3通入3 L的密闭容器中进行反应(此时容器内总压为200 kPa),各物质的分压随时间的变化曲线如图所示。在该温度下,用分压表示的平衡常数Kp=___ 。(已知:分压=总压×该组分物质的量分数)
(3)我国力争于2030年前做到碳达峰,2060年前实现碳中和。CH4与CO2重整是CO2利用研究热点之一。该重整反应体系主要涉及以下反应:
a)CH4(g)+CO2(g) 2CO(g)+2H2(g) △H1
2CO(g)+2H2(g) △H1
b)CO2(g)+H2(g) CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
c)CH4(g) C(s)+2H2(g) △H3
C(s)+2H2(g) △H3
d)2CO(g) CO2(g)+C(s) △H4
CO2(g)+C(s) △H4
e)CO(g)+H2(g) H2O(g)+C(s) △H5
H2O(g)+C(s) △H5
①根据盖斯定律,反应a的△H1=___ (写出一个代数式即可)。
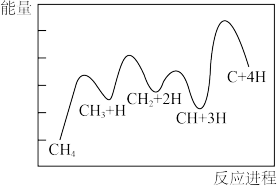
②一定条件下,CH4分解形成碳的反应历程如图所示。该历程分___ 步进行,其中,第___ 步的正反应活化能最大。
③某学生应用平衡原理对b)CO2(g)+H2(g) CO(g)+H2O(g) △H2>0的反应进行研究。向一恒温恒容的密闭容器中充入1 mol CO2和2 mol H2发生反应,t1时达到平衡状态Ⅰ,在t2时改变某一条件,t3时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是
CO(g)+H2O(g) △H2>0的反应进行研究。向一恒温恒容的密闭容器中充入1 mol CO2和2 mol H2发生反应,t1时达到平衡状态Ⅰ,在t2时改变某一条件,t3时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是___ (填字母)。
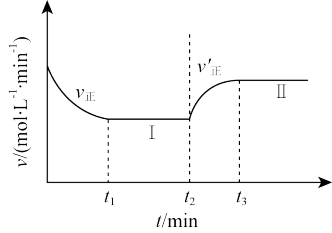
A.容器内压强不变,表明反应达到平衡
B.t2时改变的条件:向容器中加入CO或加入H2O(g)
C.t2时若升高温度或增大压强,均有利于提高CO2的转化率
D.平衡常数K:K(Ⅱ)<K(Ⅰ)
(1)化学反应中伴随着能量变化。下列属于吸热反应的是
a.燃烧CO b.C与CO2反应
c.铝和稀盐酸反应 d.液态水变为水蒸气
(2)氨气中氢含量高,是一种优良的小分子储氢载体,且胺全、易储运。
相关化学键的键能数据
| 化学键 | N≡N | H—H | N—H |
| 键能E/(kJ·mol-1) | 946 | 436.0 | 390.8 |
则:①2NH3(g)
 N2(g)+3H2(g) △H=
N2(g)+3H2(g) △H=②某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下,将0.1 mol NH3通入3 L的密闭容器中进行反应(此时容器内总压为200 kPa),各物质的分压随时间的变化曲线如图所示。在该温度下,用分压表示的平衡常数Kp=

(3)我国力争于2030年前做到碳达峰,2060年前实现碳中和。CH4与CO2重整是CO2利用研究热点之一。该重整反应体系主要涉及以下反应:
a)CH4(g)+CO2(g)
 2CO(g)+2H2(g) △H1
2CO(g)+2H2(g) △H1b)CO2(g)+H2(g)
 CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2c)CH4(g)
 C(s)+2H2(g) △H3
C(s)+2H2(g) △H3d)2CO(g)
 CO2(g)+C(s) △H4
CO2(g)+C(s) △H4e)CO(g)+H2(g)
 H2O(g)+C(s) △H5
H2O(g)+C(s) △H5①根据盖斯定律,反应a的△H1=
②一定条件下,CH4分解形成碳的反应历程如图所示。该历程分

③某学生应用平衡原理对b)CO2(g)+H2(g)
 CO(g)+H2O(g) △H2>0的反应进行研究。向一恒温恒容的密闭容器中充入1 mol CO2和2 mol H2发生反应,t1时达到平衡状态Ⅰ,在t2时改变某一条件,t3时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是
CO(g)+H2O(g) △H2>0的反应进行研究。向一恒温恒容的密闭容器中充入1 mol CO2和2 mol H2发生反应,t1时达到平衡状态Ⅰ,在t2时改变某一条件,t3时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是
A.容器内压强不变,表明反应达到平衡
B.t2时改变的条件:向容器中加入CO或加入H2O(g)
C.t2时若升高温度或增大压强,均有利于提高CO2的转化率
D.平衡常数K:K(Ⅱ)<K(Ⅰ)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】氢气是一种理想的绿色能源。利用生物质发酵得到的乙醇制取氢气,具有良好的应用前景。
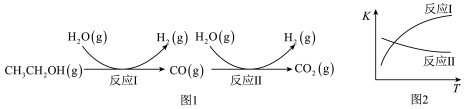
已知:①乙醇水蒸气重整制氢的部分反应过程如图1所示。
②反应I和反应II的平衡常数(K)随温度(T)的变化曲线如图2所示。
(1)反应I中,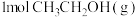 参与反应后的热量变化是256 kJ,则该反应的热化学方程式为
参与反应后的热量变化是256 kJ,则该反应的热化学方程式为_______ 。
(2)一定温度下,在一恒容密闭容器中发生反应I,下列叙述能说明此反应达到化学平衡状态的是_______(填选项字母)。
(3)在一恒容密闭容器中按不同进料比通入 与
与 发生反应II,在不同温度时测得CO的平衡转化率如图3所示。
发生反应II,在不同温度时测得CO的平衡转化率如图3所示。
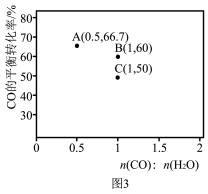
①B、C两点对应的反应温度分别为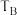 和
和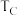 ,则
,则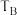
_______ 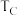 (填“<”“=”或“>”)。
(填“<”“=”或“>”)。
②A点对应温度下,反应II的化学平衡常数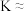
_______ 。
③若向A点对应的平衡体系中再充入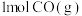 、
、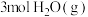 、
、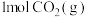 和
和 ,此时平衡向
,此时平衡向_______ (填“正反应”或“逆反应”)方向移动。
④实验发现,其他条件不变,在相同时间内,向上述体系中投入一定量的CaO可以增大 的体积分数,其原因为
的体积分数,其原因为_______ 。
已知:①乙醇水蒸气重整制氢的部分反应过程如图1所示。
②反应I和反应II的平衡常数(K)随温度(T)的变化曲线如图2所示。

(1)反应I中,
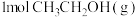 参与反应后的热量变化是256 kJ,则该反应的热化学方程式为
参与反应后的热量变化是256 kJ,则该反应的热化学方程式为(2)一定温度下,在一恒容密闭容器中发生反应I,下列叙述能说明此反应达到化学平衡状态的是_______(填选项字母)。
A. | B.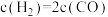 |
C.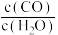 不再发生变化 不再发生变化 | D.混合气体密度不再发生变化 |
 与
与 发生反应II,在不同温度时测得CO的平衡转化率如图3所示。
发生反应II,在不同温度时测得CO的平衡转化率如图3所示。
①B、C两点对应的反应温度分别为
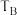 和
和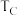 ,则
,则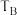
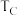 (填“<”“=”或“>”)。
(填“<”“=”或“>”)。②A点对应温度下,反应II的化学平衡常数
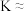
③若向A点对应的平衡体系中再充入
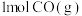 、
、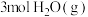 、
、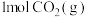 和
和 ,此时平衡向
,此时平衡向④实验发现,其他条件不变,在相同时间内,向上述体系中投入一定量的CaO可以增大
 的体积分数,其原因为
的体积分数,其原因为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】回答下列问题。
(1)已知同温同压下,下列反应的焓变和平衡常数分别表示为
①
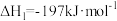

②
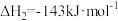
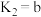
③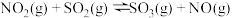
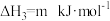
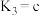
则m的数值为_____ ,c与a、b之间的关系为_____ 。
(2)目前工业上有一种方法是用 生产燃料甲醇。一定条件下发生反应:
生产燃料甲醇。一定条件下发生反应: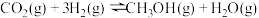 。在体积为
。在体积为 的密闭容器中,充入
的密闭容器中,充入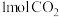 和
和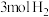 ,在相同温度、容积不变的条件下,能说明该反应已达平衡状态的是
,在相同温度、容积不变的条件下,能说明该反应已达平衡状态的是_____ (填序号)。
A. 、
、 、
、 、
、 的浓度均不再变化
的浓度均不再变化
B.
C.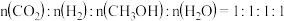
D. 的消耗速率与
的消耗速率与 的消耗速率之比为
的消耗速率之比为
E.容器中混合气体的密度保持不变
(3)汽车尾气是城市主要空气污染物,利用反应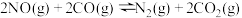 可实现汽车尾气的无害化处理。向甲、乙两个体积都为
可实现汽车尾气的无害化处理。向甲、乙两个体积都为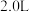 的恒容密闭容器中分别充入
的恒容密闭容器中分别充入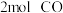 和
和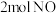 ,分别在
,分别在 、
、 温度下,经过一段时间后达到平衡。反应过程中
温度下,经过一段时间后达到平衡。反应过程中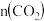 随时间(t)变化情况见下表:
随时间(t)变化情况见下表:
①
_____  (填“>”、“<”或“=”下同),该反应
(填“>”、“<”或“=”下同),该反应
______ 0。
②甲容器中, 内
内 的平均反应速率
的平均反应速率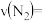
_____ 。
③乙容器中 平衡转化率为
平衡转化率为______ , 温度下该反应的平衡常数为
温度下该反应的平衡常数为_______ 。
④该反应达到平衡后,为提高反应速率同时提高 的转化率,可采取的措施有
的转化率,可采取的措施有_____ (填字母序号)。
a.增大NO浓度
b.移去部分N2
c.压缩容器体积
d.改用高效催化剂
e.保持容器体积不变加入惰性气体
(1)已知同温同压下,下列反应的焓变和平衡常数分别表示为
①

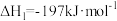

②

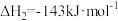
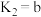
③
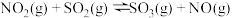
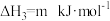
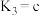
则m的数值为
(2)目前工业上有一种方法是用
 生产燃料甲醇。一定条件下发生反应:
生产燃料甲醇。一定条件下发生反应: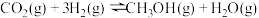 。在体积为
。在体积为 的密闭容器中,充入
的密闭容器中,充入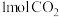 和
和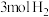 ,在相同温度、容积不变的条件下,能说明该反应已达平衡状态的是
,在相同温度、容积不变的条件下,能说明该反应已达平衡状态的是A.
 、
、 、
、 、
、 的浓度均不再变化
的浓度均不再变化B.

C.
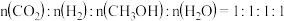
D.
 的消耗速率与
的消耗速率与 的消耗速率之比为
的消耗速率之比为
E.容器中混合气体的密度保持不变
(3)汽车尾气是城市主要空气污染物,利用反应
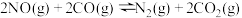 可实现汽车尾气的无害化处理。向甲、乙两个体积都为
可实现汽车尾气的无害化处理。向甲、乙两个体积都为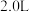 的恒容密闭容器中分别充入
的恒容密闭容器中分别充入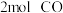 和
和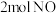 ,分别在
,分别在 、
、 温度下,经过一段时间后达到平衡。反应过程中
温度下,经过一段时间后达到平衡。反应过程中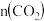 随时间(t)变化情况见下表:
随时间(t)变化情况见下表:| 时间/s | 0 | 2 | 4 | 6 | 8 | 10 |
甲容器( ) )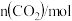 | 0 | 0.72 | 1.20 | 1.60 | 1.60 | 1.60 |
乙容器( ) )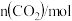 | 0 | 0.60 | 1.00 | 1.40 | 1.70 | 1.70 |

 (填“>”、“<”或“=”下同),该反应
(填“>”、“<”或“=”下同),该反应
②甲容器中,
 内
内 的平均反应速率
的平均反应速率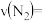
③乙容器中
 平衡转化率为
平衡转化率为 温度下该反应的平衡常数为
温度下该反应的平衡常数为④该反应达到平衡后,为提高反应速率同时提高
 的转化率,可采取的措施有
的转化率,可采取的措施有a.增大NO浓度
b.移去部分N2
c.压缩容器体积
d.改用高效催化剂
e.保持容器体积不变加入惰性气体
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】(1)接触法制硫酸工艺中,其主反应是在恒容、温度为450℃并有催化剂存在的条件下进行:2SO2(g)+O2(g) 2SO3(g) ΔH=-190kJ/mol。
2SO3(g) ΔH=-190kJ/mol。
①下列描述中能说明上述反应已达平衡的是____________ 。
a. v(O2)正=2v(SO3)逆
b.容器中气体的密度不随时间而变化
c.容器中气体的平均相对分子质量不随时间而变化
d.容器中气体的分子总数不随时间而变化
②在一个固定容积为5L的密闭容器中充入0.20molSO2和0.10molO2,半分钟后达到平衡,测得容器中含SO30.18mol,则v(O2)=__________ mol·L-1·min-1,若继续通入0.40 mol SO2和0.20molO2则平衡______ 移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,________ mol<n(SO3)<_____ mol。
(2)工业生成尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(l),该反应的平衡常数和温度关系如下:
CO(NH2)2(l)+H2O(l),该反应的平衡常数和温度关系如下:
①ΔH_______ 0(填“>”、“<”或“=”)
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比) =x,下图是氨碳比(x)与CO2平衡转化率(α)的关系,α随着x增大而增大的原因是
=x,下图是氨碳比(x)与CO2平衡转化率(α)的关系,α随着x增大而增大的原因是___________ 。
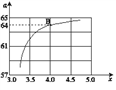
③图中的B点对应的NH3的平衡转化率为___________ 。
 2SO3(g) ΔH=-190kJ/mol。
2SO3(g) ΔH=-190kJ/mol。①下列描述中能说明上述反应已达平衡的是
a. v(O2)正=2v(SO3)逆
b.容器中气体的密度不随时间而变化
c.容器中气体的平均相对分子质量不随时间而变化
d.容器中气体的分子总数不随时间而变化
②在一个固定容积为5L的密闭容器中充入0.20molSO2和0.10molO2,半分钟后达到平衡,测得容器中含SO30.18mol,则v(O2)=
(2)工业生成尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3(g)+CO2(g)
 CO(NH2)2(l)+H2O(l),该反应的平衡常数和温度关系如下:
CO(NH2)2(l)+H2O(l),该反应的平衡常数和温度关系如下:| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
①ΔH
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)
 =x,下图是氨碳比(x)与CO2平衡转化率(α)的关系,α随着x增大而增大的原因是
=x,下图是氨碳比(x)与CO2平衡转化率(α)的关系,α随着x增大而增大的原因是
③图中的B点对应的NH3的平衡转化率为
您最近一年使用:0次



