解题方法
1 . 请完成下列小题:
(1)工业上可利用CO2和H2生成甲醇,热化学方程式如下:
CO2(g)+3H2(g) CH3OH(l)+H2O(g) △H=Q1 kJ·mol-1
CH3OH(l)+H2O(g) △H=Q1 kJ·mol-1
又查资料得知:①CH3OH(l)+ O2(g)
O2(g)  CO2(g)+H2(g) △H=Q2 kJ·mol-1
CO2(g)+H2(g) △H=Q2 kJ·mol-1
②H2O(g)= H2O(l) △H=Q3 kJ·mol-1
则表示甲醇的燃烧热的热化学方程式为________________ 。
某同学设计了一个甲醇燃料电池,并用该电池电解200mL一定浓度的NaCl与CuSO4混合溶液,其装置如图:
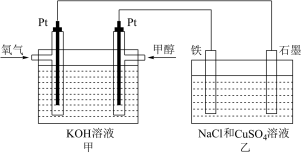
(2)写出甲中通入甲醇这一极的电极反应式_______________________ 。
(3)理论上乙中两极所得气体的体积随时间变化的关系如图所示(已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式___________ ,原混合溶液中NaCl的物质的量浓度为_______ mol/L。(设溶液体积不变)

(4)当向上述甲装置中通入标况下的氧气336mL时,理论上在铁电极上可析出铜的质量为_________ g。
(5)已知草酸H2C2O4为弱酸。
①常温下,下列事实能说明草酸是弱电解质的是____________ 。
A.向草酸钠溶液加酚酞,溶液变红
B.取一定量草酸溶液加水稀释至10倍,pH变化小于1
C.草酸能使酸性KMnO4溶液褪色
D.取相同pH的草酸溶液和盐酸,分别加入足量的大小、形状相同的镁条,草酸溶液反应速度快
②常温下,0.1mol·L-1的草酸溶液与pH=13的NaOH溶液等体积混合,所得溶液的pH为6,则c(HC2O4-)+2c(C2O42-)=________________ 。(用准确的数学表达式表示)
(1)工业上可利用CO2和H2生成甲醇,热化学方程式如下:
CO2(g)+3H2(g)
 CH3OH(l)+H2O(g) △H=Q1 kJ·mol-1
CH3OH(l)+H2O(g) △H=Q1 kJ·mol-1又查资料得知:①CH3OH(l)+
 O2(g)
O2(g)  CO2(g)+H2(g) △H=Q2 kJ·mol-1
CO2(g)+H2(g) △H=Q2 kJ·mol-1②H2O(g)= H2O(l) △H=Q3 kJ·mol-1
则表示甲醇的燃烧热的热化学方程式为
某同学设计了一个甲醇燃料电池,并用该电池电解200mL一定浓度的NaCl与CuSO4混合溶液,其装置如图:

(2)写出甲中通入甲醇这一极的电极反应式
(3)理论上乙中两极所得气体的体积随时间变化的关系如图所示(已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式

(4)当向上述甲装置中通入标况下的氧气336mL时,理论上在铁电极上可析出铜的质量为
(5)已知草酸H2C2O4为弱酸。
①常温下,下列事实能说明草酸是弱电解质的是
A.向草酸钠溶液加酚酞,溶液变红
B.取一定量草酸溶液加水稀释至10倍,pH变化小于1
C.草酸能使酸性KMnO4溶液褪色
D.取相同pH的草酸溶液和盐酸,分别加入足量的大小、形状相同的镁条,草酸溶液反应速度快
②常温下,0.1mol·L-1的草酸溶液与pH=13的NaOH溶液等体积混合,所得溶液的pH为6,则c(HC2O4-)+2c(C2O42-)=
您最近一年使用:0次
解题方法
2 . 有X、Y、Z、R四种短周期元素,Y、Z、R同周期。相关信息如下:
(1)Z 元素在周期表的位置是__________ ,Y、Z、R简单离子的半径从大到小的顺序是_________ (用离子符号表示);
(2)由X、Z两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构。甲遇水蒸气可形成一种常见的漂白性物质。则甲的分子式为____________ ;
(3)化合物乙(Y2R)溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Y2R2,其溶液显黄色。则Y2R2的电子式为____________ ,写出乙溶液在空气中变质过程的化学方程式______________ 。
(4)元素X与氢可形成分子式为X2H4的燃料,X2H4结构式为________________ ;
已知:X2(g)+2O2(g)=2XO2(g) △H=+68kJ·mol-1
X2H4(g)+O2(g)=X2(g)+2H2O(g) △H=-534kJ·mol-1
写出气态 X2H4和 XO2反应生成 X2和水蒸气的热化学方程式___________ 。
| 元素 | 相关信息 |
| X | 单质为双原子分子。若低温蒸发液态空气,因其沸点较低可先获得 X 的单质 |
| Y | 含 Y 元素的物质焰色反应为黄色 |
| Z | 同周期元素中原子半径最小 |
| R | R 元素原子的最外层电子数是 K 层电子数的 3 倍 |
(2)由X、Z两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构。甲遇水蒸气可形成一种常见的漂白性物质。则甲的分子式为
(3)化合物乙(Y2R)溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Y2R2,其溶液显黄色。则Y2R2的电子式为
(4)元素X与氢可形成分子式为X2H4的燃料,X2H4结构式为
已知:X2(g)+2O2(g)=2XO2(g) △H=+68kJ·mol-1
X2H4(g)+O2(g)=X2(g)+2H2O(g) △H=-534kJ·mol-1
写出气态 X2H4和 XO2反应生成 X2和水蒸气的热化学方程式
您最近一年使用:0次
2017-02-17更新
|
1049次组卷
|
2卷引用:湖北省利川市第五中学2020-2021学年高二上学期期中考试化学试题
名校
解题方法
3 . CO是现代化工生产的基础原料,下列有关问题都和CO的使用有关。
(1)工业上可利用CO生产乙醇:
2CO(g)+4H2(g)⇌CH3CH2OH(g)+H2O(g) ΔH1
又已知:H2O(l)= H2O(g) ΔH2
CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH3
工业上也可利用CO2(g)与H2(g)为原料合成乙醇:
2CO2(g)+6H2(g)⇌CH3CH2OH(g)+3H2O(l) ΔH
则:ΔH与ΔH1、ΔH2、ΔH3之间的关系是:ΔH=_______________________ 。
(2)一定条件下,H2、CO在体积固定的密闭容器中发生如下反应:
4H2(g)+2CO(g)⇌CH3OCH3(g)+H2O(g),
下列选项能判断该反应达到平衡状态的依据的有____。
(3)工业可采用CO与H2反应合成再生能源甲醇,反应如下:
CO(g)+ 2H2(g) CH3OH(g)
CH3OH(g)
在一容积可变的密闭容器中充有10molCO和20mol H2,
在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如(图1)所示。
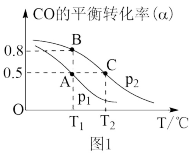
①合成甲醇的反应为_____ (填“放热”或“吸热”)反应。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为_________ 。
③若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为______________ L。
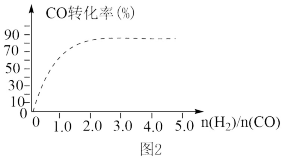
④(图2)中虚线为该反应在使用催化剂条件下关于起始氢气与CO投料比和CO平衡转化率的关系图。当其条件完全相同时,用实线画出不使用催化剂情况下CO平衡转化率的示意图______________ .
⑤CO的平衡转化率(α)与温度(T)、压强(p)的关系如(图3)所示,实际生产时条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是________ 。

(1)工业上可利用CO生产乙醇:
2CO(g)+4H2(g)⇌CH3CH2OH(g)+H2O(g) ΔH1
又已知:H2O(l)= H2O(g) ΔH2
CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH3
工业上也可利用CO2(g)与H2(g)为原料合成乙醇:
2CO2(g)+6H2(g)⇌CH3CH2OH(g)+3H2O(l) ΔH
则:ΔH与ΔH1、ΔH2、ΔH3之间的关系是:ΔH=
(2)一定条件下,H2、CO在体积固定的密闭容器中发生如下反应:
4H2(g)+2CO(g)⇌CH3OCH3(g)+H2O(g),
下列选项能判断该反应达到平衡状态的依据的有____。
| A.2v(H2)= v(CO) |
| B.CO的消耗速率等于CH3OCH3的生成速率 |
| C.容器内的压强保持不变 |
| D.混合气体的密度保持不变 |
| E.混合气体的平均相对分子质量不随时间而变化 |
CO(g)+ 2H2(g)
 CH3OH(g)
CH3OH(g)在一容积可变的密闭容器中充有10molCO和20mol H2,
在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如(图1)所示。

①合成甲醇的反应为
②A、B、C三点的平衡常数KA、KB、KC的大小关系为
③若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为
④(图2)中虚线为该反应在使用催化剂条件下关于起始氢气与CO投料比和CO平衡转化率的关系图。当其条件完全相同时,用实线画出不使用催化剂情况下CO平衡转化率的示意图

⑤CO的平衡转化率(α)与温度(T)、压强(p)的关系如(图3)所示,实际生产时条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是

您最近一年使用:0次
2016-12-09更新
|
1017次组卷
|
3卷引用:2015-2016学年湖北武汉第二中学高二上期中考试化学试卷
4 . 工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:已知:H2的热值为142.9kJ·g−1
N2(g)+2O2(g)=2NO2(g) △H=+133 kJ∙mol−1
H2O(g)=H2O(l)△H=−44 kJ∙mol−1
(1)催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为__________ 。
Ⅱ.脱碳:向2L密闭容器中加入2molCO2、6molH2,在适当的催化剂作用下,发生反应:
CO2(g)+3H2(g) CH3OH(l)+H2O(l)
CH3OH(l)+H2O(l)
(2)①该反应自发进行的条件是_________ (填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是__________ 。
a、混合气体的平均式量保持不变
b、CO2和H2的体积分数保持不变
c、CO2和H2的转化率相等
d、混合气体的密度保持不变
e、1mol CO2生成的同时有3mol H−H键断裂
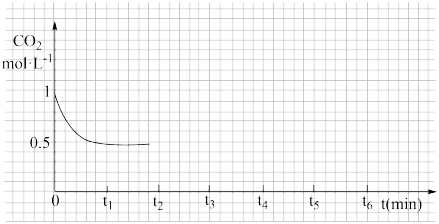
③CO2的浓度随时间(0~t2)变化如下图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6 CO2的浓度随时间的变化___________ 。
(3)改变温度,使反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H<0 中的所有物质都为气态。起始温度体积相同(T1℃、2 L密闭容器)。反应过程中部分数据见下表:
CH3OH(g)+H2O(g) △H<0 中的所有物质都为气态。起始温度体积相同(T1℃、2 L密闭容器)。反应过程中部分数据见下表:
① 达到平衡时,反应I、II对比:平衡常数K(I)_________ K(II)(填“>”、“<”或“=”下同);平衡时CH3OH的浓度c(I)__________ c(II)。
②对反应I,前10min内的平均反应速率υ(CH3OH)=__________ ,在其它条件不变下,若30min时只改变温度为T2℃,此时H2的物质的量为3.2mol,则T1_________ T2(填“>”、“<”或“=”)。若30min时只向容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡________ 移动(填“正向”、“逆向”或“不”)。
Ⅰ.脱硝:已知:H2的热值为142.9kJ·g−1
N2(g)+2O2(g)=2NO2(g) △H=+133 kJ∙mol−1
H2O(g)=H2O(l)△H=−44 kJ∙mol−1
(1)催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为
Ⅱ.脱碳:向2L密闭容器中加入2molCO2、6molH2,在适当的催化剂作用下,发生反应:
CO2(g)+3H2(g)
 CH3OH(l)+H2O(l)
CH3OH(l)+H2O(l) (2)①该反应自发进行的条件是
②下列叙述能说明此反应达到平衡状态的是
a、混合气体的平均式量保持不变
b、CO2和H2的体积分数保持不变
c、CO2和H2的转化率相等
d、混合气体的密度保持不变
e、1mol CO2生成的同时有3mol H−H键断裂
③CO2的浓度随时间(0~t2)变化如下图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6 CO2的浓度随时间的变化

(3)改变温度,使反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H<0 中的所有物质都为气态。起始温度体积相同(T1℃、2 L密闭容器)。反应过程中部分数据见下表:
CH3OH(g)+H2O(g) △H<0 中的所有物质都为气态。起始温度体积相同(T1℃、2 L密闭容器)。反应过程中部分数据见下表:| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应I 恒温恒容 | 0 min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应II 绝热恒容 | 0 min | 0 | 0 | 2 | 2 |
②对反应I,前10min内的平均反应速率υ(CH3OH)=
您最近一年使用:0次
2016-12-09更新
|
0次组卷
|
5卷引用:2015-2016学年湖北省枣阳二中高二下学期期中考试化学试卷
13-14高二上·湖北·期中
解题方法
5 . 研究燃料的燃烧和对污染气体产物的无害化处理,对于防止大气污染有重要意义。
(1)将煤转化为清洁气体燃料:已知:H2(g)+1/2O2(g)=H2O(g) H= −241.8kJ/mol;C(s)+1/2O2(g)=CO(g)
H= −241.8kJ/mol;C(s)+1/2O2(g)=CO(g) H= −110.5kJ/mol;写出焦炭与水蒸气反应制H2和CO的热化学方程式
H= −110.5kJ/mol;写出焦炭与水蒸气反应制H2和CO的热化学方程式________________________ 。
(2)一定条件下,在密闭容器内,SO2被氧化成SO3的热化学方程式为:2SO2(g)+O2(g) 2SO3(g);△H=−a kJ/mol,在相同条件下要想得到2akJ热量,加入各物质的物质的量可能是
2SO3(g);△H=−a kJ/mol,在相同条件下要想得到2akJ热量,加入各物质的物质的量可能是____________
A.4mol SO2和2mol O2 B.4mol SO2、2mol O2和2mol SO3
C.4mol SO2和4mol O2 D.6mol SO2和4mol O2
(3)汽车尾气中NOx和CO的生成及转化:
①已知气缸中生成NO的反应为:N2(g)+O2(g) 2NO(g)
2NO(g) H>0,在一定温度下的定容密闭容器中,能说明此反应已达平衡的是
H>0,在一定温度下的定容密闭容器中,能说明此反应已达平衡的是__________
A.压强不变B.混合气体平均相对分子质量不变
C.2v正(N2)=v逆(NO) D.N2的体积分数不再改变
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g) H>0,简述该设想能否实现的依据
H>0,简述该设想能否实现的依据_______________________________________________ 。
(4)燃料CO、H2在一定条件下可以相互转化:CO(g)+H2O(g) CO2(g)+H2(g)。在420℃时,平衡常数K=9。若反应开始时,CO、H2O的浓度均为0.1mol/L,则CO在此反应条件下的转化率为
CO2(g)+H2(g)。在420℃时,平衡常数K=9。若反应开始时,CO、H2O的浓度均为0.1mol/L,则CO在此反应条件下的转化率为______________ 。
(1)将煤转化为清洁气体燃料:已知:H2(g)+1/2O2(g)=H2O(g)
 H= −241.8kJ/mol;C(s)+1/2O2(g)=CO(g)
H= −241.8kJ/mol;C(s)+1/2O2(g)=CO(g) H= −110.5kJ/mol;写出焦炭与水蒸气反应制H2和CO的热化学方程式
H= −110.5kJ/mol;写出焦炭与水蒸气反应制H2和CO的热化学方程式(2)一定条件下,在密闭容器内,SO2被氧化成SO3的热化学方程式为:2SO2(g)+O2(g)
 2SO3(g);△H=−a kJ/mol,在相同条件下要想得到2akJ热量,加入各物质的物质的量可能是
2SO3(g);△H=−a kJ/mol,在相同条件下要想得到2akJ热量,加入各物质的物质的量可能是A.4mol SO2和2mol O2 B.4mol SO2、2mol O2和2mol SO3
C.4mol SO2和4mol O2 D.6mol SO2和4mol O2
(3)汽车尾气中NOx和CO的生成及转化:
①已知气缸中生成NO的反应为:N2(g)+O2(g)
 2NO(g)
2NO(g) H>0,在一定温度下的定容密闭容器中,能说明此反应已达平衡的是
H>0,在一定温度下的定容密闭容器中,能说明此反应已达平衡的是A.压强不变B.混合气体平均相对分子质量不变
C.2v正(N2)=v逆(NO) D.N2的体积分数不再改变
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g)
 H>0,简述该设想能否实现的依据
H>0,简述该设想能否实现的依据(4)燃料CO、H2在一定条件下可以相互转化:CO(g)+H2O(g)
 CO2(g)+H2(g)。在420℃时,平衡常数K=9。若反应开始时,CO、H2O的浓度均为0.1mol/L,则CO在此反应条件下的转化率为
CO2(g)+H2(g)。在420℃时,平衡常数K=9。若反应开始时,CO、H2O的浓度均为0.1mol/L,则CO在此反应条件下的转化率为
您最近一年使用:0次



