1 . 氮的氧化物是造成大气污染的主要物质,研究氮氧化物间的相互转化及脱除具有重要意义。
I.氮氧化物间的相互转化
(1)已知2NO(g)+O2(g) 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
第一步 2NO(g) N2O2(g) (快速平衡)
N2O2(g) (快速平衡)
第二步 N2O2(g) +O2(g) =2NO2(g) (慢反应)
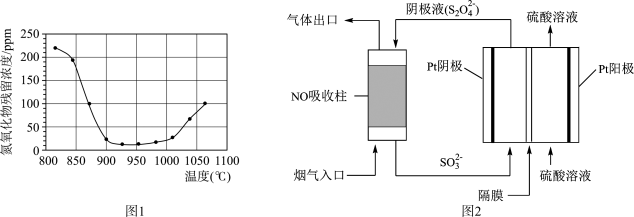
①用O2表示的速率方程为v(O2)= k1·c2(NO)·c(O2);NO2表示的速率方程为v(NO2)=k2·c2(NO)·c(O2),k1与k2分别表示速率常数(与温度有关),则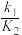 =
=________ 。
②下列关于反应2NO(g)+O2(g)=2NO2(g)的说法正确的是_________ (填序号)。
A.增大压强,反应速率常数一定增大
B.第一步反应的活化能小于第二步反应的活化能
C.反应的总活化能等于第一步和第二步反应的活化能之和
(2)容积均为1L的甲、乙两个容器,其中甲为绝热容器,乙为恒温容器.相同温度下,分别充入0.2mol的NO2,发生反应:2NO2(g) N2O4(g) ∆H<0,甲中NO2的相关量随时间变化如图所示。
N2O4(g) ∆H<0,甲中NO2的相关量随时间变化如图所示。
①0~3s内,甲容器中NO2的反应速率增大的原因是______________________ 。
②甲达平衡时,温度若为T℃,此温度下的平衡常数K=____________________ 。
③平衡时,K甲_____ K乙,P甲_____ P乙(填“>”、“<” 或“=”)。
(3)以NH3为还原剂在脱硝装置中消除烟气中的氮氧化物。
主反应:4NH3(g)+4NO(g)+O2(g)= 4N2(g)+6H2O(g) △H1
副反应:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H2=-1267.1kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H3=-907.3 kJ/mol
①△H1=____________ 。
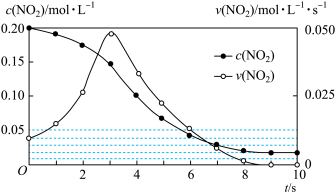
②将烟气按一定的流速通过脱硝装置,测得出口NO的浓度与温度的关系如图1,试分析脱硝的适宜温度是______ (填序号)。
a.<850℃ b.900~1000℃ c.>1050 ℃
(4)以连二亚硫酸盐(S2O42-)为还原剂脱除烟气中的NO,并通过电解再生,装置如图2。阴极的电极反应式为____________ ,电解槽中的隔膜为____________ (填“阳”或“阴”)离子交换膜。
I.氮氧化物间的相互转化
(1)已知2NO(g)+O2(g)
 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:第一步 2NO(g)
 N2O2(g) (快速平衡)
N2O2(g) (快速平衡)第二步 N2O2(g) +O2(g) =2NO2(g) (慢反应)
①用O2表示的速率方程为v(O2)= k1·c2(NO)·c(O2);NO2表示的速率方程为v(NO2)=k2·c2(NO)·c(O2),k1与k2分别表示速率常数(与温度有关),则
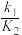 =
=②下列关于反应2NO(g)+O2(g)=2NO2(g)的说法正确的是
A.增大压强,反应速率常数一定增大
B.第一步反应的活化能小于第二步反应的活化能
C.反应的总活化能等于第一步和第二步反应的活化能之和
(2)容积均为1L的甲、乙两个容器,其中甲为绝热容器,乙为恒温容器.相同温度下,分别充入0.2mol的NO2,发生反应:2NO2(g)
 N2O4(g) ∆H<0,甲中NO2的相关量随时间变化如图所示。
N2O4(g) ∆H<0,甲中NO2的相关量随时间变化如图所示。
①0~3s内,甲容器中NO2的反应速率增大的原因是
②甲达平衡时,温度若为T℃,此温度下的平衡常数K=
③平衡时,K甲
(3)以NH3为还原剂在脱硝装置中消除烟气中的氮氧化物。
主反应:4NH3(g)+4NO(g)+O2(g)= 4N2(g)+6H2O(g) △H1
副反应:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H2=-1267.1kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H3=-907.3 kJ/mol
①△H1=
②将烟气按一定的流速通过脱硝装置,测得出口NO的浓度与温度的关系如图1,试分析脱硝的适宜温度是
a.<850℃ b.900~1000℃ c.>1050 ℃

(4)以连二亚硫酸盐(S2O42-)为还原剂脱除烟气中的NO,并通过电解再生,装置如图2。阴极的电极反应式为
您最近一年使用:0次
2019-09-04更新
|
688次组卷
|
2卷引用:湖北省宜城市第三高级中学2021-2022学年高三上学期期中考试化学试题
名校
2 . 氨气是重要的化工原料。
(1)已知: N2(g)+O2(g)=2NO(g) △H= +180.5kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H= -905kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H= -483.6kJ·mol-1
写出氨气在高温高压催化剂条件下生成氮气和氢气的热化学方程式:_____________________ ;如果在1 L密闭容器中,3mol NH3 在等温条件下充分反应,2min后达到平衡,平衡时吸收的热量为92.4 kJ ,则在这段时间内v(H2)=___________________ ;保持温度不变,将起始NH3的物质的量调整为8 mol,平衡时NH3的转化率为_________________ 。
(2)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式:___________________ ,科学家利用此原理,设计成氨气一氧气燃料电池,则通入氨气的电极是 _____________ (填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为______________________________________ 。
(3)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H<0。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是
4NO(g)+6H2O(g) △H<0。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是____________ (填字母代号)。
a.增大压强 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
(4)如果某氨水的电离程度为1%,向浓度为0.01 mol/L MgCl2溶液中滴加氨水,则开始产生沉淀时(忽略溶液体积变化)溶液中的NH3·H2O的浓度为______________ (已知Ksp[Mg(OH)2]=4.010-12])。
(1)已知: N2(g)+O2(g)=2NO(g) △H= +180.5kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H= -905kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H= -483.6kJ·mol-1
写出氨气在高温高压催化剂条件下生成氮气和氢气的热化学方程式:
(2)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式:
(3)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g)
 4NO(g)+6H2O(g) △H<0。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是
4NO(g)+6H2O(g) △H<0。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是a.增大压强 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
(4)如果某氨水的电离程度为1%,向浓度为0.01 mol/L MgCl2溶液中滴加氨水,则开始产生沉淀时(忽略溶液体积变化)溶液中的NH3·H2O的浓度为
您最近一年使用:0次
名校
3 . 工业上常利用含硫废水生产 Na2S2O3•5H2O,实验室可用如图装置(略去部分加持仪器)模拟生成过程。
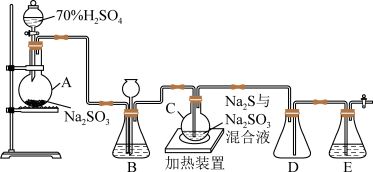
烧瓶C中发生反应如下 :
(I) Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq)
(II)2H2S(aq)+SO2(g)=3S(s)+2H2O(l)
(III)S(s)+Na2SO3(aq) Na2S2O3(aq)
Na2S2O3(aq)
(1)仪器组装完成后,关闭两端活塞,向装置 B 中的长颈漏斗内注入液体至形成一段液注, 若____ 则整个装置气密性良好。 装置 D 的作用是_____
(2)装置 B 的作用之一是观察 SO2的生成速率,其中的液体最好选择_____
A.蒸馏水 B.饱和 Na2SO3溶液
C.饱和 NaHSO3溶液 D.饱和 NaHCO3 溶液
(3)为提高产品纯度,应使烧瓶 C 中 Na2S 和 Na2SO3恰好完全反应,则烧瓶 C 中 Na2S 和Na2SO3 物质的量之比_________
(4)经研究发现 SO2水溶液可以在 I-催化作用下发生歧化反应,可能的催化过程如下。将 ii 用离子方程式补充完整。i.SO2+4I-+4H+=S↓+2I2+2H2O ii.___________
(5)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:准确称取 0.214g KIO3 固体配成溶液,加入过量 KI 固体和 H2SO4溶液,再向其中加入 Na2S2O3与之反应,消耗 Na2S2O3溶液的体积为 24mL 时恰好完全反应。则 c(Na2S2O3)=________
(已知:IO3-+5I-+6H+=3I2+3H2O 2S2O32-+I2=S4O62-+2I-)

烧瓶C中发生反应如下 :
(I) Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq)
(II)2H2S(aq)+SO2(g)=3S(s)+2H2O(l)
(III)S(s)+Na2SO3(aq)
 Na2S2O3(aq)
Na2S2O3(aq) (1)仪器组装完成后,关闭两端活塞,向装置 B 中的长颈漏斗内注入液体至形成一段液注, 若
(2)装置 B 的作用之一是观察 SO2的生成速率,其中的液体最好选择
A.蒸馏水 B.饱和 Na2SO3溶液
C.饱和 NaHSO3溶液 D.饱和 NaHCO3 溶液
(3)为提高产品纯度,应使烧瓶 C 中 Na2S 和 Na2SO3恰好完全反应,则烧瓶 C 中 Na2S 和Na2SO3 物质的量之比
(4)经研究发现 SO2水溶液可以在 I-催化作用下发生歧化反应,可能的催化过程如下。将 ii 用离子方程式补充完整。i.SO2+4I-+4H+=S↓+2I2+2H2O ii.
(5)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:准确称取 0.214g KIO3 固体配成溶液,加入过量 KI 固体和 H2SO4溶液,再向其中加入 Na2S2O3与之反应,消耗 Na2S2O3溶液的体积为 24mL 时恰好完全反应。则 c(Na2S2O3)=
(已知:IO3-+5I-+6H+=3I2+3H2O 2S2O32-+I2=S4O62-+2I-)
您最近一年使用:0次
解题方法
4 . CO2是一种重要的化工原料,依据题给信息,回答下列问题:
Ⅰ.碳酸钠可利用CO2采用氨碱法生产
(1)碳酸钠可作为碱使用的原因是_____________ (用离子方程式表示)。
(2)已知:①2NaOH(s)+CO2(g)=Na2CO3(s)+H2O(g) ΔH1=−127.4 kJ/mol
②NaOH(s)+CO2(g)=NaHCO3(s) ΔH2=−131.5kJ/mol
反应2NaHCO3(s)=Na2CO3(s)+ H2O(g) +CO2(g)的ΔH=___________ kJ/mol。
Ⅱ.在体积为2 L的密闭容器中,充入1mol/LCO2和1mol/L H2,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
回答下列问题:
(1)该反应为____________ 反应(选填吸热、放热)。
(2)能判断该反应是否达到化学平衡状态的依据是_______________ 。
a.容器中压强不变 b.混合气体中 c(CO)不变
c. υ正(H2)=υ逆(H2O) d. c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为____________ ℃。
(4)某温度下经2min反应达到平衡后c(CO)=0.8mol/L,此温度下的平衡常数为________ 。
Ⅰ.碳酸钠可利用CO2采用氨碱法生产
(1)碳酸钠可作为碱使用的原因是
(2)已知:①2NaOH(s)+CO2(g)=Na2CO3(s)+H2O(g) ΔH1=−127.4 kJ/mol
②NaOH(s)+CO2(g)=NaHCO3(s) ΔH2=−131.5kJ/mol
反应2NaHCO3(s)=Na2CO3(s)+ H2O(g) +CO2(g)的ΔH=
Ⅱ.在体积为2 L的密闭容器中,充入1mol/LCO2和1mol/L H2,进行如下化学反应:
CO2(g)+H2(g)
 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:| t℃ | 700 | 800 | 830 | 1000 | 1200 | |||
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应为
(2)能判断该反应是否达到化学平衡状态的依据是
a.容器中压强不变 b.混合气体中 c(CO)不变
c. υ正(H2)=υ逆(H2O) d. c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为
(4)某温度下经2min反应达到平衡后c(CO)=0.8mol/L,此温度下的平衡常数为
您最近一年使用:0次
5 . 甲醇是一种重要的可再生能源.
(1)利用二氧化碳合成甲醇来替代汽油。
已知:2CH3OH(l) +3O2(g)=4H2O(l)+2CO2(g) △H=—1453.0 kJ/mol,2H2(g) + O2(g)=2H2O(l) △H=—571.6 kJ/mol
计算CO2(g)+3H2(g) =CH3OH(l)+ H2O(l)的反应热△H=___________ kJ/mol。
(2)下图是反应CO(g)+2H2(g) CH3OH(g)中CO和CH3OH(g)的物质的量浓度随时间(t)的变化曲线.从反应开始至达到平衡时,用H2表示的反应速率v(H2)=
CH3OH(g)中CO和CH3OH(g)的物质的量浓度随时间(t)的变化曲线.从反应开始至达到平衡时,用H2表示的反应速率v(H2)=______________ .
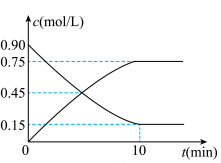
(3)在一恒容的密闭容器中充入1mol CO和2mol H2,发生反应CO(g)+2H2(g)⇌CH3OH(g)△H并达到平衡,CO的平衡转化率随温度(T)、压强(P)的变化曲线如图所示.
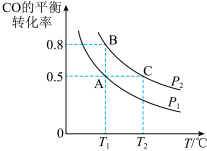
①能判断该反应达到化学平衡状态的是_____ (填选项字母).
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的体积分数不再改变
C.H2的转化率和CO的转化率相等
D.混合气体的平均相对分子质量不再改变
②比较平衡常数KA、KB、KC的大小:____________
(4)在容积均为V L的甲、乙、丙三个密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时三个容器中一定处在化学平衡状态的是________ (填“T1”或“T2” 或“T3”);

(5)电化学在我们的生产生活中占有越来越重要的地位。
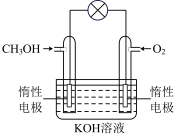
①燃料电池是一种绿色环保、高效的化学电源。图为甲醇燃料电池,则负极反应式为_____________ 。
②用甲醇燃料电池电解300mL饱和食盐水(惰性电极),则电解的离子方程式为____________________ ,电解一段时间后,当溶液的pH值为13时,消耗O2的质量为_______ g。(忽略溶液体积变化)
(1)利用二氧化碳合成甲醇来替代汽油。
已知:2CH3OH(l) +3O2(g)=4H2O(l)+2CO2(g) △H=—1453.0 kJ/mol,2H2(g) + O2(g)=2H2O(l) △H=—571.6 kJ/mol
计算CO2(g)+3H2(g) =CH3OH(l)+ H2O(l)的反应热△H=
(2)下图是反应CO(g)+2H2(g)
 CH3OH(g)中CO和CH3OH(g)的物质的量浓度随时间(t)的变化曲线.从反应开始至达到平衡时,用H2表示的反应速率v(H2)=
CH3OH(g)中CO和CH3OH(g)的物质的量浓度随时间(t)的变化曲线.从反应开始至达到平衡时,用H2表示的反应速率v(H2)=
(3)在一恒容的密闭容器中充入1mol CO和2mol H2,发生反应CO(g)+2H2(g)⇌CH3OH(g)△H并达到平衡,CO的平衡转化率随温度(T)、压强(P)的变化曲线如图所示.

①能判断该反应达到化学平衡状态的是
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的体积分数不再改变
C.H2的转化率和CO的转化率相等
D.混合气体的平均相对分子质量不再改变
②比较平衡常数KA、KB、KC的大小:
(4)在容积均为V L的甲、乙、丙三个密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时三个容器中一定处在化学平衡状态的是

(5)电化学在我们的生产生活中占有越来越重要的地位。

①燃料电池是一种绿色环保、高效的化学电源。图为甲醇燃料电池,则负极反应式为
②用甲醇燃料电池电解300mL饱和食盐水(惰性电极),则电解的离子方程式为
您最近一年使用:0次
6 . 利用化学原理对废气、废水进行脱硝、脱碳处理,可实现绿色环保、废物利用,对构建生态文明有重要意义。
Ⅰ.脱硝:(1)H2还原法消除氮氧化物
已知:N2(g)+2O2(g)=2NO2(g) ΔH1=+133kJ/mol
H2O(g)=H2O(l) ΔH2=-44kJ/mol H2的燃烧热ΔH3=-285.8kJ/mol
在催化剂存在下,H2还原NO2生成水蒸气和氮气的热化学方程式为______ 。
(2)用NH3催化还原法消除氮氧化物,发生反应:
4NH3(g)+6NO(g) 5N2(g)+6H2O(l) ΔH<0
5N2(g)+6H2O(l) ΔH<0
相同条件下,在2L恒容密闭容器中,选用不同催化剂,产生N2的量随时间变化如图所示。
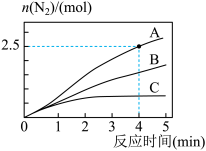
①计算0~4分钟在A催化剂作用下,反应速率v(NO)=____ 。
②下列说法正确的是____ 。
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已达到平衡
D.若反应在恒容绝热的密闭容器中进行,当K值不变时,说明已达到平衡
(3)利用原电池反应可实现NO2的无害化,总反应为6NO2+8NH3=7N2+12H2O,电解质溶液为NaOH溶液,工作一段时间后,该电池正极区附近溶液pH_____ (填“增大”“减小”或“不变”),负极的电极反应式为________ 。
Ⅱ.脱碳:
(4)用甲醇与CO反应生成醋酸可消除CO污染。常温下,将amol/L醋酸与bmol/LBa(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),忽略溶液体积变化,计算醋酸的电离常数Ka=____ (用含a、b的代数式表示)。
Ⅰ.脱硝:(1)H2还原法消除氮氧化物
已知:N2(g)+2O2(g)=2NO2(g) ΔH1=+133kJ/mol
H2O(g)=H2O(l) ΔH2=-44kJ/mol H2的燃烧热ΔH3=-285.8kJ/mol
在催化剂存在下,H2还原NO2生成水蒸气和氮气的热化学方程式为
(2)用NH3催化还原法消除氮氧化物,发生反应:
4NH3(g)+6NO(g)
 5N2(g)+6H2O(l) ΔH<0
5N2(g)+6H2O(l) ΔH<0相同条件下,在2L恒容密闭容器中,选用不同催化剂,产生N2的量随时间变化如图所示。

①计算0~4分钟在A催化剂作用下,反应速率v(NO)=
②下列说法正确的是
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已达到平衡
D.若反应在恒容绝热的密闭容器中进行,当K值不变时,说明已达到平衡
(3)利用原电池反应可实现NO2的无害化,总反应为6NO2+8NH3=7N2+12H2O,电解质溶液为NaOH溶液,工作一段时间后,该电池正极区附近溶液pH
Ⅱ.脱碳:
(4)用甲醇与CO反应生成醋酸可消除CO污染。常温下,将amol/L醋酸与bmol/LBa(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),忽略溶液体积变化,计算醋酸的电离常数Ka=
您最近一年使用:0次
2019-04-26更新
|
190次组卷
|
3卷引用:【全国百强校】湖北省沙市中学2018-2019学年高二下学期期中考试化学试题
【全国百强校】湖北省沙市中学2018-2019学年高二下学期期中考试化学试题(已下线)安徽省六安市舒城中学2018-2019学年高二下学期第四次月考化学试题重庆市万州第二高级中学2022-2023学年高二上学期1月月考化学试题
名校
解题方法
7 . 研究氮氧化合物的治理是环保的一项重要工作,合理应用和处理氮的化合物,在生产生活中有着重要的意义。
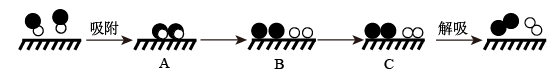
(1)已知:N2(g)+O2(g)=2NO(g) △H=+181.5 kJ·mol-1某科研小组尝试利用固体表面催化工艺进行NO的分解。若用●● 、●○ 、○○和 分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如下图所示。从吸附到解吸的过程中,能量状态最低的是
分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如下图所示。从吸附到解吸的过程中,能量状态最低的是___________ (填字母序号)。
(2)为减少汽车尾气中NOx的排放,常采用CxHy(烃)催化还原NOx消除氮氧化物的污染。
例如:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
②CH4(g)+4NO(g)=2N2 (g)+CO2 (g)+2H2O(g) △H2=-1160 kJ/mol
③CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H3
则△H3=___________ 。
(3)亚硝酰氯(ClNO)是有机合成中常用试剂,已知:2NO(g)+Cl2(g) 2 ClNO(g) △H<0
2 ClNO(g) △H<0
①一定温度下,将2 molNO与2 molCl2置于2L密闭容器中发生反应,若该反应4min后达平衡,此时压强是初始的0.8倍,则平均反应速率v(Cl2)=___________ mol·L-1·min-1。下列可判断反应达平衡状态的是___________ (项序号字母)。
A 混合气体的平均相对分子质量不变
B 混合气体密度保持不变
C NO和Cl2的物质的量之比保持不变
D 每消耗1 mol NO同时生成1molClNO
②为了加快化学反应速率,同时提高NO的转化率,其他条件不变时,可采取的措施有___________ (填选项序号字母)。
A 升高温度 B 缩小容器体积
C 再充入Cl2气体 D 使用合适的催化剂
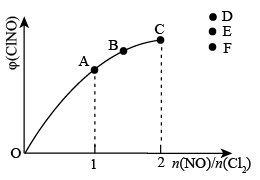
③一定条件下在恒温恒容的密闭容器中,按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化图象如图(b)所示,当n(NO)/n(Cl2)=2.5时,达到平衡状态,ClNO的体积分数可能是图中D、E、F三点中的___________ 点。
(4)已知2NO(g)+O2(g) 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
①2NO(g) N2O2(g)(快),v1正=k1正c2(NO),v1逆 =k1逆c (N2O2)
N2O2(g)(快),v1正=k1正c2(NO),v1逆 =k1逆c (N2O2)
②N2O2(g)+O2(g) 2NO2(g)(慢),v2正=k2正c(N2O2)·c(O2),v2逆=k2逆c2(NO2)
2NO2(g)(慢),v2正=k2正c(N2O2)·c(O2),v2逆=k2逆c2(NO2)
比较反应①的活化能E1与反应②的活化能E2的大小:E1___________ E2(填“>”、"<”或“=”):2NO(g)+O2(g) 2NO2(g)的平衡常数K与上述反应速率常数k1正、k1逆、k2正、k2逆的关系式为
2NO2(g)的平衡常数K与上述反应速率常数k1正、k1逆、k2正、k2逆的关系式为___________ 。
(1)已知:N2(g)+O2(g)=2NO(g) △H=+181.5 kJ·mol-1某科研小组尝试利用固体表面催化工艺进行NO的分解。若用●● 、●○ 、○○和
 分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如下图所示。从吸附到解吸的过程中,能量状态最低的是
分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如下图所示。从吸附到解吸的过程中,能量状态最低的是
(2)为减少汽车尾气中NOx的排放,常采用CxHy(烃)催化还原NOx消除氮氧化物的污染。
例如:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
②CH4(g)+4NO(g)=2N2 (g)+CO2 (g)+2H2O(g) △H2=-1160 kJ/mol
③CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H3
则△H3=
(3)亚硝酰氯(ClNO)是有机合成中常用试剂,已知:2NO(g)+Cl2(g)
 2 ClNO(g) △H<0
2 ClNO(g) △H<0①一定温度下,将2 molNO与2 molCl2置于2L密闭容器中发生反应,若该反应4min后达平衡,此时压强是初始的0.8倍,则平均反应速率v(Cl2)=
A 混合气体的平均相对分子质量不变
B 混合气体密度保持不变
C NO和Cl2的物质的量之比保持不变
D 每消耗1 mol NO同时生成1molClNO
②为了加快化学反应速率,同时提高NO的转化率,其他条件不变时,可采取的措施有
A 升高温度 B 缩小容器体积
C 再充入Cl2气体 D 使用合适的催化剂
③一定条件下在恒温恒容的密闭容器中,按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化图象如图(b)所示,当n(NO)/n(Cl2)=2.5时,达到平衡状态,ClNO的体积分数可能是图中D、E、F三点中的

(4)已知2NO(g)+O2(g)
 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:①2NO(g)
 N2O2(g)(快),v1正=k1正c2(NO),v1逆 =k1逆c (N2O2)
N2O2(g)(快),v1正=k1正c2(NO),v1逆 =k1逆c (N2O2)②N2O2(g)+O2(g)
 2NO2(g)(慢),v2正=k2正c(N2O2)·c(O2),v2逆=k2逆c2(NO2)
2NO2(g)(慢),v2正=k2正c(N2O2)·c(O2),v2逆=k2逆c2(NO2)比较反应①的活化能E1与反应②的活化能E2的大小:E1
 2NO2(g)的平衡常数K与上述反应速率常数k1正、k1逆、k2正、k2逆的关系式为
2NO2(g)的平衡常数K与上述反应速率常数k1正、k1逆、k2正、k2逆的关系式为
您最近一年使用:0次
2019-04-09更新
|
479次组卷
|
3卷引用:湖北省黄石市有色第一中学2021-2022学年高二上学期期中考试化学试题
12-13高三上·湖北·期中
8 . 人工固氮是指将氮元素由游离态转化为化合态的过程。据报道,常温、常压、光照条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成的主要产物为NH3,相应的热化学方程式为:N2(g)+3H2O(l) 2NH3(g)+
2NH3(g)+ O2(g) △H=+765.0kJ/mol。
O2(g) △H=+765.0kJ/mol。
Ⅰ.请在下图所示的坐标中画出上述反应在有催化剂和无催化剂两种情况下反应体系中的能量变化示意图,并进行标注(包括△H)____________ 。

Ⅱ.目前工业合成氨的原理是:N2(g)+3H2(g) 2NH3(g) △H=-93.0kJ /mol。
2NH3(g) △H=-93.0kJ /mol。
回答下列问题:
(1)氢气的燃烧热△H=_______________ kJ/mol。
(2)在恒温恒容密闭容器中进行的合成氨反应,下列能表示达到平衡状态的是_______ (填序号)。
a.混合气体的压强不再发生变化
b.混合气体的密度不再发生变化
c.反应容器中N2、NH3的物质的量的比值不再发生变化
d.单位时间内断开a个H-H键的同时形成3 a个N-H键
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
(3)在恒温恒容的密闭容器中,合成氨反应的各物质浓度变化曲线如下图所示。请回答下列问题:
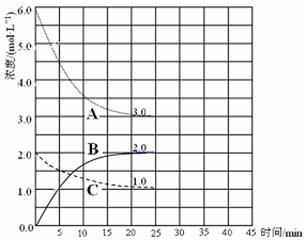
① 表示N2的浓度变化的曲线是______________ (选填曲线代号“A”、“B”或“C”)。
② 前25 min 内,用H2的浓度变化表示的化学反应平均速率是____________ 。
③在25 min 末反应刚好达到平衡,则该温度下反应的平衡常数K=_______ (计算结果可用分数表示)。若升高温度,该反应的平衡常数值将_______ (填“增大”、“减小”或“不变”)。
(4)在第25 min 末,保持其它条件不变,若升高反应温度并设法保持该温度不变,在第35 min末再次达到平衡。平衡移动过程中H2浓度变化了1.5 mol·L-1,请你在图中画出第25 min ~ 40 min NH3浓度变化曲线__________ 。
(5)在一定温度下,将1 mol N2和3 mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8 mol 。
①达平衡时,H2的转化率α1 =____________ 。
②在相同条件下,若起始时只将NH3置于该容器中,达到平衡状态时NH3的转化率为α2,当α1 +α2 =1时,则起始时n (NH3)=________ mol。
 2NH3(g)+
2NH3(g)+ O2(g) △H=+765.0kJ/mol。
O2(g) △H=+765.0kJ/mol。Ⅰ.请在下图所示的坐标中画出上述反应在有催化剂和无催化剂两种情况下反应体系中的能量变化示意图,并进行标注(包括△H)

Ⅱ.目前工业合成氨的原理是:N2(g)+3H2(g)
 2NH3(g) △H=-93.0kJ /mol。
2NH3(g) △H=-93.0kJ /mol。回答下列问题:
(1)氢气的燃烧热△H=
(2)在恒温恒容密闭容器中进行的合成氨反应,下列能表示达到平衡状态的是
a.混合气体的压强不再发生变化
b.混合气体的密度不再发生变化
c.反应容器中N2、NH3的物质的量的比值不再发生变化
d.单位时间内断开a个H-H键的同时形成3 a个N-H键
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
(3)在恒温恒容的密闭容器中,合成氨反应的各物质浓度变化曲线如下图所示。请回答下列问题:

① 表示N2的浓度变化的曲线是
② 前25 min 内,用H2的浓度变化表示的化学反应平均速率是
③在25 min 末反应刚好达到平衡,则该温度下反应的平衡常数K=
(4)在第25 min 末,保持其它条件不变,若升高反应温度并设法保持该温度不变,在第35 min末再次达到平衡。平衡移动过程中H2浓度变化了1.5 mol·L-1,请你在图中画出第25 min ~ 40 min NH3浓度变化曲线
(5)在一定温度下,将1 mol N2和3 mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8 mol 。
①达平衡时,H2的转化率α1 =
②在相同条件下,若起始时只将NH3置于该容器中,达到平衡状态时NH3的转化率为α2,当α1 +α2 =1时,则起始时n (NH3)=
您最近一年使用:0次
解题方法
9 . 近几年我国大面积发生雾霾天气,其主要原因是SO2、NOx等挥发性有机物等发生二次转化,研究碳、氮、硫及其化合物的转化对于环境的改善有重大意义。
(1)在一定条件下,CH4可与NOx反应除去NOx,已知有下列热化学方程式:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ·mol-1
②N2(g)+2O2(g) 2NO2(g) △H=+67.0 kJ·mol-1
2NO2(g) △H=+67.0 kJ·mol-1
③H2O(g)=H2O(l) △H=-41.0 kJ·mol-1
则CH4(g)+2NO2(g) CO2(g)+2H2O(g)+N2 (g) △H=
CO2(g)+2H2O(g)+N2 (g) △H=_____ kJ·mol-1;该反应在_____ (高温,低温,任何温度)下可自发进行
(2)SO2经过净化后与空气混合进行催化氧化可制取硫酸,其中SO2发生催化氧化的反应为: 2SO2(g)+O2(g) 2SO3(g) △H< 0,在一定温度下的定容容器中,能说明上述平衡达到平衡状态的是:
2SO3(g) △H< 0,在一定温度下的定容容器中,能说明上述平衡达到平衡状态的是:_______________ 。
A. 混合气体的密度不再发生变化 B.混合气体的平均摩尔质量不再发生变化
C. v(SO2):v(O2):v(SO3)=2:1:2 D.混合气体的总物质的量不再发生变化
(3)若在T1℃、0.1 MPa条件下,往一密闭容器通入SO2和O2 [其中n(SO2):n(O2)= 2:1],测得容器内总压强与反应时间如下图所示。
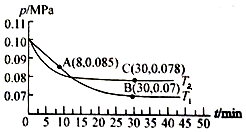
①图中A点时,SO2的转化率为________ 。
②在其他条件不变的情况下,测得T2℃时压强的变化曲线如图所示,则C点的正反应速率vc(正)与A点的逆反应速率vA(逆)的大小关系为vc(正)_____ v A(逆) (填“>"、“<”或“ = ”)。
③图中B点的平衡常数Kp=______ 。(Kp=压强平衡常数,用平衡分压代替平衡浓度计算,分压=总压物质的量分数)
(4)为了清除NO、NO2、N2O4对大气的污染,常采用氢氧化钠溶液进行吸收处理。现有由a mol NO、b molNO2、c molN2O4组成的混合气体恰好被VL氢氧化钠溶液吸收(无气体剩余),则此氢氧化钠溶液的物质的量浓度最小为____________ 。
(1)在一定条件下,CH4可与NOx反应除去NOx,已知有下列热化学方程式:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ·mol-1
②N2(g)+2O2(g)
 2NO2(g) △H=+67.0 kJ·mol-1
2NO2(g) △H=+67.0 kJ·mol-1③H2O(g)=H2O(l) △H=-41.0 kJ·mol-1
则CH4(g)+2NO2(g)
 CO2(g)+2H2O(g)+N2 (g) △H=
CO2(g)+2H2O(g)+N2 (g) △H=(2)SO2经过净化后与空气混合进行催化氧化可制取硫酸,其中SO2发生催化氧化的反应为: 2SO2(g)+O2(g)
 2SO3(g) △H< 0,在一定温度下的定容容器中,能说明上述平衡达到平衡状态的是:
2SO3(g) △H< 0,在一定温度下的定容容器中,能说明上述平衡达到平衡状态的是:A. 混合气体的密度不再发生变化 B.混合气体的平均摩尔质量不再发生变化
C. v(SO2):v(O2):v(SO3)=2:1:2 D.混合气体的总物质的量不再发生变化
(3)若在T1℃、0.1 MPa条件下,往一密闭容器通入SO2和O2 [其中n(SO2):n(O2)= 2:1],测得容器内总压强与反应时间如下图所示。

①图中A点时,SO2的转化率为
②在其他条件不变的情况下,测得T2℃时压强的变化曲线如图所示,则C点的正反应速率vc(正)与A点的逆反应速率vA(逆)的大小关系为vc(正)
③图中B点的平衡常数Kp=
(4)为了清除NO、NO2、N2O4对大气的污染,常采用氢氧化钠溶液进行吸收处理。现有由a mol NO、b molNO2、c molN2O4组成的混合气体恰好被VL氢氧化钠溶液吸收(无气体剩余),则此氢氧化钠溶液的物质的量浓度最小为
您最近一年使用:0次
名校
解题方法
10 . CO2的转化一直是全球研究的热点,其中将CO2和H2合成甲醇及二甲醚具备相对成熟的技术。工业生产中,有以下相关反应(热效应都是在25 ℃,1.01105Pa下测定):
①CO2(g) + 3H2(g) ⇌CH3OH(l) + H2O(l) ΔH =-49.01 kJ·mol-1
②2CH3OH(l)⇌CH3OCH3(g) + H2O(l) ΔH =-24.52 kJ·mol-1
③CO(g) + H2O(l)⇌CO2(g) + H2(g) ΔH = -41.17 kJ·mol-1
(1)工业上用CO2和H2合成二甲醚的热化学方程式为_______ 。
(2)反应①的平衡常数表达式K=_______ 。
(3)在一常温恒容的密闭容器中,放入一定量的甲醇发生如②式化学反应并建立平衡,以下说法正确并可以作为该反应达到平衡状态的判断依据的是_______ (填字母)。
A.容器内气体相对分子质量保持不变 B. 容器内气体压强不变
C.相同时间内消耗甲醇的量是消耗二甲醚的两倍 D.甲醇和二甲醚物质的量相等
(4)在三个体积相同的密闭容器中加入相同物质的量的CO和H2O,在不同温度下发生反应③,经过相同时间后测得容器中的CO物质的量与温度的关系如图:
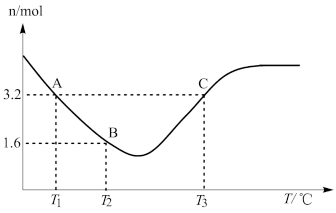
I.A、C两点的速率大小v(A)_______ (填“大于”“小于”“等于”或“无 法判断”)v(C)。
II.请解释曲线中CO的物质的量先减小后增大的原因_______ 。
①CO2(g) + 3H2(g) ⇌CH3OH(l) + H2O(l) ΔH =-49.01 kJ·mol-1
②2CH3OH(l)⇌CH3OCH3(g) + H2O(l) ΔH =-24.52 kJ·mol-1
③CO(g) + H2O(l)⇌CO2(g) + H2(g) ΔH = -41.17 kJ·mol-1
(1)工业上用CO2和H2合成二甲醚的热化学方程式为
(2)反应①的平衡常数表达式K=
(3)在一常温恒容的密闭容器中,放入一定量的甲醇发生如②式化学反应并建立平衡,以下说法正确并可以作为该反应达到平衡状态的判断依据的是
A.容器内气体相对分子质量保持不变 B. 容器内气体压强不变
C.相同时间内消耗甲醇的量是消耗二甲醚的两倍 D.甲醇和二甲醚物质的量相等
(4)在三个体积相同的密闭容器中加入相同物质的量的CO和H2O,在不同温度下发生反应③,经过相同时间后测得容器中的CO物质的量与温度的关系如图:

I.A、C两点的速率大小v(A)
II.请解释曲线中CO的物质的量先减小后增大的原因
您最近一年使用:0次



