1 . NOx是造成大气污染的主要物质,现在工业上脱硝有多种方法。用焦炭还原法将其转化为无污染的物质也可进行脱硝。已知:
2C(s)+O2(g)===2CO(g) ΔH1=-221.0 kJ·mol-1
N2(g)+O2(g)===2NO(g) ΔH2=+180.5 kJ/mol
2NO(g)+2CO(g)===2CO2(g)+N2(g) ΔH3=-746.0 kJ/mol
回答下列问题:
(1)用焦炭还原NO生成无污染气体的热化学方程式为____________ 。
(2)在一定温度下,向甲、乙、丙三个恒容密闭容器中加入一定量的NO和足量的焦炭,反应过程中测得各容器中c(NO)(mo/L)随时间(s)的变化如下表:(已知:三个容器的反应温度分别为T甲=400 ℃、T乙=400 ℃、T丙=a ℃)
甲容器中,该反应的平衡常数K=_______ ,丙容器的反应温度a______ (填“>”“<”或“=”)400 ℃,理由是________ 。
(3)已知:8NH3(g)+6NO2(g) 7N2(g)+12H2O(l),ΔH<0。相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间的变化如图所示:
7N2(g)+12H2O(l),ΔH<0。相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间的变化如图所示:
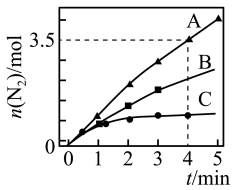
①在催化剂A的作用下0~4 min的v(NO2)=_______ 。
②该反应活化能Ea(A)、Ea(B)、Ea(C)由小到大的顺序是______ ,理由是_________ 。
③下列说法不正确的是__________ (填字母)。
a.使用催化剂A达平衡时,ΔH值更大
b.升高温度可使容器内气体颜色加深
c.单位时间内形成N—H键与O—H键的数目相等时,说明反应已经达到平衡
d.若在恒容绝热的密闭容器中反应,当平衡常数不变时,说明反应已经达到平衡
2C(s)+O2(g)===2CO(g) ΔH1=-221.0 kJ·mol-1
N2(g)+O2(g)===2NO(g) ΔH2=+180.5 kJ/mol
2NO(g)+2CO(g)===2CO2(g)+N2(g) ΔH3=-746.0 kJ/mol
回答下列问题:
(1)用焦炭还原NO生成无污染气体的热化学方程式为
(2)在一定温度下,向甲、乙、丙三个恒容密闭容器中加入一定量的NO和足量的焦炭,反应过程中测得各容器中c(NO)(mo/L)随时间(s)的变化如下表:(已知:三个容器的反应温度分别为T甲=400 ℃、T乙=400 ℃、T丙=a ℃)
| 时间 | 0 s | 10 s | 20 s | 30 s | 40 s |
| 甲 | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| 乙 | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
| 丙 | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
甲容器中,该反应的平衡常数K=
(3)已知:8NH3(g)+6NO2(g)
 7N2(g)+12H2O(l),ΔH<0。相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间的变化如图所示:
7N2(g)+12H2O(l),ΔH<0。相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间的变化如图所示:
①在催化剂A的作用下0~4 min的v(NO2)=
②该反应活化能Ea(A)、Ea(B)、Ea(C)由小到大的顺序是
③下列说法不正确的是
a.使用催化剂A达平衡时,ΔH值更大
b.升高温度可使容器内气体颜色加深
c.单位时间内形成N—H键与O—H键的数目相等时,说明反应已经达到平衡
d.若在恒容绝热的密闭容器中反应,当平衡常数不变时,说明反应已经达到平衡
您最近一年使用:0次
2 . 2019年12月4日“全球碳计划”发布报告说,全球CO2排放量增速趋缓。人们还需要更有力的政策来逐步淘汰化石燃料的使用。CO2的综合利用是解决温室问题的有效途径。
(1)一种途径是用CO2转化成为有机物实现碳循环。如:
C2H4 (g) + H2O(l) C2H5OH(l) ΔH=- 44.2 kJ·mol−1
C2H5OH(l) ΔH=- 44.2 kJ·mol−1
2CO2(g) + 2H2O(l) C2H4 (g) +3O2(g) ΔH=+1411.0 kJ·mol−1
C2H4 (g) +3O2(g) ΔH=+1411.0 kJ·mol−1
已知2CO2(g) + 3H2O(l) C2H5OH(l) + 3O2(g)其正反应的活化能为Ea kJ·mol−1,则逆反应的活化能为
C2H5OH(l) + 3O2(g)其正反应的活化能为Ea kJ·mol−1,则逆反应的活化能为___________ kJ·mol−1。
(2)利用工业废气中的 CO2可以制取甲醇和水蒸气,一定条件下,往2 L恒容密闭容器中充入1 mol CO2和3 mol H2,在不同催化剂作用下发生反应 I、反应II与反应III,相同时间内CO2的转化率随温度变化如图所示:
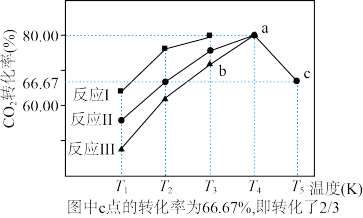
①催化剂效果最佳的反应是__________ (填“反应I”,“反应II”,“反应III”)。
②b点v(正)___________ v(逆) (填 “>”, “<”, “=”)。
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因______________ 。
④c点时该反应的平衡常数K=__________________ 。
(3)中国科学家首次用CO2高效合成乙酸,其反应路径如图所示:
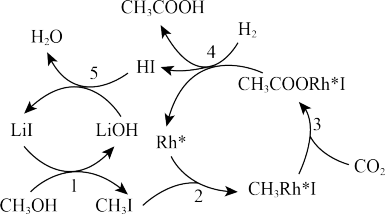
①原料中的CH3OH可通过电解法由CO2制取,用稀硫酸作电解质溶液,写出生成CH3OH的电极反应式________________ 。
②根据图示,写出总反应的化学方程式:________________ 。
(1)一种途径是用CO2转化成为有机物实现碳循环。如:
C2H4 (g) + H2O(l)
 C2H5OH(l) ΔH=- 44.2 kJ·mol−1
C2H5OH(l) ΔH=- 44.2 kJ·mol−12CO2(g) + 2H2O(l)
 C2H4 (g) +3O2(g) ΔH=+1411.0 kJ·mol−1
C2H4 (g) +3O2(g) ΔH=+1411.0 kJ·mol−1已知2CO2(g) + 3H2O(l)
 C2H5OH(l) + 3O2(g)其正反应的活化能为Ea kJ·mol−1,则逆反应的活化能为
C2H5OH(l) + 3O2(g)其正反应的活化能为Ea kJ·mol−1,则逆反应的活化能为(2)利用工业废气中的 CO2可以制取甲醇和水蒸气,一定条件下,往2 L恒容密闭容器中充入1 mol CO2和3 mol H2,在不同催化剂作用下发生反应 I、反应II与反应III,相同时间内CO2的转化率随温度变化如图所示:

①催化剂效果最佳的反应是
②b点v(正)
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因
④c点时该反应的平衡常数K=
(3)中国科学家首次用CO2高效合成乙酸,其反应路径如图所示:

①原料中的CH3OH可通过电解法由CO2制取,用稀硫酸作电解质溶液,写出生成CH3OH的电极反应式
②根据图示,写出总反应的化学方程式:
您最近一年使用:0次
名校
解题方法
3 . (1)已知葡萄糖(C6H12O6)的燃烧热是2804 kJ/mol,写出葡萄糖的燃烧热的热化学方程式:____________ ,当它在人体内氧化生成1 g水时放出的热量约为____________ 。
(2)已知:HCN(aq)与 NaOH(aq)反应生成1mol液态水的△H =-12. 1 kJ/mol, HCl(aq) 与NaOH(aq)反应生成l mol液态水的△H = -55.6 kJ/mol,则HCN在水溶液中电离的热化学方程式为:_____________ 。
(3) 2 L 0.5 mol/LH2SO4溶液与足量Ba(OH)2稀溶液反应放出a kJ热量,2 L 0.5 mol/L HCl溶液与足量NaOH稀溶液充分反应放出b kJ热量,则500 mL0.4 mol/LBaCl2溶液与足量稀硫酸反应放出的热量为_________ 。
(4) 2015年冬季,雾霾天气严重影响了我国北方地区。国内电力行业和供暖部门引进先进脱硫工艺以减少污染。目前脱硫工艺涉及的主要反应有:①H2S(g)+ O2(g)=SO2(g)+H2O(g) △H1
O2(g)=SO2(g)+H2O(g) △H1
②S(g)+ O2(g)=SO2(g) △H2
③S(g)+ H2(g)=H2S(g) △H3
则“2H2(g)+O2(g)=2H2O(g) △H4”中△H4=_______________ 。
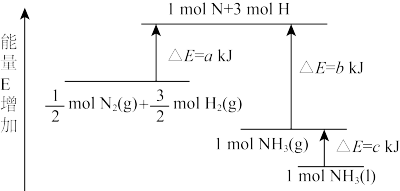
(5) N2和H2合成NH3的能量变化如图所示,写出生成液氨的热化学方程式是____________ 。
(2)已知:HCN(aq)与 NaOH(aq)反应生成1mol液态水的△H =-12. 1 kJ/mol, HCl(aq) 与NaOH(aq)反应生成l mol液态水的△H = -55.6 kJ/mol,则HCN在水溶液中电离的热化学方程式为:
(3) 2 L 0.5 mol/LH2SO4溶液与足量Ba(OH)2稀溶液反应放出a kJ热量,2 L 0.5 mol/L HCl溶液与足量NaOH稀溶液充分反应放出b kJ热量,则500 mL0.4 mol/LBaCl2溶液与足量稀硫酸反应放出的热量为
(4) 2015年冬季,雾霾天气严重影响了我国北方地区。国内电力行业和供暖部门引进先进脱硫工艺以减少污染。目前脱硫工艺涉及的主要反应有:①H2S(g)+
 O2(g)=SO2(g)+H2O(g) △H1
O2(g)=SO2(g)+H2O(g) △H1②S(g)+ O2(g)=SO2(g) △H2
③S(g)+ H2(g)=H2S(g) △H3
则“2H2(g)+O2(g)=2H2O(g) △H4”中△H4=
(5) N2和H2合成NH3的能量变化如图所示,写出生成液氨的热化学方程式是

您最近一年使用:0次
2020-08-30更新
|
117次组卷
|
3卷引用:湖北省武汉市第三中学2019-2020学年高一下学期期中考试化学试题
湖北省武汉市第三中学2019-2020学年高一下学期期中考试化学试题河南省驻马店市正阳县高级中学2020-2021学年高二上学期第一次月考化学试题(已下线)专题1 综合评价(1)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)
4 . 如图所示的氮循环是生态系统物质循环的重要组成部分,人类活动加剧了氮循环中的物质转化。
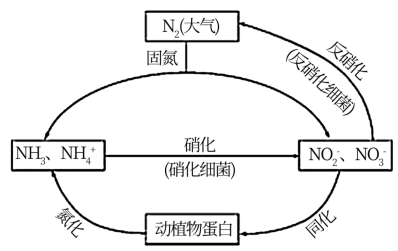
(1)结合上图判断下列说法正确的是____________ (填字母序号)。
A 固氮过程中,N2只作氧化剂
B 在硝化细菌作用下发生的硝化过程需要有氧化剂参与
C 反硝化过程有助于弥补人工固氮对氮循环造成的影响
D 同化、氨化过程中,氮元素均从无机物转移至有机物
(2)硝化过程中,NH3转化成HNO2的化学方程式为____________ 。
(3)反硝化过程中,CH3OH可作为反应的还原剂,请将该反应的离子方程式补充完整:
5CH3OH+6NO

____ N2↑+4HCO +
+_____ +______ 。
(4)利用下表数据进行估算,写出工业合成氨反应的热化学方程式:____________
(5)已知,氨气易液化,可做制冷剂,试比较NH3的沸点______ (选填“高于”或“低于”)PH3,原因是_______________________ 。
(6)已知:①4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H1= -a kJ/mol
②4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H2= -bkJ/mol;
③H2(g)+ O2(g)=H2O(g) △H3= -c kJ/mol
O2(g)=H2O(g) △H3= -c kJ/mol
④H2(g)+ O2(g)=H2O(l) △H4= -d kJ/mol
O2(g)=H2O(l) △H4= -d kJ/mol
有关下列叙述不正确的是_____________ 。
a.由上述热化学方程式可知△H3<△H4
b.H2的燃烧热为d kJ/mol
c.4NH3(g)+4O2(g)=2NO(g)+N2(g)+6H2O(g) △H=(-a-b) kJ/mol
d.4NH3(g) 2N2(g)+6H2(g) △H =(6d-b)kJ/mol
2N2(g)+6H2(g) △H =(6d-b)kJ/mol

(1)结合上图判断下列说法正确的是
A 固氮过程中,N2只作氧化剂
B 在硝化细菌作用下发生的硝化过程需要有氧化剂参与
C 反硝化过程有助于弥补人工固氮对氮循环造成的影响
D 同化、氨化过程中,氮元素均从无机物转移至有机物
(2)硝化过程中,NH3转化成HNO2的化学方程式为
(3)反硝化过程中,CH3OH可作为反应的还原剂,请将该反应的离子方程式补充完整:
5CH3OH+6NO


 +
+(4)利用下表数据进行估算,写出工业合成氨反应的热化学方程式:
| 共价键 | N≡N | H-H | N-H |
| 断开1 mol共价键所需能量(kJ) | 946 | 436 | 391 |
(6)已知:①4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H1= -a kJ/mol
②4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H2= -bkJ/mol;
③H2(g)+
 O2(g)=H2O(g) △H3= -c kJ/mol
O2(g)=H2O(g) △H3= -c kJ/mol④H2(g)+
 O2(g)=H2O(l) △H4= -d kJ/mol
O2(g)=H2O(l) △H4= -d kJ/mol有关下列叙述不正确的是
a.由上述热化学方程式可知△H3<△H4
b.H2的燃烧热为d kJ/mol
c.4NH3(g)+4O2(g)=2NO(g)+N2(g)+6H2O(g) △H=(-a-b) kJ/mol
d.4NH3(g)
 2N2(g)+6H2(g) △H =(6d-b)kJ/mol
2N2(g)+6H2(g) △H =(6d-b)kJ/mol
您最近一年使用:0次
5 . 探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ.
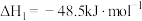
Ⅱ.
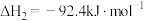
Ⅲ.
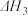
回答下列问题:
(1)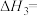
_________  。
。
(2)一定条件下,向体积为VL的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为ɑ mol,CO为b mol,此时H2(g)的浓度为__________ mol﹒L-1(用含a、b、V的代数式表示,下同),反应Ⅲ的平衡常数为___________ 。
(3)不同压强下,按照n(CO2):n(H2)=1:3投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。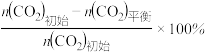
CH3OH的平衡产率=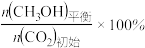
其中纵坐标表示CO2平衡转化率的是图___________ (填“甲”或“乙”);压强p1、p2、p3由大到小的顺序为___________ ;图乙中T1温度时,三条曲线几乎交于一点的原因是___________ 。
(4)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为_________ (填标号)。
A.低温、高压 B.高温、低压 C.低温、低压 D.高温、高压
Ⅰ.

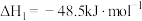
Ⅱ.

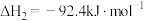
Ⅲ.

回答下列问题:
(1)
 。
。(2)一定条件下,向体积为VL的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为ɑ mol,CO为b mol,此时H2(g)的浓度为
(3)不同压强下,按照n(CO2):n(H2)=1:3投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
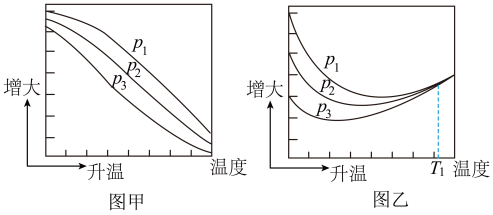
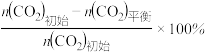
CH3OH的平衡产率=
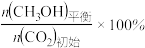
其中纵坐标表示CO2平衡转化率的是图
(4)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为
A.低温、高压 B.高温、低压 C.低温、低压 D.高温、高压
您最近一年使用:0次
2020-07-11更新
|
11091次组卷
|
23卷引用:湖北省武汉市常青联合体2022-2023学年高二上学期期中考试化学试题
湖北省武汉市常青联合体2022-2023学年高二上学期期中考试化学试题山西省长治市第二中学校2021-2022学年高二上学期期中考试化学试题黑龙江省哈尔滨市德强高中2021-2022学年高二上学期期中考试化学试题2020年山东省高考化学试卷(新高考)(已下线)专题09 反应速率、化学平衡-2020年高考真题和模拟题化学分项汇编西藏自治区拉萨市拉萨中学2021届高三第一次月考理综化学试题湖南师范大学附属中学2020-2021学年高二上学期第三次大练习化学试题福建省宁德市2020-2021学年高二上学期期末考试化学试题江苏省扬州中学2020-2021学年高二下学期开学检测化学试题四川省邻水实验学校2021届高三下学期3月开学考试理综化学试题(已下线)重点9 化学反应原理的综合应用-2021年高考化学【热点·重点·难点】专练(山东专用)(已下线)重点8 化学反应原理的综合应用-2021年高考化学专练【热点·重点·难点】(已下线)押山东卷第18题 化学反应原理综合题-备战2021年高考化学临考题号押题(山东卷)湖南省长沙市第一中学2020-2021学年高二上学期入学考试化学试题(已下线)专题15 化学反应原理综合-备战2022年高考化学真题及地市好题专项集训【山东专用】(已下线)专题12 化学反应原理综合题—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)押新高考卷17题 化学反应原理综合题-备战2022年高考化学临考题号押题(新高考通版)(已下线)2022年全国甲卷高考真题变式题(非选择题)(已下线)2020年山东卷化学高考真题变式题16-20(已下线)2022年全国乙卷高考变式题(非选择题)(已下线)第20讲 化学平衡常数及转化率的计算(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第10讲 影响化学平衡的因素(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)(已下线)专题17 原理综合题
解题方法
6 . “绿水青山就是金山银山”,现今“环境保护”意识深入人心。氮的氧化物是大气主要污染物,研究氮氧化物间的相互转化及脱除,让空气更加清洁是环境科学的重要课题。
(1)已知2NO(g)+O2(g) 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
第一步 2NO(g) N2O2(g) (快速平衡)
N2O2(g) (快速平衡)
第二步 N2O2(g)+O2(g)=2NO2(g) (慢反应)
①用O2表示的速率方程为v(O2)=k1·c2(NO)·c(O2);NO2表示的速率方程为v(NO2)=k2·c2(NO)·c(O2),k1与k2分别表示速率常数(与温度有关),则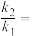
_________ 。
②下列关于反应2NO(g)+O2(g)=2NO2(g)的说法正确的是_________ (填序号)。
A.增大压强,反应速率常数一定增大
B.第一步反应的活化能大于第二步反应的活化能
C.反应的总活化能小于第一步和第二步反应的活化能之和
(2)已知:反应N2(g)+O2(g) 2NO(g) ΔH=+180.0 kJ·mol-1,CO的燃烧热ΔH=-283.5 kJ·mol-1,某脱硝反应的平衡常数表达式为
2NO(g) ΔH=+180.0 kJ·mol-1,CO的燃烧热ΔH=-283.5 kJ·mol-1,某脱硝反应的平衡常数表达式为 ,则该反应的热化学方程式为
,则该反应的热化学方程式为_________________________ 。
(3)用活性炭还原法也可以处理氮氧化物,某研究小组在2 L的恒容密闭容器中加入3 mol活性炭和2 mol NO2,发生反应2C(s)+2NO2(g) N2(g)+2CO2(g),60 min后,体系达到平衡状态,此时气体的压强变为原来的1.3倍,请回答下列问题。
N2(g)+2CO2(g),60 min后,体系达到平衡状态,此时气体的压强变为原来的1.3倍,请回答下列问题。
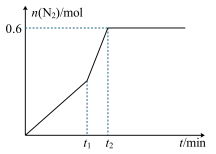
①该反应在0~60 min的平均反应速率v(N2)=_________ 。
②相同条件下进行上述反应,若在t1时刻,只改变一种条件,所得N2的物质的量随时间的变化如图所示,则,t1时刻改变的条件是_________ (填选项编号A.加压 B.加入催化剂 C.升温 D.降温 E.通入NO2),t2_________ 60 min(填“大于”、“小于”或“等于”)
③已知:升高温度,该反应的平衡常数减小,则该反应正向是_________ 反应。(填“吸热”或“放热”)保持温度不变,改为恒压容器发生该反应,达平衡后,NO2的转化率_________ (填“增大”、“减小”或“不变”,下同),K值_________ 。
(1)已知2NO(g)+O2(g)
 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:第一步 2NO(g)
 N2O2(g) (快速平衡)
N2O2(g) (快速平衡)第二步 N2O2(g)+O2(g)=2NO2(g) (慢反应)
①用O2表示的速率方程为v(O2)=k1·c2(NO)·c(O2);NO2表示的速率方程为v(NO2)=k2·c2(NO)·c(O2),k1与k2分别表示速率常数(与温度有关),则
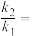
②下列关于反应2NO(g)+O2(g)=2NO2(g)的说法正确的是
A.增大压强,反应速率常数一定增大
B.第一步反应的活化能大于第二步反应的活化能
C.反应的总活化能小于第一步和第二步反应的活化能之和
(2)已知:反应N2(g)+O2(g)
 2NO(g) ΔH=+180.0 kJ·mol-1,CO的燃烧热ΔH=-283.5 kJ·mol-1,某脱硝反应的平衡常数表达式为
2NO(g) ΔH=+180.0 kJ·mol-1,CO的燃烧热ΔH=-283.5 kJ·mol-1,某脱硝反应的平衡常数表达式为 ,则该反应的热化学方程式为
,则该反应的热化学方程式为(3)用活性炭还原法也可以处理氮氧化物,某研究小组在2 L的恒容密闭容器中加入3 mol活性炭和2 mol NO2,发生反应2C(s)+2NO2(g)
 N2(g)+2CO2(g),60 min后,体系达到平衡状态,此时气体的压强变为原来的1.3倍,请回答下列问题。
N2(g)+2CO2(g),60 min后,体系达到平衡状态,此时气体的压强变为原来的1.3倍,请回答下列问题。
①该反应在0~60 min的平均反应速率v(N2)=
②相同条件下进行上述反应,若在t1时刻,只改变一种条件,所得N2的物质的量随时间的变化如图所示,则,t1时刻改变的条件是
③已知:升高温度,该反应的平衡常数减小,则该反应正向是
您最近一年使用:0次
7 . 火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会对环境造成严重影响。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。
利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ/mol
则甲烷直接将NO2还原为N2的热化学方程式为________________ 。
(2)脱碳。
将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
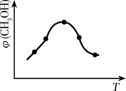
①取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后 ,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图所示,则上述CO2转化为甲醇的反应热△H3_____ 0(填“>”、“<”或“=”),该反应的平衡常数表达式为_______________ 。
②在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图所示,试回答:
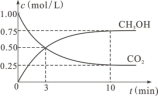
0~10 min内,氢气的平均反应速率为___________________ mol/(L·min)。第10 min后,若向该容器中再充入1 mol CO2和3 mol H2,则再次达到平衡时CH3OH(g)的体积分数____________ (填“增大”、“减小”或“不变”,下同),反应的平衡常数_____________________ 。
(3)脱硫。
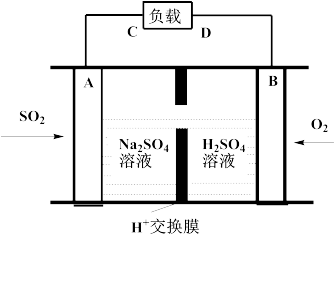
①有学者想利用如图所示装置用原电池原理将SO2转化为重要的化工原料。A、B是惰性电极,A极的电极反应式为:_________ 。
②某种脱硫工艺中将废气处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物,可作为化肥。常温下,将NH4NO3 溶解于水中,为了使该溶液中的NH4+ 和 NO3-离子的物质的量浓度之比等于1 : 1,可以采取的正确措施为_________ 。
A.加入适量的硝酸,抑制 NH4+的水解
B.加入适量的氨水,使溶液的 PH = 7
C.加入适量的 NaOH 溶液,使溶液的PH = 7
D.加入适量的NH4NO3
(1)脱硝。
利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ/mol
则甲烷直接将NO2还原为N2的热化学方程式为
(2)脱碳。
将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3①取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应

②在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图所示,试回答:

0~10 min内,氢气的平均反应速率为
(3)脱硫。
①有学者想利用如图所示装置用原电池原理将SO2转化为重要的化工原料。A、B是惰性电极,A极的电极反应式为:

②某种脱硫工艺中将废气处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物,可作为化肥。常温下,将NH4NO3 溶解于水中,为了使该溶液中的NH4+ 和 NO3-离子的物质的量浓度之比等于1 : 1,可以采取的正确措施为
A.加入适量的硝酸,抑制 NH4+的水解
B.加入适量的氨水,使溶液的 PH = 7
C.加入适量的 NaOH 溶液,使溶液的PH = 7
D.加入适量的NH4NO3
您最近一年使用:0次
名校
解题方法
8 . 甲醇既是基本有机化工原料,又可作为燃料用于替代矿物燃料。
(1)工业上合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g) ΔH。下表所列数据是该反应在不同温度下的化学平衡常数(K)。
CH3OH(g) ΔH。下表所列数据是该反应在不同温度下的化学平衡常数(K)。
由表中数据判断该反应为________ 反应(填“吸热”或“放热”)。 某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中充分反应,达到平衡后,测得c(CO)=0.2 mol/L,则CO的转化率为______ ,此时的温度为______ (从表中选择)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1 kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH2 kJ/mol
③H2O(g)=H2O(l) ΔH3 kJ/mol
则反应 CH3OH(l)+O2(g)=CO(g)+2H2O(l) ΔH=_____________ kJ/mol(用ΔH1、ΔH2、ΔH3表示)。
(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O72‾)时,实验室利用如图装置模拟该法:
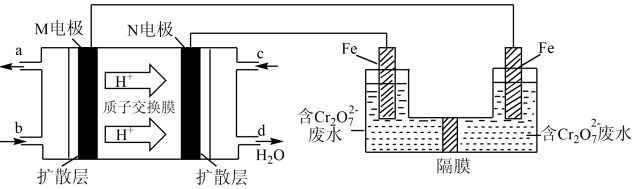
①N电极的电极反应式为___________________________________ 。
②请完成电解池中Cr2O72‾转化为Cr3+的离子反应方程式:
Cr2O72‾ +______ Fe2+ + ______ = ______ Cr3+ + ______ Fe3+ + ______
(4)处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×10‾5 mol/L 时,Cr3+沉淀完全,此时溶液的pH=______ 。(已知:Ksp=6.4×10‾31,lg2=0.3)
(1)工业上合成甲醇的反应为:CO(g)+2H2(g)
 CH3OH(g) ΔH。下表所列数据是该反应在不同温度下的化学平衡常数(K)。
CH3OH(g) ΔH。下表所列数据是该反应在不同温度下的化学平衡常数(K)。| 温度 | 250℃ | 300℃ | 350℃ |
| 平衡常数K | 2.041 | 0.270 | 0.012 |
由表中数据判断该反应为
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1 kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH2 kJ/mol
③H2O(g)=H2O(l) ΔH3 kJ/mol
则反应 CH3OH(l)+O2(g)=CO(g)+2H2O(l) ΔH=
(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O72‾)时,实验室利用如图装置模拟该法:

①N电极的电极反应式为
②请完成电解池中Cr2O72‾转化为Cr3+的离子反应方程式:
Cr2O72‾ +
(4)处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×10‾5 mol/L 时,Cr3+沉淀完全,此时溶液的pH=
您最近一年使用:0次
2019-11-28更新
|
373次组卷
|
3卷引用:湖北省沙市中学2019-2020学年高二上学期期中考试化学(选考)试题
名校
9 . 氨的合成原理为:N2(g)+3H2(g)⇌2NH3(g)∆H=-92.4kJ·mol-1在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图。回答下列问题:
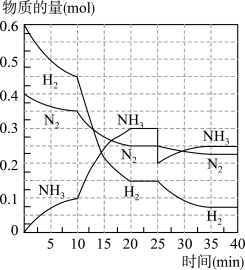
(1)10min内以NH3表示的平均反应速率为_________
(2)在10~20min内,NH3浓度变化的原因可能是_____________
A.加了催化剂
B.缩小容器体积
C.降低温度
D.增加NH3物质的量
(3)第1次平衡:平衡常数K1=__________ (带数据的表达式),第2次平衡时NH3的体积分数为_____________ 。
(4)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fc2O3的TiO2)表面与水发生下列反应:N2(g)+3H2O(l)⇌2NH3+1.5O2(g)∆H=akJ·mol-1,进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
①此合成反应的a______ 0,△S_______ 0;(填“>”、“<”或一”)
②已知N2(g)+3H2(g)⇌2NH3(g)∆H=-92.4kJ·mol-1,2 H2(g)+ O2(g)=2H2O(l) ∆H=-571.kJ·mol-1 则常温下氮气与水反应生成氨气与氧气的热化学方程式为_____________________________

(1)10min内以NH3表示的平均反应速率为
(2)在10~20min内,NH3浓度变化的原因可能是
A.加了催化剂
B.缩小容器体积
C.降低温度
D.增加NH3物质的量
(3)第1次平衡:平衡常数K1=
(4)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fc2O3的TiO2)表面与水发生下列反应:N2(g)+3H2O(l)⇌2NH3+1.5O2(g)∆H=akJ·mol-1,进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
①此合成反应的a
②已知N2(g)+3H2(g)⇌2NH3(g)∆H=-92.4kJ·mol-1,2 H2(g)+ O2(g)=2H2O(l) ∆H=-571.kJ·mol-1 则常温下氮气与水反应生成氨气与氧气的热化学方程式为
您最近一年使用:0次
2019-10-28更新
|
188次组卷
|
2卷引用:湖北省随州一中2019-2020学年高二上学期期中考试化学试题
解题方法
10 . Ⅰ.利用甲烷催化还原NOx消除氮氧化物的污染
①CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) ΔH1=-574kJ·mol-1
②CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g) ΔH2=-1 160kJ·mol-1
2N2(g)+CO2(g)+2H2O(g) ΔH2=-1 160kJ·mol-1
③CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH3=-867kJ·mol-1
N2(g)+CO2(g)+2H2O(g) ΔH3=-867kJ·mol-1
(1)如果三个反应的平衡常数依次为K1、K2、K3,则K3=___ (用K1、K2表示)。
(2)在2L恒容密闭容器中充入1molCH4和2molNO2进行反应③,CH4的平衡转化率α(CH4)与温度和压强的关系如图所示。

①若容器中的压强为p2,y点:v正____ (填“大于”“等于”或“小于”)v逆。
②x点对应温度下反应的平衡常数K=___ 。
Ⅱ.甲烷蒸气转化法制H2的主要反应为:CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
(3)在恒容密闭容器中充入2 mol CH4和H2O(g)的混合气体,且CH4和H2O(g)的物质的量之比为x,相同温度下达到平衡时测得H2的体积分数φ(H2)与x的关系如图所示。
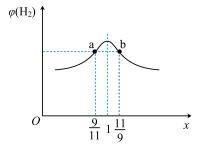
则CH4的转化率:a点____ (填“>”“=”或“<”,下同)b点,CH4(g)的浓度:a点_____ b点,氢气的产率:a点____ b点。
Ⅲ.(4)根据以下三个热化学方程式:2H2S(g)+3O2(g)=SO2(g) +2H2O(l) ΔH=-Q1kJ·mol-1,2H2S(g)+O2(g)= S(s)+2H2O(l) ΔH=-Q2kJ·mol-1,2H2S(g)+O2(g)= S(s)+2H2O(g) ΔH=-Q3kJ·mol-1,判断Q1、Q2、Q3的大小关系是___ 。
①CH4(g)+4NO2(g)
 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) ΔH1=-574kJ·mol-1②CH4(g)+4NO(g)
 2N2(g)+CO2(g)+2H2O(g) ΔH2=-1 160kJ·mol-1
2N2(g)+CO2(g)+2H2O(g) ΔH2=-1 160kJ·mol-1③CH4(g)+2NO2(g)
 N2(g)+CO2(g)+2H2O(g) ΔH3=-867kJ·mol-1
N2(g)+CO2(g)+2H2O(g) ΔH3=-867kJ·mol-1(1)如果三个反应的平衡常数依次为K1、K2、K3,则K3=
(2)在2L恒容密闭容器中充入1molCH4和2molNO2进行反应③,CH4的平衡转化率α(CH4)与温度和压强的关系如图所示。

①若容器中的压强为p2,y点:v正
②x点对应温度下反应的平衡常数K=
Ⅱ.甲烷蒸气转化法制H2的主要反应为:CH4(g)+H2O(g)
 CO(g)+3H2(g)
CO(g)+3H2(g)(3)在恒容密闭容器中充入2 mol CH4和H2O(g)的混合气体,且CH4和H2O(g)的物质的量之比为x,相同温度下达到平衡时测得H2的体积分数φ(H2)与x的关系如图所示。

则CH4的转化率:a点
Ⅲ.(4)根据以下三个热化学方程式:2H2S(g)+3O2(g)=SO2(g) +2H2O(l) ΔH=-Q1kJ·mol-1,2H2S(g)+O2(g)= S(s)+2H2O(l) ΔH=-Q2kJ·mol-1,2H2S(g)+O2(g)= S(s)+2H2O(g) ΔH=-Q3kJ·mol-1,判断Q1、Q2、Q3的大小关系是
您最近一年使用:0次
2019-10-18更新
|
165次组卷
|
2卷引用:湖北省荆州开发区滩桥高级中学2019-2020学年高二上学期期中考试化学(等级考)试题



