解题方法
1 . 碳、氮及其化合物在工业生产等领域中有着重要应用,同时氮的氧化物也是造成空气污染的主要成分之一,降低其排放可以改善空气质量。
(1)已知:
Ⅰ.2H2(g)+O2(g)=2H2O(g)H1=-483.6kJ·mol-1
Ⅱ.N2(g)+O2(g) 2NO(g)H2=+180.5kJ·mol-1
2NO(g)H2=+180.5kJ·mol-1
Ⅲ.2H2(g)+2NO(g) N2(g)+2H2O(g)
N2(g)+2H2O(g)
①若反应Ⅲ的逆反应活化能为EakJ·mol-1,则正反应活化能为__ kJ·mol-1(用含Ea的式子表示)。
②我国学者在刚性容器中按投料比 =1发生反应Ⅲ,不同催化剂条件下,反应相同时间测得NO转化率与温度的关系如图。
=1发生反应Ⅲ,不同催化剂条件下,反应相同时间测得NO转化率与温度的关系如图。
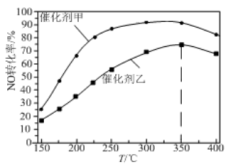
使用催化剂乙时,NO转化率随温度升高先增大后减小的可能原因是___ 。
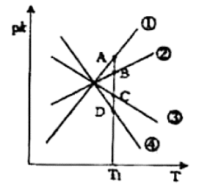
(2)CO还原法处理氮氧化物的原理为2CO(g)+2NO(g)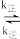 2CO2(g)+N2(g)∆H<0。实验测得v正=k正·c2(CO)·c2(NO),v逆=k逆·c2(CO2)·c(N2)(k正、k逆为速率常数,只与温度有关)。如图所示①②③④四条斜线中,能表示pk逆(pk=-lgk)随温度变化的斜线是
2CO2(g)+N2(g)∆H<0。实验测得v正=k正·c2(CO)·c2(NO),v逆=k逆·c2(CO2)·c(N2)(k正、k逆为速率常数,只与温度有关)。如图所示①②③④四条斜线中,能表示pk逆(pk=-lgk)随温度变化的斜线是___ ,图中A、B、C、D四点的纵坐标分别为a+2.5、a+0.5、a-0.5、a-2.5,则T1温度下,反应达到平衡时 =
=__ (填具体数字)。
(3)氨气可还原氮氧化物,工业上常利用反应N2(g)+3H2(g) 2NH3(g)∆H<0合成氨气,按照n(N2):n(H2)=1:3投料,发生合成氨反应,NH3的平衡体积分数φ(NH3)在不同压强下随温度变化如图所示。
2NH3(g)∆H<0合成氨气,按照n(N2):n(H2)=1:3投料,发生合成氨反应,NH3的平衡体积分数φ(NH3)在不同压强下随温度变化如图所示。

①900K时,反应的平衡常数Kp(p1)___ Kp(p2)。(填“<”、“=”、“>”)
②A点(700K,0.5MPa)时氮气的平衡转化率α(N2)=___ 。
(1)已知:
Ⅰ.2H2(g)+O2(g)=2H2O(g)H1=-483.6kJ·mol-1
Ⅱ.N2(g)+O2(g)
 2NO(g)H2=+180.5kJ·mol-1
2NO(g)H2=+180.5kJ·mol-1Ⅲ.2H2(g)+2NO(g)
 N2(g)+2H2O(g)
N2(g)+2H2O(g)①若反应Ⅲ的逆反应活化能为EakJ·mol-1,则正反应活化能为
②我国学者在刚性容器中按投料比
 =1发生反应Ⅲ,不同催化剂条件下,反应相同时间测得NO转化率与温度的关系如图。
=1发生反应Ⅲ,不同催化剂条件下,反应相同时间测得NO转化率与温度的关系如图。
使用催化剂乙时,NO转化率随温度升高先增大后减小的可能原因是
(2)CO还原法处理氮氧化物的原理为2CO(g)+2NO(g)
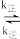 2CO2(g)+N2(g)∆H<0。实验测得v正=k正·c2(CO)·c2(NO),v逆=k逆·c2(CO2)·c(N2)(k正、k逆为速率常数,只与温度有关)。如图所示①②③④四条斜线中,能表示pk逆(pk=-lgk)随温度变化的斜线是
2CO2(g)+N2(g)∆H<0。实验测得v正=k正·c2(CO)·c2(NO),v逆=k逆·c2(CO2)·c(N2)(k正、k逆为速率常数,只与温度有关)。如图所示①②③④四条斜线中,能表示pk逆(pk=-lgk)随温度变化的斜线是 =
=
(3)氨气可还原氮氧化物,工业上常利用反应N2(g)+3H2(g)
 2NH3(g)∆H<0合成氨气,按照n(N2):n(H2)=1:3投料,发生合成氨反应,NH3的平衡体积分数φ(NH3)在不同压强下随温度变化如图所示。
2NH3(g)∆H<0合成氨气,按照n(N2):n(H2)=1:3投料,发生合成氨反应,NH3的平衡体积分数φ(NH3)在不同压强下随温度变化如图所示。
①900K时,反应的平衡常数Kp(p1)
②A点(700K,0.5MPa)时氮气的平衡转化率α(N2)=
您最近一年使用:0次
2 . 含氮化合物在生活、生产、研究领域至关重要。回答下列问题:已知:
Ⅰ.2H2(g)+O2(g) =2H2O(g) ΔH1=−483.6 kJ∙mol−1
Ⅱ.N2(g)+O2(g) 2NO(g) ΔH2=+180.5 kJ∙mol−1
2NO(g) ΔH2=+180.5 kJ∙mol−1
Ⅲ.2H2(g)+2NO(g) N2(g)+2H2O(g)
N2(g)+2H2O(g)
(1)反应Ⅲ的ΔH3=___________ kJ∙mol−1
(2)在恒温恒容的容器中发生反应Ⅲ。
①下列能够说明该反应已达到化学平衡状态的是___________ (填标号)。
A.2υ逆(NO)= υ正(N2)
B.混合气体的密度不再变化
C.容器内总压强不再变化
D.混合气体的平均相对分子质量不再变化
②反应Ⅲ的平衡常数表达式为:___________ 。
(3)如图所示的装置,电源为甲烷燃料电池,其电解质溶液是稀硫酸。X、Y 都是惰性电极。将电源接通后,向甲中滴入酚酞溶液,在 Fe 极附近显红色。试回答下列问题:
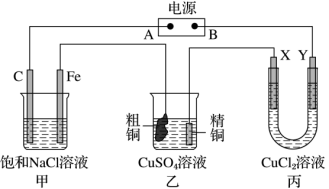
①在电源中,B 电极为___________ (填“正极”或“负极”);该极的电极反应是___________ 。
②甲装置中总的化学方程式是___________ 。
③丙装置在通电一段时间后,X 电极上发生的电极反应式是___________ 。
④如果乙装置中精铜电极的质量增加了 0.64g,请问甲装置中,铁电极上产生的气体在标准状况下为___________ L。
Ⅰ.2H2(g)+O2(g) =2H2O(g) ΔH1=−483.6 kJ∙mol−1
Ⅱ.N2(g)+O2(g)
 2NO(g) ΔH2=+180.5 kJ∙mol−1
2NO(g) ΔH2=+180.5 kJ∙mol−1Ⅲ.2H2(g)+2NO(g)
 N2(g)+2H2O(g)
N2(g)+2H2O(g)(1)反应Ⅲ的ΔH3=
(2)在恒温恒容的容器中发生反应Ⅲ。
①下列能够说明该反应已达到化学平衡状态的是
A.2υ逆(NO)= υ正(N2)
B.混合气体的密度不再变化
C.容器内总压强不再变化
D.混合气体的平均相对分子质量不再变化
②反应Ⅲ的平衡常数表达式为:
(3)如图所示的装置,电源为甲烷燃料电池,其电解质溶液是稀硫酸。X、Y 都是惰性电极。将电源接通后,向甲中滴入酚酞溶液,在 Fe 极附近显红色。试回答下列问题:

①在电源中,B 电极为
②甲装置中总的化学方程式是
③丙装置在通电一段时间后,X 电极上发生的电极反应式是
④如果乙装置中精铜电极的质量增加了 0.64g,请问甲装置中,铁电极上产生的气体在标准状况下为
您最近一年使用:0次
2021-05-05更新
|
116次组卷
|
2卷引用:湖北省鄂西北六校联考2020-2021学年高二下学期期中考试化学试题
3 . 煤的综合利用包括煤的干馏、气化、液化等。煤的气化用于生产各种气体燃料,有利于环境保护和提高煤的利用效率;煤的液化产品将替代目前的石油,最常见的液化方法是用煤生产 ,对优化终端能源结构具有重要的战略意义。
,对优化终端能源结构具有重要的战略意义。
(1)工业上可利用煤气化后的产物CO或 来制备清洁液体燃料甲醇。已知:800
来制备清洁液体燃料甲醇。已知:800 时
时
反应Ⅰ:
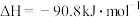
反应Ⅱ:
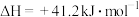
写出用 与
与 反应制备甲醇的热化学方程式:
反应制备甲醇的热化学方程式:___________ 。
①对于反应Ⅰ,在体积一定的密闭容器中按物质的量之比为1∶2充入CO和 ,测得平衡混合物中
,测得平衡混合物中 的体积分数在不同压强下随温度的变化情况如图所示。据此判断:
的体积分数在不同压强下随温度的变化情况如图所示。据此判断:
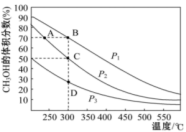
压强
___________ (填“ ”、“
”、“ ”或“
”或“ ”,下同)
”,下同) ;反应速率:
;反应速率: (状态A)
(状态A)___________  (状态B)。
(状态B)。
②对于反应Ⅱ,在体积一定的密闭容器中加入一定量的 和
和 进行反应。下列说法正确的是
进行反应。下列说法正确的是___________ 。
A.若该反应在恒容、绝热容器中进行,当容器中压强保持不变时表明反应达到平衡状态
B.该反应达到平衡时,向平衡体系中充入一定量的氦气,平衡可能发生移动
C.恒温恒容条件下,若改变反应物的投入量, 的值不发生变化
的值不发生变化
D.恒温恒容条件下,若投入气体的总量保持不变,设起始投料比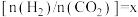 ,当
,当 或1/2时,
或1/2时, 的体积分数不变
的体积分数不变
(2)煤干馏产物焦炭常用于冶炼工业。已知反应①: ;反应②:
;反应②: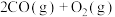
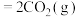 ,反应①、②的反应趋势与温度关系如图所示。
,反应①、②的反应趋势与温度关系如图所示。
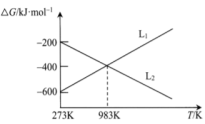
 对应反应是
对应反应是___________ ;当温度低于983K时,过量焦炭的氧化产物以为___________ 主。
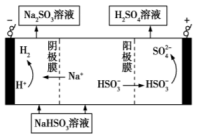
(3)燃煤烟道气常用 溶液充分吸收
溶液充分吸收 得到
得到 溶液,然后电解该溶液可制得硫酸。原理如图,写出电解时阳极的电极反应式
溶液,然后电解该溶液可制得硫酸。原理如图,写出电解时阳极的电极反应式___________ 。
 ,对优化终端能源结构具有重要的战略意义。
,对优化终端能源结构具有重要的战略意义。(1)工业上可利用煤气化后的产物CO或
 来制备清洁液体燃料甲醇。已知:800
来制备清洁液体燃料甲醇。已知:800 时
时反应Ⅰ:

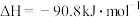
反应Ⅱ:

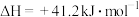
写出用
 与
与 反应制备甲醇的热化学方程式:
反应制备甲醇的热化学方程式:①对于反应Ⅰ,在体积一定的密闭容器中按物质的量之比为1∶2充入CO和
 ,测得平衡混合物中
,测得平衡混合物中 的体积分数在不同压强下随温度的变化情况如图所示。据此判断:
的体积分数在不同压强下随温度的变化情况如图所示。据此判断:
压强

 ”、“
”、“ ”或“
”或“ ”,下同)
”,下同) ;反应速率:
;反应速率: (状态A)
(状态A) (状态B)。
(状态B)。②对于反应Ⅱ,在体积一定的密闭容器中加入一定量的
 和
和 进行反应。下列说法正确的是
进行反应。下列说法正确的是A.若该反应在恒容、绝热容器中进行,当容器中压强保持不变时表明反应达到平衡状态
B.该反应达到平衡时,向平衡体系中充入一定量的氦气,平衡可能发生移动
C.恒温恒容条件下,若改变反应物的投入量,
 的值不发生变化
的值不发生变化D.恒温恒容条件下,若投入气体的总量保持不变,设起始投料比
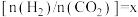 ,当
,当 或1/2时,
或1/2时, 的体积分数不变
的体积分数不变(2)煤干馏产物焦炭常用于冶炼工业。已知反应①:
 ;反应②:
;反应②: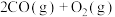
 ,反应①、②的反应趋势与温度关系如图所示。
,反应①、②的反应趋势与温度关系如图所示。
 对应反应是
对应反应是(3)燃煤烟道气常用
 溶液充分吸收
溶液充分吸收 得到
得到 溶液,然后电解该溶液可制得硫酸。原理如图,写出电解时阳极的电极反应式
溶液,然后电解该溶液可制得硫酸。原理如图,写出电解时阳极的电极反应式
您最近一年使用:0次
解题方法
4 . 目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应平衡常数(K1、K2、K3)如下表所示:
请回答下列问题:
(1)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=___________ (用K1、K2表示);
(2)根据反应③判断熵变△S___________ 0(填“>”“=”或“<”),依据反应自发进行的判据:△G=△H-T△S<0时可自发进行,判断:在___________ (填“较高”或“较低”)温度下有利于该反应自发进行。
(3)500℃下,测得反应③在某时刻时,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.15 mol·L-1、0.2 mol·L-1、0.4 mol·L-1、0.25 mol·L-1,则此时v正___________ v逆(填“>”“=”或“<”)。
(4)要提高反应③的反应速率,同时增大CH3OH(g)的产率,可采取的措施有___________ (填字母代号)。
A.扩大反应容器的容积 B.使用合适的催化剂
C.缩小反应容器的容积 D.从平衡体系中及时分离出CH3OH(g)
| 化学反应 | 平衡常数 | 平衡常数 | ||
| 500℃ | 700℃ | 800℃ | ||
| ①2H2(g)+CO(g)=CH3OH(g) △H1 | K1 | 2.5 | 0.34 | 0.15 |
| ②CO2(g)+ H2(g)=CO(g)+H2O(g) △H2 | K2 | 1.0 | 1.70 | 2.52 |
| ③CO2(g)+ 3H2(g)=CH3OH(g)+H2O(g) △H3 | K3 |
请回答下列问题:
(1)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=
(2)根据反应③判断熵变△S
(3)500℃下,测得反应③在某时刻时,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.15 mol·L-1、0.2 mol·L-1、0.4 mol·L-1、0.25 mol·L-1,则此时v正
(4)要提高反应③的反应速率,同时增大CH3OH(g)的产率,可采取的措施有
A.扩大反应容器的容积 B.使用合适的催化剂
C.缩小反应容器的容积 D.从平衡体系中及时分离出CH3OH(g)
您最近一年使用:0次
名校
5 . 化学反应伴随能量变化,获取反应能量变化有多条途径。
(1)下列反应中,属于吸热反应的是___________ (填字母)。
A.Na2O与水反应 B.甲烷的燃烧反应
C.Ba(OH)2·8H2O与氯化铵反应 D.锌与盐酸反应
(2)获取能量变化的途径
①通过化学键的键能计算。已知:
计算可得:H2(g)+Cl2(g)=2HCl(g) △H= ___________ kJ·mol-1
②通过盖斯定律可计算。已知在25℃、101 kPa时:
I.2Na(s)+ O2(g)=Na2O(s) △H=-414 kJ·mol-1
O2(g)=Na2O(s) △H=-414 kJ·mol-1
II.2Na(s)+O2(g)=Na2O2(s) △H=-511 kJ·mol-1
写出Na2O2与Na反应生成Na2O的热化学方程式:___________ 。
(3)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如下图所示。
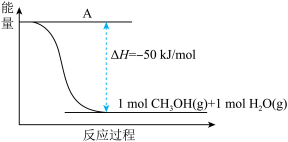
①补全上图:图中A处应填入___________ 。
②该反应需要加入铜-锌基催化剂。加入催化剂后,该反应的△H___________ (填“变大”“变小”或“不变” )。
)。
③某研究者分别以甲醇和汽油做燃料,实验测得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如图所示。
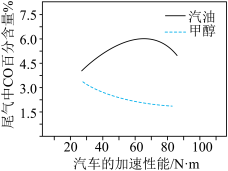
据图信息分析,与汽油相比,甲醇作为燃料的优点是___________ 。
(1)下列反应中,属于吸热反应的是
A.Na2O与水反应 B.甲烷的燃烧反应
C.Ba(OH)2·8H2O与氯化铵反应 D.锌与盐酸反应
(2)获取能量变化的途径
①通过化学键的键能计算。已知:
| 化学键种类 | H-H | Cl-Cl | H-Cl |
| 键能(kJ/mol) | 436 | 247 | 434 |
②通过盖斯定律可计算。已知在25℃、101 kPa时:
I.2Na(s)+
 O2(g)=Na2O(s) △H=-414 kJ·mol-1
O2(g)=Na2O(s) △H=-414 kJ·mol-1II.2Na(s)+O2(g)=Na2O2(s) △H=-511 kJ·mol-1
写出Na2O2与Na反应生成Na2O的热化学方程式:
(3)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如下图所示。

①补全上图:图中A处应填入
②该反应需要加入铜-锌基催化剂。加入催化剂后,该反应的△H
 )。
)。③某研究者分别以甲醇和汽油做燃料,实验测得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如图所示。

据图信息分析,与汽油相比,甲醇作为燃料的优点是
您最近一年使用:0次
2021-01-28更新
|
468次组卷
|
6卷引用:湖北省部分高中2020-2021学年高二上学期期中考试化学试题
解题方法
6 . 大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究。
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+ O3(g)=IO-(aq)+O2(g) ΔH1
②IO-(aq)+H+(aq)⇌HOI(aq) ΔH2
③HOI(aq)+I-(aq)+H+(aq)⇌I2(aq)+H2O(l) ΔH3
总反应的热化学方程式为_______ 。
(2)在溶液中存在化学平衡:I2(aq)+I-(aq)⇌I (aq),其平衡常数表达式为
(aq),其平衡常数表达式为_______ 。
(3)为探究Fe2+对O3氧化I-反应的影响(反应体系如下图1),某研究小组测定两组实验中I 浓度和体系pH,结果见下图2和下表。
浓度和体系pH,结果见下图2和下表。

①图1中的A为Fe(OH)3,由于Fe(OH)3的生成能显著提高I-的转化率,原因是_______ 。
②第1组实验中,导致反应后pH升高的原因是_______ 。
③第2组实验进行18s后,I 浓度下降。导致下降的直接原因有
浓度下降。导致下降的直接原因有_______ 。
A.c(H+)减小B.c(I-)减小C.c(Fe3+)增加D.I2(g)不断生成
(4)据图2,计算10~18 s内第2组实验中生成I 的平均反应速率
的平均反应速率_______ 。
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+ O3(g)=IO-(aq)+O2(g) ΔH1
②IO-(aq)+H+(aq)⇌HOI(aq) ΔH2
③HOI(aq)+I-(aq)+H+(aq)⇌I2(aq)+H2O(l) ΔH3
总反应的热化学方程式为
(2)在溶液中存在化学平衡:I2(aq)+I-(aq)⇌I
 (aq),其平衡常数表达式为
(aq),其平衡常数表达式为(3)为探究Fe2+对O3氧化I-反应的影响(反应体系如下图1),某研究小组测定两组实验中I
 浓度和体系pH,结果见下图2和下表。
浓度和体系pH,结果见下图2和下表。| 编号 | 反应物 | 反应前pH | 反应后pH |
| 第1组 | O3+I- | 5.2 | 11.0 |
| 第2组 | O3+I-+Fe2+ | 5.2 | 4.1 |

①图1中的A为Fe(OH)3,由于Fe(OH)3的生成能显著提高I-的转化率,原因是
②第1组实验中,导致反应后pH升高的原因是
③第2组实验进行18s后,I
 浓度下降。导致下降的直接原因有
浓度下降。导致下降的直接原因有A.c(H+)减小B.c(I-)减小C.c(Fe3+)增加D.I2(g)不断生成
(4)据图2,计算10~18 s内第2组实验中生成I
 的平均反应速率
的平均反应速率
您最近一年使用:0次
7 . 以天然气(CH4)为原料合成甲醇(CH3OH)。有关热化学方程式如下:
①2CH4(g)+O2(g) = 2CO(g)+4H2(g) ΔH1=-70.8 kJ·mol-1
②CO(g)+2H2(g)⇌CH3OH(g) ΔH2
③2CH4(g)+O2(g)⇌2CH3OH(g) ΔH3=-251.0 kJ·mol-1
(1)ΔH2=________ kJ·mol-1。 反应①自发进行的条件是_________ (填序号)。
a.高温 b. 低温 c. 任何环境都自发 d. 任何环境都不自发
(2)在体积可变的密闭容器中投入1 mol CO和2 mol H2,在不同条件下发生反应:CO(g)+2H2(g)⇌CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强的变化如图所示。
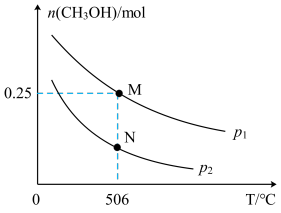
①M点时,H2的转化率为__________ ;压强:p1_______ p2 (填“>”、“<”或“=”)。
②反应速率:N点ʋ正(CO)________ M点ʋ逆(CO)(填“>”、“<”或“=”)。
③温度为506℃时,若压强为p1、在密闭容器中进行上述反应(起始投料不变),平衡时容器体积为1L,则平衡常数K=__________ (用分数表示)。在不同温度下上述反应的平衡常数的对数(lg K)如图所示,则B、C、D、E四点中能正确表示该反应的lg K与T的关系的点为_______ (填字母)。

④在2 L恒容密闭容器中充入a(a>0) mol H2、2 mol CO和6 mol CH3OH(g),在506℃下进行上述反应。为了使该反应逆向进行,a的范围为____________ 。
①2CH4(g)+O2(g) = 2CO(g)+4H2(g) ΔH1=-70.8 kJ·mol-1
②CO(g)+2H2(g)⇌CH3OH(g) ΔH2
③2CH4(g)+O2(g)⇌2CH3OH(g) ΔH3=-251.0 kJ·mol-1
(1)ΔH2=
a.高温 b. 低温 c. 任何环境都自发 d. 任何环境都不自发
(2)在体积可变的密闭容器中投入1 mol CO和2 mol H2,在不同条件下发生反应:CO(g)+2H2(g)⇌CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强的变化如图所示。

①M点时,H2的转化率为
②反应速率:N点ʋ正(CO)
③温度为506℃时,若压强为p1、在密闭容器中进行上述反应(起始投料不变),平衡时容器体积为1L,则平衡常数K=

④在2 L恒容密闭容器中充入a(a>0) mol H2、2 mol CO和6 mol CH3OH(g),在506℃下进行上述反应。为了使该反应逆向进行,a的范围为
您最近一年使用:0次
2020-12-04更新
|
168次组卷
|
2卷引用:湖北省汉川市第二中学2020-2021学年高二上学期期中考试化学试题
名校
解题方法
8 . Ⅰ.硫单质及其化合物在工农业生产中有着重要的应用。请回答下列问题:
(1)一种煤炭脱硫技术可以把硫元素以CaSO4的形式固定下来,但产生的CO又会与CaSO4发生化学反应,相关的热化学方程式如下:
①CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g) ΔH=+210.5 kJ·mol−1
CaO(s)+SO2(g)+CO2(g) ΔH=+210.5 kJ·mol−1
② CaSO4(s)+CO(g)
CaSO4(s)+CO(g)
 CaS(s)+CO2(g) ΔH=-47.3 kJ·mol−1
CaS(s)+CO2(g) ΔH=-47.3 kJ·mol−1
反应CaO(s)+3CO(g)+SO2(g) CaS(s)+3CO2(g) ΔH=
CaS(s)+3CO2(g) ΔH=_______________ kJ·mol−1
Ⅱ.根据下列化合物:①HCl ②NaOH ③NH4Cl ④CH3COONa ⑤CH3COOH ⑥NH3•H2O ⑦Na2CO3,请根据字母序号提示的物质回答下列问题。
(2)③溶液中离子浓度大小顺序为____________________________________ 。用离子方程式表示⑦溶液显碱性的原因________________________________________ 。
(3)常温下,pH=11的④的溶液中,由水电离出来的c(OH-)=____________ 。 已知常温下⑤和⑥的电离常数均为1.7×10-5 mol·L-1,则反应:CH3COOH+NH3•H2O CH3COO- +
CH3COO- + +H2O的平衡常数为
+H2O的平衡常数为______________ 。
(4)常温下,关于pH值相同的①和⑤两种溶液,下列说法不正确的是________ 。
A.两种溶液中水的电离程度相同 B.c(CH3COO-)=c(Cl-)
C.c(CH3COOH)>c(HCl) D.与等浓度的氢氧化钠溶液反应,醋酸消耗的体积少
(5)若等浓度、等体积的②NaOH和⑥NH3•H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH相等,则 m___________ n (填 “<”、“>”或“=”)。
(6)若题干中①~⑥溶液的物质的量浓度相同,则这6种溶液按pH由大到小的顺序为________ (填编号)。
(7)已知水存在如下平衡:H2O+ H2O H3O++OH-△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择方法是
H3O++OH-△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择方法是____________ 。
A. 向水中加入NaHSO4固体 B. 向水中加Na2CO3固体
C. 加热至100℃[其中c(H+) = 1×10-6 mol•L-1] D. 向水中加入 (NH4)2SO4固体
(1)一种煤炭脱硫技术可以把硫元素以CaSO4的形式固定下来,但产生的CO又会与CaSO4发生化学反应,相关的热化学方程式如下:
①CaSO4(s)+CO(g)
 CaO(s)+SO2(g)+CO2(g) ΔH=+210.5 kJ·mol−1
CaO(s)+SO2(g)+CO2(g) ΔH=+210.5 kJ·mol−1②
 CaSO4(s)+CO(g)
CaSO4(s)+CO(g)
 CaS(s)+CO2(g) ΔH=-47.3 kJ·mol−1
CaS(s)+CO2(g) ΔH=-47.3 kJ·mol−1反应CaO(s)+3CO(g)+SO2(g)
 CaS(s)+3CO2(g) ΔH=
CaS(s)+3CO2(g) ΔH=Ⅱ.根据下列化合物:①HCl ②NaOH ③NH4Cl ④CH3COONa ⑤CH3COOH ⑥NH3•H2O ⑦Na2CO3,请根据字母序号提示的物质回答下列问题。
(2)③溶液中离子浓度大小顺序为
(3)常温下,pH=11的④的溶液中,由水电离出来的c(OH-)=
 CH3COO- +
CH3COO- + +H2O的平衡常数为
+H2O的平衡常数为(4)常温下,关于pH值相同的①和⑤两种溶液,下列说法不正确的是
A.两种溶液中水的电离程度相同 B.c(CH3COO-)=c(Cl-)
C.c(CH3COOH)>c(HCl) D.与等浓度的氢氧化钠溶液反应,醋酸消耗的体积少
(5)若等浓度、等体积的②NaOH和⑥NH3•H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH相等,则 m
(6)若题干中①~⑥溶液的物质的量浓度相同,则这6种溶液按pH由大到小的顺序为
(7)已知水存在如下平衡:H2O+ H2O
 H3O++OH-△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择方法是
H3O++OH-△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择方法是A. 向水中加入NaHSO4固体 B. 向水中加Na2CO3固体
C. 加热至100℃[其中c(H+) = 1×10-6 mol•L-1] D. 向水中加入 (NH4)2SO4固体
您最近一年使用:0次
解题方法
9 . 纯过氧化氢(H2O2)是淡蓝色的黏稠液体,可任意比例与水混溶,广泛应用于医疗消毒、绿色化学合成等领域。回答下列问题:
(1)已知:H2(g)+ O2(g)=H2O(l)∆H1=-286kJ·mol-1
O2(g)=H2O(l)∆H1=-286kJ·mol-1
H2(g)+O2(g)=H2O2(l)∆H2=-188kJ·mol-1
过氧化氢分解反应2H2O2(l)=2H2O(l)+O2(g)的∆H=_____ kJ·mol-1。
(2)100℃时,在不同金属离子存在下,纯过氧化氢24h的分解率见下表:
①由上表数据可知,能使过氧化氢分解反应活化能降低最多的离子是____ 。贮运过氧化氢时,可选用的容器材质为____ (填标号)。
A.不锈钢 B.纯铝 C.黄铜 D.铸铁
②已知反应:H2O2(l)=H2O(1)+ O2(g)K=2.88×1020。纯H2O2相对稳定,原因是H2O2分解反应的
O2(g)K=2.88×1020。纯H2O2相对稳定,原因是H2O2分解反应的___ (填编号)。
A.ΔH比较小 B.K不够大 C.速率比较小 D.活化能比较大
(3)H2O2的强氧化性使其对大多数致病菌和病毒具有消杀功能。用3%医用H2O2对传染病房喷洒消毒时,地板上有气泡冒出,该气体是___ 。
(4)过氧化氢的制备方法很多,早期制备方法如下:
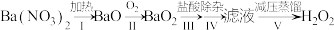
①Ⅰ为分解反应,产物除BaO、O2外,还有一种红棕色气体。该反应的化学方程式是___ 。
②Ⅱ为可逆反应,促进该反应正向进行的措施是___ (答一条即可)。
(1)已知:H2(g)+
 O2(g)=H2O(l)∆H1=-286kJ·mol-1
O2(g)=H2O(l)∆H1=-286kJ·mol-1H2(g)+O2(g)=H2O2(l)∆H2=-188kJ·mol-1
过氧化氢分解反应2H2O2(l)=2H2O(l)+O2(g)的∆H=
(2)100℃时,在不同金属离子存在下,纯过氧化氢24h的分解率见下表:
| 离子 | 加入量(mg·L-1) | 分解率% | 离子 | 加入量(mg·L-1) | 分解率% |
| 无 | 0 | 2 | Fe3+ | 1.0 | 15 |
| Al3+ | 10 | 2 | Cu2+ | 0.1 | 86 |
| Zn2+ | 10 | 10 | Cr3+ | 0.1 | 96 |
①由上表数据可知,能使过氧化氢分解反应活化能降低最多的离子是
A.不锈钢 B.纯铝 C.黄铜 D.铸铁
②已知反应:H2O2(l)=H2O(1)+
 O2(g)K=2.88×1020。纯H2O2相对稳定,原因是H2O2分解反应的
O2(g)K=2.88×1020。纯H2O2相对稳定,原因是H2O2分解反应的A.ΔH比较小 B.K不够大 C.速率比较小 D.活化能比较大
(3)H2O2的强氧化性使其对大多数致病菌和病毒具有消杀功能。用3%医用H2O2对传染病房喷洒消毒时,地板上有气泡冒出,该气体是
(4)过氧化氢的制备方法很多,早期制备方法如下:
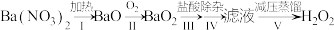
①Ⅰ为分解反应,产物除BaO、O2外,还有一种红棕色气体。该反应的化学方程式是
②Ⅱ为可逆反应,促进该反应正向进行的措施是
您最近一年使用:0次
10 . 由H、C、N、O、S等元素形成的多种化合物在生产生活中有着重要应用。
Ⅰ.化工生产中用甲烷和水蒸气反应得到以CO和H2为主的混合气体,这种混合气体可用于生产甲醇,回答下列问题:
(1)对甲烷而言,有如下两个主要反应:
①CH4(g)+ O2(g)===CO(g)+2H2(g) ΔH1=-36 kJ·mol-1
O2(g)===CO(g)+2H2(g) ΔH1=-36 kJ·mol-1
②CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH2=+216 kJ·mol-1
若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO、H2,为维持热平衡,产生1 mol CO,转移电子的数目为__________ 。
(2)甲醇催化脱氢可制得重要的化工产品——甲醛,制备过程中能量的转化关系如图所示。
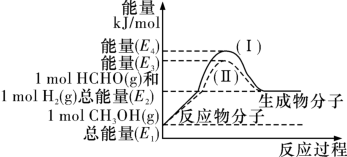
①写出上述反应的热化学方程式_______ 。
②反应热大小比较:过程Ⅰ______ (填“大于”“小于”或“等于”)过程Ⅱ。
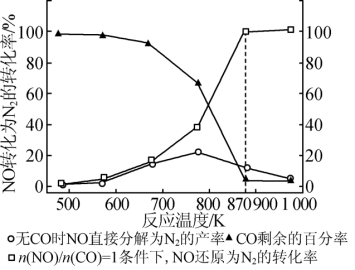
Ⅱ.(3)汽车使用乙醇汽油并不能减少NOx的排放,这使得NOx的有效消除成为环保领域的重要课题。某研究性小组在实验室以AgZSM5为催化剂,则得NO转化为N2的转化率随温度变化情况如图所示。若不使用CO,温度超过775 K,发现NO的分解率降低。其可能的原因为_______ ,在n(NO)/n(CO)=1的条件下,为更好地除去NOx物质,应控制的最佳温度在_______ K左右。
Ⅲ.研究表明,在催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
反应Ⅰ.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=-49.0 kJ·mol-1;
CH3OH(g)+H2O(g) ΔH1=-49.0 kJ·mol-1;
反应Ⅱ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1,
CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1,
(4)T1时,将1.00 mol CO2和3.00 mol H2充入体积为1.00 L的恒容密闭容器中发生反应Ⅰ,容器起始压强为p0。
①充分反应达到平衡后,若CO2的转化率为a,则容器的压强与起始压强之比为_______ (用含a的代数式表示)。
②若经过3h反应达到平衡,平衡后,混合气体的物质的量为3.00 mol,则该过程中H2的平均反应速率为___________ ;平衡常数K可用反应体系中气体物质分压表示,即用平衡分压代替平衡浓度,分压=总压×物质的量分数。则上述反应的平衡常数Kp=______ (用含p0的代数式表示)。
Ⅰ.化工生产中用甲烷和水蒸气反应得到以CO和H2为主的混合气体,这种混合气体可用于生产甲醇,回答下列问题:
(1)对甲烷而言,有如下两个主要反应:
①CH4(g)+
 O2(g)===CO(g)+2H2(g) ΔH1=-36 kJ·mol-1
O2(g)===CO(g)+2H2(g) ΔH1=-36 kJ·mol-1②CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH2=+216 kJ·mol-1
若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO、H2,为维持热平衡,产生1 mol CO,转移电子的数目为
(2)甲醇催化脱氢可制得重要的化工产品——甲醛,制备过程中能量的转化关系如图所示。

①写出上述反应的热化学方程式
②反应热大小比较:过程Ⅰ
Ⅱ.(3)汽车使用乙醇汽油并不能减少NOx的排放,这使得NOx的有效消除成为环保领域的重要课题。某研究性小组在实验室以AgZSM5为催化剂,则得NO转化为N2的转化率随温度变化情况如图所示。若不使用CO,温度超过775 K,发现NO的分解率降低。其可能的原因为

Ⅲ.研究表明,在催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
反应Ⅰ.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH1=-49.0 kJ·mol-1;
CH3OH(g)+H2O(g) ΔH1=-49.0 kJ·mol-1;反应Ⅱ.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1,
CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1,(4)T1时,将1.00 mol CO2和3.00 mol H2充入体积为1.00 L的恒容密闭容器中发生反应Ⅰ,容器起始压强为p0。
①充分反应达到平衡后,若CO2的转化率为a,则容器的压强与起始压强之比为
②若经过3h反应达到平衡,平衡后,混合气体的物质的量为3.00 mol,则该过程中H2的平均反应速率为
您最近一年使用:0次
2020-11-26更新
|
117次组卷
|
2卷引用:湖北省鄂州市部分高中联考协作体2020-2021学年高二上学期期中考试化学试题



