Ⅰ.硫单质及其化合物在工农业生产中有着重要的应用。请回答下列问题:
(1)一种煤炭脱硫技术可以把硫元素以CaSO4的形式固定下来,但产生的CO又会与CaSO4发生化学反应,相关的热化学方程式如下:
①CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g) ΔH=+210.5 kJ·mol−1
CaO(s)+SO2(g)+CO2(g) ΔH=+210.5 kJ·mol−1
② CaSO4(s)+CO(g)
CaSO4(s)+CO(g)
 CaS(s)+CO2(g) ΔH=-47.3 kJ·mol−1
CaS(s)+CO2(g) ΔH=-47.3 kJ·mol−1
反应CaO(s)+3CO(g)+SO2(g) CaS(s)+3CO2(g) ΔH=
CaS(s)+3CO2(g) ΔH=_______________ kJ·mol−1
Ⅱ.根据下列化合物:①HCl ②NaOH ③NH4Cl ④CH3COONa ⑤CH3COOH ⑥NH3•H2O ⑦Na2CO3,请根据字母序号提示的物质回答下列问题。
(2)③溶液中离子浓度大小顺序为____________________________________ 。用离子方程式表示⑦溶液显碱性的原因________________________________________ 。
(3)常温下,pH=11的④的溶液中,由水电离出来的c(OH-)=____________ 。 已知常温下⑤和⑥的电离常数均为1.7×10-5 mol·L-1,则反应:CH3COOH+NH3•H2O CH3COO- +
CH3COO- + +H2O的平衡常数为
+H2O的平衡常数为______________ 。
(4)常温下,关于pH值相同的①和⑤两种溶液,下列说法不正确的是________ 。
A.两种溶液中水的电离程度相同 B.c(CH3COO-)=c(Cl-)
C.c(CH3COOH)>c(HCl) D.与等浓度的氢氧化钠溶液反应,醋酸消耗的体积少
(5)若等浓度、等体积的②NaOH和⑥NH3•H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH相等,则 m___________ n (填 “<”、“>”或“=”)。
(6)若题干中①~⑥溶液的物质的量浓度相同,则这6种溶液按pH由大到小的顺序为________ (填编号)。
(7)已知水存在如下平衡:H2O+ H2O H3O++OH-△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择方法是
H3O++OH-△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择方法是____________ 。
A. 向水中加入NaHSO4固体 B. 向水中加Na2CO3固体
C. 加热至100℃[其中c(H+) = 1×10-6 mol•L-1] D. 向水中加入 (NH4)2SO4固体
(1)一种煤炭脱硫技术可以把硫元素以CaSO4的形式固定下来,但产生的CO又会与CaSO4发生化学反应,相关的热化学方程式如下:
①CaSO4(s)+CO(g)
 CaO(s)+SO2(g)+CO2(g) ΔH=+210.5 kJ·mol−1
CaO(s)+SO2(g)+CO2(g) ΔH=+210.5 kJ·mol−1②
 CaSO4(s)+CO(g)
CaSO4(s)+CO(g)
 CaS(s)+CO2(g) ΔH=-47.3 kJ·mol−1
CaS(s)+CO2(g) ΔH=-47.3 kJ·mol−1反应CaO(s)+3CO(g)+SO2(g)
 CaS(s)+3CO2(g) ΔH=
CaS(s)+3CO2(g) ΔH=Ⅱ.根据下列化合物:①HCl ②NaOH ③NH4Cl ④CH3COONa ⑤CH3COOH ⑥NH3•H2O ⑦Na2CO3,请根据字母序号提示的物质回答下列问题。
(2)③溶液中离子浓度大小顺序为
(3)常温下,pH=11的④的溶液中,由水电离出来的c(OH-)=
 CH3COO- +
CH3COO- + +H2O的平衡常数为
+H2O的平衡常数为(4)常温下,关于pH值相同的①和⑤两种溶液,下列说法不正确的是
A.两种溶液中水的电离程度相同 B.c(CH3COO-)=c(Cl-)
C.c(CH3COOH)>c(HCl) D.与等浓度的氢氧化钠溶液反应,醋酸消耗的体积少
(5)若等浓度、等体积的②NaOH和⑥NH3•H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH相等,则 m
(6)若题干中①~⑥溶液的物质的量浓度相同,则这6种溶液按pH由大到小的顺序为
(7)已知水存在如下平衡:H2O+ H2O
 H3O++OH-△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择方法是
H3O++OH-△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择方法是A. 向水中加入NaHSO4固体 B. 向水中加Na2CO3固体
C. 加热至100℃[其中c(H+) = 1×10-6 mol•L-1] D. 向水中加入 (NH4)2SO4固体
更新时间:2020-12-02 15:00:48
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】由化学能产生的能量是目前人类使用的主要能源。请回答下列问题:
(1)如图所示:反应2H2+O2 2H2O的能量变化。
2H2O的能量变化。

①已知拆开1molH—H、1moLO=O和1molH—O中的化学键分别需要消耗436kJ、496kJ和463kJ的能量。则反应过程(Ⅱ)____ (填“吸收”或“放出”)____ kJ。
②已知:Ⅰ.CO(g)+2H2(g)=CH3OH(l)△H=-128.6kJ/mol
Ⅱ.2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
Ⅲ.2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol
写出CH3OH燃烧热的热化学方程式:____ 。
(2)用如图所示的装置进行中和热的测定实验,分别取50mL0.55mol/L的NaOH溶液、50mL0.25mol/L的硫酸进行实验,回答下列问题:
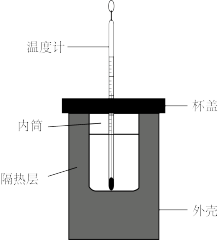
①从图实验装置看,其中尚缺少的一种玻璃用品是___ 。
②若改用60mL0.25mol/L的H2SO4和50mL0.55mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量____ (填“相等”或“不相等”)。所求得的中和热____ (填“相等”或“不相等”)。
(1)如图所示:反应2H2+O2
 2H2O的能量变化。
2H2O的能量变化。
①已知拆开1molH—H、1moLO=O和1molH—O中的化学键分别需要消耗436kJ、496kJ和463kJ的能量。则反应过程(Ⅱ)
②已知:Ⅰ.CO(g)+2H2(g)=CH3OH(l)△H=-128.6kJ/mol
Ⅱ.2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
Ⅲ.2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol
写出CH3OH燃烧热的热化学方程式:
(2)用如图所示的装置进行中和热的测定实验,分别取50mL0.55mol/L的NaOH溶液、50mL0.25mol/L的硫酸进行实验,回答下列问题:

①从图实验装置看,其中尚缺少的一种玻璃用品是
②若改用60mL0.25mol/L的H2SO4和50mL0.55mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】CO和H2均是重要的化工原料,CO2的固定和利用对环境保护及能源开发具有重要的意义。
(1)利用水煤气(CO+H2)作为合成气,在同一容器中,选择双催化剂,经过如下三步反应,最终合成二甲醚(CH3OCH3)。
甲醇合成反应:CO(g)+2H2(g) CH3OH(g) △H1=-90.8kJ·mol-1
CH3OH(g) △H1=-90.8kJ·mol-1
水煤气变换反应:CO(g)+H2O(g) CO2(g)+H2(g) △H2=-41.3kJ·mol-1
CO2(g)+H2(g) △H2=-41.3kJ·mol-1
甲醇脱水反应:2CH3OH(g) CH3OCH3(g)+H2O(g) △H3=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g) △H3=-23.5kJ·mol-1
写出由CO和H2合成二甲醚气体和水蒸气的热化学方程式____________ 。
(2)在2L恒容密闭容器中,投入CO(g)和H2(g)各5mol,发生如下反应:
3CO(g)+3H2(g) CH3OCH3(g)+CO2(g) △H<0,CO的转化率α与温度、压强的关系如图所示:
CH3OCH3(g)+CO2(g) △H<0,CO的转化率α与温度、压强的关系如图所示:
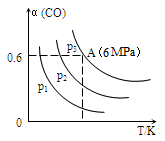
①p1、p2、p3中最大的是________ 。
②若该反应进行50min时达到平衡,此时CO的转化率α=0.6,则50min内H2的反应速率为____ mol·L-1·min-1。
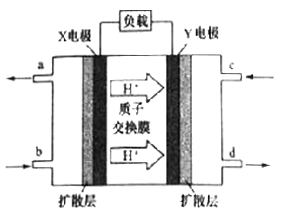
(3)二甲醚(CH3OCH3)燃料电池具有启动快。效率高等优点,其能量密度高于甲醇燃料电池。其工作原理如图所示。X极附近的酸性______ (填“减弱”、“增强”或“不变”),Y电极是_____ 极,写出X电极上发生的电极反应式__________ 。若用该二甲醚燃料电池电解饱和食盐水(阳极为石墨电极),当有2.3g燃料被消耗时,阴极产生气体的体积为_____ L(标准状况下)
(1)利用水煤气(CO+H2)作为合成气,在同一容器中,选择双催化剂,经过如下三步反应,最终合成二甲醚(CH3OCH3)。
甲醇合成反应:CO(g)+2H2(g)
 CH3OH(g) △H1=-90.8kJ·mol-1
CH3OH(g) △H1=-90.8kJ·mol-1水煤气变换反应:CO(g)+H2O(g)
 CO2(g)+H2(g) △H2=-41.3kJ·mol-1
CO2(g)+H2(g) △H2=-41.3kJ·mol-1甲醇脱水反应:2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H3=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g) △H3=-23.5kJ·mol-1写出由CO和H2合成二甲醚气体和水蒸气的热化学方程式
(2)在2L恒容密闭容器中,投入CO(g)和H2(g)各5mol,发生如下反应:
3CO(g)+3H2(g)
 CH3OCH3(g)+CO2(g) △H<0,CO的转化率α与温度、压强的关系如图所示:
CH3OCH3(g)+CO2(g) △H<0,CO的转化率α与温度、压强的关系如图所示:
①p1、p2、p3中最大的是
②若该反应进行50min时达到平衡,此时CO的转化率α=0.6,则50min内H2的反应速率为
(3)二甲醚(CH3OCH3)燃料电池具有启动快。效率高等优点,其能量密度高于甲醇燃料电池。其工作原理如图所示。X极附近的酸性

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】甲醇是应用广泛的化工原料和前景乐观的无色液体燃料。请按要求回答下列问题。
(1)已知25℃、101 kpa时一些物质的燃烧热如下表:
写出由CO和H2反应生成CH3OH(l)的热化学方程式: _________________________ 。
(2)一定温度下,在容积为2L的恒容密闭容器中进行反应:CO(g)+2H2(g)=CH3OH(g),其相关数据如图所示。
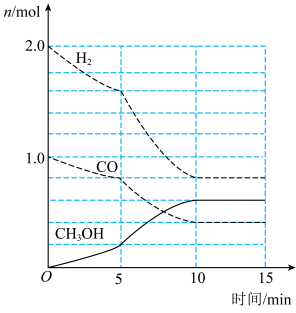
①从反应开始至5min时,用CH3OH表示的反应平均速度为____________ 。
②图中反应达平衡时,K=_______ (mol/L)-2;CO的平衡转化率为________________ 。
(3)人们利用甲醇制得能量转化率高、对环境无污染的燃料电池,其工作原理如图所示,该装置工作时,a极反应式为____________________ 。
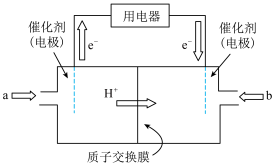
若用该电池及惰性电极电解2L饱和食盐水产生224mL(标准误差2)Cl2时(假设全部句逸出并收集,忽略溶液体积的变化),常温下所得溶液的pH为________ 。
(4)甲醇在一定条件下可转化为甲酸。常温下,向0.1mol/L HCOOH溶液中滴加0.1mol/LNaOH溶液至pH=7[已知,K(HCOOH)=1.8×10-4]。此时混合溶液中两溶质的物质的量之比n(HCOOH):n(HCOONa)____________ 。
(1)已知25℃、101 kpa时一些物质的燃烧热如下表:
| 物质 | CH3OH(l) | CO(g) | H2(g) |
| 燃烧热/(kJ/mol) | 726.8 | 283.0 | 285.8 |
(2)一定温度下,在容积为2L的恒容密闭容器中进行反应:CO(g)+2H2(g)=CH3OH(g),其相关数据如图所示。

①从反应开始至5min时,用CH3OH表示的反应平均速度为
②图中反应达平衡时,K=
(3)人们利用甲醇制得能量转化率高、对环境无污染的燃料电池,其工作原理如图所示,该装置工作时,a极反应式为

若用该电池及惰性电极电解2L饱和食盐水产生224mL(标准误差2)Cl2时(假设全部句逸出并收集,忽略溶液体积的变化),常温下所得溶液的pH为
(4)甲醇在一定条件下可转化为甲酸。常温下,向0.1mol/L HCOOH溶液中滴加0.1mol/LNaOH溶液至pH=7[已知,K(HCOOH)=1.8×10-4]。此时混合溶液中两溶质的物质的量之比n(HCOOH):n(HCOONa)
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】氮化铬(CrN)是一种良好的耐磨材料,实验室可用如下装置进行模拟制备(省略夹持装置):

Ⅰ.完成下列填空:
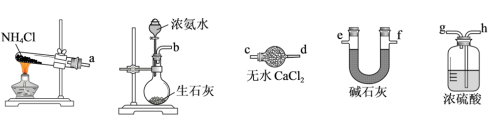
(1)干燥的NH3可选用以下装置制得,相应的连接顺序可以是_______→_______→_______(选填端口字母编号)。_______
Ⅱ.固体X可用无水氯化铬(CrCl3)固体,主要反应为NH3+CrCl3 CrN+3HCl。
CrN+3HCl。
(2)无水氯化铬具有很强的吸水性,通常形成晶体CrCl3·6H2O。直接加热脱水往往得到Cr2O3,有关反应的化学方程式为_______ 。以氯化铬晶体制备无水氯化铬的方法是_______ 。
(3)实际进行实验时,发现上述装置存在一个缺陷,会导致危险,请简要说明。_______
Ⅲ.固体X也可用Cr2O3固体。通入NH3时先将氧化物还原为金属单质,然后金属单质与另一产物化合得到CrN,这些过程几乎同时进行。
(4)写出NH3与Cr2O3发生氧化还原反应的化学方程式:_______ 。
(5)CrN产品中含有Cr2N杂质,可利用如下方法进行纯度测定:取样品14.380g在空气中充分加热至反应完全,剩余固体全为Cr2O3,质量为16.720g。样品中CrN与Cr2N的物质的量之比为_______ 。
(6)证明样品已反应完全的操作名称是_______ ;若加热时长不足,则最终测定CrN的纯度将_______ (选填“偏大”“偏小”或“不变”)。

Ⅰ.完成下列填空:
(1)干燥的NH3可选用以下装置制得,相应的连接顺序可以是_______→_______→_______(选填端口字母编号)。

Ⅱ.固体X可用无水氯化铬(CrCl3)固体,主要反应为NH3+CrCl3
 CrN+3HCl。
CrN+3HCl。(2)无水氯化铬具有很强的吸水性,通常形成晶体CrCl3·6H2O。直接加热脱水往往得到Cr2O3,有关反应的化学方程式为
(3)实际进行实验时,发现上述装置存在一个缺陷,会导致危险,请简要说明。
Ⅲ.固体X也可用Cr2O3固体。通入NH3时先将氧化物还原为金属单质,然后金属单质与另一产物化合得到CrN,这些过程几乎同时进行。
(4)写出NH3与Cr2O3发生氧化还原反应的化学方程式:
(5)CrN产品中含有Cr2N杂质,可利用如下方法进行纯度测定:取样品14.380g在空气中充分加热至反应完全,剩余固体全为Cr2O3,质量为16.720g。样品中CrN与Cr2N的物质的量之比为
(6)证明样品已反应完全的操作名称是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】回答下列问题
(1)已知25℃时有关弱酸的电离平衡常数:
①同温度下,等pH值的下列溶液,物质的量浓度由大到小的顺序为_______ (填序号)。
a. b.
b. c.
c.
②25℃时将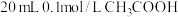 溶液和
溶液和 溶液分别与
溶液分别与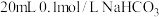 溶液混合。
溶液混合。
a.请将产生的气体体积随时间的变化关系表示在坐标中_______ (做好必要的标注)

b.反应结束后所得两溶液中,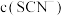
_______ 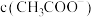 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
③向 溶液中通入少量
溶液中通入少量 气体,反应的离子方程式为
气体,反应的离子方程式为_______ 。
(2)煤燃烧的烟气也含氮氧化物,用 催化还原
催化还原 可以消除氮氧化物的污染。
可以消除氮氧化物的污染。
已知:
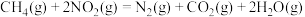




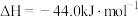
在常温下, 催化还原
催化还原 的热化学方程式
的热化学方程式_______
(3)电池可以提升能量利用率。下图是利用甲烷燃料电池电解 的氯化铜溶液的装置示意图,请回答下列问题:
的氯化铜溶液的装置示意图,请回答下列问题:
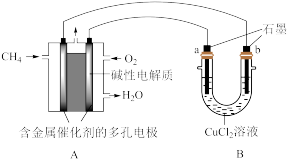
①甲烷燃料电池的负极反应式是_______ ;
②当A中消耗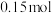 氧气时,B中
氧气时,B中_______ 极增重_______ g。
(1)已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 |  |  |  |  |
| 电离平衡常数 | 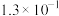 |  |  |   |
a.
 b.
b. c.
c.
②25℃时将
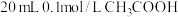 溶液和
溶液和 溶液分别与
溶液分别与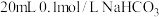 溶液混合。
溶液混合。a.请将产生的气体体积随时间的变化关系表示在坐标中

b.反应结束后所得两溶液中,
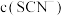
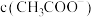 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)③向
 溶液中通入少量
溶液中通入少量 气体,反应的离子方程式为
气体,反应的离子方程式为(2)煤燃烧的烟气也含氮氧化物,用
 催化还原
催化还原 可以消除氮氧化物的污染。
可以消除氮氧化物的污染。已知:
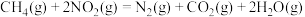




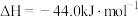
在常温下,
 催化还原
催化还原 的热化学方程式
的热化学方程式(3)电池可以提升能量利用率。下图是利用甲烷燃料电池电解
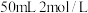 的氯化铜溶液的装置示意图,请回答下列问题:
的氯化铜溶液的装置示意图,请回答下列问题:
①甲烷燃料电池的负极反应式是
②当A中消耗
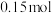 氧气时,B中
氧气时,B中
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】回答下列问题:
(1)常温下0.1mol•L-1NaA溶液的pH=8。则溶液中由水电离出的氢氧根离子浓度_____ (填“>”、“<”或“=”)10-7mol•L-1。HA在水溶液中的电离方程式为______ 。
(2)已知氢氟酸、次氯酸、碳酸在室温下的电离常数分别为:
根据上述数据,回答下列问题:
①比较同浓度的NaF、NaClO溶液的pH值大小:NaF_____ NaClO。
②少量的CO2通入NaClO溶液中,写出反应的离子方程式_____ 。
(3)用标准NaOH溶液对测定白醋中醋酸的浓度,完全反应时所得溶液的pH大致为9。
①该实验应选用_____ 作指示剂:判断酸碱中和滴定反应到达滴定终点时的现象为_____ 。
②一共进行了三次实验,每次所取白醋体积均为VmL,每次消耗cmol•L-1NaOH标准液如表:
从表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是_____ 。
A.实验结束时,俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前碱式滴定管尖嘴有气泡,滴定结束尖嘴部分充满溶液
C.盛装白醋溶液的滴定管用蒸馏水洗过,未用白醋溶液润洗
D.锥形瓶预先用食用白醋润洗过
E.滴加NaOH溶液时,未充分振荡,刚看到溶液变色,立刻停止滴定
③根据实验结果计算,该醋酸溶液的浓度为______ mol•L-1。
(1)常温下0.1mol•L-1NaA溶液的pH=8。则溶液中由水电离出的氢氧根离子浓度
(2)已知氢氟酸、次氯酸、碳酸在室温下的电离常数分别为:
| HF | Ka=6.8×10-4mol•L-1 |
| HClO | Ka=2.9×10-8mol•L-1 |
| H2CO3 | Ka1=4.4×10-7mol•L-1 Ka2=6.7×10-11mol•L-1 |
①比较同浓度的NaF、NaClO溶液的pH值大小:NaF
②少量的CO2通入NaClO溶液中,写出反应的离子方程式
(3)用标准NaOH溶液对测定白醋中醋酸的浓度,完全反应时所得溶液的pH大致为9。
①该实验应选用
②一共进行了三次实验,每次所取白醋体积均为VmL,每次消耗cmol•L-1NaOH标准液如表:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.05 | 24.95 |
A.实验结束时,俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前碱式滴定管尖嘴有气泡,滴定结束尖嘴部分充满溶液
C.盛装白醋溶液的滴定管用蒸馏水洗过,未用白醋溶液润洗
D.锥形瓶预先用食用白醋润洗过
E.滴加NaOH溶液时,未充分振荡,刚看到溶液变色,立刻停止滴定
③根据实验结果计算,该醋酸溶液的浓度为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
真题
解题方法
【推荐1】北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g)= CH4(g)+HC≡CH(g)+H2(g)△H1=156.6kJ·mol-1
CH3CH=CH2(g)= CH4(g)+HC≡CH(g)△H2=32.4kJ·mol-1
则相同条件下,反应C3H8(g)= CH3CH=CH2(g)+H2(g)的△H=_____ kJ·mol-1。
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为___________ ;放电时,CO32-移向电池的_______ (填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的平衡常数K1=
HCO3-+H+的平衡常数K1=_____________ 。(已知:10-5.60=2.5×10-6)
(4)常温下,0.1mol/L的NaHCO3溶液的pH大于8,则溶液c(H2CO3)______ c(CO32-)(填“>”、“=”或“<”),原因是_______________________ (用离子方程式和必要的文字说明)。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g)= CH4(g)+HC≡CH(g)+H2(g)△H1=156.6kJ·mol-1
CH3CH=CH2(g)= CH4(g)+HC≡CH(g)△H2=32.4kJ·mol-1
则相同条件下,反应C3H8(g)= CH3CH=CH2(g)+H2(g)的△H=
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3
 HCO3-+H+的平衡常数K1=
HCO3-+H+的平衡常数K1=(4)常温下,0.1mol/L的NaHCO3溶液的pH大于8,则溶液c(H2CO3)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】回答下列问题:。
(1)T℃时,水的离子积常数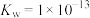 ,此时,纯水的pH=
,此时,纯水的pH=_______ ,该温度下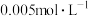 的
的 溶液的pH为
溶液的pH为_______ 。
(2)将 溶液蒸干并灼烧,所得固体的化学式为
溶液蒸干并灼烧,所得固体的化学式为_______ 。
(3)热的纯碱能够去油污的原理(用离子方程式表示)_______ 。
(4)加水稀释 溶液,溶液中
溶液,溶液中 将
将_______ (填“增大”、“减小”或“不变”,下同),加水稀释 溶液,溶液中
溶液,溶液中 将
将_______ 。
(5)常温下,向0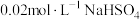 溶液中逐滴加入
溶液中逐滴加入 溶液至
溶液至 恰好完全沉淀,此时溶液的pH=
恰好完全沉淀,此时溶液的pH=_______ 。
(6)已知 的
的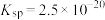 ,现有
,现有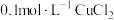 溶液,调节pH使铜离子恰好完全沉淀,此时溶液中的
溶液,调节pH使铜离子恰好完全沉淀,此时溶液中的 为
为_______  。
。
(7)已知HCN的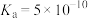 ,将
,将 的HCN溶液与
的HCN溶液与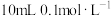 的NaOH溶液混合,所得溶液中的离子浓度由大到小的顺序为
的NaOH溶液混合,所得溶液中的离子浓度由大到小的顺序为_______ 。
(1)T℃时,水的离子积常数
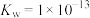 ,此时,纯水的pH=
,此时,纯水的pH=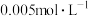 的
的 溶液的pH为
溶液的pH为(2)将
 溶液蒸干并灼烧,所得固体的化学式为
溶液蒸干并灼烧,所得固体的化学式为(3)热的纯碱能够去油污的原理(用离子方程式表示)
(4)加水稀释
 溶液,溶液中
溶液,溶液中 将
将 溶液,溶液中
溶液,溶液中 将
将(5)常温下,向0
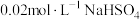 溶液中逐滴加入
溶液中逐滴加入 溶液至
溶液至 恰好完全沉淀,此时溶液的pH=
恰好完全沉淀,此时溶液的pH=(6)已知
 的
的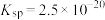 ,现有
,现有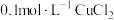 溶液,调节pH使铜离子恰好完全沉淀,此时溶液中的
溶液,调节pH使铜离子恰好完全沉淀,此时溶液中的 为
为 。
。(7)已知HCN的
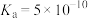 ,将
,将 的HCN溶液与
的HCN溶液与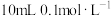 的NaOH溶液混合,所得溶液中的离子浓度由大到小的顺序为
的NaOH溶液混合,所得溶液中的离子浓度由大到小的顺序为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】某兴趣小组借助数字化实验仪器完成了两组实验,分别为酸碱中和滴定、沉淀滴定,通过传感器反馈的数据绘制图像。
[实验1]室温下,取 溶液于洁净的烧杯中,将烧杯放在磁力搅拌器上,加入磁子,将
溶液于洁净的烧杯中,将烧杯放在磁力搅拌器上,加入磁子,将 传感器连接到采集器上,传感器插入液面以下,接通电源,向
传感器连接到采集器上,传感器插入液面以下,接通电源,向 溶液中滴加
溶液中滴加 溶液并不断搅拌,随
溶液并不断搅拌,随 溶液的加入绘制
溶液的加入绘制 变化曲线如图1所示。
变化曲线如图1所示。
[实验2]与实验1类似,向 溶液中滴加
溶液中滴加 溶液,设置纵坐标为氯离子浓度的负对数,随
溶液,设置纵坐标为氯离子浓度的负对数,随 溶液的加入绘制变化曲线如图2所示。
溶液的加入绘制变化曲线如图2所示。

请回答下列问题:
(1)室温下由图1知,A点溶液 ,此时由水电离出的氢离子浓度为
,此时由水电离出的氢离子浓度为______  ;
; 的电离平衡常数Ka=
的电离平衡常数Ka=______  。
。
(2)分析B点溶液中离子浓度由大到小的顺序是______ 。
(3)C点溶液 ,该点
,该点______ (填“是”或“否”)达到滴定终点;D点加入 溶液
溶液 ,酸碱恰好完全反应,而图像显示
,酸碱恰好完全反应,而图像显示 ,请说明原因:
,请说明原因:______ (用离子方程式表示)。
(4)图2中,根据曲线数据计算可知:Ksp(AgCl)数量级为______ 。
(5)加入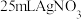 溶液后,继续滴加
溶液后,继续滴加 溶液,分析氯离子浓度变化的原因:
溶液,分析氯离子浓度变化的原因:______ 。
(6)实验室测定 溶液浓度过程中,用碱式滴定管量取一定体积的
溶液浓度过程中,用碱式滴定管量取一定体积的 溶液,注入锥形瓶中,滴加几滴酚酞溶液,用酸式滴定管向其中滴加盐酸,并不断摇动锥形瓶。当看到溶液颜色变浅时放慢滴加速度,直到滴入半滴盐酸后变成无色时停止滴加盐酸。其中“滴入半滴盐酸”的具体操作是
溶液,注入锥形瓶中,滴加几滴酚酞溶液,用酸式滴定管向其中滴加盐酸,并不断摇动锥形瓶。当看到溶液颜色变浅时放慢滴加速度,直到滴入半滴盐酸后变成无色时停止滴加盐酸。其中“滴入半滴盐酸”的具体操作是______ 。
[实验1]室温下,取
 溶液于洁净的烧杯中,将烧杯放在磁力搅拌器上,加入磁子,将
溶液于洁净的烧杯中,将烧杯放在磁力搅拌器上,加入磁子,将 传感器连接到采集器上,传感器插入液面以下,接通电源,向
传感器连接到采集器上,传感器插入液面以下,接通电源,向 溶液中滴加
溶液中滴加 溶液并不断搅拌,随
溶液并不断搅拌,随 溶液的加入绘制
溶液的加入绘制 变化曲线如图1所示。
变化曲线如图1所示。[实验2]与实验1类似,向
 溶液中滴加
溶液中滴加 溶液,设置纵坐标为氯离子浓度的负对数,随
溶液,设置纵坐标为氯离子浓度的负对数,随 溶液的加入绘制变化曲线如图2所示。
溶液的加入绘制变化曲线如图2所示。
请回答下列问题:
(1)室温下由图1知,A点溶液
 ,此时由水电离出的氢离子浓度为
,此时由水电离出的氢离子浓度为 ;
; 的电离平衡常数Ka=
的电离平衡常数Ka= 。
。(2)分析B点溶液中离子浓度由大到小的顺序是
(3)C点溶液
 ,该点
,该点 溶液
溶液 ,酸碱恰好完全反应,而图像显示
,酸碱恰好完全反应,而图像显示 ,请说明原因:
,请说明原因:(4)图2中,根据曲线数据计算可知:Ksp(AgCl)数量级为
(5)加入
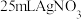 溶液后,继续滴加
溶液后,继续滴加 溶液,分析氯离子浓度变化的原因:
溶液,分析氯离子浓度变化的原因:(6)实验室测定
 溶液浓度过程中,用碱式滴定管量取一定体积的
溶液浓度过程中,用碱式滴定管量取一定体积的 溶液,注入锥形瓶中,滴加几滴酚酞溶液,用酸式滴定管向其中滴加盐酸,并不断摇动锥形瓶。当看到溶液颜色变浅时放慢滴加速度,直到滴入半滴盐酸后变成无色时停止滴加盐酸。其中“滴入半滴盐酸”的具体操作是
溶液,注入锥形瓶中,滴加几滴酚酞溶液,用酸式滴定管向其中滴加盐酸,并不断摇动锥形瓶。当看到溶液颜色变浅时放慢滴加速度,直到滴入半滴盐酸后变成无色时停止滴加盐酸。其中“滴入半滴盐酸”的具体操作是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】磷酸二氢钾(KH2PO4)是一种大型非线性光学晶体。以氯磷灰石(主要成分为Ca5(PO4)3Cl,还含有少量Al2O3、Fe2O3等杂质)为原料制备KH2PO4的一种工艺流程如图所示:

已知:①Ksp[Fe(OH)3]=1.0×10-38
②Ca3(PO4)2与CaHPO4均难溶于水,Ca(H2PO4)2易溶于水。
(1)“酸浸”时发生的化学反应为Ca5(PO4)3Cl+5H2SO4(浓)=5CaSO4+3H3PO4+HCl↑,该反应体现了浓硫酸的___________ 性和___________ 性。可提高酸浸反应速率的措施有___________ 。(写其中一条即可)
(2)滤渣的成分为___________ 和CaSO4,若c(离子)<1.0×10-5mol∙L-1时表明沉淀完全,计算Fe3+完全沉淀时的pH>___________ 。
(3)常温下磷酸的电离平衡常数Ka1=7.1×10-3、Ka2=6.3×10-8、Ka3=4.4×10-13,H2CO3的电离常数Ka1=4.3×10-7、Ka2=4.7×10-11,则常温下KH2PO4水溶液显___________ (填“酸性”“碱性”或“中性”),若将磷酸滴入碳酸钠溶液中,反应的离子方程式有错误的是___________ 。
A.H3PO4+ =
= +
+ B.2H3PO4+
B.2H3PO4+ =CO2↑+2
=CO2↑+2 +H2O
+H2O
C.H3PO4+2 =2
=2 +
+ D.H3PO4+3
D.H3PO4+3 =3
=3 +
+
(4)以熔融碳酸钠燃料电池(图1)为电源,KH2PO4可通过图2装置电解制备:


①燃料电池(图1)中电极A上H2参与的电极反应式为___________ 。
②电解池中若通电前a、b两室溶液的质量相等,若有2NA个K+通过交换膜,则两室溶液的质量差为___________ g。

已知:①Ksp[Fe(OH)3]=1.0×10-38
②Ca3(PO4)2与CaHPO4均难溶于水,Ca(H2PO4)2易溶于水。
(1)“酸浸”时发生的化学反应为Ca5(PO4)3Cl+5H2SO4(浓)=5CaSO4+3H3PO4+HCl↑,该反应体现了浓硫酸的
(2)滤渣的成分为
(3)常温下磷酸的电离平衡常数Ka1=7.1×10-3、Ka2=6.3×10-8、Ka3=4.4×10-13,H2CO3的电离常数Ka1=4.3×10-7、Ka2=4.7×10-11,则常温下KH2PO4水溶液显
A.H3PO4+
 =
= +
+ B.2H3PO4+
B.2H3PO4+ =CO2↑+2
=CO2↑+2 +H2O
+H2OC.H3PO4+2
 =2
=2 +
+ D.H3PO4+3
D.H3PO4+3 =3
=3 +
+
(4)以熔融碳酸钠燃料电池(图1)为电源,KH2PO4可通过图2装置电解制备:


①燃料电池(图1)中电极A上H2参与的电极反应式为
②电解池中若通电前a、b两室溶液的质量相等,若有2NA个K+通过交换膜,则两室溶液的质量差为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】火法有色金属冶炼烟气制酸过程中会产生大量含砷污酸,采用硫化一石膏中和法处理含砷污酸可获得达标废水,同时变废为宝,能得到多级产品,工艺流程如下:
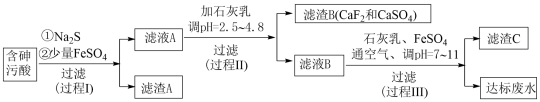
资料:
i .常温下H2CO3的Ka1=4.4×10-7,Ka2=4.7×10-11;H2S的Ka1=1.3×10-7,Ka2=7.1×10-15
ii .含砷污酸中砷的主要存在形式为亚砷酸(H3AsO3,弱酸),除砷外H+、Cu2+、F -、 含量均超标;
含量均超标;
iii.室温下三价砷在水溶液中的主要存在形式与溶液pH的关系如下表:
(1)基态砷原子价层电子排布式为 _____________ 。 过程 I可除去含砷污酸中的Cu2+和部分砷,滤渣A的主要成分为CuS和As2S3,生成As2S3的离子方程式是 __________________ 。
(2)过程I会发生副反应As2S3(s)+3S2-(aq)
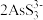 (aq) ,影响后续处理。为此在加入Na2S充分反应要后加入少量FeSO4。请结合平衡移动原理解释加入FeSO4的原因:
(aq) ,影响后续处理。为此在加入Na2S充分反应要后加入少量FeSO4。请结合平衡移动原理解释加入FeSO4的原因:_______ ,  的空间构型为
的空间构型为__________ 。
(3)工业上制备Na2S时,只能用NaOH溶液吸收H2S,而不能以纯碱代替NaOH,原因是___________ 。
(4)过程III中获得的滤渣C主要成分是FeAsO4,该过程中通入空气的作用是__________________ 。
(5)利用反应H3AsO4+2I-+2H+=H3AsO3+I2+H2O可测定滤渣C中FeAsO4含量。取a g样品,用硫酸溶液溶解并调节pH在4.6以上,过滤沉淀,向滤液中加入过量KI,充分反应后将溶液转移至锥形瓶中,以淀粉为指示剂,用c mol·L-1的Na2S2O3标准溶液滴定,可以判断已达到滴定终点的现象是__________ 。 重复三次实验,平均用去Na2S2O3溶液体积为VmL,则滤渣C中FeAsO4的质量分数为____ %(要求用 a、c、V等字母及数字的代数式表示。已知:2 Na2S2O3+I2=Na2S4O6+2NaI;FeAsO4的式量为195。)。

资料:
i .常温下H2CO3的Ka1=4.4×10-7,Ka2=4.7×10-11;H2S的Ka1=1.3×10-7,Ka2=7.1×10-15
ii .含砷污酸中砷的主要存在形式为亚砷酸(H3AsO3,弱酸),除砷外H+、Cu2+、F -、
 含量均超标;
含量均超标;iii.室温下三价砷在水溶液中的主要存在形式与溶液pH的关系如下表:
主要存在形式 | H3AsO3 |
|
pH值 | pH<7 | pH=10~11 |
(2)过程I会发生副反应As2S3(s)+3S2-(aq)

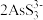 (aq) ,影响后续处理。为此在加入Na2S充分反应要后加入少量FeSO4。请结合平衡移动原理解释加入FeSO4的原因:
(aq) ,影响后续处理。为此在加入Na2S充分反应要后加入少量FeSO4。请结合平衡移动原理解释加入FeSO4的原因: 的空间构型为
的空间构型为(3)工业上制备Na2S时,只能用NaOH溶液吸收H2S,而不能以纯碱代替NaOH,原因是
(4)过程III中获得的滤渣C主要成分是FeAsO4,该过程中通入空气的作用是
(5)利用反应H3AsO4+2I-+2H+=H3AsO3+I2+H2O可测定滤渣C中FeAsO4含量。取a g样品,用硫酸溶液溶解并调节pH在4.6以上,过滤沉淀,向滤液中加入过量KI,充分反应后将溶液转移至锥形瓶中,以淀粉为指示剂,用c mol·L-1的Na2S2O3标准溶液滴定,可以判断已达到滴定终点的现象是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】研究电解质在水溶液中的平衡能了解它的存在形式。
(1)已知部分弱酸的电离常数如下表:
①常温下,pH相同的三种溶液NaF、Na2CO3、Na2S,物质的量浓度最大的是____ 。
②将过量H2S通入Na2CO3溶液,反应的离子方程式是____ 。
(2)二元弱酸H2A溶液中H2A、HA-、A2-的物质的量分数δ(X) 随pH的变化如图所示。则H2A的电离平衡常数K2=____ 。

(3)常温下,用0.100mol·L-1的盐酸滴定20.00mL未知浓度的氨水,滴定曲线如图2所示,滴加20.00mL盐酸时所得溶液中,c(Cl-)=c(NH ) +c(NH3·H2O)+c(NH3)(忽略溶液体积的变化)。
) +c(NH3·H2O)+c(NH3)(忽略溶液体积的变化)。

①该氨水物质的量浓度为____ 。
②a、b、c、d四个点,水的电离程度最大的是____ 。
③b点所示的溶液中c(NH3·H2O)____ c(Cl-)(填“大于”“等于”或“小于”)
④若所得溶液中的c(NH )>c(OH—),则下列说法正确的是
)>c(OH—),则下列说法正确的是____ ;
A.溶液一定呈酸性 B.溶液一定呈碱性
C.溶液一定呈中性 D.溶液可能呈酸性、中性或碱性
(1)已知部分弱酸的电离常数如下表:
化学式 | HF | H2CO3 | H2S |
电离平衡常数K (25℃) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | K1=9.1×10-8 K2=1.1×10-12 |
①常温下,pH相同的三种溶液NaF、Na2CO3、Na2S,物质的量浓度最大的是
②将过量H2S通入Na2CO3溶液,反应的离子方程式是
(2)二元弱酸H2A溶液中H2A、HA-、A2-的物质的量分数δ(X) 随pH的变化如图所示。则H2A的电离平衡常数K2=

(3)常温下,用0.100mol·L-1的盐酸滴定20.00mL未知浓度的氨水,滴定曲线如图2所示,滴加20.00mL盐酸时所得溶液中,c(Cl-)=c(NH
 ) +c(NH3·H2O)+c(NH3)(忽略溶液体积的变化)。
) +c(NH3·H2O)+c(NH3)(忽略溶液体积的变化)。
①该氨水物质的量浓度为
②a、b、c、d四个点,水的电离程度最大的是
③b点所示的溶液中c(NH3·H2O)
④若所得溶液中的c(NH
 )>c(OH—),则下列说法正确的是
)>c(OH—),则下列说法正确的是A.溶液一定呈酸性 B.溶液一定呈碱性
C.溶液一定呈中性 D.溶液可能呈酸性、中性或碱性
您最近一年使用:0次




