回答下列问题
(1)已知25℃时有关弱酸的电离平衡常数:
①同温度下,等pH值的下列溶液,物质的量浓度由大到小的顺序为_______ (填序号)。
a. b.
b. c.
c.
②25℃时将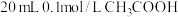 溶液和
溶液和 溶液分别与
溶液分别与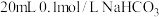 溶液混合。
溶液混合。
a.请将产生的气体体积随时间的变化关系表示在坐标中_______ (做好必要的标注)

b.反应结束后所得两溶液中,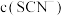
_______ 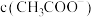 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
③向 溶液中通入少量
溶液中通入少量 气体,反应的离子方程式为
气体,反应的离子方程式为_______ 。
(2)煤燃烧的烟气也含氮氧化物,用 催化还原
催化还原 可以消除氮氧化物的污染。
可以消除氮氧化物的污染。
已知:
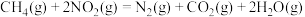




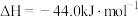
在常温下, 催化还原
催化还原 的热化学方程式
的热化学方程式_______
(3)电池可以提升能量利用率。下图是利用甲烷燃料电池电解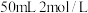 的氯化铜溶液的装置示意图,请回答下列问题:
的氯化铜溶液的装置示意图,请回答下列问题:
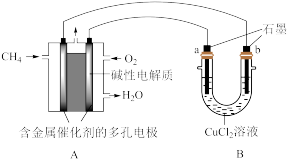
①甲烷燃料电池的负极反应式是_______ ;
②当A中消耗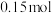 氧气时,B中
氧气时,B中_______ 极增重_______ g。
(1)已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 |  |  |  |  |
| 电离平衡常数 | 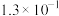 |  |  |   |
a.
 b.
b. c.
c.
②25℃时将
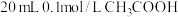 溶液和
溶液和 溶液分别与
溶液分别与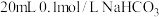 溶液混合。
溶液混合。a.请将产生的气体体积随时间的变化关系表示在坐标中

b.反应结束后所得两溶液中,
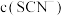
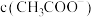 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)③向
 溶液中通入少量
溶液中通入少量 气体,反应的离子方程式为
气体,反应的离子方程式为(2)煤燃烧的烟气也含氮氧化物,用
 催化还原
催化还原 可以消除氮氧化物的污染。
可以消除氮氧化物的污染。已知:
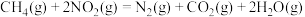




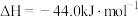
在常温下,
 催化还原
催化还原 的热化学方程式
的热化学方程式(3)电池可以提升能量利用率。下图是利用甲烷燃料电池电解
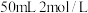 的氯化铜溶液的装置示意图,请回答下列问题:
的氯化铜溶液的装置示意图,请回答下列问题:
①甲烷燃料电池的负极反应式是
②当A中消耗
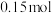 氧气时,B中
氧气时,B中
更新时间:2022-12-02 19:56:37
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】研究和深度开发CO2的综合应用,实现碳循环是解决温室问题的有效途径,对构建生态文明社会具有重要意义。二氧化碳加氢制甲醇的总反应可表示为: 。
。
(1)该反应一般认为通过如下步骤来实现:
i.
ii.
则
_______ kJ/mol。
(2)下列措施中,能提高CO2转化率的是_______。
(3)一定条件下,往2L恒容密闭容器中充入 和
和 ,在催化剂作用下发生反应,测得
,在催化剂作用下发生反应,测得 时CO2的转化率在五种不同温度下的变化如图1所示。
时CO2的转化率在五种不同温度下的变化如图1所示。
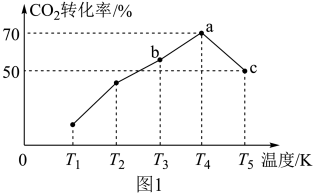
①T4温度下,反应在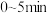 内平均反应速率
内平均反应速率
_______ 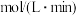 。
。
②b点对应的正反应速率
_______ c点对应逆反应速率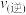 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
③若反应在c点的体系总压强为 ,则c点反应的
,则c点反应的
_______  (
( 为以分压表示的平衡常数)。
为以分压表示的平衡常数)。
(4) 基催化剂光催化还原
基催化剂光催化还原 亦可制得燃料甲醇,其原理如图2所示。
亦可制得燃料甲醇,其原理如图2所示。
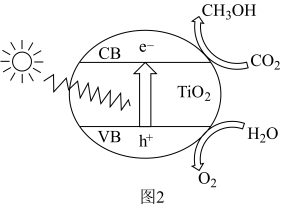
①CB极的电势_______ VB极的电势(填“低于”或“高于”)。
②碱性条件下甲醇燃料电池的负极反应式是_______ 。
 。
。(1)该反应一般认为通过如下步骤来实现:
i.

ii.

则

(2)下列措施中,能提高CO2转化率的是_______。
A.在原料气中加入适量 | B.从体系中不断分离出甲醇 |
| C.循环利用原料气 | D.提高原料气中CO2的体积分数 |
 和
和 ,在催化剂作用下发生反应,测得
,在催化剂作用下发生反应,测得 时CO2的转化率在五种不同温度下的变化如图1所示。
时CO2的转化率在五种不同温度下的变化如图1所示。
①T4温度下,反应在
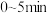 内平均反应速率
内平均反应速率
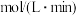 。
。②b点对应的正反应速率

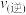 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。③若反应在c点的体系总压强为
 ,则c点反应的
,则c点反应的
 (
( 为以分压表示的平衡常数)。
为以分压表示的平衡常数)。(4)
 基催化剂光催化还原
基催化剂光催化还原 亦可制得燃料甲醇,其原理如图2所示。
亦可制得燃料甲醇,其原理如图2所示。
①CB极的电势
②碱性条件下甲醇燃料电池的负极反应式是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】我国力争于2030年前做到碳达峰,2060年前实现碳中和。“碳中和”是指二氧化碳的排放总量和减少总量相当,这对于改善环境,实现绿色发展至关重要。回答下列问题:
I.化学链燃烧(CLC)是利用载氧体将空气中的氧传输至燃料的新技术,与传统燃烧方式相比,避免了空气和燃料的直接接触,有利于高效捕集CO2.基于CuO/Cu2O载氧体的甲烷化学链燃烧技术示意图如下。
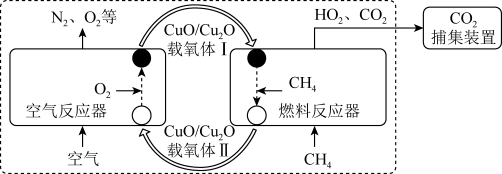
空气反应器与燃料反应器中发生的反应分别为:
①2Cu2O(s)+O2(g)=4CuO(s) ΔH=-227kJ/mol
②8CuO(s)+CH4(g)=4Cu2O(s)+CO2(g)+2H2O(g) ΔH=-348 kJ/mol
(1)反应CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=___________ kJ/mol。
(2)氧的质量分数:载氧体I___________ (填“>”“=”或“<”)载氧体II。
(3)往盛有CuO/Cu2O载氧体的刚性密闭容器中充入空气[氧气的物的量分数x(O2)为21%],发生反应①。平衡时x(O2)随反应温度T变化的曲线如图1所示。985℃时O2的平衡转化率a(O2)=___________ (保留2位有效数字)。

II.利用工厂废气中的硫化氢可将CO转化为化工原料羰基硫(COS):CO(g)+H2S(g)→COS(g)+H2(g) ΔH,240℃时,其平衡常数K=1。
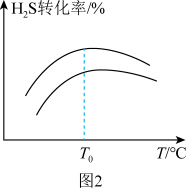
(4)在某密闭容器中,以不同投料比[ ]进行上述反应,相同时间内H2S的转化率与温度(T)的关系如图2所示。则ΔH
]进行上述反应,相同时间内H2S的转化率与温度(T)的关系如图2所示。则ΔH ___________ (填“>”或“<”)0,转化率先增大后减小的原因是___________ 。
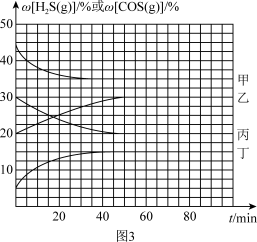
(5)分别在300℃、320℃进行上述反应,反应中H2S(g)和COS(g)的体积分数(ω)随时间(t)的变化关系如图3所示。已知:起始时密闭容器中ω[H2S(g)]和ω[CO(g)]、ω[COS(g)]和ω[H2(g)]分别相等。则320℃时,表示ω[H2S(g)]的曲线是___________ (填“甲”“乙”“丙”或“丁”)。
III.二氧化碳催化加氢合成乙烯也是综合利用CO2的热点研究领域。CO2和H2在铁系催化剂作用下发生化学反应:①2CO2(g)+6H2(g) C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)
②CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)
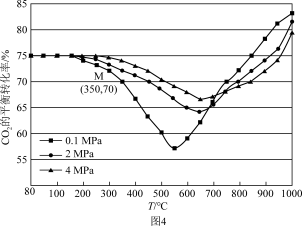
(6)在1L密闭容器中通入1mol CO2和3mol H2,在铁系催化剂作用下进行反应,CO2的平衡转化率随温度和压强的变化如图4所示,图4中点M(350,70),此时乙烯的选择性为 (选择性:转化的CO2中生成C2H4和CO的百分比)。则该温度时反应②的平衡常数Kp=
(选择性:转化的CO2中生成C2H4和CO的百分比)。则该温度时反应②的平衡常数Kp=___________ (分压=总压×物质的量分数)。
I.化学链燃烧(CLC)是利用载氧体将空气中的氧传输至燃料的新技术,与传统燃烧方式相比,避免了空气和燃料的直接接触,有利于高效捕集CO2.基于CuO/Cu2O载氧体的甲烷化学链燃烧技术示意图如下。

空气反应器与燃料反应器中发生的反应分别为:
①2Cu2O(s)+O2(g)=4CuO(s) ΔH=-227kJ/mol
②8CuO(s)+CH4(g)=4Cu2O(s)+CO2(g)+2H2O(g) ΔH=-348 kJ/mol
(1)反应CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=
(2)氧的质量分数:载氧体I
(3)往盛有CuO/Cu2O载氧体的刚性密闭容器中充入空气[氧气的物的量分数x(O2)为21%],发生反应①。平衡时x(O2)随反应温度T变化的曲线如图1所示。985℃时O2的平衡转化率a(O2)=

II.利用工厂废气中的硫化氢可将CO转化为化工原料羰基硫(COS):CO(g)+H2S(g)→COS(g)+H2(g) ΔH,240℃时,其平衡常数K=1。
(4)在某密闭容器中,以不同投料比[
 ]进行上述反应,相同时间内H2S的转化率与温度(T)的关系如图2所示。则ΔH
]进行上述反应,相同时间内H2S的转化率与温度(T)的关系如图2所示。则ΔH 
(5)分别在300℃、320℃进行上述反应,反应中H2S(g)和COS(g)的体积分数(ω)随时间(t)的变化关系如图3所示。已知:起始时密闭容器中ω[H2S(g)]和ω[CO(g)]、ω[COS(g)]和ω[H2(g)]分别相等。则320℃时,表示ω[H2S(g)]的曲线是

III.二氧化碳催化加氢合成乙烯也是综合利用CO2的热点研究领域。CO2和H2在铁系催化剂作用下发生化学反应:①2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)②CO2(g)+H2(g)
 CO(g)+H2O(g)
CO(g)+H2O(g)(6)在1L密闭容器中通入1mol CO2和3mol H2,在铁系催化剂作用下进行反应,CO2的平衡转化率随温度和压强的变化如图4所示,图4中点M(350,70),此时乙烯的选择性为
 (选择性:转化的CO2中生成C2H4和CO的百分比)。则该温度时反应②的平衡常数Kp=
(选择性:转化的CO2中生成C2H4和CO的百分比)。则该温度时反应②的平衡常数Kp=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】研究 、
、 、CO等大气污染气体的处理具有重要意义。
、CO等大气污染气体的处理具有重要意义。
(1)已知: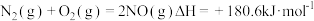
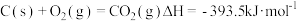
采取还原法,可用炭粉将NO还原,则该反应的热化学方程式为:_____________ 。
(2)一定条件下,将 与
与 以体积比
以体积比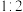 置于恒温恒容密闭容器中发生反应
置于恒温恒容密闭容器中发生反应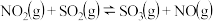 ,下列能说明反应达到平衡状态的是
,下列能说明反应达到平衡状态的是____ 。
a.体系压强保持不变
b.混合气体颜色保持不变
c. 和NO2的体积比保持不变
和NO2的体积比保持不变
d.每消耗 的同时生成
的同时生成
(3) 可用于合成甲醇,反应方程式为
可用于合成甲醇,反应方程式为 。该反应在较低温度下能自发进行,则该反应
。该反应在较低温度下能自发进行,则该反应
__________ 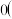 填“
填“ ”或“
”或“ ”
” 。
。
(4)氮氧化物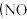 和
和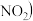 污染环境。若用
污染环境。若用 溶液吸收
溶液吸收 可生成
可生成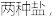 写出该反应的离子方程式
写出该反应的离子方程式_________________ 。吸收了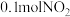 时转移电子物质的量为
时转移电子物质的量为________________  。
。
 、
、 、CO等大气污染气体的处理具有重要意义。
、CO等大气污染气体的处理具有重要意义。(1)已知:
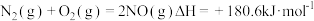
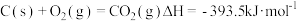
采取还原法,可用炭粉将NO还原,则该反应的热化学方程式为:
(2)一定条件下,将
 与
与 以体积比
以体积比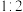 置于恒温恒容密闭容器中发生反应
置于恒温恒容密闭容器中发生反应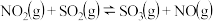 ,下列能说明反应达到平衡状态的是
,下列能说明反应达到平衡状态的是a.体系压强保持不变
b.混合气体颜色保持不变
c.
 和NO2的体积比保持不变
和NO2的体积比保持不变d.每消耗
 的同时生成
的同时生成
(3)
 可用于合成甲醇,反应方程式为
可用于合成甲醇,反应方程式为 。该反应在较低温度下能自发进行,则该反应
。该反应在较低温度下能自发进行,则该反应
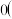 填“
填“ ”或“
”或“ ”
” 。
。(4)氮氧化物
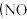 和
和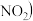 污染环境。若用
污染环境。若用 溶液吸收
溶液吸收 可生成
可生成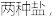 写出该反应的离子方程式
写出该反应的离子方程式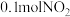 时转移电子物质的量为
时转移电子物质的量为 。
。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】磷酸铁 常用作制备电极材料的原料。一种制备磷酸铁的流程如图所示:
常用作制备电极材料的原料。一种制备磷酸铁的流程如图所示:

回答下列问题:
(1) 的价层电子排布式是
的价层电子排布式是_______ ,其中未成对电子数为_______ 。 中含有化学键的类型有
中含有化学键的类型有_______ 。
(2)实验室保存 溶液时常加少量稀硫酸,其作用是
溶液时常加少量稀硫酸,其作用是_______ 。还加少量铁粉,其作用是_______ 。
(3)为了提高“氧化槽”中的反应速率,宜采取的措施有_______ (填一条)。
(4)“真空过滤”与抽滤原理相同,采用“真空过滤器”的优点有_______ 。
(5)“撞击流反应器”、“陈化槽”都使用了磷酸,该酸在水中第二步电离的离子方程式为_______ 。
(6)已知常温下, 。
。 的电离常数
的电离常数 ,
, ,当
,当 时,
时, 已完全沉淀。“撞击流反应器”中,若保持溶液中含
已完全沉淀。“撞击流反应器”中,若保持溶液中含 浓度为
浓度为 ,当其
,当其 时,
时,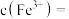
_______  (用含
(用含 的代数式表示)。
的代数式表示)。
 常用作制备电极材料的原料。一种制备磷酸铁的流程如图所示:
常用作制备电极材料的原料。一种制备磷酸铁的流程如图所示:
回答下列问题:
(1)
 的价层电子排布式是
的价层电子排布式是 中含有化学键的类型有
中含有化学键的类型有(2)实验室保存
 溶液时常加少量稀硫酸,其作用是
溶液时常加少量稀硫酸,其作用是(3)为了提高“氧化槽”中的反应速率,宜采取的措施有
(4)“真空过滤”与抽滤原理相同,采用“真空过滤器”的优点有
(5)“撞击流反应器”、“陈化槽”都使用了磷酸,该酸在水中第二步电离的离子方程式为
(6)已知常温下,
 。
。 的电离常数
的电离常数 ,
, ,当
,当 时,
时, 已完全沉淀。“撞击流反应器”中,若保持溶液中含
已完全沉淀。“撞击流反应器”中,若保持溶液中含 浓度为
浓度为 ,当其
,当其 时,
时,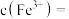
 (用含
(用含 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
【推荐2】2015年8月12日天津港特大爆炸事故,再一次引发了人们对环境问题的关注。据查危化仓库中存有大量的钠、钾、白磷(P4)、硝酸铵和氰化钠(NaCN)。
(1)白磷有毒能和氯酸溶液发生氧化还原反应:3P4+10HClO3+18H2O=10HCl+12H3PO4,该反应的氧化产物是_______ ,若有1 mol P4参加反应转移电子为_______ mol。
(2)氰化钠(NaCN)是一种化工原料,用于基本化学合成、电镀、冶金和有机合成医药、农药及金属处理等方面。
①已知:25℃时,HCN的电离平衡常数Ka=6.2×10-10,H2CO3在25℃时的电离平衡常数是Ka1= 4.5×10-7、Ka2 = 4.7×10-11,则向NaCN溶液通入少量CO2反应的化学方程式是:_________________ 。
②常温下,氰化钠能与过氧化氢溶液反应,生成碳酸氢钠和能使湿润的红色石蕊试纸变蓝色的气体,大大降低其毒性。该反应的化学方程式是:________________________ 。
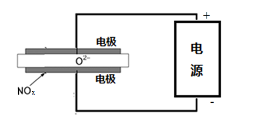
③电解法可以处理空气中的氮氧化物,用如右图示电解池,将NOx在电解池中分解成无污染的N2和O2除去,两电极间是固体氧化物电解质,在一定条件下可自由传导O2-,电解池阴极反应为___________ 。
(3)①传统工业上利用氨气可以合成尿素。主要反应如下:
2NH3(g)+CO2(g)=NH2CO2NH4(s) △H= -159.47 kJ·mol-1
NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H= +72.49 kJ·mol-1
反应2NH3(g)+ CO2(g)= CO(NH2)2(s)+H2O(g)的△H=__________ kJ·mol-1
②工业上用氨气制备硝酸,将一定质量的铁粉加入到100mL某浓度的稀硝酸中充分反应后,容器中剩余m1 g铁粉,此时共收集到NO气体448mL(标准状况)。然后向上述混合物中加入稀硫酸至不再产生NO为止,容器剩余铁粉m2 g,则m1-m2为___________ 。
(1)白磷有毒能和氯酸溶液发生氧化还原反应:3P4+10HClO3+18H2O=10HCl+12H3PO4,该反应的氧化产物是
(2)氰化钠(NaCN)是一种化工原料,用于基本化学合成、电镀、冶金和有机合成医药、农药及金属处理等方面。
①已知:25℃时,HCN的电离平衡常数Ka=6.2×10-10,H2CO3在25℃时的电离平衡常数是Ka1= 4.5×10-7、Ka2 = 4.7×10-11,则向NaCN溶液通入少量CO2反应的化学方程式是:
②常温下,氰化钠能与过氧化氢溶液反应,生成碳酸氢钠和能使湿润的红色石蕊试纸变蓝色的气体,大大降低其毒性。该反应的化学方程式是:
③电解法可以处理空气中的氮氧化物,用如右图示电解池,将NOx在电解池中分解成无污染的N2和O2除去,两电极间是固体氧化物电解质,在一定条件下可自由传导O2-,电解池阴极反应为

(3)①传统工业上利用氨气可以合成尿素。主要反应如下:
2NH3(g)+CO2(g)=NH2CO2NH4(s) △H= -159.47 kJ·mol-1
NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H= +72.49 kJ·mol-1
反应2NH3(g)+ CO2(g)= CO(NH2)2(s)+H2O(g)的△H=
②工业上用氨气制备硝酸,将一定质量的铁粉加入到100mL某浓度的稀硝酸中充分反应后,容器中剩余m1 g铁粉,此时共收集到NO气体448mL(标准状况)。然后向上述混合物中加入稀硫酸至不再产生NO为止,容器剩余铁粉m2 g,则m1-m2为
您最近一年使用:0次
【推荐3】氯化亚铜(CuCl是一种难溶于水和乙醇的白色粉末,广泛应用于印染等行业。工业上用铜矿粉(主要含Cu2S及少量Al2O3和SiO2)为原料制备CuCl,其流程如下图。已知:常温下, 的
的 约为
约为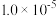 。
。
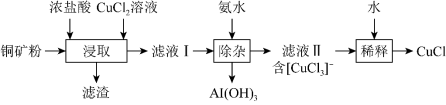
(1)“浸取”时,发生反应为: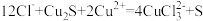 ,该反应分为两步进行:
,该反应分为两步进行:
第一步为 ;
;
第二步为___________ ;
其中,滤渣的成分为___________ (填化学式)。
(2)除杂时,在常温下加入氨水,并控制混合溶液pH=4.0;此时,该溶液中
___________ 。在分离出 沉淀前需要对混合体系充分搅拌或加热,其目的是
沉淀前需要对混合体系充分搅拌或加热,其目的是___________ 。
(3)加水“稀释”时发生的相关离子反应方程式为___________ ;若“稀释”时加水不足,会导致CuCl的产率___________ (选填“偏低”、“偏高”或“不变”)。
(4)CuCl纯度的测定。在锥形瓶中,将ag CuCl样品溶解于H2O2和H2SO4的混合溶液,得到CuSO4溶液;加热溶液,待没有气体逸出后,再加入过量KI溶液,充分反应;向所得溶液中滴加2滴淀粉溶液,用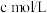 的
的 标准溶液滴定至终点,平均消耗
标准溶液滴定至终点,平均消耗 溶液V mL。已知:
溶液V mL。已知: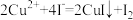 、
、 。
。
①“加热溶液,待没有气体逸出”的目的是___________ 。
②滴定终点的判断依据是___________ 。
 的
的 约为
约为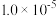 。
。
(1)“浸取”时,发生反应为:
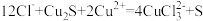 ,该反应分为两步进行:
,该反应分为两步进行:第一步为
 ;
;第二步为
其中,滤渣的成分为
(2)除杂时,在常温下加入氨水,并控制混合溶液pH=4.0;此时,该溶液中

 沉淀前需要对混合体系充分搅拌或加热,其目的是
沉淀前需要对混合体系充分搅拌或加热,其目的是(3)加水“稀释”时发生的相关离子反应方程式为
(4)CuCl纯度的测定。在锥形瓶中,将ag CuCl样品溶解于H2O2和H2SO4的混合溶液,得到CuSO4溶液;加热溶液,待没有气体逸出后,再加入过量KI溶液,充分反应;向所得溶液中滴加2滴淀粉溶液,用
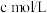 的
的 标准溶液滴定至终点,平均消耗
标准溶液滴定至终点,平均消耗 溶液V mL。已知:
溶液V mL。已知: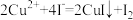 、
、 。
。①“加热溶液,待没有气体逸出”的目的是
②滴定终点的判断依据是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】电解质水溶液中存在电离平衡、水解平衡、溶解平衡等,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
①0.1 mol/L NaCN溶液和0.1 mol/L NaHCO3溶液中,c(CN-)______ c( )(填“>”、“<”或“=”)。
)(填“>”、“<”或“=”)。
②将少量CO2通入NaCN溶液,反应的离子方程式是_____ 。
③室温下,—定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是_____ 。
④室温下,某溶液中存在着CH3COOH(aq)+ (aq)
(aq) CH3COO-(aq) +H2CO3(aq),该反应的平衡常数K=
CH3COO-(aq) +H2CO3(aq),该反应的平衡常数K=___________ 。
(2)常温下,将a mol·L-1的醋酸与 b mol·L-1 Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=________________ (用含a和b的代数式表示)。
(1)已知部分弱酸的电离常数如下表:
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离常数(室温) | Ka= 1.8×10-5 | Ka=4.3×10-10 | Ka1=5.0×10-7 Ka2=5.6×10-11 |
①0.1 mol/L NaCN溶液和0.1 mol/L NaHCO3溶液中,c(CN-)
 )(填“>”、“<”或“=”)。
)(填“>”、“<”或“=”)。②将少量CO2通入NaCN溶液,反应的离子方程式是
③室温下,—定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是
④室温下,某溶液中存在着CH3COOH(aq)+
 (aq)
(aq) CH3COO-(aq) +H2CO3(aq),该反应的平衡常数K=
CH3COO-(aq) +H2CO3(aq),该反应的平衡常数K=(2)常温下,将a mol·L-1的醋酸与 b mol·L-1 Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】回答下列问题
Ⅰ.现有下列物质:① 晶体;②液态
晶体;②液态 ;③冰醋酸;④铜;⑤
;③冰醋酸;④铜;⑤ 固体;⑥蔗糖;⑦乙醇;⑧熔融的氯化钠;⑨
固体;⑥蔗糖;⑦乙醇;⑧熔融的氯化钠;⑨ 溶液。其中:
溶液。其中:
(1)能导电的是___________ (填序号,下同);属于电解质的是___________ ;属于非电解质的是___________ 。
Ⅱ.25℃时,三种酸的电离平衡常数如下:
回答下列问题:
(2)物质的量浓度均为 的四种溶液;①
的四种溶液;① ②
② ③
③ ④
④ ,溶液的
,溶液的 由大到小的顺序是
由大到小的顺序是___________ (填编号,下同);
(3) 溶液显碱性的原因:
溶液显碱性的原因:___________ ;泡沫灭火器工作原理___________ (均用离子方程式表示)。
(4)下列反应不能发生的是填序号___________
(5)在25℃下, 的
的 溶液中,水电离产生的
溶液中,水电离产生的 浓度
浓度
___________ ; 的
的 溶液中,水电离出来的
溶液中,水电离出来的
___________ 。
(6)25℃下,将 的苛性钠溶液
的苛性钠溶液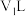 与
与 的稀硫酸
的稀硫酸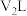 混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的
混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的 ,则
,则
___________ 。
Ⅰ.现有下列物质:①
 晶体;②液态
晶体;②液态 ;③冰醋酸;④铜;⑤
;③冰醋酸;④铜;⑤ 固体;⑥蔗糖;⑦乙醇;⑧熔融的氯化钠;⑨
固体;⑥蔗糖;⑦乙醇;⑧熔融的氯化钠;⑨ 溶液。其中:
溶液。其中:(1)能导电的是
Ⅱ.25℃时,三种酸的电离平衡常数如下:
| 化学式 |  |  |  |
| 电离平衡常数 |  |  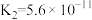 |  |
(2)物质的量浓度均为
 的四种溶液;①
的四种溶液;① ②
② ③
③ ④
④ ,溶液的
,溶液的 由大到小的顺序是
由大到小的顺序是(3)
 溶液显碱性的原因:
溶液显碱性的原因:(4)下列反应不能发生的是填序号___________
A. |
B. |
C. |
D.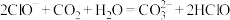 |
 的
的 溶液中,水电离产生的
溶液中,水电离产生的 浓度
浓度
 的
的 溶液中,水电离出来的
溶液中,水电离出来的
(6)25℃下,将
 的苛性钠溶液
的苛性钠溶液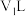 与
与 的稀硫酸
的稀硫酸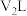 混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的
混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的 ,则
,则
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】软锰矿在生产中有广泛的应用。
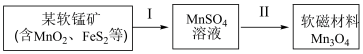
(1)过程I:酸浸
①用稀 溶液处理软锰矿后,溶液中含有
溶液处理软锰矿后,溶液中含有 ,矿粉颗粒表面附着有黄色固体硫。上述过程中的主要反应为(将方程式补充完整):
,矿粉颗粒表面附着有黄色固体硫。上述过程中的主要反应为(将方程式补充完整):


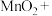
 ___________=
___________= ___________+
___________+ ___________
___________
 ___________
___________ ___________
②硫附着在矿粉颗粒表面不利于酸浸进行,加入 可以提高锰元素的浸出率。
可以提高锰元素的浸出率。
结合化学方程式说明 的作用原理:(写出两条)
的作用原理:(写出两条)
i___________ ;
ii___________ 。
(2)过程II:
①使用过量 固体可以去除酸浸后滤液中的
固体可以去除酸浸后滤液中的 。选用
。选用 的理由是
的理由是___________ 。
②制备

下图表示通入 时pH随时间的变化。
时pH随时间的变化。

0—15分钟,pH几乎不变;15—150分钟,pH明显降低。结合方程式解释原因:___________ 。

(1)过程I:酸浸
①用稀
 溶液处理软锰矿后,溶液中含有
溶液处理软锰矿后,溶液中含有 ,矿粉颗粒表面附着有黄色固体硫。上述过程中的主要反应为(将方程式补充完整):
,矿粉颗粒表面附着有黄色固体硫。上述过程中的主要反应为(将方程式补充完整):

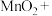
 ___________=
___________= ___________+
___________+ ___________
___________
 ___________
___________ ②硫附着在矿粉颗粒表面不利于酸浸进行,加入
 可以提高锰元素的浸出率。
可以提高锰元素的浸出率。结合化学方程式说明
 的作用原理:(写出两条)
的作用原理:(写出两条)i
ii
(2)过程II:
①使用过量
 固体可以去除酸浸后滤液中的
固体可以去除酸浸后滤液中的 。选用
。选用 的理由是
的理由是②制备


下图表示通入
 时pH随时间的变化。
时pH随时间的变化。
0—15分钟,pH几乎不变;15—150分钟,pH明显降低。结合方程式解释原因:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】原电池的发明是化学对人类的一项重大贡献。
(1)一种新型燃料电池,它以多孔铂板为两个电极插入稀硫酸中,然后分别向两极通入氢气和氧气而获得电能。通入氢气的电极反应式为___ 。放电一段时间后,负极附近溶液的pH___ (填“升高”“降低”或“不变”)。
(2)如图是某兴趣小组设计的原电池示意图,实验结束后,在实验报告上记录信息如下:

①实验报告中记录合理的是___ (填序号)。
②若有2mol电子流过导线,则理论上产生H2的质量为___ g。
(3)常温下,将除去表面氧化膜的铝片、铜片插入浓HNO3中组成原电池装置如图甲所示,测得原电池的电流强度(I)随时间(t)的变化如图乙所示,反应过程中有红棕色气体产生。
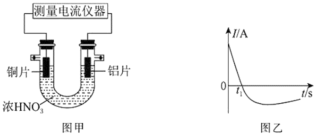
t1s前,原电池的铜片是___ (填“正”或“负”)极,其电极反应式为___ ,溶液中的H+向___ (填“正”或“负”)极移动。t1s后,外电路中电子流动方向发生改变,其原因是___ 。
(1)一种新型燃料电池,它以多孔铂板为两个电极插入稀硫酸中,然后分别向两极通入氢气和氧气而获得电能。通入氢气的电极反应式为
(2)如图是某兴趣小组设计的原电池示意图,实验结束后,在实验报告上记录信息如下:

| a.电流计指针偏转 |
| b.Cu极有H2产生 |
| c.H+向负极移动 |
| d.电流由Zn经导线流向Cu |
①实验报告中记录合理的是
②若有2mol电子流过导线,则理论上产生H2的质量为
(3)常温下,将除去表面氧化膜的铝片、铜片插入浓HNO3中组成原电池装置如图甲所示,测得原电池的电流强度(I)随时间(t)的变化如图乙所示,反应过程中有红棕色气体产生。

t1s前,原电池的铜片是
您最近一年使用:0次
【推荐2】甲烷是天然气的主要成分,是生产生活中应用非常广泛的一种化学物质。
1.一定条件下,用甲烷可以消除氮氧化物(NOx)的污染。已知:
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ∆H1=-1160kJ/mol
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ∆H2=-574kJ/mol
现有一份在相同条件下对H2的相对密度为17的NO与NO2的混合气体。
①该混合气体中NO和NO2的物质的量之比为________ ;
②在一定条件下NO气体可以分解为NO2气体和N2气体,写出该反应的热化学方程式:________ .
2.以甲烷为燃料的新型燃料电池,其成本大大低于以氢气为燃料的传统燃料电池,目前已得到了广泛的研究。如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。
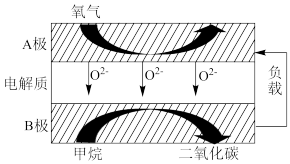
①B极为电池________ 极,电极反应式为________ 。
②若用该燃料电池作电源,用石墨作电极电解100mL 1mol/L的硫酸铜溶液,写出阳极的电极反应式:_______ ;标准状况下,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为________ ,实际上消耗的甲烷体积( 已折算成标准状况下)比理论上大,可能原因为______________ 。
1.一定条件下,用甲烷可以消除氮氧化物(NOx)的污染。已知:
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ∆H1=-1160kJ/mol
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ∆H2=-574kJ/mol
现有一份在相同条件下对H2的相对密度为17的NO与NO2的混合气体。
①该混合气体中NO和NO2的物质的量之比为
②在一定条件下NO气体可以分解为NO2气体和N2气体,写出该反应的热化学方程式:
2.以甲烷为燃料的新型燃料电池,其成本大大低于以氢气为燃料的传统燃料电池,目前已得到了广泛的研究。如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。

①B极为电池
②若用该燃料电池作电源,用石墨作电极电解100mL 1mol/L的硫酸铜溶液,写出阳极的电极反应式:
您最近一年使用:0次
【推荐3】丙烯(C3H6)是仅次于乙烯(C2H4)的重要基本有机原料,工业上常利用丙烷(C3H8)催化脱氢氧化制取丙烯。丙烷脱氢过程主要包含以下3个反应:
①C3H8→C3H6+H2 ②2 C3H6+9O2→6CO2+9H2O ③C3H8→CH4+C2H4
根据以下所给条件回答问题:
(1)已知各物质的燃烧热如下表,请计算反应①的反应热ΔH1=_________ .
(2)如果要加快石油工业中丙烷的裂解速度,可以采取的措施是_________ .
A.高温低压B.低温高压C.高温高压D.低温低压
(3)在500℃下,按一定的原料气比和气流速度的条件下,不同载体催化剂对丙烷脱氢反应的影响如图所示。其中某一组实验数据如下表所示。(其中丙烷的转化率指的是总转化率,丙烯的选择性指最终转化为丙烯的丙烷占反应丙烷的百分比。)

①磷酸钙、磷酸锆、磷酸铝三种载体的催化效率最高的是_________ .
②经研究发现,不同载体的催化效果与载体本身的酸碱性有关,以下三种催化剂中催化效果最好的是_________ .
A.SiO2 B.Al2O3 C.MgO
③由上表计算该条件下,丙烷的转化率=_________ .;丙烯的选择性=_________ .
④根据化学平衡理论催化剂并不会改变平衡体系中的转化率和产率,但在丙烷催化生产丙烯的反应中,使用不同的催化剂所得到的丙烯的选择性却有不同。请说明原因:_________ .
(4)目前有一种便携式固体氧化物燃料电池,它以丙烷气体为燃料。电池中的一极通入空气,另一极通入丙烷气体,电解质是固态氧化物,在熔融状态下能传导O2-,请写出该电池负极的电极反应式:_________
①C3H8→C3H6+H2 ②2 C3H6+9O2→6CO2+9H2O ③C3H8→CH4+C2H4
根据以下所给条件回答问题:
(1)已知各物质的燃烧热如下表,请计算反应①的反应热ΔH1=
| 物质 | H2 | CH4 | C2H4 | C3H6 | C3H8 |
| 燃烧热(KJ/mol) | 285.8 | 891.0 | 1411.0 | 2013.4 | 2217.8 |
A.高温低压B.低温高压C.高温高压D.低温低压
(3)在500℃下,按一定的原料气比和气流速度的条件下,不同载体催化剂对丙烷脱氢反应的影响如图所示。其中某一组实验数据如下表所示。(其中丙烷的转化率指的是总转化率,丙烯的选择性指最终转化为丙烯的丙烷占反应丙烷的百分比。)

| 物质 | 反应前(mol) | 反应后(mol) |
| C3H8 | 10 | |
| C3H6 | 0 | 1.02 |
| CO2 | 0 | 1.98 |
| C2H4 | 0 | 0.02 |
| CH4 | 0 | 0.02 |
①磷酸钙、磷酸锆、磷酸铝三种载体的催化效率最高的是
②经研究发现,不同载体的催化效果与载体本身的酸碱性有关,以下三种催化剂中催化效果最好的是
A.SiO2 B.Al2O3 C.MgO
③由上表计算该条件下,丙烷的转化率=
④根据化学平衡理论催化剂并不会改变平衡体系中的转化率和产率,但在丙烷催化生产丙烯的反应中,使用不同的催化剂所得到的丙烯的选择性却有不同。请说明原因:
(4)目前有一种便携式固体氧化物燃料电池,它以丙烷气体为燃料。电池中的一极通入空气,另一极通入丙烷气体,电解质是固态氧化物,在熔融状态下能传导O2-,请写出该电池负极的电极反应式:
您最近一年使用:0次



