解题方法
1 . 汽车已成为现代社会的重要交通工具之一。它所使用燃料经历了从煤到汽油的变迁。时至今日,人们依然在探索、优化车用燃料。
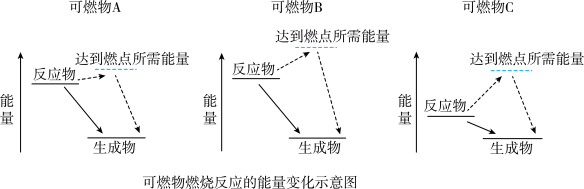
(1)某同学根据所查阅资料,绘制了三种可燃物在空气中发生燃烧反应的能量变化示意图(如图)。根据示意图,你认为哪种物质更适合用作车用燃料______ (填写字母);并说出你的选择依据______ 。
(2)庚烷(C7H16)是汽油的主要成分之一。完全燃烧1g庚烷生成二氧化碳气体和液态水时产生的热量为48kJ。请写出表示庚烷燃烧热的热化学方程式______ ;
(3)目前汽车主要使用燃料为汽油。“辛烷值”用来表示汽油的质量。异辛烷用作抗爆性优良的标准,辛烷值为100。正庚烷用作抗爆性低劣的标准,辛烷值为0。如图是异辛烷的球棍模型:
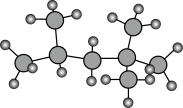
①1mol异辛烷和1mol正庚烷分别完全燃烧生成水和二氧化碳,消耗氧气的质量之差是______ g。
②异辛烷的同分异构体有很多,其中一种同分异构体X,其一氯代物只有一种结构,则X的结构简式为______ 。
(4)车用燃料在使用过程中会产生汽车尾气(主要含有一氧化碳,一氧化氮),是造成空气污染的主要因素之一。可在汽车尾气系统中安装催化转化器,使CO和NO在催化剂的作用下反应生成两种无污染的气体。其中,氮气和氧气反应生成一氧化氮的能量变化如图所示,则由该反应生成2mol NO(g),对应热化学方程式的△H=______

(1)某同学根据所查阅资料,绘制了三种可燃物在空气中发生燃烧反应的能量变化示意图(如图)。根据示意图,你认为哪种物质更适合用作车用燃料

(2)庚烷(C7H16)是汽油的主要成分之一。完全燃烧1g庚烷生成二氧化碳气体和液态水时产生的热量为48kJ。请写出表示庚烷燃烧热的热化学方程式
(3)目前汽车主要使用燃料为汽油。“辛烷值”用来表示汽油的质量。异辛烷用作抗爆性优良的标准,辛烷值为100。正庚烷用作抗爆性低劣的标准,辛烷值为0。如图是异辛烷的球棍模型:

①1mol异辛烷和1mol正庚烷分别完全燃烧生成水和二氧化碳,消耗氧气的质量之差是
②异辛烷的同分异构体有很多,其中一种同分异构体X,其一氯代物只有一种结构,则X的结构简式为
(4)车用燃料在使用过程中会产生汽车尾气(主要含有一氧化碳,一氧化氮),是造成空气污染的主要因素之一。可在汽车尾气系统中安装催化转化器,使CO和NO在催化剂的作用下反应生成两种无污染的气体。其中,氮气和氧气反应生成一氧化氮的能量变化如图所示,则由该反应生成2mol NO(g),对应热化学方程式的△H=

您最近一年使用:0次
名校
2 . 肼(N2H4)是一种无色易溶于水的油状液体,具有碱性和极强的还原性,在工业生产中应用非常广泛。

(1)已知肼的球棍模型如图所示,写出肼的电子式:____________ 。
(2)已知1g肼(N2H4)气体燃烧生成氮气和水蒸气,放出16.7kJ的热量。写出该反应的热化学方程式:______________ 。
(3)目前正在研发的一-种肼燃料电池的结构如下图所示。
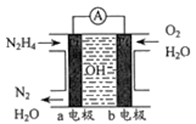
①该电池的负极是______ (填“a”或“b”)电极。
②写出正极的电极反应式:_____________ 。
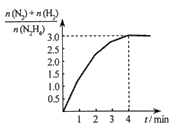
(4)在1L固定体积的容器中加入0.1molN2H4,在303K、Pt催化下发生反应:N2H4(l) N2(g)+2H2(g)。测得容器中
N2(g)+2H2(g)。测得容器中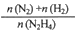 与时间关系如下图所示,则0~4min内氮气的平均反应速率v(N2)=
与时间关系如下图所示,则0~4min内氮气的平均反应速率v(N2)=______ 。

(1)已知肼的球棍模型如图所示,写出肼的电子式:
(2)已知1g肼(N2H4)气体燃烧生成氮气和水蒸气,放出16.7kJ的热量。写出该反应的热化学方程式:
(3)目前正在研发的一-种肼燃料电池的结构如下图所示。

①该电池的负极是
②写出正极的电极反应式:
(4)在1L固定体积的容器中加入0.1molN2H4,在303K、Pt催化下发生反应:N2H4(l)
 N2(g)+2H2(g)。测得容器中
N2(g)+2H2(g)。测得容器中 与时间关系如下图所示,则0~4min内氮气的平均反应速率v(N2)=
与时间关系如下图所示,则0~4min内氮气的平均反应速率v(N2)=
您最近一年使用:0次
2018-07-04更新
|
367次组卷
|
3卷引用:【全国百强校】江苏省常熟中学2017-2018学年高一下学期期末调研测试化学试题
名校
3 . 社会在飞速发展,环境问题也备受关注,如何减少污染,寻求清洁能源是现代学者研究的方向。
Ⅰ、为了模拟汽车尾气在催化转化器内的工作情况
(1)控制条件,让反应在恒容密闭容器中进行如下反应:2NO(g)+2CO(g) N2(g)+2CO2(g),用传感器测得不同时间NO和CO的浓度如下表:
N2(g)+2CO2(g),用传感器测得不同时间NO和CO的浓度如下表:
前2s内的平均反应速率v(N2)=_______
(2)用氨气催化氧化还原法脱硝(NOx)
①根据下图 (纵坐标是脱硝效率、横坐标为氨氮物质的量之比),判断提高脱硝效率的最佳条件是:___ 。

②已知: N2(g)+O2(g)=2NO(g)△H=+akJ/mol
N2(g)+3H2(g) 2NH3(g)△H=-bk/mol
2NH3(g)△H=-bk/mol
2H2(g)+O2(g)=2H2O(g)△H=-ckJ/mol其中a、b、c均为大于0。
则放热反应:4NO(g)+4NH3(g)+O2(g) 4N2(g)+6H2O(g)△H=
4N2(g)+6H2O(g)△H=________ 。
Ⅱ、甲醇是一种很好的燃料
(1)在压强为0.1MPa条件下,a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)⇌CH3OH(l) △H<0 。为了寻找合成甲醇的适宜温度和压强,某同学设计了三组实验,部分实验条件已经填在了下面的实验设计表中.
表中剩余的实验数据:n=________ ,m=________ .
(2)CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。下列说法正确的是______________ (填序号)。
①电池放电时通入空气的电极为负极
②电池放电时,电解质溶液的碱性逐渐减弱
③电池放电时每消耗6.4 g CH3OH转移1.2 mol电子
④负极反应式为CH3OH+8OH--6e-=CO32-+6H2O
Ⅰ、为了模拟汽车尾气在催化转化器内的工作情况
(1)控制条件,让反应在恒容密闭容器中进行如下反应:2NO(g)+2CO(g)
 N2(g)+2CO2(g),用传感器测得不同时间NO和CO的浓度如下表:
N2(g)+2CO2(g),用传感器测得不同时间NO和CO的浓度如下表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)(10-4mol/L) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)(10-3mol/L) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
(2)用氨气催化氧化还原法脱硝(NOx)
①根据下图 (纵坐标是脱硝效率、横坐标为氨氮物质的量之比),判断提高脱硝效率的最佳条件是:

②已知: N2(g)+O2(g)=2NO(g)△H=+akJ/mol
N2(g)+3H2(g)
 2NH3(g)△H=-bk/mol
2NH3(g)△H=-bk/mol2H2(g)+O2(g)=2H2O(g)△H=-ckJ/mol其中a、b、c均为大于0。
则放热反应:4NO(g)+4NH3(g)+O2(g)
 4N2(g)+6H2O(g)△H=
4N2(g)+6H2O(g)△H=Ⅱ、甲醇是一种很好的燃料
(1)在压强为0.1MPa条件下,a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)⇌CH3OH(l) △H<0 。为了寻找合成甲醇的适宜温度和压强,某同学设计了三组实验,部分实验条件已经填在了下面的实验设计表中.
| 实验编号 | T(℃) | n(CO)/n(H2) | P(MPa) |
| ① | 180 | 2:3 | 0.1 |
| ② | n | 2:3 | 5 |
| ③ | 350 | m | 5 |
(2)CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。下列说法正确的是
①电池放电时通入空气的电极为负极
②电池放电时,电解质溶液的碱性逐渐减弱
③电池放电时每消耗6.4 g CH3OH转移1.2 mol电子
④负极反应式为CH3OH+8OH--6e-=CO32-+6H2O
您最近一年使用:0次
解题方法
4 . 近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)下列事实中,不能比较硫与氯元素非金属性强弱的是____________ (填标号)。
A.将Cl2通入Na2S溶液中,有黄色浑浊出现 B.比较次氯酸和硫酸的酸性强弱
C.氯气与铁反应生成氯化铁,硫和铁反应生成硫化亚铁 D.还原性:H2S>HCl
(2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(Ⅰ)和系统(Ⅱ)制备氢气的热化学方程式分别为___________ 、_______ ,制得等量H2所需能量较少的是_______ 。
(3)H2S与CO2在高温下发生反应:H2S(g)+CO2(g) COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①H2S的平衡转化率α1=______ %,反应平衡常数K=_____ 。(可用分数表示)
②在620 K重复试验,平衡后水的物质的量分数为0.03,H2S的转化率α2_________ α1,该反应的△H___ 0。(填“>”“<”或“=”)
③向反应器中再分别充入下列气体,能使H2S转化率增大的是____________ (填标号)
A.H2S B.CO2 C.COS D.N2
(1)下列事实中,不能比较硫与氯元素非金属性强弱的是
A.将Cl2通入Na2S溶液中,有黄色浑浊出现 B.比较次氯酸和硫酸的酸性强弱
C.氯气与铁反应生成氯化铁,硫和铁反应生成硫化亚铁 D.还原性:H2S>HCl
(2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(Ⅰ)和系统(Ⅱ)制备氢气的热化学方程式分别为
(3)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)
 COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。①H2S的平衡转化率α1=
②在620 K重复试验,平衡后水的物质的量分数为0.03,H2S的转化率α2
③向反应器中再分别充入下列气体,能使H2S转化率增大的是
A.H2S B.CO2 C.COS D.N2
您最近一年使用:0次
5 . 汽车、工厂等污染源排入大气的碳氢化合物和氮氧化物等一次污染物,在紫外光作用下发生光化学反应生成了二次污染物。光化学烟雾是一次污染物和二次污染物的混合物。
(1)汽车尾气中含有CO、NO及碳氢化合物等。
①CO的来源是_______ (用文字说明)。
②NO的来源是______ (用方程式说明)。
③C8H18在汽缸中可裂解生成丙烯和戊烷等,戊烷的同分异构体有______ 种。
(2)文献报道了一种研究模拟光化学烟雾产生的实验,将添加丙烯和NO的空气在烟雾箱中用紫外线照射,各物质浓度的消长关系如图所示:
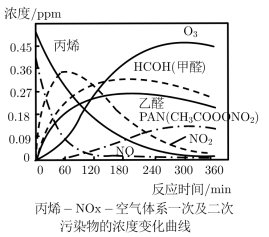
①下列说法正确的是_____ (填标号)。
A.O3具有强氧化性 B.在光反应过程中NO最终全部转变为NO2
C.二次污染物只有乙醛 D.0~120min生成PAN的反应速率最快
②写出CH3CH=CH2被O3氧化为甲醛和乙醛的化学方程式______ (注:每消耗1molO3,同时生成1molO2)。
(1)汽车尾气中含有CO、NO及碳氢化合物等。
①CO的来源是
②NO的来源是
③C8H18在汽缸中可裂解生成丙烯和戊烷等,戊烷的同分异构体有
(2)文献报道了一种研究模拟光化学烟雾产生的实验,将添加丙烯和NO的空气在烟雾箱中用紫外线照射,各物质浓度的消长关系如图所示:

①下列说法正确的是
A.O3具有强氧化性 B.在光反应过程中NO最终全部转变为NO2
C.二次污染物只有乙醛 D.0~120min生成PAN的反应速率最快
②写出CH3CH=CH2被O3氧化为甲醛和乙醛的化学方程式
您最近一年使用:0次
名校
解题方法
6 . 每到冬季,雾霾天气肆虐京津冀等地区。其中,燃煤和汽车尾气是造成空气污染的原因之一。
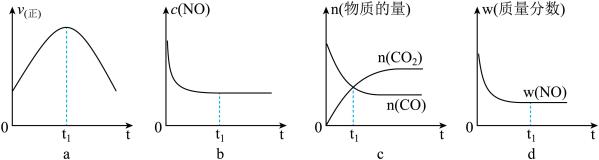
(l)汽车尾气净化的主要原理为:2NO(g)+2CO(g) 2CO2(g)+N2(g)△H<0。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是
2CO2(g)+N2(g)△H<0。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是________________ (填代号)。
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol ①
2NO2(g)⇌N2O4(g) △H=-56.9 kJ/mol ②
H2O(g)=H2O(l) △H=-44.0 kJ/mol ③
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式__________________ 。
(3)甲烷燃料电池可以提升能量利用率。
①碱性介质中甲烷燃料电池的负极反应式_________________________ 。
②如果电路上有0.1mol电子通过,理论上消耗标准状况下氧气的体积为_______ 。
(4)已知燃料电池的比能量与单位质量的燃料失去的电子数成正比。理论上,氢气、甲烷、甲醇燃料电池的比能量从大到小的顺序是_________ 。
(l)汽车尾气净化的主要原理为:2NO(g)+2CO(g)
 2CO2(g)+N2(g)△H<0。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是
2CO2(g)+N2(g)△H<0。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol ①
2NO2(g)⇌N2O4(g) △H=-56.9 kJ/mol ②
H2O(g)=H2O(l) △H=-44.0 kJ/mol ③
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式
(3)甲烷燃料电池可以提升能量利用率。
①碱性介质中甲烷燃料电池的负极反应式
②如果电路上有0.1mol电子通过,理论上消耗标准状况下氧气的体积为
(4)已知燃料电池的比能量与单位质量的燃料失去的电子数成正比。理论上,氢气、甲烷、甲醇燃料电池的比能量从大到小的顺序是
您最近一年使用:0次
名校
7 . (1)某小组同学在烧杯中加入5mL1.0mol/L盐酸,再放入用砂纸打磨过的铝条,观察产生H2的速率,如图A所示,则该反应是_____________ (填“吸热”或“放热”)反应,其能量变化可用图中的____________ (填“B”或“C”)表示。

(2)已知拆开1molH-H键、1molN≡N键、lmolN-H键分别需要吸收的能量为436kJ、946kJ、391kJ。则生成1mol NH3时反应___________ (填“放出”或“吸收”)________ kJ 的热量。
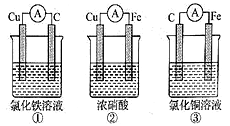
(3)为了验证Fe2+与Cu2+氧化性强弱,下列装置能达到实验目的的是______ (填序号),写出正极的电极反应_____________________ 。若构建原电池时两个电极的质量相等,当导线中通过0.05mol电子时,两个电极的质量差为________ g。

(2)已知拆开1molH-H键、1molN≡N键、lmolN-H键分别需要吸收的能量为436kJ、946kJ、391kJ。则生成1mol NH3时反应
(3)为了验证Fe2+与Cu2+氧化性强弱,下列装置能达到实验目的的是

您最近一年使用:0次
2018-06-23更新
|
131次组卷
|
3卷引用:【全国百强校】江西省高安中学2017-2018学年高一6月月考(创新班)化学试题
名校
8 . 能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务。
(1)天然气和可燃冰(mCH4·nH2O)既是高效洁净的能源,也是重要的化工原料,
①甲烷分子的空间构型为__________ ,可燃冰(mCH4·nH2O)属于________ 晶体。
②已知25℃、101kPa时,1g甲烷完全燃烧生成液态水放出55.65kJ热量,则该条件下反应
CH4(g)+2O2(g)=CO2(g)+2H2O(l)的△H=______ kJ·mol-1
(2)用甲烷-氧气碱性(KOH溶液)燃料电池作电源,电解CuCl2溶液。反应装置如下图所示:
①b电极名称为___________ ,d电极的电极反应式为_________ 。
②假设CuCl2溶液足量,当某电极上析出3.2g金属Cu时,理论上燃料电池消耗氧气在标准状况下的体积是______ mL。
(3)在相同条件下,下面各组热化学方程式中,△H1<△H2的是________ 。(填字母)
A组:2H2(g)+O2(g)=2H2O(g) △H12H2(g)+O2(g)═2H2O(l) △H2
B组:S(g)+O2(g)=SO2(g) △H1S(s)+O2(g)=SO2(g) △H2
C组:C(s)+1/2O2(g)=CO(g) △H1C(s)+O2(g)=CO2(g) △H2
D组:CO(g)+1/2O2(g)=CO2(g) △H12CO(g)+O2(g)=2CO2(g) △H2
(4)25℃,10lkPa条件下,14gN2和3gH2应生成NH3的能量变化如下图所示:
已知:①x=1127;
②25℃101kPa下,N2(g)+3H2(g) 2NH3(g) △H=-92kJ·mol-1。则y=
2NH3(g) △H=-92kJ·mol-1。则y=___________ 。
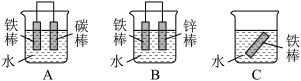
(5)金属材料的腐蚀是人类面临的严重问题,金属的防腐对节约能源、保护环境起着十分重要的作用。下列三个装置中,铁被腐蚀速率由快到慢的顺序为_________ (填字母)。
(1)天然气和可燃冰(mCH4·nH2O)既是高效洁净的能源,也是重要的化工原料,
①甲烷分子的空间构型为
②已知25℃、101kPa时,1g甲烷完全燃烧生成液态水放出55.65kJ热量,则该条件下反应
CH4(g)+2O2(g)=CO2(g)+2H2O(l)的△H=
(2)用甲烷-氧气碱性(KOH溶液)燃料电池作电源,电解CuCl2溶液。反应装置如下图所示:

①b电极名称为
②假设CuCl2溶液足量,当某电极上析出3.2g金属Cu时,理论上燃料电池消耗氧气在标准状况下的体积是
(3)在相同条件下,下面各组热化学方程式中,△H1<△H2的是
A组:2H2(g)+O2(g)=2H2O(g) △H12H2(g)+O2(g)═2H2O(l) △H2
B组:S(g)+O2(g)=SO2(g) △H1S(s)+O2(g)=SO2(g) △H2
C组:C(s)+1/2O2(g)=CO(g) △H1C(s)+O2(g)=CO2(g) △H2
D组:CO(g)+1/2O2(g)=CO2(g) △H12CO(g)+O2(g)=2CO2(g) △H2
(4)25℃,10lkPa条件下,14gN2和3gH2应生成NH3的能量变化如下图所示:

已知:①x=1127;
②25℃101kPa下,N2(g)+3H2(g)
 2NH3(g) △H=-92kJ·mol-1。则y=
2NH3(g) △H=-92kJ·mol-1。则y=(5)金属材料的腐蚀是人类面临的严重问题,金属的防腐对节约能源、保护环境起着十分重要的作用。下列三个装置中,铁被腐蚀速率由快到慢的顺序为
您最近一年使用:0次
2017-05-03更新
|
338次组卷
|
2卷引用:江苏省宿迁市名校2016-2017学年高一下学期期中考试化学试题
名校
解题方法
9 . CO2是一种主要的温室气体,研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)金刚石和石墨燃烧反应中的能量变化如图所示。在通常状况下,金刚石和石墨中,__ (填“金刚石”或“石墨”)更稳定,石墨的燃烧热ΔH为___ 。

(2)采用电化学法可将二氧化碳转化为甲烷,试写出以氢氧化钾水溶液作电解质溶液时,该转化的电极反应式为___ 。
(3)以CO2为原料还可以合成多种物质。工业上常以CO2(g)与H2(g)为原料合成乙醇。
①已知:H2O(l)=H2O(g) △H=+44kJ·mol-1
CO(g)+H2O(g) CO2(g)+H2(g) △H=-41.2kJ·mol-1
CO2(g)+H2(g) △H=-41.2kJ·mol-1
2CO(g)+4H2(g) CH3CH2OH(g)+H2O(g) △H=-256.1kJ·mol-1
CH3CH2OH(g)+H2O(g) △H=-256.1kJ·mol-1
则:CO2气体与氢气反应生成气态乙醇和液态水的热化学方程式为___ 。
②如图是一种以烟道气为原料合成乙醇的工作原理示意图。对该流程的分析,下列说法正确的是___ 。
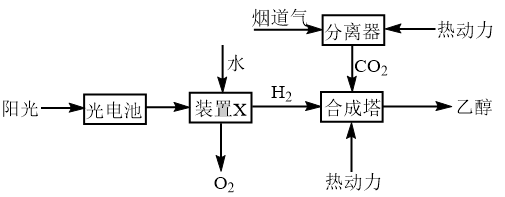
A.该流程至少包含4种形式的能量转化
B.装置X中为了增强水的导电性,通常向其中加入少量Na2SO4或NaOH
C.合成塔中生成乙醇的反应是化合反应
D.流程设计体现了绿色化学思想
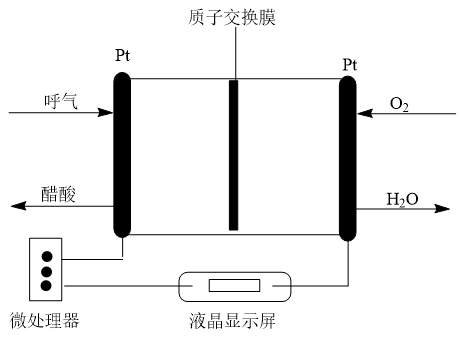
③如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。该电池负极的电极反应式为_____ 。
(1)金刚石和石墨燃烧反应中的能量变化如图所示。在通常状况下,金刚石和石墨中,

(2)采用电化学法可将二氧化碳转化为甲烷,试写出以氢氧化钾水溶液作电解质溶液时,该转化的电极反应式为
(3)以CO2为原料还可以合成多种物质。工业上常以CO2(g)与H2(g)为原料合成乙醇。
①已知:H2O(l)=H2O(g) △H=+44kJ·mol-1
CO(g)+H2O(g)
 CO2(g)+H2(g) △H=-41.2kJ·mol-1
CO2(g)+H2(g) △H=-41.2kJ·mol-12CO(g)+4H2(g)
 CH3CH2OH(g)+H2O(g) △H=-256.1kJ·mol-1
CH3CH2OH(g)+H2O(g) △H=-256.1kJ·mol-1则:CO2气体与氢气反应生成气态乙醇和液态水的热化学方程式为
②如图是一种以烟道气为原料合成乙醇的工作原理示意图。对该流程的分析,下列说法正确的是

A.该流程至少包含4种形式的能量转化
B.装置X中为了增强水的导电性,通常向其中加入少量Na2SO4或NaOH
C.合成塔中生成乙醇的反应是化合反应
D.流程设计体现了绿色化学思想
③如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。该电池负极的电极反应式为

您最近一年使用:0次
解题方法
10 . 完成下列题目:
(1)现有如下两个反应:
A.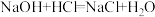
B.
①根据两反应本质判断,_____________ 能设计成原电池(填“A”或“B”)。
②如果(A或B)不能,说明其原因________________________________ 。
(2)研究大气中含硫化合物(主要是SO2和H2S)的转化具有重要意义。
①高湿条件下,写出大气中SO2转化为 的方程式:
的方程式:_____________ 。
②土壤中的微生物可将大气中H2S经两步反应氧化成,两步反应的能量变化示意图如下:

1mol H2S(g)全部氧化成 (aq)的热化学方程式为
(aq)的热化学方程式为___________________ 。
(3)二氧化硫—空气质子交换膜燃料电池可以利用大气所含SO2快速启动,其装置示意图如下:

质子的流动方向为___________ (“从A到B”或“从B到A”)。
(1)现有如下两个反应:
A.
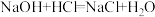
B.

①根据两反应本质判断,
②如果(A或B)不能,说明其原因
(2)研究大气中含硫化合物(主要是SO2和H2S)的转化具有重要意义。
①高湿条件下,写出大气中SO2转化为
 的方程式:
的方程式:②土壤中的微生物可将大气中H2S经两步反应氧化成,两步反应的能量变化示意图如下:

1mol H2S(g)全部氧化成
 (aq)的热化学方程式为
(aq)的热化学方程式为(3)二氧化硫—空气质子交换膜燃料电池可以利用大气所含SO2快速启动,其装置示意图如下:

质子的流动方向为
您最近一年使用:0次



