1 . Ⅰ.(1) P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是______
a.NH3 b.HI c.SO2 d.CO2
(2)工业生产甲醇的常用方法是:CO(g)+2H2(g) CH3OH(g) △H1 = —90.8kJ/mol。
CH3OH(g) △H1 = —90.8kJ/mol。
已知:2H2(g)+O2(g)=2H2O(l) △H2 = -571.6kJ/mol;
2CO(g)+O2(g)=2CO2(g) △H3= -566.0kJ/mol
计算2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) △H4 =___________ 。
(3)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4 + 3Zn ="=" Fe2O3 +ZnO +2K2ZnO2
该电池正极发生的反应的电极反应式为____________________________ 。
II.用如图所示装置进行实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。
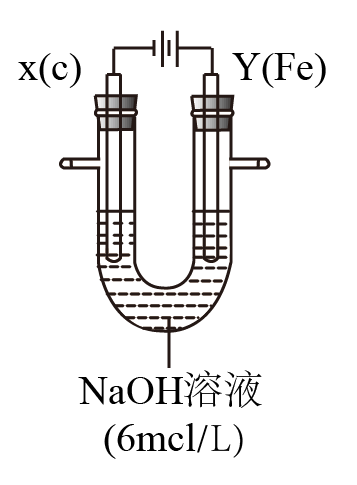
(4)电解过程中,X极区溶液的pH____________ (填“增大” 、“减小”或“不变”)。
(5)电解过程中,Y极发生的电极反应为Fe - 6e- + 8OH-=FeO42- + 4H2O和___________________ 。
(6)若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少___________ g。
a.NH3 b.HI c.SO2 d.CO2
(2)工业生产甲醇的常用方法是:CO(g)+2H2(g)
 CH3OH(g) △H1 = —90.8kJ/mol。
CH3OH(g) △H1 = —90.8kJ/mol。已知:2H2(g)+O2(g)=2H2O(l) △H2 = -571.6kJ/mol;
2CO(g)+O2(g)=2CO2(g) △H3= -566.0kJ/mol
计算2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) △H4 =
(3)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4 + 3Zn ="=" Fe2O3 +ZnO +2K2ZnO2
该电池正极发生的反应的电极反应式为
II.用如图所示装置进行实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。

(4)电解过程中,X极区溶液的pH
(5)电解过程中,Y极发生的电极反应为Fe - 6e- + 8OH-=FeO42- + 4H2O和
(6)若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少
您最近一年使用:0次
2016-12-09更新
|
122次组卷
|
3卷引用:2016届黑龙江双鸭山第一中学高三上学期期中测试化学试卷
名校
解题方法
2 . A、B是中学化学常见的化合物,它们各由两种元素组成;乙为元素R组成的单质,它们之间存在如图所示关系.根据要求回答问题:

 如图三个反应中,属于氧化还原反应的有
如图三个反应中,属于氧化还原反应的有______ 个.
 若元素R与氧同主族,下列事实能说明R与氧的非金属性相对强弱的有
若元素R与氧同主族,下列事实能说明R与氧的非金属性相对强弱的有______ .
A.还原性: B.酸性:
B.酸性:
C.稳定性: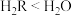 C.沸点:
C.沸点: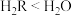
 若化合物B常温下为气体,其水溶液呈碱性
若化合物B常温下为气体,其水溶液呈碱性 答题必须用具体物质表示
答题必须用具体物质表示 .
.
 化合物B的电子式为
化合物B的电子式为______ ;其水溶液呈碱性的原因是______  用离子方程式表示
用离子方程式表示 .
.
 化合物B可与
化合物B可与 组成燃料电池
组成燃料电池 氢氧化钾溶液为电解质溶液
氢氧化钾溶液为电解质溶液 ,其反应产物与反应Ⅲ相同.写出该电池负极的电极反应式
,其反应产物与反应Ⅲ相同.写出该电池负极的电极反应式______ .
 当1mol的化合物B分别参与反应Ⅱ、Ⅲ时,热效应为
当1mol的化合物B分别参与反应Ⅱ、Ⅲ时,热效应为 和
和 ,则反应Ⅰ的热化学方程式为
,则反应Ⅰ的热化学方程式为______  注:反应条件相同、所有物质均为气体
注:反应条件相同、所有物质均为气体 .
.

 如图三个反应中,属于氧化还原反应的有
如图三个反应中,属于氧化还原反应的有 若元素R与氧同主族,下列事实能说明R与氧的非金属性相对强弱的有
若元素R与氧同主族,下列事实能说明R与氧的非金属性相对强弱的有A.还原性:
 B.酸性:
B.酸性:
C.稳定性:
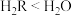 C.沸点:
C.沸点: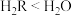
 若化合物B常温下为气体,其水溶液呈碱性
若化合物B常温下为气体,其水溶液呈碱性 答题必须用具体物质表示
答题必须用具体物质表示 .
. 化合物B的电子式为
化合物B的电子式为 用离子方程式表示
用离子方程式表示 .
. 化合物B可与
化合物B可与 组成燃料电池
组成燃料电池 氢氧化钾溶液为电解质溶液
氢氧化钾溶液为电解质溶液 ,其反应产物与反应Ⅲ相同.写出该电池负极的电极反应式
,其反应产物与反应Ⅲ相同.写出该电池负极的电极反应式 当1mol的化合物B分别参与反应Ⅱ、Ⅲ时,热效应为
当1mol的化合物B分别参与反应Ⅱ、Ⅲ时,热效应为 和
和 ,则反应Ⅰ的热化学方程式为
,则反应Ⅰ的热化学方程式为 注:反应条件相同、所有物质均为气体
注:反应条件相同、所有物质均为气体 .
.
您最近一年使用:0次
2020-01-04更新
|
376次组卷
|
5卷引用:2015届福建省龙岩市高三5月教学质量检查理综化学试卷
名校
3 . 氮的重要化合物如氨(NH3)、肼(N2H4)、三氟化氮(NF3)等,在生产、生活中具有重要作用。
(1) 利用NH3的还原性可消除氮氧化物的污染,相关热化学方程式如下:
H2O(l)=H2O(g) △H1=44.0 kJ·mol-1
N2(g)+O2(g)=2NO(g) △H2=229.3 kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H3=-906.5 kJ·mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H4
则△H4=_______ kJ·mol-1。
(2)使用NaBH4为诱导剂,可使Co2+与肼在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体。
① 写出该反应的离子方程式:________ 。
② 在纳米钴的催化作用下,肼可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如下图1所示,则N2H4发生分解反应的化学方程式为:________ ;为抑制肼的分解,可采取的合理措施有________ (任写一种)。
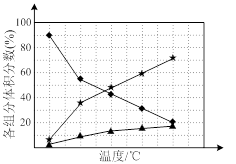
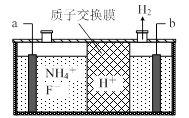
图1 图2
(3)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如上图2所示。
① 氮化硅的化学式为___________________ 。
② a电极为电解池的_____________ (填“阴”或“阳”)极,写出该电极的电极反应式:________________ ;电解过程中还会生成少量氧化性极强的气体单质,该气体的分子式是_______________ 。
(1) 利用NH3的还原性可消除氮氧化物的污染,相关热化学方程式如下:
H2O(l)=H2O(g) △H1=44.0 kJ·mol-1
N2(g)+O2(g)=2NO(g) △H2=229.3 kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H3=-906.5 kJ·mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H4
则△H4=
(2)使用NaBH4为诱导剂,可使Co2+与肼在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体。
① 写出该反应的离子方程式:
② 在纳米钴的催化作用下,肼可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如下图1所示,则N2H4发生分解反应的化学方程式为:


图1 图2
(3)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如上图2所示。
① 氮化硅的化学式为
② a电极为电解池的
您最近一年使用:0次
2016-01-21更新
|
369次组卷
|
3卷引用:2015届江苏省南通、扬州、连云港高三第二次调研测试化学试卷
4 . 氨氮(NH3、NH4+等)是一种重要污染物,可利用合适的氧化剂氧化去除。
(1)氯气与水反应产生的HClO可去除废水中含有的NH3。
已知:NH3(aq)+HClO(aq)=NH2Cl(aq)+H2O(l) ΔH=a kJ·mol-1
2NH2Cl(aq)+HClO(aq)=N2(g)+H2O(l)+3H+(aq)+3Cl-(aq) ΔH=b kJ·mol-1
则反应2NH3(aq)+3HClO(aq)=N2(g)+3H2O(l)+3H+(aq)+3Cl-(aq)的ΔH=________ kJ·mol-1。
(2)在酸性废水中加入NaCl进行电解,阳极产生的HClO可氧化氨氮。电解过程中,废水中初始Cl-浓度对氨氮去除速率及能耗(处理一定量氨氮消耗的电能)的影响如图所示。
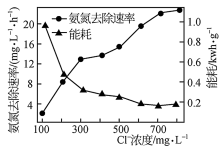
①写出电解时阳极的电极反应式:________________ 。
②当Cl-浓度减小时,氨氮去除速率下降,能耗却增加的原因是____________________________ 。
③保持加入NaCl的量不变,当废水的pH低于4时,氨氮去除速率也会降低的原因是____________________________ 。
(3)高铁酸钾(K2FeO4)是一种高效氧化剂,可用于氨氮处理。K2FeO4在干燥空气中和强碱性溶液中能稳定存在。氧化剂的氧化性受溶液中的H+浓度影响较大。
①碱性条件下K2FeO4可将水中的NH3转化为N2除去,该反应的离子方程式为________________________________ 。
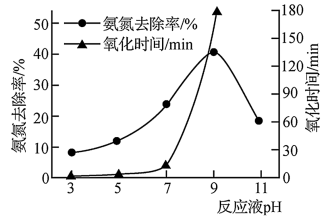
②用K2FeO4氧化含氨氮废水,其他条件相同时,废水pH对氧化氨氮去除率及氧化时间的影响如图所示。当pH小于9时,随着pH的增大,氨氮去除率增大、氧化时间明显增长的原因是_________________ 。
(1)氯气与水反应产生的HClO可去除废水中含有的NH3。
已知:NH3(aq)+HClO(aq)=NH2Cl(aq)+H2O(l) ΔH=a kJ·mol-1
2NH2Cl(aq)+HClO(aq)=N2(g)+H2O(l)+3H+(aq)+3Cl-(aq) ΔH=b kJ·mol-1
则反应2NH3(aq)+3HClO(aq)=N2(g)+3H2O(l)+3H+(aq)+3Cl-(aq)的ΔH=
(2)在酸性废水中加入NaCl进行电解,阳极产生的HClO可氧化氨氮。电解过程中,废水中初始Cl-浓度对氨氮去除速率及能耗(处理一定量氨氮消耗的电能)的影响如图所示。

①写出电解时阳极的电极反应式:
②当Cl-浓度减小时,氨氮去除速率下降,能耗却增加的原因是
③保持加入NaCl的量不变,当废水的pH低于4时,氨氮去除速率也会降低的原因是
(3)高铁酸钾(K2FeO4)是一种高效氧化剂,可用于氨氮处理。K2FeO4在干燥空气中和强碱性溶液中能稳定存在。氧化剂的氧化性受溶液中的H+浓度影响较大。
①碱性条件下K2FeO4可将水中的NH3转化为N2除去,该反应的离子方程式为
②用K2FeO4氧化含氨氮废水,其他条件相同时,废水pH对氧化氨氮去除率及氧化时间的影响如图所示。当pH小于9时,随着pH的增大,氨氮去除率增大、氧化时间明显增长的原因是

您最近一年使用:0次
2020-04-14更新
|
462次组卷
|
2卷引用:江苏省苏锡常镇四市2020届高三教学情况调查(一) 化学试题
解题方法
5 . 空气污染问题日益引起全民关注。
(1)汽车尾气中存在大量的CO、NO、NO2和碳氢化合物,可采用铂等贵金属作为催化剂,使CO和NO转化为无毒的气体,请写出其化学方程式____________________________
(2)科研工作者研究出利用石灰乳除工业燃煤尾气中的硫 (SO2、SO3)和氮 (NO、NO2)的新工艺,既能净化尾气,又能获得应用广泛的CaSO4 和Ca(NO3)2 。

①硫酸型酸雨的形成过程是大气中的SO2 溶于雨水生成某种弱酸,在空气中经催化氧化生成硫酸,该过程中反应的化学方程式为____________________________ 、 ______________________________
②CaSO4 可以调节水泥的硬化时间。尾气中 SO2 与石灰乳反应生成CaSO4 的化学方程式为___________________________
③ Ca(NO3)2可制成混凝土防冻剂、钢筋阻锈剂等.尾气中NO、NO2与石灰乳反应生成Ca(NO3)2的化学方程式___________________________
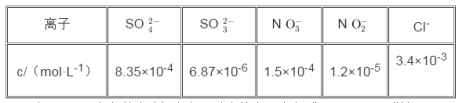
(3)还可用NaClO2溶液(溶液呈碱性)作为吸收剂,对含有SO2和NOX的燃煤烟气进行脱硫、脱硝。(已知:酸性条件下,ClO2-会转化成ClO2和Cl-。ClO2是黄绿色、易溶于水的气体,具有强氧化性,能氧化SO2或NOX)在鼓泡反应期中通入含SO2和NO的烟气,反应温度为323K,NaClO2溶液的浓度为5×10-3mol·L-1。反应一段时间后溶液中离子浓度的分析结果如下表。
①写出NaClO2溶液脱硝过程中主要反应的离子方程式_____________________________ 。增加压强,NO的转化率_______ (填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐__________ (填“提高”、“不变”或“减小”)。
(1)汽车尾气中存在大量的CO、NO、NO2和碳氢化合物,可采用铂等贵金属作为催化剂,使CO和NO转化为无毒的气体,请写出其化学方程式
(2)科研工作者研究出利用石灰乳除工业燃煤尾气中的硫 (SO2、SO3)和氮 (NO、NO2)的新工艺,既能净化尾气,又能获得应用广泛的CaSO4 和Ca(NO3)2 。

①硫酸型酸雨的形成过程是大气中的SO2 溶于雨水生成某种弱酸,在空气中经催化氧化生成硫酸,该过程中反应的化学方程式为
②CaSO4 可以调节水泥的硬化时间。尾气中 SO2 与石灰乳反应生成CaSO4 的化学方程式为
③ Ca(NO3)2可制成混凝土防冻剂、钢筋阻锈剂等.尾气中NO、NO2与石灰乳反应生成Ca(NO3)2的化学方程式
(3)还可用NaClO2溶液(溶液呈碱性)作为吸收剂,对含有SO2和NOX的燃煤烟气进行脱硫、脱硝。(已知:酸性条件下,ClO2-会转化成ClO2和Cl-。ClO2是黄绿色、易溶于水的气体,具有强氧化性,能氧化SO2或NOX)在鼓泡反应期中通入含SO2和NO的烟气,反应温度为323K,NaClO2溶液的浓度为5×10-3mol·L-1。反应一段时间后溶液中离子浓度的分析结果如下表。

①写出NaClO2溶液脱硝过程中主要反应的离子方程式
②随着吸收反应的进行,吸收剂溶液的pH逐渐
您最近一年使用:0次
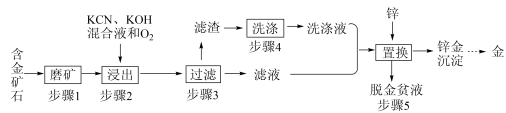
6 . 金是一种用途广泛的贵重金属。某化工厂利用氰化法从一种含金矿石中提取金的工艺流程如下:
资料:
① Zn + O2 + H2O = Zn(OH)2
O2 + H2O = Zn(OH)2
② Zn2+(aq) Zn(CN)2(s)
Zn(CN)2(s)  Zn(CN)42-(aq)
Zn(CN)42-(aq)
(1)步骤2中发生的反应有:
① 2Au(s) + 4CN-(aq) + 2H2O(l) + O2(g) = 2Au(CN)2-(aq) + 2OH-(aq) + H2O2(aq) ∆H = -197.61 kJ·mol-1
② 2Au(s) + 4CN-(aq)+ H2O2(aq) = 2Au(CN)2-(aq) + 2OH-(aq) ∆H = -386.93 kJ·mol-1
则2Au(s)+ 4CN-(aq)+ H2O(l) + 1/2O2(g) = 2Au(CN)2-(aq) + 2OH-(aq)的∆H =_______ 。
(2)下图是步骤2中金的溶解速率与温度的关系。80℃以后溶解速率降低的原因是___________ 。

(3)步骤4的目的是_________________ 。
(4)步骤5置换的总反应是:
2Au(CN)2- + 3Zn + 4CN- + 2H2O = 2Au + 2Zn(CN)42- + ZnO22- + 2H2↑
则以下说法正确的是________ (填字母序号)。
A 步骤5进行时要先脱氧,否则会增加锌的用量
B 若溶液中c(CN-)过小,会生成Zn(CN)2,减缓置换速率
C 实际生产中加入适量Pb(NO3)2的目的是形成原电池加快置换速率
(5)脱金贫液(主要含有CN-)会破坏环境,影响人类健康,可通过化学方法转化为无毒废水净化排放。碱性条件下,用Cl2将贫液中的CN-氧化成无毒的CO2和N2,该反应的离子方程式为_______________ 。

资料:
① Zn +
 O2 + H2O = Zn(OH)2
O2 + H2O = Zn(OH)2② Zn2+(aq)
 Zn(CN)2(s)
Zn(CN)2(s)  Zn(CN)42-(aq)
Zn(CN)42-(aq)(1)步骤2中发生的反应有:
① 2Au(s) + 4CN-(aq) + 2H2O(l) + O2(g) = 2Au(CN)2-(aq) + 2OH-(aq) + H2O2(aq) ∆H = -197.61 kJ·mol-1
② 2Au(s) + 4CN-(aq)+ H2O2(aq) = 2Au(CN)2-(aq) + 2OH-(aq) ∆H = -386.93 kJ·mol-1
则2Au(s)+ 4CN-(aq)+ H2O(l) + 1/2O2(g) = 2Au(CN)2-(aq) + 2OH-(aq)的∆H =
(2)下图是步骤2中金的溶解速率与温度的关系。80℃以后溶解速率降低的原因是

(3)步骤4的目的是
(4)步骤5置换的总反应是:
2Au(CN)2- + 3Zn + 4CN- + 2H2O = 2Au + 2Zn(CN)42- + ZnO22- + 2H2↑
则以下说法正确的是
A 步骤5进行时要先脱氧,否则会增加锌的用量
B 若溶液中c(CN-)过小,会生成Zn(CN)2,减缓置换速率
C 实际生产中加入适量Pb(NO3)2的目的是形成原电池加快置换速率
(5)脱金贫液(主要含有CN-)会破坏环境,影响人类健康,可通过化学方法转化为无毒废水净化排放。碱性条件下,用Cl2将贫液中的CN-氧化成无毒的CO2和N2,该反应的离子方程式为
您最近一年使用:0次
解题方法
7 . 已知反应 是可逆反应。设计如图装置(
是可逆反应。设计如图装置( 均为石墨电极),分别进行下述操作:
均为石墨电极),分别进行下述操作:

①向B烧杯中逐滴加入浓盐酸。②向B烧杯中逐滴加入 溶液。结果发现电流表指针均发生偏转。
溶液。结果发现电流表指针均发生偏转。
(1)①过程中 棒上发生的反应为
棒上发生的反应为_________ ;
②过程中 棒上发生的反应为
棒上发生的反应为___________ 。
(2)操作②过程中,盐桥中的 移向
移向_________ 烧杯溶液(填“A”或“B”)。
资料: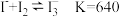 。向
。向 一定浓度的
一定浓度的 溶液中加入
溶液中加入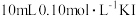 溶液,达平衡后,相关微粒浓度如下:
溶液,达平衡后,相关微粒浓度如下:
(3)a=________________ 。该平衡体系中除了含有 和
和 外,判断溶液是否一定还含有其他含碘微粒
外,判断溶液是否一定还含有其他含碘微粒______________ (填“是”或“否”)。
(4)已知:甲醇与水蒸气重整制氢可直接用于燃料电池。
反应:
反应: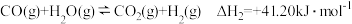
则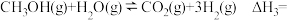
______________ 
(5)已知:25℃时,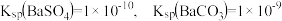 。医学上进行消化系统的X射线透视时,常使用
。医学上进行消化系统的X射线透视时,常使用 作内服造影剂。胃酸酸性很强(pH约为1),但服用大量
作内服造影剂。胃酸酸性很强(pH约为1),但服用大量 仍然是安全的,
仍然是安全的, 不溶于酸的原因是(用溶解平衡原理解释):
不溶于酸的原因是(用溶解平衡原理解释):_________ 。误服少量 ,应尽快用大量的一定浓度的
,应尽快用大量的一定浓度的 溶液给患者洗胃,忽略洗胃过程中
溶液给患者洗胃,忽略洗胃过程中 溶液浓度的变化,要使残留在胃液中的
溶液浓度的变化,要使残留在胃液中的 浓度为
浓度为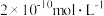 ,应服用的
,应服用的 溶液的最低浓度为
溶液的最低浓度为_______  。
。
 是可逆反应。设计如图装置(
是可逆反应。设计如图装置( 均为石墨电极),分别进行下述操作:
均为石墨电极),分别进行下述操作:
①向B烧杯中逐滴加入浓盐酸。②向B烧杯中逐滴加入
 溶液。结果发现电流表指针均发生偏转。
溶液。结果发现电流表指针均发生偏转。(1)①过程中
 棒上发生的反应为
棒上发生的反应为②过程中
 棒上发生的反应为
棒上发生的反应为(2)操作②过程中,盐桥中的
 移向
移向资料:
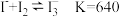 。向
。向 一定浓度的
一定浓度的 溶液中加入
溶液中加入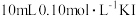 溶液,达平衡后,相关微粒浓度如下:
溶液,达平衡后,相关微粒浓度如下:| 微粒 |  |  |  |
浓度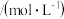 |  |  | a |
(3)a=
 和
和 外,判断溶液是否一定还含有其他含碘微粒
外,判断溶液是否一定还含有其他含碘微粒(4)已知:甲醇与水蒸气重整制氢可直接用于燃料电池。
反应:

反应:
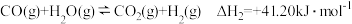
则
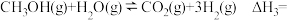

(5)已知:25℃时,
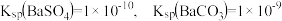 。医学上进行消化系统的X射线透视时,常使用
。医学上进行消化系统的X射线透视时,常使用 作内服造影剂。胃酸酸性很强(pH约为1),但服用大量
作内服造影剂。胃酸酸性很强(pH约为1),但服用大量 仍然是安全的,
仍然是安全的, 不溶于酸的原因是(用溶解平衡原理解释):
不溶于酸的原因是(用溶解平衡原理解释): ,应尽快用大量的一定浓度的
,应尽快用大量的一定浓度的 溶液给患者洗胃,忽略洗胃过程中
溶液给患者洗胃,忽略洗胃过程中 溶液浓度的变化,要使残留在胃液中的
溶液浓度的变化,要使残留在胃液中的 浓度为
浓度为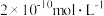 ,应服用的
,应服用的 溶液的最低浓度为
溶液的最低浓度为 。
。
您最近一年使用:0次
名校
解题方法
8 . 氨和二氧化碳都是重要的化工原料。
Ⅰ.氨在农业、化工和国防上意义重大。
(1)利用NH3的还原性可消除氮氧化物的污染,相关热化学方程式如下:
①N2(g)+O2(g)=2NO(g) ΔH1=+a kJ·mol-1
②4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH2=-b kJ·mol-1
4NO(g)+6H2O(g) ΔH2=-b kJ·mol-1
a、b均大于0,则反应4NH3(g)+6NO(g)=5N2(g)+6H2O(g)的ΔH3=___________ kJ·mol-1(用a、b表示)。
(2)工业上用氨催化氧化法制硝酸的主要反应是4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH<0,若其他条件不变,下列关系图错误的是
4NO(g)+6H2O(g) ΔH<0,若其他条件不变,下列关系图错误的是___________ (填标号)。
A. B.
B.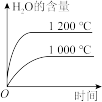 C.
C.
Ⅱ.以CO2和NH3为原料合成尿素的化学方程式为2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) ΔH<0。
CO(NH2)2(s)+H2O(g) ΔH<0。
(3)在一定的温度下,向2.0 L的密闭容器中通入0.2 mol NH3和0.1 mol CO2,测得反应时间与气体总压强p的数据如表所示:
平衡时NH3的转化率为___________ 。
(4)在恒容的绝热容器中投入0.2 mol NH3和0.1 mol CO2进行化学反应,下列可以说明该反应达到平衡状态的有___________ (填序号)。
①混合气体的平均摩尔质量不变 ②v正(H2O)=2v逆(NH3) ③化学平衡常数K不变 ④NH3和CO2物质的量的比值不变
Ⅲ.CO2溶于水形成H2CO3,已知常温下H2CO3的电离平衡常数Ka1=4.4×10-7,Ka2=4.7×10-11,NH3·H2O的电离平衡常数Kb=1.7×10-5
(5)NH4HCO3溶液呈___________ (填“酸性”“中性”或“碱性”);反应NH +HCO
+HCO +H2O
+H2O NH3·H2O+H2CO3的平衡常数K=
NH3·H2O+H2CO3的平衡常数K=___________ (保留3位有效数字)。
(6)25 ℃时,Al(OH)3的Ksp=8.0×10-33。若要使某铝盐溶液中的Al3+的浓度降至1.0×10-6 mol·L-1,则需要加氨水调节溶液的pH至___________ (已知lg5≈0.7)。
Ⅰ.氨在农业、化工和国防上意义重大。
(1)利用NH3的还原性可消除氮氧化物的污染,相关热化学方程式如下:
①N2(g)+O2(g)=2NO(g) ΔH1=+a kJ·mol-1
②4NH3(g)+5O2(g)
 4NO(g)+6H2O(g) ΔH2=-b kJ·mol-1
4NO(g)+6H2O(g) ΔH2=-b kJ·mol-1a、b均大于0,则反应4NH3(g)+6NO(g)=5N2(g)+6H2O(g)的ΔH3=
(2)工业上用氨催化氧化法制硝酸的主要反应是4NH3(g)+5O2(g)
 4NO(g)+6H2O(g) ΔH<0,若其他条件不变,下列关系图错误的是
4NO(g)+6H2O(g) ΔH<0,若其他条件不变,下列关系图错误的是A.
 B.
B.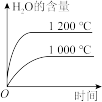 C.
C.
Ⅱ.以CO2和NH3为原料合成尿素的化学方程式为2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g) ΔH<0。
CO(NH2)2(s)+H2O(g) ΔH<0。(3)在一定的温度下,向2.0 L的密闭容器中通入0.2 mol NH3和0.1 mol CO2,测得反应时间与气体总压强p的数据如表所示:
| 时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 65 | 80 | 100 |
| 总压强p/ (100 kPa) | 9.0 | 7.5 | 6.3 | 5.7 | 5.2 | 4.9 | 4.6 | 4.5 | 4.5 |
平衡时NH3的转化率为
(4)在恒容的绝热容器中投入0.2 mol NH3和0.1 mol CO2进行化学反应,下列可以说明该反应达到平衡状态的有
①混合气体的平均摩尔质量不变 ②v正(H2O)=2v逆(NH3) ③化学平衡常数K不变 ④NH3和CO2物质的量的比值不变
Ⅲ.CO2溶于水形成H2CO3,已知常温下H2CO3的电离平衡常数Ka1=4.4×10-7,Ka2=4.7×10-11,NH3·H2O的电离平衡常数Kb=1.7×10-5
(5)NH4HCO3溶液呈
 +HCO
+HCO +H2O
+H2O NH3·H2O+H2CO3的平衡常数K=
NH3·H2O+H2CO3的平衡常数K=(6)25 ℃时,Al(OH)3的Ksp=8.0×10-33。若要使某铝盐溶液中的Al3+的浓度降至1.0×10-6 mol·L-1,则需要加氨水调节溶液的pH至
您最近一年使用:0次
解题方法
9 . C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的不利影响。
 尿素
尿素 是一种非常重要的高效氮肥,工业上以
是一种非常重要的高效氮肥,工业上以 、
、 为原料生产尿素,该反应实际为两步反应:
为原料生产尿素,该反应实际为两步反应:
第一步:

第二步:

写出工业上以 、
、 为原料合成尿素和
为原料合成尿素和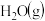 的热化学方程式:
的热化学方程式:_________ 。
 一定温度下,向
一定温度下,向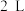 恒容密闭容器中通入
恒容密闭容器中通入 和
和 ,发生反应
,发生反应 。若反应进行到
。若反应进行到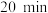 时达到平衡,测得
时达到平衡,测得 的体积分数为
的体积分数为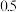 ,则前
,则前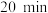 内平均反应速率
内平均反应速率
________ ,该温度下反应的化学平衡常数
________ 。
 工业上可用NaClO碱性溶液或“亚硫酸盐法”吸收
工业上可用NaClO碱性溶液或“亚硫酸盐法”吸收 。
。
 为了提高吸收效率,常用
为了提高吸收效率,常用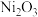 作为催化剂。催化过程如图1所示。
作为催化剂。催化过程如图1所示。
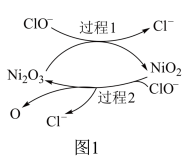
 过程2的反应式为
过程2的反应式为____________ 。
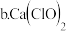 也可用于脱硫,且脱硫效果比NaClO更好,原因是
也可用于脱硫,且脱硫效果比NaClO更好,原因是_________ 。
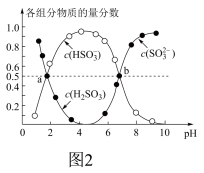
 室温下,
室温下, 溶液中含硫组分物质的量分数随溶液pH的变化关系如图2所示,b点时溶液
溶液中含硫组分物质的量分数随溶液pH的变化关系如图2所示,b点时溶液 ,则
,则
________ 。
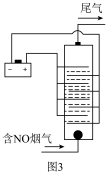
 用食盐水作电解液电解烟气脱氮的原理如图3所示,碱性条件下NO被阳极产生的
用食盐水作电解液电解烟气脱氮的原理如图3所示,碱性条件下NO被阳极产生的 氧化为
氧化为 ,尾气经氢氧化钠溶液吸收后排入空气。碱性条件下NO被阳极产生的氧化性物质氧化为
,尾气经氢氧化钠溶液吸收后排入空气。碱性条件下NO被阳极产生的氧化性物质氧化为 的离子方程式为
的离子方程式为________ 。
 尿素
尿素 是一种非常重要的高效氮肥,工业上以
是一种非常重要的高效氮肥,工业上以 、
、 为原料生产尿素,该反应实际为两步反应:
为原料生产尿素,该反应实际为两步反应:第一步:


第二步:


写出工业上以
 、
、 为原料合成尿素和
为原料合成尿素和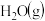 的热化学方程式:
的热化学方程式: 一定温度下,向
一定温度下,向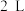 恒容密闭容器中通入
恒容密闭容器中通入 和
和 ,发生反应
,发生反应 。若反应进行到
。若反应进行到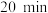 时达到平衡,测得
时达到平衡,测得 的体积分数为
的体积分数为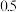 ,则前
,则前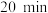 内平均反应速率
内平均反应速率

 工业上可用NaClO碱性溶液或“亚硫酸盐法”吸收
工业上可用NaClO碱性溶液或“亚硫酸盐法”吸收 。
。 为了提高吸收效率,常用
为了提高吸收效率,常用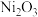 作为催化剂。催化过程如图1所示。
作为催化剂。催化过程如图1所示。
 过程2的反应式为
过程2的反应式为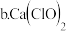 也可用于脱硫,且脱硫效果比NaClO更好,原因是
也可用于脱硫,且脱硫效果比NaClO更好,原因是 室温下,
室温下, 溶液中含硫组分物质的量分数随溶液pH的变化关系如图2所示,b点时溶液
溶液中含硫组分物质的量分数随溶液pH的变化关系如图2所示,b点时溶液 ,则
,则

 用食盐水作电解液电解烟气脱氮的原理如图3所示,碱性条件下NO被阳极产生的
用食盐水作电解液电解烟气脱氮的原理如图3所示,碱性条件下NO被阳极产生的 氧化为
氧化为 ,尾气经氢氧化钠溶液吸收后排入空气。碱性条件下NO被阳极产生的氧化性物质氧化为
,尾气经氢氧化钠溶液吸收后排入空气。碱性条件下NO被阳极产生的氧化性物质氧化为 的离子方程式为
的离子方程式为
您最近一年使用:0次
解题方法
10 . C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的不利影响。
(1)尿素[CO(NH2)2]是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为两步反应:
第一步:2NH3(g)+CO2(g)⇌H2NCOONH4(s) ΔH=-272kJ•mol-1
第二步:H2NCOONH4(s)⇌CO(NH2)2(s)+H2O(g) ΔH=+138kJ•mol-1
写出工业上以NH3、CO2为原料合成尿素和H2O(g)的热化学方程式:___ 。
(2)一定温度下,向2L恒容密闭容器中通入2molCO和1molSO2,发生反应2CO(g)+SO2(g)⇌2CO2(g)+S(s)。若反应进行到20min时达到平衡,测得CO2的体积分数为0.5,则前20min内平均反应速率v(CO)=___ ,该温度下反应的化学平衡常数K=___ 。
(3)工业上可用NaClO碱性溶液或“亚硫酸盐法”吸收SO2。
①为了提高吸收效率,常用Ni2O3作为催化剂。催化过程如图1所示。
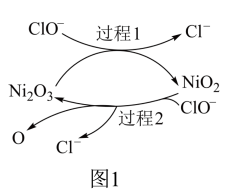
a.过程2的反应式为___ 。
b.Ca(ClO)2也可用于脱硫,且脱硫效果比NaClO更好,原因是___ 。
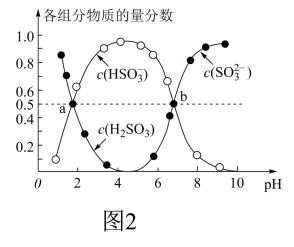
②室温下,(NH4)2SO3溶液中含硫组分物质的量分数随溶液pH的变化关系如图2所示,b点时溶液pH=7,则n(NH4+):n(SO32-)=___ 。
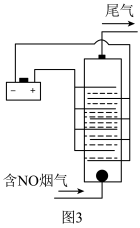
(4)用食盐水作电解液电解烟气脱氮的原理如图3所示,碱性条件下NO被阳极产生的Cl2氧化为NO3-,尾气经氢氧化钠溶液吸收后排入空气。碱性条件下NO被阳极产生的氧化性物质氧化为NO3-的离子方程式为___ 。
(1)尿素[CO(NH2)2]是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为两步反应:
第一步:2NH3(g)+CO2(g)⇌H2NCOONH4(s) ΔH=-272kJ•mol-1
第二步:H2NCOONH4(s)⇌CO(NH2)2(s)+H2O(g) ΔH=+138kJ•mol-1
写出工业上以NH3、CO2为原料合成尿素和H2O(g)的热化学方程式:
(2)一定温度下,向2L恒容密闭容器中通入2molCO和1molSO2,发生反应2CO(g)+SO2(g)⇌2CO2(g)+S(s)。若反应进行到20min时达到平衡,测得CO2的体积分数为0.5,则前20min内平均反应速率v(CO)=
(3)工业上可用NaClO碱性溶液或“亚硫酸盐法”吸收SO2。
①为了提高吸收效率,常用Ni2O3作为催化剂。催化过程如图1所示。

a.过程2的反应式为
b.Ca(ClO)2也可用于脱硫,且脱硫效果比NaClO更好,原因是
②室温下,(NH4)2SO3溶液中含硫组分物质的量分数随溶液pH的变化关系如图2所示,b点时溶液pH=7,则n(NH4+):n(SO32-)=

(4)用食盐水作电解液电解烟气脱氮的原理如图3所示,碱性条件下NO被阳极产生的Cl2氧化为NO3-,尾气经氢氧化钠溶液吸收后排入空气。碱性条件下NO被阳极产生的氧化性物质氧化为NO3-的离子方程式为

您最近一年使用:0次



