氨和二氧化碳都是重要的化工原料。
Ⅰ.氨在农业、化工和国防上意义重大。
(1)利用NH3的还原性可消除氮氧化物的污染,相关热化学方程式如下:
①N2(g)+O2(g)=2NO(g) ΔH1=+a kJ·mol-1
②4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH2=-b kJ·mol-1
4NO(g)+6H2O(g) ΔH2=-b kJ·mol-1
a、b均大于0,则反应4NH3(g)+6NO(g)=5N2(g)+6H2O(g)的ΔH3=___________ kJ·mol-1(用a、b表示)。
(2)工业上用氨催化氧化法制硝酸的主要反应是4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH<0,若其他条件不变,下列关系图错误的是
4NO(g)+6H2O(g) ΔH<0,若其他条件不变,下列关系图错误的是___________ (填标号)。
A. B.
B.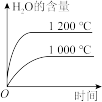 C.
C.
Ⅱ.以CO2和NH3为原料合成尿素的化学方程式为2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) ΔH<0。
CO(NH2)2(s)+H2O(g) ΔH<0。
(3)在一定的温度下,向2.0 L的密闭容器中通入0.2 mol NH3和0.1 mol CO2,测得反应时间与气体总压强p的数据如表所示:
平衡时NH3的转化率为___________ 。
(4)在恒容的绝热容器中投入0.2 mol NH3和0.1 mol CO2进行化学反应,下列可以说明该反应达到平衡状态的有___________ (填序号)。
①混合气体的平均摩尔质量不变 ②v正(H2O)=2v逆(NH3) ③化学平衡常数K不变 ④NH3和CO2物质的量的比值不变
Ⅲ.CO2溶于水形成H2CO3,已知常温下H2CO3的电离平衡常数Ka1=4.4×10-7,Ka2=4.7×10-11,NH3·H2O的电离平衡常数Kb=1.7×10-5
(5)NH4HCO3溶液呈___________ (填“酸性”“中性”或“碱性”);反应NH +HCO
+HCO +H2O
+H2O NH3·H2O+H2CO3的平衡常数K=
NH3·H2O+H2CO3的平衡常数K=___________ (保留3位有效数字)。
(6)25 ℃时,Al(OH)3的Ksp=8.0×10-33。若要使某铝盐溶液中的Al3+的浓度降至1.0×10-6 mol·L-1,则需要加氨水调节溶液的pH至___________ (已知lg5≈0.7)。
Ⅰ.氨在农业、化工和国防上意义重大。
(1)利用NH3的还原性可消除氮氧化物的污染,相关热化学方程式如下:
①N2(g)+O2(g)=2NO(g) ΔH1=+a kJ·mol-1
②4NH3(g)+5O2(g)
 4NO(g)+6H2O(g) ΔH2=-b kJ·mol-1
4NO(g)+6H2O(g) ΔH2=-b kJ·mol-1a、b均大于0,则反应4NH3(g)+6NO(g)=5N2(g)+6H2O(g)的ΔH3=
(2)工业上用氨催化氧化法制硝酸的主要反应是4NH3(g)+5O2(g)
 4NO(g)+6H2O(g) ΔH<0,若其他条件不变,下列关系图错误的是
4NO(g)+6H2O(g) ΔH<0,若其他条件不变,下列关系图错误的是A.
 B.
B.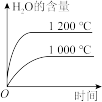 C.
C.
Ⅱ.以CO2和NH3为原料合成尿素的化学方程式为2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g) ΔH<0。
CO(NH2)2(s)+H2O(g) ΔH<0。(3)在一定的温度下,向2.0 L的密闭容器中通入0.2 mol NH3和0.1 mol CO2,测得反应时间与气体总压强p的数据如表所示:
| 时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 65 | 80 | 100 |
| 总压强p/ (100 kPa) | 9.0 | 7.5 | 6.3 | 5.7 | 5.2 | 4.9 | 4.6 | 4.5 | 4.5 |
平衡时NH3的转化率为
(4)在恒容的绝热容器中投入0.2 mol NH3和0.1 mol CO2进行化学反应,下列可以说明该反应达到平衡状态的有
①混合气体的平均摩尔质量不变 ②v正(H2O)=2v逆(NH3) ③化学平衡常数K不变 ④NH3和CO2物质的量的比值不变
Ⅲ.CO2溶于水形成H2CO3,已知常温下H2CO3的电离平衡常数Ka1=4.4×10-7,Ka2=4.7×10-11,NH3·H2O的电离平衡常数Kb=1.7×10-5
(5)NH4HCO3溶液呈
 +HCO
+HCO +H2O
+H2O NH3·H2O+H2CO3的平衡常数K=
NH3·H2O+H2CO3的平衡常数K=(6)25 ℃时,Al(OH)3的Ksp=8.0×10-33。若要使某铝盐溶液中的Al3+的浓度降至1.0×10-6 mol·L-1,则需要加氨水调节溶液的pH至
19-20高三上·河北石家庄·阶段练习 查看更多[2]
更新时间:2020-12-27 16:31:19
|
相似题推荐
【推荐1】I. 已知:H2O2可看作二元弱酸。
(1)请写出H2O2与Ba(OH)2溶液反应生成的酸式盐的电子式________________ 。
某兴趣小组分析H2O2的催化分解原理。
(2)I-催化H2O2分解的原理分为两步,总反应可表示为:2H2O2(aq)=2H2O(l)+O2(g) △H<0,若第一步反应的热化学方程式为:H2O2(aq)+I-(aq)=IO-(aq)+H2O(l) △H>0 慢反应,则第二步反应的热化学方程式为:___________ △H <0 快反应
(3)能正确表示I-催化H2O2分解原理的示意图为______ 。

II. 丙烯(C3H6)是重要的有机化工原料。丙烷脱氢制丙烯发生的主要反应及能量变化如下图,主反应为丙烷脱氢反应,副反应为丙烷裂解反应
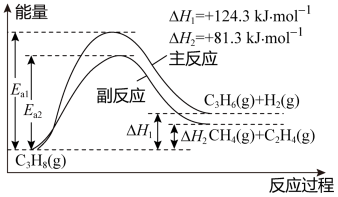
已知主反应:v正= k正p(C3H8),v逆= k逆p(C3H6)·p(H2)。
其中v正、v逆 为正、逆反应速率,k正、k逆为速率常数,p为各组分的分压。
(4)下表中为各物质的燃烧热,计算丙烯的燃烧热为△H =______ kJ·mol-1。
副反应丙烷裂解制乙烯的过程中,其原子利用率为_______ (保留三位有效数字)。
(5)在T1、T2、T3不同温度下,向体积为1L的恒容密闭容器中充入1molC3H8,开始时容器的压强分别为p1、p2、p3,仅发生主反应,丙烷转化率(α)随时间(t)的变化关系如图所示:
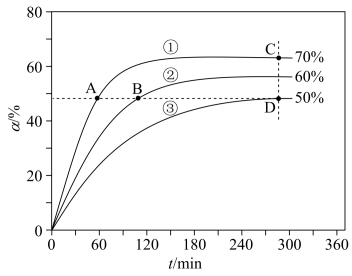
①A、B、D三点中,k正/k逆 值最大的是_________ ,
②A、B、C、D四点中,v逆 最大的是_________ 。
(1)请写出H2O2与Ba(OH)2溶液反应生成的酸式盐的电子式
某兴趣小组分析H2O2的催化分解原理。
(2)I-催化H2O2分解的原理分为两步,总反应可表示为:2H2O2(aq)=2H2O(l)+O2(g) △H<0,若第一步反应的热化学方程式为:H2O2(aq)+I-(aq)=IO-(aq)+H2O(l) △H>0 慢反应,则第二步反应的热化学方程式为:
(3)能正确表示I-催化H2O2分解原理的示意图为

II. 丙烯(C3H6)是重要的有机化工原料。丙烷脱氢制丙烯发生的主要反应及能量变化如下图,主反应为丙烷脱氢反应,副反应为丙烷裂解反应

已知主反应:v正= k正p(C3H8),v逆= k逆p(C3H6)·p(H2)。
其中v正、v逆 为正、逆反应速率,k正、k逆为速率常数,p为各组分的分压。
(4)下表中为各物质的燃烧热,计算丙烯的燃烧热为△H =
| H2 | CH4 | C2H4 | |
| △H /kJ·mol—1 | -285.8 | -890.3 | -1411.0 |
副反应丙烷裂解制乙烯的过程中,其原子利用率为
(5)在T1、T2、T3不同温度下,向体积为1L的恒容密闭容器中充入1molC3H8,开始时容器的压强分别为p1、p2、p3,仅发生主反应,丙烷转化率(α)随时间(t)的变化关系如图所示:

①A、B、D三点中,k正/k逆 值最大的是
②A、B、C、D四点中,v逆 最大的是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】(1)已知常温常压下:
①CH3OH(l)+O2(g)═CO(g)+2H2O(g) △H=-359.8kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) △H=-556.0kJ·mol-1
③H2O(g)=H2O(l) △H=-44.0kJ·mol-1
写出体现甲醇燃烧热的热化学方程式为________________________________ 。
(2)某温度时,将2 mol CO与5 mol H2的混合气体充入容积为2 L的密闭容器中,在催化剂的作用下发生反应:CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
①经过5 min后,反应达到平衡,此时转移电子6 mol。该反应的平衡常数为________ 。v(H2)=________ mol/(L·min)。若保持体积不变,再充入2 mol CO和1.5 mol CH3OH,此时v(正)________ v(逆)(填“>”“<”或“=”)。
②在其他条件不变的情况下,再增加2 mol CO与5 mol H2,达到新平衡时,CO的转化率________ (填“增大”“减小”或“不变”)。
③下列不能说明该反应已达到平衡状态的是________ 。
a.CH3OH的质量不变 b.混合气体的平均相对分子质量不再改变 c.v逆(CO)=2v正(H2) d.混合气体的密度不再发生改变
①CH3OH(l)+O2(g)═CO(g)+2H2O(g) △H=-359.8kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) △H=-556.0kJ·mol-1
③H2O(g)=H2O(l) △H=-44.0kJ·mol-1
写出体现甲醇燃烧热的热化学方程式为
(2)某温度时,将2 mol CO与5 mol H2的混合气体充入容积为2 L的密闭容器中,在催化剂的作用下发生反应:CO(g)+2H2(g)
 CH3OH(g)。
CH3OH(g)。①经过5 min后,反应达到平衡,此时转移电子6 mol。该反应的平衡常数为
②在其他条件不变的情况下,再增加2 mol CO与5 mol H2,达到新平衡时,CO的转化率
③下列不能说明该反应已达到平衡状态的是
a.CH3OH的质量不变 b.混合气体的平均相对分子质量不再改变 c.v逆(CO)=2v正(H2) d.混合气体的密度不再发生改变
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】氨的合成对国民经济发展有着重要的意义。根据要求,回答下列问题:
I.氨气可用于工业脱硝( ),脱硝反应为:
),脱硝反应为:
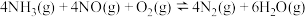
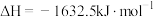 。
。
已知:反应①: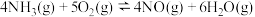
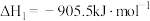
反应②: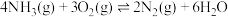
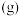

(1)反应①中正反应的活化能___________ 逆反应的活化能(填“小于”或“大于”),由反应①和脱硝反应可知反应②的
___________  。
。
II.某实验小组为了模拟工业上利用氨气合成尿素,在 压强下,容积为
压强下,容积为 的恒容密闭容器中充入
的恒容密闭容器中充入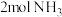 和
和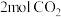 ,发生反应:
,发生反应: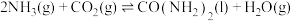
 ,反应过程中混合气体中
,反应过程中混合气体中 的体积分数如图所示:
的体积分数如图所示:
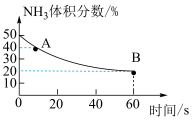
(2)①A点时 的体积分数为40%,则此时
的体积分数为40%,则此时 的转化率为
的转化率为___________ (保留三位有效数字);B点时,
___________  。若要提高氨气平衡转化率,可采取的措施有:
。若要提高氨气平衡转化率,可采取的措施有:___________ 。(写一条即可)
②下列能说明该反应达到平衡状态的是___________ (填字母)。
a.体系的压强保持不变
b.单位时间内消耗 同时消耗
同时消耗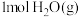
c.
(3)B点的平衡常数
___________ (写出含 的代数式再代入数据进行计算,气体分压=气体总压×气体的物质的量分数)。
的代数式再代入数据进行计算,气体分压=气体总压×气体的物质的量分数)。
(4)向恒容密闭容器中加入适量催化剂,并充入一定量的 和
和 发生上述反应合成尿素,在不同温度、相同反应时间,测得
发生上述反应合成尿素,在不同温度、相同反应时间,测得 的转化率与反应温度的变化关系如图所示。
的转化率与反应温度的变化关系如图所示。

温度为 ℃时,
℃时, 的转化率降低,可能原因是
的转化率降低,可能原因是___________ 。
(5)在反应
 中,正反应速率为
中,正反应速率为
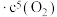 ,逆反应速率为
,逆反应速率为 ,
, 、
、 为速率常数,受温度影响。已知
为速率常数,受温度影响。已知 时,
时, ,则该温度下,平衡常数
,则该温度下,平衡常数
___________ 。
I.氨气可用于工业脱硝(
 ),脱硝反应为:
),脱硝反应为: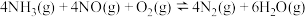
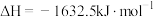 。
。已知:反应①:
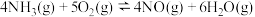
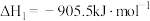
反应②:
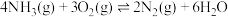
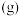

(1)反应①中正反应的活化能

 。
。II.某实验小组为了模拟工业上利用氨气合成尿素,在
 压强下,容积为
压强下,容积为 的恒容密闭容器中充入
的恒容密闭容器中充入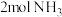 和
和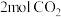 ,发生反应:
,发生反应: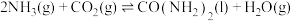
 ,反应过程中混合气体中
,反应过程中混合气体中 的体积分数如图所示:
的体积分数如图所示:
(2)①A点时
 的体积分数为40%,则此时
的体积分数为40%,则此时 的转化率为
的转化率为
 。若要提高氨气平衡转化率,可采取的措施有:
。若要提高氨气平衡转化率,可采取的措施有:②下列能说明该反应达到平衡状态的是
a.体系的压强保持不变
b.单位时间内消耗
 同时消耗
同时消耗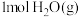
c.

(3)B点的平衡常数

 的代数式再代入数据进行计算,气体分压=气体总压×气体的物质的量分数)。
的代数式再代入数据进行计算,气体分压=气体总压×气体的物质的量分数)。(4)向恒容密闭容器中加入适量催化剂,并充入一定量的
 和
和 发生上述反应合成尿素,在不同温度、相同反应时间,测得
发生上述反应合成尿素,在不同温度、相同反应时间,测得 的转化率与反应温度的变化关系如图所示。
的转化率与反应温度的变化关系如图所示。
温度为
 ℃时,
℃时, 的转化率降低,可能原因是
的转化率降低,可能原因是(5)在反应

 中,正反应速率为
中,正反应速率为
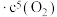 ,逆反应速率为
,逆反应速率为 ,
, 、
、 为速率常数,受温度影响。已知
为速率常数,受温度影响。已知 时,
时, ,则该温度下,平衡常数
,则该温度下,平衡常数
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】碳的氧化物对环境的影响较大,CO是燃煤工业生产中的大气污染物,CO2则促进了地球的温室效应。给地球生命带来了极大的威胁。
(1)已知:①甲醇的燃烧热△H=-726.4kJ·mol-1②H2(g)+ O2(g)=H2O(l) △H=-285.8kJ·mol-1。则二氧化碳和氢气合成液态甲醇,生成液态水的热化学方程式为
O2(g)=H2O(l) △H=-285.8kJ·mol-1。则二氧化碳和氢气合成液态甲醇,生成液态水的热化学方程式为_____ 。
(2)二氧化碳合成CH3OH 的热化学方程式为CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H1,过程中会产生副反应:CO2(g)+H2(g)
CH3OH(g)+H2O(g)△H1,过程中会产生副反应:CO2(g)+H2(g) CO(g)+H2O(g)△H2。图1是合成甲醇反应中温度对CH3OH、CO的产率影响曲线图,△H2
CO(g)+H2O(g)△H2。图1是合成甲醇反应中温度对CH3OH、CO的产率影响曲线图,△H2________ 0(填“>”或“<”)。增大反应体系的压强,合成甲醇的反应速率___________ (填“增大”“减小”或“ 不变”),副反应的化学平衡________ (填“向正反应方向”“向逆反应方向”或“不”)移动。

(3)以某些过渡金属氧化物作催化剂,二氧化碳与甲烷可转化为乙酸:CO2(g) +CH4(g) CH3COOH(g) △H=+36.0kJ·mol-1。不同温度下,乙酸的生成速率变化曲线如图2。结合反应速率,使用催化剂的最佳温度是
CH3COOH(g) △H=+36.0kJ·mol-1。不同温度下,乙酸的生成速率变化曲线如图2。结合反应速率,使用催化剂的最佳温度是________ ℃,欲提高CH4的转化率,请提供一种可行的措施:______________ 。
(4)一定条件下,CO2 与NH3 可合成尿素[CO(NH2)2]:CO2(g)+2NH3(g) CO(NH2)2(g)+H2O(g)△H。某温度下。在容积为1L的恒容密闭容器中,加入一定氨碳比
CO(NH2)2(g)+H2O(g)△H。某温度下。在容积为1L的恒容密闭容器中,加入一定氨碳比 的3molCO2 和NH3的混合气体。图3是有关量的变化曲线,其中表示NH3转化率的是曲线
的3molCO2 和NH3的混合气体。图3是有关量的变化曲线,其中表示NH3转化率的是曲线________ (填“a”或“b”),曲线c 表示尿素在平衡体系中的体积分数变化曲线,则M点的平衡常数K=________ ,y=________ 。
(1)已知:①甲醇的燃烧热△H=-726.4kJ·mol-1②H2(g)+
 O2(g)=H2O(l) △H=-285.8kJ·mol-1。则二氧化碳和氢气合成液态甲醇,生成液态水的热化学方程式为
O2(g)=H2O(l) △H=-285.8kJ·mol-1。则二氧化碳和氢气合成液态甲醇,生成液态水的热化学方程式为(2)二氧化碳合成CH3OH 的热化学方程式为CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H1,过程中会产生副反应:CO2(g)+H2(g)
CH3OH(g)+H2O(g)△H1,过程中会产生副反应:CO2(g)+H2(g) CO(g)+H2O(g)△H2。图1是合成甲醇反应中温度对CH3OH、CO的产率影响曲线图,△H2
CO(g)+H2O(g)△H2。图1是合成甲醇反应中温度对CH3OH、CO的产率影响曲线图,△H2
(3)以某些过渡金属氧化物作催化剂,二氧化碳与甲烷可转化为乙酸:CO2(g) +CH4(g)
 CH3COOH(g) △H=+36.0kJ·mol-1。不同温度下,乙酸的生成速率变化曲线如图2。结合反应速率,使用催化剂的最佳温度是
CH3COOH(g) △H=+36.0kJ·mol-1。不同温度下,乙酸的生成速率变化曲线如图2。结合反应速率,使用催化剂的最佳温度是(4)一定条件下,CO2 与NH3 可合成尿素[CO(NH2)2]:CO2(g)+2NH3(g)
 CO(NH2)2(g)+H2O(g)△H。某温度下。在容积为1L的恒容密闭容器中,加入一定氨碳比
CO(NH2)2(g)+H2O(g)△H。某温度下。在容积为1L的恒容密闭容器中,加入一定氨碳比 的3molCO2 和NH3的混合气体。图3是有关量的变化曲线,其中表示NH3转化率的是曲线
的3molCO2 和NH3的混合气体。图3是有关量的变化曲线,其中表示NH3转化率的是曲线
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】以乙苯催化脱氢来制取苯乙烯,是化工产业中常用的方法如下所示:
 (g)
(g)
 (g)+H2(g) ΔH=+117.6kJ·mol-1
(g)+H2(g) ΔH=+117.6kJ·mol-1
已知:上述反应的速率方程为v正=k正P乙苯,v 逆=k逆P苯乙烯P氢气, 其中k正、k逆分别为正、逆反应速率常数,P为各组分分压。
(1)在Fe2O3催化作用下将乙苯加入三个恒容密闭容器发生上述反应,相关数据如下:
①T1时,向乙容器中按表格中数据投料,则此时v正_______ v 逆。(填写“>”“=”“<”)
②若想同时增大该反应的反应速率和平衡转化率,应采取的措施是_______ 。
③乙苯脱氢经历如下过程:

T2更有利于发生的“环节”是_______ , 在该温度下,“吸附环节”的平衡常数为K1,“反应环节”的平衡常数为K2,“脱吸附环节”的平衡常数为K3,则“脱氢环节”的平衡常数为_______ 。
(2)为了节省能源,乙苯催化脱氢制苯乙烯的过程可以在CO2气氛下进行。100kPa下,反应气组成n (乙苯): n (CO2) 按照1:0、1:1、 1:5、1:9投料,乙苯平衡转化率随反应温度变化关系如图。图中n (乙苯): n (CO2) =1: 9的曲线是_______ (填曲线标号)。500℃按此投料时, =
=_______ kPa (用最简分数表示)。

 (g)
(g)
 (g)+H2(g) ΔH=+117.6kJ·mol-1
(g)+H2(g) ΔH=+117.6kJ·mol-1已知:上述反应的速率方程为v正=k正P乙苯,v 逆=k逆P苯乙烯P氢气, 其中k正、k逆分别为正、逆反应速率常数,P为各组分分压。
(1)在Fe2O3催化作用下将乙苯加入三个恒容密闭容器发生上述反应,相关数据如下:
| 容器 | 容积/L | 温度/℃ | 起始量/ mol | 平衡量/mol | ||
| 乙苯(g) | 苯乙烯(g) | 氢气(g) | 苯乙烯(g) | |||
| 甲 | 1 | T1 | 3 | 0 | 0 | 1 |
| 乙 | 1 | T1 | 4 | 3 | 1 | x |
| 丙 | 2 | T2 | 5 | 0 | 0 | 1.2 |
②若想同时增大该反应的反应速率和平衡转化率,应采取的措施是
③乙苯脱氢经历如下过程:

T2更有利于发生的“环节”是
(2)为了节省能源,乙苯催化脱氢制苯乙烯的过程可以在CO2气氛下进行。100kPa下,反应气组成n (乙苯): n (CO2) 按照1:0、1:1、 1:5、1:9投料,乙苯平衡转化率随反应温度变化关系如图。图中n (乙苯): n (CO2) =1: 9的曲线是
 =
=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】汽车尾气中NO和CO的催化转化是目前化学研究热点。回答下列问题:
(1)已知下列反应的热化学方程式:
①
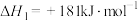

②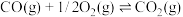


则反应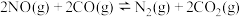 的
的
___________  ,平衡常数
,平衡常数
___________ (用 、
、 表示)。
表示)。
(2) 与
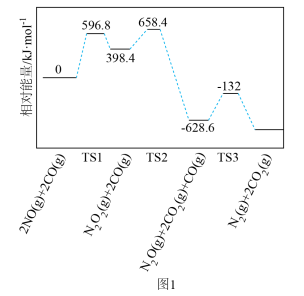
与 的反应机理及体系的相对能量变化如图1所示(TS表示过渡态)。该反应有
的反应机理及体系的相对能量变化如图1所示(TS表示过渡态)。该反应有___________ 个分步反应,写出最易发生的分步反应的化学方程式___________ 。
(3)当起始物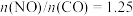 时,不同条件下达到平衡,设
时,不同条件下达到平衡,设 的转化率为
的转化率为 ,在
,在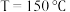 下
下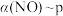 、
、 下
下 的关系如图2所示。
的关系如图2所示。
①图2中对应等温过程的曲线是___________ ,判断理由为___________ 。
②M点 的分压为
的分压为___________ kPa,该温度下此反应的分压平衡常数
___________  。
。
(1)已知下列反应的热化学方程式:
①

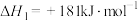

②
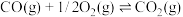


则反应
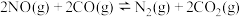 的
的
 ,平衡常数
,平衡常数
 、
、 表示)。
表示)。(2)
 与
与 的反应机理及体系的相对能量变化如图1所示(TS表示过渡态)。该反应有
的反应机理及体系的相对能量变化如图1所示(TS表示过渡态)。该反应有
(3)当起始物
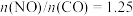 时,不同条件下达到平衡,设
时,不同条件下达到平衡,设 的转化率为
的转化率为 ,在
,在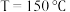 下
下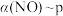 、
、 下
下 的关系如图2所示。
的关系如图2所示。
①图2中对应等温过程的曲线是
②M点
 的分压为
的分压为
 。
。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】C、S和Cl元素的单质及化合物在工业生产中的有效利用备受关注。请回答下列问题:
(1)已知:Ⅰ.2SO2(g)+O2(g)+2H2O(l)=2H2SO4(aq)ΔH1;
Ⅱ.Cl2(g)+H2O(l) HCl(aq)+HClO(aq)ΔH2;
HCl(aq)+HClO(aq)ΔH2;
Ⅲ.2HClO(aq)=2HCl(aq)+O2(g)ΔH3;
SO2(g)+Cl2(g)+2H2O(l)=2HCl(aq)+H2SO4(aq)
ΔH4=____________________ (用含有ΔH1、ΔH2和ΔH3的代数式表示)。
(2)25℃时,H2SO3溶液中各含硫微粒的物质的量分数(δ)与溶液pH的变化关系如图甲所示。

已知25℃时,NaHSO3的水溶液pH<7,用图中的数据通过计算解释原因_____________________________________________________ 。

(3)NaClO2是一种绿色消毒剂和漂白剂,工业上采用电解法制备NaClO2的原理如图乙所示。
①交换膜应选用____________________ (填“阳离子交换膜”或“阴离子交换膜”)。
②阳极的电极反应式为_____________________________________ 。
(4)一定温度下,向2L恒容密闭容器中通入2molCO和1molSO2,发生反应2CO(g)+SO2(g) S(l)+2CO2(g)ΔH=-270kJ/mol,若反应进行到20min时达到平衡,测得CO2的体积分数为0.5,则前20min的反应速率v(CO)=
S(l)+2CO2(g)ΔH=-270kJ/mol,若反应进行到20min时达到平衡,测得CO2的体积分数为0.5,则前20min的反应速率v(CO)=______________ ,该温度下化学平衡常数K=____________ (L·mol-1)

(5)在不同条件下,向2L恒容密闭容器中通入2molCO和1molSO2,反应体系总压强随时间的变化如图丙所示:
①图丙中三组实验从反应开始至达到平衡时,v(CO)最大的为__________ (填字母序号)。
②与实验a相比,c组改变的实验条件可能是_____________________________________ 。
(1)已知:Ⅰ.2SO2(g)+O2(g)+2H2O(l)=2H2SO4(aq)ΔH1;
Ⅱ.Cl2(g)+H2O(l)
 HCl(aq)+HClO(aq)ΔH2;
HCl(aq)+HClO(aq)ΔH2;Ⅲ.2HClO(aq)=2HCl(aq)+O2(g)ΔH3;
SO2(g)+Cl2(g)+2H2O(l)=2HCl(aq)+H2SO4(aq)
ΔH4=
(2)25℃时,H2SO3溶液中各含硫微粒的物质的量分数(δ)与溶液pH的变化关系如图甲所示。

已知25℃时,NaHSO3的水溶液pH<7,用图中的数据通过计算解释原因

(3)NaClO2是一种绿色消毒剂和漂白剂,工业上采用电解法制备NaClO2的原理如图乙所示。
①交换膜应选用
②阳极的电极反应式为
(4)一定温度下,向2L恒容密闭容器中通入2molCO和1molSO2,发生反应2CO(g)+SO2(g)
 S(l)+2CO2(g)ΔH=-270kJ/mol,若反应进行到20min时达到平衡,测得CO2的体积分数为0.5,则前20min的反应速率v(CO)=
S(l)+2CO2(g)ΔH=-270kJ/mol,若反应进行到20min时达到平衡,测得CO2的体积分数为0.5,则前20min的反应速率v(CO)=
(5)在不同条件下,向2L恒容密闭容器中通入2molCO和1molSO2,反应体系总压强随时间的变化如图丙所示:
①图丙中三组实验从反应开始至达到平衡时,v(CO)最大的为
②与实验a相比,c组改变的实验条件可能是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】已知常温下部分弱电解质的电离平衡常数如表:
(1)常温下,物质的量溶度相同的三种溶液①NaF溶液②NaClO溶液③Na2CO3溶液,其pH由大到小的顺序是____ (填序号)。
(2)25℃时,pH=4的NH4Cl溶液中各离子浓度的大小关系为___ 。
(3)NaClO溶液中的电荷守恒关系为___ 。
(4)向NaClO溶液中通入少量的CO2,所发生的离子方程式为___ 。
(5)常温下,将cmol/L的氨水与0.01mol/L的盐酸等体积混合。若混合后溶液中存在c(NH )=c(Cl-),则c
)=c(Cl-),则c___ 0.01(填“大于”、“小于”、“等于”或“无法确定”),溶液显___ 性。(填“酸”、“碱”、“中”或“无法确定”)。
| 化学式 | HF | HClO | H2CO3 | NH3·H2O |
| 电离常数 | 6.8×10-4 | 4.7×10-8 | K1=4.3×10-7 K2=5.6×10-11 | Kb=1.7×10-5 |
(2)25℃时,pH=4的NH4Cl溶液中各离子浓度的大小关系为
(3)NaClO溶液中的电荷守恒关系为
(4)向NaClO溶液中通入少量的CO2,所发生的离子方程式为
(5)常温下,将cmol/L的氨水与0.01mol/L的盐酸等体积混合。若混合后溶液中存在c(NH
 )=c(Cl-),则c
)=c(Cl-),则c
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】将磷肥生产形成的副产物石膏( )转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。石膏转化为硫酸钾和氯化钙的工艺流程示意图如图所示
)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。石膏转化为硫酸钾和氯化钙的工艺流程示意图如图所示
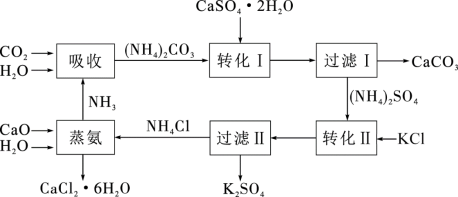
请回答下列问题:
(1)本工艺中所用的原料除 、CaCO3、H2O外,还需要的两种原料是
、CaCO3、H2O外,还需要的两种原料是______ 、______ (填化学式,不考虑损耗)。
(2)室温下, 溶液的pH
溶液的pH______ 7(填“>”、“<”或“=”),该溶液中所有微粒(水分子除外)的物质的量浓度由小到大的顺序为______ 。
(3)转化Ⅰ是将难溶的CaSO4(s)转化为更难溶的CaCO3(s),将一定量的 加入过量的CaSO4悬浊液中,充分反应后,测得溶液中
加入过量的CaSO4悬浊液中,充分反应后,测得溶液中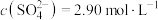 ,此时溶液中的
,此时溶液中的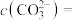
______  。[已知:
。[已知: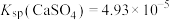 、
、 ]
]
(4)已知不同温度下K2SO4在100 g水中达到饱和时溶解的量如下表:
75℃的K2SO4饱和溶液482 g冷却到20℃,可析出K2SO4晶体______ g。
(5)写出“蒸氨”过程中的化学方程式:____________________ 。
 )转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。石膏转化为硫酸钾和氯化钙的工艺流程示意图如图所示
)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。石膏转化为硫酸钾和氯化钙的工艺流程示意图如图所示
请回答下列问题:
(1)本工艺中所用的原料除
 、CaCO3、H2O外,还需要的两种原料是
、CaCO3、H2O外,还需要的两种原料是(2)室温下,
 溶液的pH
溶液的pH(3)转化Ⅰ是将难溶的CaSO4(s)转化为更难溶的CaCO3(s),将一定量的
 加入过量的CaSO4悬浊液中,充分反应后,测得溶液中
加入过量的CaSO4悬浊液中,充分反应后,测得溶液中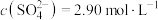 ,此时溶液中的
,此时溶液中的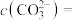
 。[已知:
。[已知: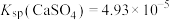 、
、 ]
](4)已知不同温度下K2SO4在100 g水中达到饱和时溶解的量如下表:
温度/℃ | 0 | 20 | 40 | 60 | 75 |
K2SO4溶解的量/g | 7.7 | 11.1 | 14.7 | 18.1 | 20.5 |
(5)写出“蒸氨”过程中的化学方程式:
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
不同温度(℃)下的溶解度(g/100g水)
回答下列问题:
(1)该电池的正极反应式为___________ 。
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn________ g。(已知F=96500C/ mol)
(3)用废电池的锌皮制备ZnSO4•7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,加碱调节至pH为______ 时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为_______ 时,锌开始沉淀(假定Zn2+浓度为0.l m ol/ L)。若上述过程不加H2O2后果是________ (结果均保留一位小数)
(4)铅蓄电池作为应用广泛的二次电源,广泛应用于汽车和电动车中。在为电动车充电时,充电器除导电作用外,最重要的作用是_______ 。
不同温度(℃)下的溶解度(g/100g水)
| 0 | 20 | 40 | 60 | |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55 |
| ZnCl2 | 343 | 395 | 452 | 483 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
回答下列问题:
(1)该电池的正极反应式为
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn
(3)用废电池的锌皮制备ZnSO4•7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,加碱调节至pH为
(4)铅蓄电池作为应用广泛的二次电源,广泛应用于汽车和电动车中。在为电动车充电时,充电器除导电作用外,最重要的作用是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐2】氯氧化铜[xCuO·yCuCl2·zH2O]在农业上用作杀菌剂。工业上用铜矿粉(主要含Cu2(OH)2CO3、Fe3O4等)为原料制取氯氧化铜的流程如下:
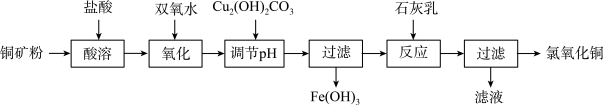
⑴“调节pH”并生成Fe(OH)3时反应的离子方程式为______ 。
⑵调节pH,要使常温溶液中c(Cu2+)≥0.022mol·L-1,而c(Fe3+)≤1×10-6mol·L-1,则应调节pH的范围为______ 。{已知Ksp[Cu(OH)2=2.2×10-20],Ksp[Fe(OH)3=1×10-36]}
⑶为测定氯氧化铜的组成,现进行如下实验:
步骤Ⅰ:称取0.4470 g氯氧化铜,放入锥形瓶,加入一定量30%的硝酸使固体完全溶解。滴加K2CrO4溶液作指示剂,用0.1000mol·L-1 AgNO3标准溶液滴定溶液中的Cl-,滴定至终点时消耗AgNO3标准溶液20.00 mL;
步骤Ⅱ:称取0.4470g氯氧化铜,放入锥形瓶,加入一定量硫酸使固体完全溶解。向溶液中加入过量的KI固体,充分反应后向溶液中滴入数滴淀粉溶液,用0.2000mol·L-1Na2S2O3标准溶液滴定,滴定至终点时消耗Na2S2O3标准溶液20.00mL。
已知步骤Ⅱ中所发生的反应如下:
2Cu2++4I-=2CuI↓+I2 2Na2S2O3+I2=2NaI+Na2S4O6
①已知Ag2CrO4为砖红色沉淀,步骤Ⅰ滴定终点时的实验现象是_______ 。
②通过计算确定氯氧化铜的化学式________________ (写出计算过程)。

⑴“调节pH”并生成Fe(OH)3时反应的离子方程式为
⑵调节pH,要使常温溶液中c(Cu2+)≥0.022mol·L-1,而c(Fe3+)≤1×10-6mol·L-1,则应调节pH的范围为
⑶为测定氯氧化铜的组成,现进行如下实验:
步骤Ⅰ:称取0.4470 g氯氧化铜,放入锥形瓶,加入一定量30%的硝酸使固体完全溶解。滴加K2CrO4溶液作指示剂,用0.1000mol·L-1 AgNO3标准溶液滴定溶液中的Cl-,滴定至终点时消耗AgNO3标准溶液20.00 mL;
步骤Ⅱ:称取0.4470g氯氧化铜,放入锥形瓶,加入一定量硫酸使固体完全溶解。向溶液中加入过量的KI固体,充分反应后向溶液中滴入数滴淀粉溶液,用0.2000mol·L-1Na2S2O3标准溶液滴定,滴定至终点时消耗Na2S2O3标准溶液20.00mL。
已知步骤Ⅱ中所发生的反应如下:
2Cu2++4I-=2CuI↓+I2 2Na2S2O3+I2=2NaI+Na2S4O6
①已知Ag2CrO4为砖红色沉淀,步骤Ⅰ滴定终点时的实验现象是
②通过计算确定氯氧化铜的化学式
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】钼酸铵晶体[(NH4)2MoO4]是生产高纯度二硫化钼、三氧化钼等钼制品的基本原料。从废钼催化剂(主要含有MoS2、SiO2和CuFeS2)中回收钼酸铵的工艺流程如图1所示。

回答下列问题:
(1)高温焙烧时生成的金属氧化物是_______ (写化学式)。
(2)若选择两种不同萃取剂按一定比例(协萃比)协同萃取溶液中含金属元素的离子,萃取情况如图2所示,当协萃比为_______ 时更有利于MoO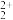 的萃取。
的萃取。

(3)调pH后所得的滤渣的主要成分是_______ (写化学式)。
(4)向有机相中滴加氨水,发生反应的离子方程式主要为_______ 。
(5)向钼酸铵溶液中加入Na2S可生成(NH4)2MoS4,再向混合液中加入盐酸即可得到沉淀MoS3。写出生成MoS3的离子方程式:_______ 。该反应适宜温度是40℃,其原因是_______ 。
(6)已知Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8。不纯的Na2MoO4溶液中含有少量可溶性硫酸盐杂质,可加入Ba(OH)2固体除去 ,为完全除去
,为完全除去 且尽量减小钼元素损耗,应控制溶液中c(MoO
且尽量减小钼元素损耗,应控制溶液中c(MoO )<
)<_______ mol·L-1(保留2位有效数字)。

回答下列问题:
(1)高温焙烧时生成的金属氧化物是
(2)若选择两种不同萃取剂按一定比例(协萃比)协同萃取溶液中含金属元素的离子,萃取情况如图2所示,当协萃比为
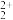 的萃取。
的萃取。
(3)调pH后所得的滤渣的主要成分是
(4)向有机相中滴加氨水,发生反应的离子方程式主要为
(5)向钼酸铵溶液中加入Na2S可生成(NH4)2MoS4,再向混合液中加入盐酸即可得到沉淀MoS3。写出生成MoS3的离子方程式:
(6)已知Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8。不纯的Na2MoO4溶液中含有少量可溶性硫酸盐杂质,可加入Ba(OH)2固体除去
 ,为完全除去
,为完全除去 且尽量减小钼元素损耗,应控制溶液中c(MoO
且尽量减小钼元素损耗,应控制溶液中c(MoO )<
)<
您最近一年使用:0次



