解题方法
1 . Ⅰ.现有部分元素的性质与原子(或分子)结构如表所示:
回答下列问题:
(1)T是_______ (填元素符号)。元素X在周期表的位置_______ 。
(2)Y与Z相比,金属性较强的是_____ (填元素符号),下列表述中能证明这一事实的是_______ (填标号)。
A.Y单质的熔点比Z单质的低
B.Y的化合价比Z的低
C.Y单质与水反应比Z单质与水反应剧烈得多
(3)Z的最高价氧化物属于_______ 氧化物(“酸性”、“碱性”或“两性”),写出Y、Z最高价氧化物对应水化物反应的离子方程式____ 。
Ⅱ.2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。
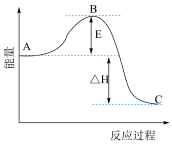
已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
(4)图中A、C分别表示_______ 、_______ 。
(5)图中△H=_______ kJ·mol-1。
(6)已知单质硫的燃烧热为296KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H_______ 。
元素 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质分子为双原子分子,是空气的主要成分,分子比较稳定 |
| Y | M层比K层少一个电子 |
| Z | 有三个电子层,M层上有3个电子 |
(1)T是
(2)Y与Z相比,金属性较强的是
A.Y单质的熔点比Z单质的低
B.Y的化合价比Z的低
C.Y单质与水反应比Z单质与水反应剧烈得多
(3)Z的最高价氧化物属于
Ⅱ.2SO2(g)+O2(g)
 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。
已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
(4)图中A、C分别表示
(5)图中△H=
(6)已知单质硫的燃烧热为296KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H
您最近一年使用:0次
2 . (1)在恒容的密闭容器中,气体X与气体Y反应可生成气体Z,反应过程中,X、Y、Z三种气体的浓度(c)随时间(t)的变化关系如图

则该反应的化学方程式为_______ ,若t0=10s,用X表示的该反应速率为_______ ;若向容器中充入He,该反应速率_______ (填“加快”或“减慢”或“不变”)
(2)一种新型催化剂用于NO和CO的反应:2NO+2CO⇌2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在表中。
①a=_______ 。
②能验证温度对化学反应速率规律的是实验_______ (填实验序号)。
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线_______ (填“甲”或“乙”)。

④若要进一步提高该反应的化学反应速率,除了使用催化剂和升高温度外,还可以采取的措施有_______ (任写一条)。
(3)已知:P(s,白磷)=P(s,黑磷),每1molP(s,白磷)发生反应,放出39.3kJ的热量,P(s,白磷)=P(s,红磷),每1molP(s,白磷)发生反应,放出17.6kJ的热量,由此推知,其中最稳定的磷单质是_______ (填“黑磷”或“红磷”)。
(4)丙烷氧气燃料电池在碱性电解质环境中放电时丙烷在_______ (填“正”或“负”)极发生的电极反应式为_______ ,电路中每转移0.4mol电子,标准状况下消耗O2的体积是_______ L。

则该反应的化学方程式为
(2)一种新型催化剂用于NO和CO的反应:2NO+2CO⇌2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在表中。
| 实验编号 | t(℃) | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.2×10−3 | 5.80×10−3 | 82 |
| Ⅱ | 280 | 1.2×10−3 | b | 124 |
| Ⅲ | 350 | a | 5.80×10−3 | 82 |
①a=
②能验证温度对化学反应速率规律的是实验
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线

④若要进一步提高该反应的化学反应速率,除了使用催化剂和升高温度外,还可以采取的措施有
(3)已知:P(s,白磷)=P(s,黑磷),每1molP(s,白磷)发生反应,放出39.3kJ的热量,P(s,白磷)=P(s,红磷),每1molP(s,白磷)发生反应,放出17.6kJ的热量,由此推知,其中最稳定的磷单质是
(4)丙烷氧气燃料电池在碱性电解质环境中放电时丙烷在
您最近一年使用:0次
2021-06-15更新
|
364次组卷
|
2卷引用:四川省广安友谊中学高2020-2021学年高一下学期6月月考化学试题
解题方法
3 . 作为一种绿色消毒剂,H2O2在公共卫生事业中发挥了重要的作用。已知反应:H2O2(l)=H2O(1)+ O2(g)ΔH=-98kJ·mol-1K=2.88×1020
O2(g)ΔH=-98kJ·mol-1K=2.88×1020
回答问题:
(1)H2O2的强氧化性使其对大多数致病菌和病毒具有消杀功能。用3%医用H2O2对传染病房喷洒消毒时,地板上有气泡冒出,该气体是___ 。
(2)纯H2O2可作为民用驱雹火箭推进剂。在火箭喷口铂网催化下,H2O2剧烈分解:H2O2(l)=H2O(g)+ O2(g),放出大量气体,驱动火箭升空。每消耗34gH2O2,理论上
O2(g),放出大量气体,驱动火箭升空。每消耗34gH2O2,理论上____ (填“放出”或“吸收”)热量____ 98kJ(填“大于”、“小于”或“等于”)。
(3)向H2O2稀溶液中滴加数滴含Mn2+的溶液,即有气泡快速逸出,反应中Mn2+起____ 作用。某组实验数据如下:
0-30minH2O2反应的平均速率v=____ mol·L-1·min-1
 O2(g)ΔH=-98kJ·mol-1K=2.88×1020
O2(g)ΔH=-98kJ·mol-1K=2.88×1020回答问题:
(1)H2O2的强氧化性使其对大多数致病菌和病毒具有消杀功能。用3%医用H2O2对传染病房喷洒消毒时,地板上有气泡冒出,该气体是
(2)纯H2O2可作为民用驱雹火箭推进剂。在火箭喷口铂网催化下,H2O2剧烈分解:H2O2(l)=H2O(g)+
 O2(g),放出大量气体,驱动火箭升空。每消耗34gH2O2,理论上
O2(g),放出大量气体,驱动火箭升空。每消耗34gH2O2,理论上(3)向H2O2稀溶液中滴加数滴含Mn2+的溶液,即有气泡快速逸出,反应中Mn2+起
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| c(H2O2)/mol·L-1 | 0.70 | 0.49 | 0.35 | 0.25 | 0.17 | 0.12 |
0-30minH2O2反应的平均速率v=
您最近一年使用:0次
4 . 在微生物作用的条件下,NH 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意图如图:
。两步反应的能量变化示意图如图:
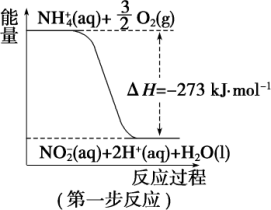
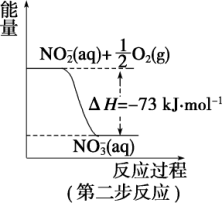
(1)第一步反应是_______ (填“放热”或“吸热”)反应,判断依据是_______ 。
(2)1 molNH (aq) 全部氧化成NO
(aq) 全部氧化成NO (aq)的热化学方程式是
(aq)的热化学方程式是_______ 。
(3) HCl与氧气在催化剂加热条件下可生成氯气:4HCl+O2 2Cl2+2H2O,已知某些化学键的键能数据如表:
2Cl2+2H2O,已知某些化学键的键能数据如表:
该反应的热化学方程式是_______ 。
(4)FeCl3溶液常用于腐蚀印刷电路铜板,发生的反应为2FeCl3+Cu=2FeCl2+CuCl2,若将此反应设计成原电池,则正极所用的电极材料为_______ ;电解质溶液为_______ ,当电路中转移0.2 mol 电子时,被腐蚀的负极反应物的质量为_______ g。
 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意图如图:
。两步反应的能量变化示意图如图:

(1)第一步反应是
(2)1 molNH
 (aq) 全部氧化成NO
(aq) 全部氧化成NO (aq)的热化学方程式是
(aq)的热化学方程式是(3) HCl与氧气在催化剂加热条件下可生成氯气:4HCl+O2
 2Cl2+2H2O,已知某些化学键的键能数据如表:
2Cl2+2H2O,已知某些化学键的键能数据如表:| 化学键 | H-Cl | O=O | Cl-Cl | H-O |
| 键能/kJ/mol | 431 | 498 | 243 | 463 |
该反应的热化学方程式是
(4)FeCl3溶液常用于腐蚀印刷电路铜板,发生的反应为2FeCl3+Cu=2FeCl2+CuCl2,若将此反应设计成原电池,则正极所用的电极材料为
您最近一年使用:0次
5 . Ⅰ.氨是工业生产硝酸的重要原料,请根据以下工业制硝酸的原理示意图回答含氮化合物相关的问题:

(1)工业用甲烷制取氢气作为合成氨的原料,已知以下的热化学反应方程式:
①2CO(g)+O2(g)=2CO2(g)∆H=-566kJ/mol
②2H2(g)+O2(g)=2H2O(g)∆H=-484kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(g)∆H=-890kJ/mol
则:CH4(g)+CO2(g)=2CO(g)+2H2(g)∆H=__ kJ/mol。
(2)一定温度下,将N2与H2以体积比1:2置于2L的密闭容器中发生反应:N2(g)+3H2(g) 2NH3(g),下列能说明反应达到平衡状态的是
2NH3(g),下列能说明反应达到平衡状态的是___ 。
A.体系压强保持不变
B.混合气体颜色保持不变
C.N2与H2的物质的量之比保持不变
D.每消耗2molNH3的同时消耗1molN2
(3)“吸收塔”尾部会有含NO、NO2等氮氧化物的尾气排出,为消除它们对环境的破坏作用,通常用氨转化法处理:已知7mol氨恰好能将含NO和NO2共6mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为__ 。
Ⅱ.氮肥厂的废水直接排放会造成污染,目前氨氮废水处理方法主要有吹脱法、化学沉淀法、生物硝化反硝化法等。某氮肥厂的氨氮废水中氮元素多以NH 和NH3•H2O的形式存在。该厂技术团队设计该废水处理方案流程如图:
和NH3•H2O的形式存在。该厂技术团队设计该废水处理方案流程如图:
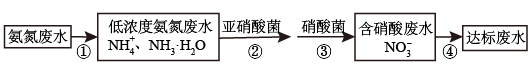
(4)检验某溶液中是否含有NH 的方法
的方法___ (写出所需试剂、操作及现象)。
(5)过程②、③:在微生物亚硝酸菌和硝酸菌作用下实现NH →NO
→NO →NO
→NO 的转化,称为硝化反应。1molNH
的转化,称为硝化反应。1molNH 可被
可被___ L(标准状况)O2最终氧化成NO 。
。
(6)过程④:在一定条件下向废水中加入甲醇(CH3OH)实现HNO2→N2转化,称为反硝化反应。此过程中甲醇(C元素-2价)转化为CO2,写出此过程的化学方程式___ 。

(1)工业用甲烷制取氢气作为合成氨的原料,已知以下的热化学反应方程式:
①2CO(g)+O2(g)=2CO2(g)∆H=-566kJ/mol
②2H2(g)+O2(g)=2H2O(g)∆H=-484kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(g)∆H=-890kJ/mol
则:CH4(g)+CO2(g)=2CO(g)+2H2(g)∆H=
(2)一定温度下,将N2与H2以体积比1:2置于2L的密闭容器中发生反应:N2(g)+3H2(g)
 2NH3(g),下列能说明反应达到平衡状态的是
2NH3(g),下列能说明反应达到平衡状态的是A.体系压强保持不变
B.混合气体颜色保持不变
C.N2与H2的物质的量之比保持不变
D.每消耗2molNH3的同时消耗1molN2
(3)“吸收塔”尾部会有含NO、NO2等氮氧化物的尾气排出,为消除它们对环境的破坏作用,通常用氨转化法处理:已知7mol氨恰好能将含NO和NO2共6mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为
Ⅱ.氮肥厂的废水直接排放会造成污染,目前氨氮废水处理方法主要有吹脱法、化学沉淀法、生物硝化反硝化法等。某氮肥厂的氨氮废水中氮元素多以NH
 和NH3•H2O的形式存在。该厂技术团队设计该废水处理方案流程如图:
和NH3•H2O的形式存在。该厂技术团队设计该废水处理方案流程如图:
(4)检验某溶液中是否含有NH
 的方法
的方法(5)过程②、③:在微生物亚硝酸菌和硝酸菌作用下实现NH
 →NO
→NO →NO
→NO 的转化,称为硝化反应。1molNH
的转化,称为硝化反应。1molNH 可被
可被 。
。(6)过程④:在一定条件下向废水中加入甲醇(CH3OH)实现HNO2→N2转化,称为反硝化反应。此过程中甲醇(C元素-2价)转化为CO2,写出此过程的化学方程式
您最近一年使用:0次
解答题-原理综合题
|
适中(0.65)
|
名校
解题方法
6 . (1)断裂 化学键所需要的能量如表所示,腓(
化学键所需要的能量如表所示,腓( )的有关化学反应的能量变化如图所示。
)的有关化学反应的能量变化如图所示。
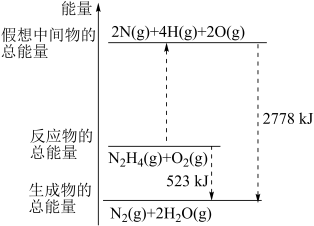
回答下列问题:
①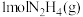 与
与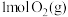 反应生成
反应生成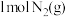 和
和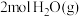 放出的能量为
放出的能量为____ kJ。
②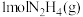 与
与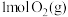 断键吸收的能量为
断键吸收的能量为____ kJ。
③a=____ 。
④当有 生成时,放出的能量
生成时,放出的能量_____ (填“>”“<”或“=”)523kJ。
(2)某镇有座硫酸厂,设备简陋,技术陈旧,该厂每天排放大量含 的废气和含
的废气和含 的酸性废水。当地的其他工厂和居民均用煤炭作燃料。只要下雨就下酸雨,对该镇环境造成极大破坏。
的酸性废水。当地的其他工厂和居民均用煤炭作燃料。只要下雨就下酸雨,对该镇环境造成极大破坏。
①分析该镇下酸雨的原因:_______ ;
②举一例说明酸雨对环境造成的危害:_______ ;
③该镇某中学环保小组提出了治理酸雨的下列措施,你认为其中不妥的是_______ ;
④可用熟石灰来处理硫酸厂排出的酸性废水,处理原理的化学方程式是_______ ;
⑤浓硫酸弄到手上后直接用大量水洗,然后涂上碳酸氢钠。这样的处理方法正确吗?_______ (填“正确”或“不正确”),理由是_______ 。
 化学键所需要的能量如表所示,腓(
化学键所需要的能量如表所示,腓( )的有关化学反应的能量变化如图所示。
)的有关化学反应的能量变化如图所示。
| 化学键 |  | 氧氧键 |  |  |
能量/( ) ) |  | 498 | 946 | 391 |
①
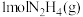 与
与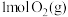 反应生成
反应生成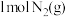 和
和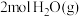 放出的能量为
放出的能量为②
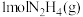 与
与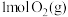 断键吸收的能量为
断键吸收的能量为③a=
④当有
 生成时,放出的能量
生成时,放出的能量(2)某镇有座硫酸厂,设备简陋,技术陈旧,该厂每天排放大量含
 的废气和含
的废气和含 的酸性废水。当地的其他工厂和居民均用煤炭作燃料。只要下雨就下酸雨,对该镇环境造成极大破坏。
的酸性废水。当地的其他工厂和居民均用煤炭作燃料。只要下雨就下酸雨,对该镇环境造成极大破坏。①分析该镇下酸雨的原因:
②举一例说明酸雨对环境造成的危害:
③该镇某中学环保小组提出了治理酸雨的下列措施,你认为其中不妥的是
| A.将硫酸厂搬离该镇 |
| B.建议环保部门限令整改 |
C.将硫酸厂排出的废气中的 处理后排放 处理后排放 |
| D.工厂和居民改用较清洁的燃料 |
⑤浓硫酸弄到手上后直接用大量水洗,然后涂上碳酸氢钠。这样的处理方法正确吗?
您最近一年使用:0次



