名校
解题方法
1 . 化学反应伴随能量变化,获取反应能量变化有多条途径。
Ⅰ.(1)下列反应中,属于吸热反应的是___________ 。
A.C和CO2高温下反应 B.甲烷的燃烧反应
C.Ba(OH)2·8H2O与氯化铵反应 D.锌与盐酸反应
(2)获取能量变化的途径
①通过化学键的键能计算。已知:
计算可得:H2(g)+Cl2(g)=2HCl(g) △H=___________ kJ·mol-1。
②通过盖斯定律可计算。已知在25 ℃、101 kPa时:
I.2Na(s)+ O2(g)=Na2O(s) △H=—414 kJ·mol-1
O2(g)=Na2O(s) △H=—414 kJ·mol-1
II.2Na(s)+O2(g)=Na2O2(s) △H=—511 kJ·mol-1
写出Na2O2与Na反应生成Na2O的热化学方程式:___________ 。
(3)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如图所示。
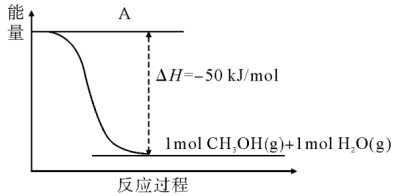
①补全图:图中A处应填入___________ 。
②该反应需要加入铜—锌基催化剂。加入催化剂后,该反应的△H___________ (填“增大”、“减小”或者“不变”);若上述反应中产物为液态水,则该反应的△H___________ (填“变大”、“变小”或者“不变”)。
II.某同学设计一个燃料电池(如图所示),目的是探究氯碱工业原理和粗铜的精炼原理,根据要求回答相关问题:
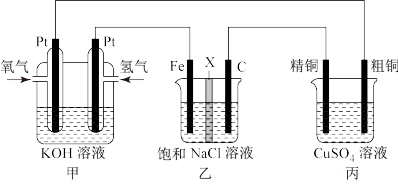
(1)若在标准状况下,甲装置有448 mL氧气参加反应,则乙装置中铁电极上生成的气体在标准状况下体积为___________ 。
(2)若用隔膜法电解饱和食盐水生成NaClO,则X应用___________ 交换膜(填“阳离子”或“阴离子”)。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将___________ (填 “增大”、“减小”或者“不变”)。
Ⅰ.(1)下列反应中,属于吸热反应的是
A.C和CO2高温下反应 B.甲烷的燃烧反应
C.Ba(OH)2·8H2O与氯化铵反应 D.锌与盐酸反应
(2)获取能量变化的途径
①通过化学键的键能计算。已知:
| 化学键种类 | H—H | Cl—Cl | H—Cl |
| 键能(kJ/mol) | 436 | 247 | 434 |
计算可得:H2(g)+Cl2(g)=2HCl(g) △H=
②通过盖斯定律可计算。已知在25 ℃、101 kPa时:
I.2Na(s)+
 O2(g)=Na2O(s) △H=—414 kJ·mol-1
O2(g)=Na2O(s) △H=—414 kJ·mol-1II.2Na(s)+O2(g)=Na2O2(s) △H=—511 kJ·mol-1
写出Na2O2与Na反应生成Na2O的热化学方程式:
(3)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如图所示。

①补全图:图中A处应填入
②该反应需要加入铜—锌基催化剂。加入催化剂后,该反应的△H
II.某同学设计一个燃料电池(如图所示),目的是探究氯碱工业原理和粗铜的精炼原理,根据要求回答相关问题:

(1)若在标准状况下,甲装置有448 mL氧气参加反应,则乙装置中铁电极上生成的气体在标准状况下体积为
(2)若用隔膜法电解饱和食盐水生成NaClO,则X应用
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将
您最近一年使用:0次
解题方法
2 . Ⅰ.以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN);通过电解法可制取铝。回答下列问题:
已知:2Al2O3(s)=4Al(g)+3O2(g) ∆H=3351kJ·mol-1
2C(s)+O2(g)=2CO(g) ∆H=-221kJ·mol-1
2Al(g)+N2(g)=2AlN(s) ∆H=-318kJ·mol-1
碳热还原Al2O3合成AlN的总热化学方程式是_______ 。
II.已知化学反应:①AgNO3+NaCl=AgCl↓+NaNO3②2FeCl3+Cu=2FeCl2+CuCl2。
(1)上述两个化学反应中有一个不可用于设计原电池,它是_______ (填序号),理由是_______ 。
(2)另一个可用于设计原电池,若利用该反应设计如下图所示的原电池,请在如图方框中标明电极材料和电解质溶液的名称①_______ ②_______ ③_______ (图中“I”表示电流)。
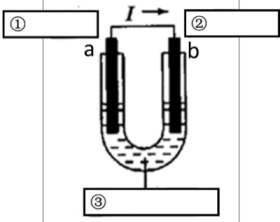
该电池电极a上发生的电极反应式是_______ ,电极b上发生_______ 反应(填“氧化”或“还原”)。
已知:2Al2O3(s)=4Al(g)+3O2(g) ∆H=3351kJ·mol-1
2C(s)+O2(g)=2CO(g) ∆H=-221kJ·mol-1
2Al(g)+N2(g)=2AlN(s) ∆H=-318kJ·mol-1
碳热还原Al2O3合成AlN的总热化学方程式是
II.已知化学反应:①AgNO3+NaCl=AgCl↓+NaNO3②2FeCl3+Cu=2FeCl2+CuCl2。
(1)上述两个化学反应中有一个不可用于设计原电池,它是
(2)另一个可用于设计原电池,若利用该反应设计如下图所示的原电池,请在如图方框中标明电极材料和电解质溶液的名称①

该电池电极a上发生的电极反应式是
您最近一年使用:0次
3 . 甲醇作为燃料,在化石能源和可再生能源时期均有广泛的应用前景。
(1)汽油的主要成分之一是辛烷[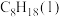 ]。已知:25℃、101kPa时,1mol
]。已知:25℃、101kPa时,1mol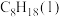 完全燃烧生成气态二氧化碳和液态水,放出5518kJ热量。该反应的热化学方程式为
完全燃烧生成气态二氧化碳和液态水,放出5518kJ热量。该反应的热化学方程式为______ 。
(2)已知:25℃、101kPa时,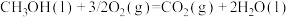

相同质量的甲醇和辛烷分别完全燃烧时,放出热量较多的是______ 。
(3)某研究者分别以甲醇和汽油做燃料,实验测得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如图所示。

根据图信息分析,与汽油相比,甲醇作为燃料的优点是______ 。
Ⅱ.甲醇的合成
(4)以 和
和 为原料合成甲醇,反应的能量变化如图所示。
为原料合成甲醇,反应的能量变化如图所示。
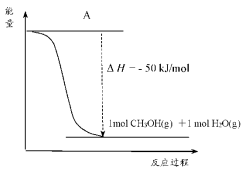
①补全图:图中A处应填入______ 。
②由图可知,该反应中反应物 和
和 的总能量
的总能量______ (填“大于”、“小于”或“等于”)生成物 和
和 的总能量。
的总能量。
(5)已知:1mol液态甲醇完全气化需吸热37.4kJ,1mol液态水完全气化需吸热44.0kJ,由 合成1mol液态甲醇和1mol液态水将
合成1mol液态甲醇和1mol液态水将______ (填“吸收”或“放出”)______ kJ热量。
(6)已知: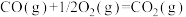
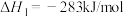
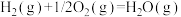
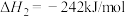
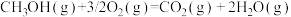
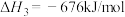
以 和
和 为原料合成甲醇的反应为
为原料合成甲醇的反应为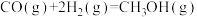 。
。
该反应的 为
为______ kJ/mol。
(1)汽油的主要成分之一是辛烷[
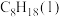 ]。已知:25℃、101kPa时,1mol
]。已知:25℃、101kPa时,1mol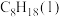 完全燃烧生成气态二氧化碳和液态水,放出5518kJ热量。该反应的热化学方程式为
完全燃烧生成气态二氧化碳和液态水,放出5518kJ热量。该反应的热化学方程式为(2)已知:25℃、101kPa时,
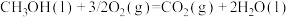

相同质量的甲醇和辛烷分别完全燃烧时,放出热量较多的是
(3)某研究者分别以甲醇和汽油做燃料,实验测得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如图所示。

根据图信息分析,与汽油相比,甲醇作为燃料的优点是
Ⅱ.甲醇的合成
(4)以
 和
和 为原料合成甲醇,反应的能量变化如图所示。
为原料合成甲醇,反应的能量变化如图所示。
①补全图:图中A处应填入
②由图可知,该反应中反应物
 和
和 的总能量
的总能量 和
和 的总能量。
的总能量。(5)已知:1mol液态甲醇完全气化需吸热37.4kJ,1mol液态水完全气化需吸热44.0kJ,由
 合成1mol液态甲醇和1mol液态水将
合成1mol液态甲醇和1mol液态水将(6)已知:
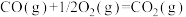
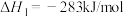
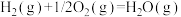
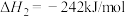
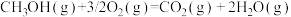
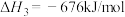
以
 和
和 为原料合成甲醇的反应为
为原料合成甲醇的反应为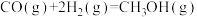 。
。该反应的
 为
为
您最近一年使用:0次
名校
解题方法
4 . 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:_______ 。
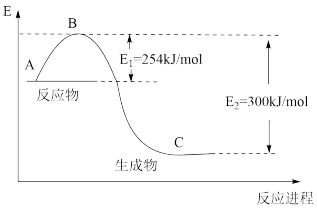
(2)若已知表中数据:
试根据表中及图中数据计算N-H的键能:_______ kJ·mol-1。
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。
已知:①4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH1=-akJ·mol-1
② N2(g)+O2(g)=2NO(g) ΔH2=-bkJ·mol-1
则NH3还原NO的热化学方程式:_______ 。
(4)N、H、O元素形成的离子化合物为_______ (填化学式)。
(5) 氨气可用电解法合成,其原料转化率大幅度提高,有望代替传统的工业合成氨工艺。电解法合成氨的两种原理及装置如图1和图2所示。
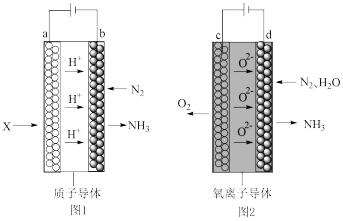
图1中,a 电极上通入的X 为_______ ;图 2 中,d 电极上的电极反应式为_______ 。
(1)图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:

(2)若已知表中数据:
| 化学键 | H-H | N≡N |
| 键能/kJ·mol-1 | 435 | 943 |
试根据表中及图中数据计算N-H的键能:
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。
已知:①4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH1=-akJ·mol-1
② N2(g)+O2(g)=2NO(g) ΔH2=-bkJ·mol-1
则NH3还原NO的热化学方程式:
(4)N、H、O元素形成的离子化合物为
(5) 氨气可用电解法合成,其原料转化率大幅度提高,有望代替传统的工业合成氨工艺。电解法合成氨的两种原理及装置如图1和图2所示。

图1中,a 电极上通入的X 为
您最近一年使用:0次
名校
解题方法
5 . 甲醇(CH3OH)是一种基本的有机化工原料,主要用于塑料、医药、农药、合成蛋白质等工业。
I.工业上常用一氧化碳(CO)和氢气(H2)合成甲醇。一定温度下,在容积为2L的某恒容密闭容器中充入一氧化碳和氢气两种气体进行反应,反应过程中各成分的相关数据如图所示。

回答下列问题:
(1)该反应的化学方程为___________ 。
(2)从反应开始至10min内,(恰好达平衡时间内)CO的消耗速率为___________ 。
(3)反应达平衡时,H2的转化率为___________ ,容器内CH3OH与CO的物质的量之比n(CH3OH):n(CO)=___________ 。
II.工业上常用天然气作为制备CH3OH的原料。已知:
①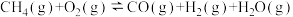 △H=-321.5kJ/mol
△H=-321.5kJ/mol
②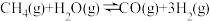 △H=+250.3kJ/mol
△H=+250.3kJ/mol
③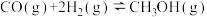 △H=-90.0kJ/mol
△H=-90.0kJ/mol
(4)CH4(g)与O2(g)化合生成CH3OH(g)的热化学方程式是___________ 。
III.CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、氧气和KOH溶液构成。回答下列问题:
(5)该电池的负极反应为___________ 。
I.工业上常用一氧化碳(CO)和氢气(H2)合成甲醇。一定温度下,在容积为2L的某恒容密闭容器中充入一氧化碳和氢气两种气体进行反应,反应过程中各成分的相关数据如图所示。

回答下列问题:
(1)该反应的化学方程为
(2)从反应开始至10min内,(恰好达平衡时间内)CO的消耗速率为
(3)反应达平衡时,H2的转化率为
II.工业上常用天然气作为制备CH3OH的原料。已知:
①
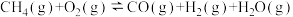 △H=-321.5kJ/mol
△H=-321.5kJ/mol②
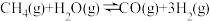 △H=+250.3kJ/mol
△H=+250.3kJ/mol③
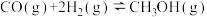 △H=-90.0kJ/mol
△H=-90.0kJ/mol(4)CH4(g)与O2(g)化合生成CH3OH(g)的热化学方程式是
III.CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、氧气和KOH溶液构成。回答下列问题:
(5)该电池的负极反应为
您最近一年使用:0次
名校
解题方法
6 . 甲醇作为燃料,在化石能源和可再生能源时期均有广泛的应用前景。
Ⅰ甲醇可以替代汽油和柴油作为内燃机燃料
(1)汽油的主要成分之一是辛烷[C8H18(l)]。已知:25℃,101KPa 时,1mol C8H18(l)完全燃烧生成气态二氧化碳和液态水,放出 5518kJ 热量。该反应的热化学方程式为:_____
(2)已知:25℃,101KPa 时,CH3OH(l)+ 3/2 O2(g)=CO2(g)+2H2O(l) ΔH=-726.5 kJ·mol-1
相同质量的甲醇和辛烷分别燃烧时,放出热量最多的是_____ (填化学式)
(3)CH3OH(l)+ O2(g)=CO(g)+2H2O(g) ΔH=-393 kJ·mol-1该反应相关化学键键能数据如下表:
则 X=_____ 。
Ⅱ甲醇的合成
(4)以 CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如图所示。
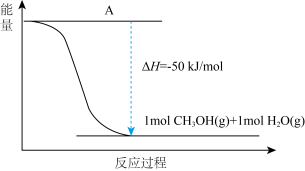
①补全上图:图中A 处应填入_____ 。
②该反应需要加入铜-锌基催化剂。加入催化剂后,该反应 ΔH_____ (填“变大”“变小”“不变”)。
③已知:
CO(g)+ 1/2 O2(g) = CO2(g) ΔH1=-283kJ·mol-1
H2(g)+ 1/2 O2(g) = H2O(g)ΔH2=-242kJ·mol-1
CH3OH(g)+ 3/2 O2(g)=CO2(g)+2H2O(g) ΔH3=-676 kJ·mol-1
以 CO(g)和 H2(g)为原料合成甲醇的反应为 CO(g)+ 2H2(g) = CH3OH(g),该反应的 ΔH=_____ kJ·mol-1。
Ⅰ甲醇可以替代汽油和柴油作为内燃机燃料
(1)汽油的主要成分之一是辛烷[C8H18(l)]。已知:25℃,101KPa 时,1mol C8H18(l)完全燃烧生成气态二氧化碳和液态水,放出 5518kJ 热量。该反应的热化学方程式为:
(2)已知:25℃,101KPa 时,CH3OH(l)+ 3/2 O2(g)=CO2(g)+2H2O(l) ΔH=-726.5 kJ·mol-1
相同质量的甲醇和辛烷分别燃烧时,放出热量最多的是
(3)CH3OH(l)+ O2(g)=CO(g)+2H2O(g) ΔH=-393 kJ·mol-1该反应相关化学键键能数据如下表:
| 化学键 | O=O | C-O | C=O | H-O | C-H |
| E/( kJ·mol-1) | X | 343 | 1076 | 465 | 413 |
Ⅱ甲醇的合成
(4)以 CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如图所示。

①补全上图:图中A 处应填入
②该反应需要加入铜-锌基催化剂。加入催化剂后,该反应 ΔH
③已知:
CO(g)+ 1/2 O2(g) = CO2(g) ΔH1=-283kJ·mol-1
H2(g)+ 1/2 O2(g) = H2O(g)ΔH2=-242kJ·mol-1
CH3OH(g)+ 3/2 O2(g)=CO2(g)+2H2O(g) ΔH3=-676 kJ·mol-1
以 CO(g)和 H2(g)为原料合成甲醇的反应为 CO(g)+ 2H2(g) = CH3OH(g),该反应的 ΔH=
您最近一年使用:0次
2020-09-30更新
|
113次组卷
|
3卷引用:陕西省延安市第四中学(宝塔中学)2020-2021学年高一下学期期末考试化学试题
名校
解题方法
7 . 源开发和利用是科学研究的热点课题。
(1)几个有关CO的热化学方程式如下:
I.CO(g)+2H2(g)⇌CH3OH(g) ∆H1
II.2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ∆H2
III.CO(g)+H2O(g)⇌CO2(g)+H2(g) ∆H3
则3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g) ∆H=_______ (用含∆H1、∆H2、∆H3的代数表示)。
(2)在1L恒容密闭容器中充入一定量CH3OH发生反应:2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ∆H,测得CH3OH的浓度与温度的关系如图所示:
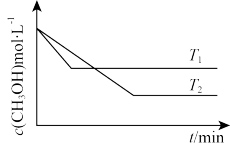
则T1_______ T2;∆H_______ 0(填“>”“<”或“=”)。
(3)工业上,利用水煤气合成CH3OH的反应表示如下:2H2(g)+CO(g)⇌CH3OH(g) ∆H=-91.0kJ·mol-1,向1L的恒容密容器中加入0.1molH2和0.05molCO在一定温度下发生上述反应,10min后反应达到平衡状态,测得放出的热量为3.64kJ。
①从反应开始恰好平衡状态时,H2的平均反应速率v(H2)为_______ 。
②在温度不变条件下,上述反应达到平衡后再向容器中充入0.01molH2和0.05molCH3OH(g)时,平衡_______ (填“向左移动”、“向右移动”或“不移动”)。
(4)探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
I.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H=-49.5kJ·mol-1
II.CO(g)+2H2(g)⇌CH3OH(g) ∆H2=-90.4kJ·mol-1
III.CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H3
一定条件下,向体积为VL的恒容密闭容器中通入1molCO2和3molH2发生上述反应,达到平衡时,容器中CH3OH(g)为amol,CO为bmol,此时H2O(g)的浓度为_______ mol·L-1(用含a、b、V的代数式表示,下同),反应III的平衡常数为_______ 。
(1)几个有关CO的热化学方程式如下:
I.CO(g)+2H2(g)⇌CH3OH(g) ∆H1
II.2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ∆H2
III.CO(g)+H2O(g)⇌CO2(g)+H2(g) ∆H3
则3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g) ∆H=
(2)在1L恒容密闭容器中充入一定量CH3OH发生反应:2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ∆H,测得CH3OH的浓度与温度的关系如图所示:

则T1
(3)工业上,利用水煤气合成CH3OH的反应表示如下:2H2(g)+CO(g)⇌CH3OH(g) ∆H=-91.0kJ·mol-1,向1L的恒容密容器中加入0.1molH2和0.05molCO在一定温度下发生上述反应,10min后反应达到平衡状态,测得放出的热量为3.64kJ。
①从反应开始恰好平衡状态时,H2的平均反应速率v(H2)为
②在温度不变条件下,上述反应达到平衡后再向容器中充入0.01molH2和0.05molCH3OH(g)时,平衡
(4)探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
I.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H=-49.5kJ·mol-1
II.CO(g)+2H2(g)⇌CH3OH(g) ∆H2=-90.4kJ·mol-1
III.CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H3
一定条件下,向体积为VL的恒容密闭容器中通入1molCO2和3molH2发生上述反应,达到平衡时,容器中CH3OH(g)为amol,CO为bmol,此时H2O(g)的浓度为
您最近一年使用:0次
名校
解题方法
8 . Ⅰ.我国学者采用量子力学方法,通过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在钯催化剂表面上的物种用*标注。
甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
方式 A:CH3OH* →CH3O* +H* Ea= +103.1kJ·mol-1
方式 B:CH3OH* →CH3* +OH* Eb= +249.3kJ·mol-1
由活化能E值推测,甲醇裂解过程主要历经的方式应为___________ (填A、B)。
下图为计算机模拟的各步反应的能量变化示意图。

该历程中,放热最多的步骤的化学方程式为___________ 。
Ⅱ.TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:

氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ΔH1=+175.4 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-220.9 kJ·mol-1
(1)沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式_____ 。
(2)工业上处理尾气中NO的方法为:将NO与H2的混合气体通入Ce(SO4)2与Ce2(SO4)3的混合溶液中,其物质转化如图所示。写出图示转化的总反应的化学方程式_____ 。

Ⅲ.甲醇可作为燃料电池的原料。CO2和CO可作为工业合成甲醇(CH3OH)的直接碳源,
(1)已知在常温常压下:①CH3OH(l)+ O2(g)=CO(g) + 2H2O(g); ΔH=﹣355.0 kJ∕mol
②2CO(g)+ O2(g)= 2CO2(g) ΔH=-566.0 kJ/mol ③H2O(l)=H2O(g) ΔH=+44.0 kJ/mol
写出表示甲醇燃烧热的热化学方程式:___________
(2)利用CO和H2在一定条件下可合成甲醇,发生如下反应:CO(g)+2H2(g)=CH3OH(g),其两种反应过程中能量的变化曲线如下图a、b所示,下列说法正确的是___________ 。
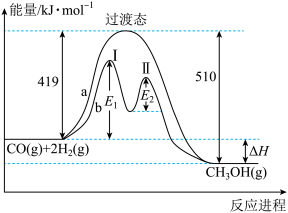
A.上述反应的ΔH=-91kJ·mol-1
B.a反应正反应的活化能为510kJ·mol-1
C.b过程中第Ⅰ阶段为吸热反应,第Ⅱ阶段为放热反应
D.b过程使用催化剂后降低了反应的活化能和ΔH
E.b过程的反应速率:第Ⅱ阶段>第Ⅰ阶段
甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
方式 A:CH3OH* →CH3O* +H* Ea= +103.1kJ·mol-1
方式 B:CH3OH* →CH3* +OH* Eb= +249.3kJ·mol-1
由活化能E值推测,甲醇裂解过程主要历经的方式应为
下图为计算机模拟的各步反应的能量变化示意图。

该历程中,放热最多的步骤的化学方程式为
Ⅱ.TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:

氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ΔH1=+175.4 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-220.9 kJ·mol-1
(1)沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式
(2)工业上处理尾气中NO的方法为:将NO与H2的混合气体通入Ce(SO4)2与Ce2(SO4)3的混合溶液中,其物质转化如图所示。写出图示转化的总反应的化学方程式

Ⅲ.甲醇可作为燃料电池的原料。CO2和CO可作为工业合成甲醇(CH3OH)的直接碳源,
(1)已知在常温常压下:①CH3OH(l)+ O2(g)=CO(g) + 2H2O(g); ΔH=﹣355.0 kJ∕mol
②2CO(g)+ O2(g)= 2CO2(g) ΔH=-566.0 kJ/mol ③H2O(l)=H2O(g) ΔH=+44.0 kJ/mol
写出表示甲醇燃烧热的热化学方程式:
(2)利用CO和H2在一定条件下可合成甲醇,发生如下反应:CO(g)+2H2(g)=CH3OH(g),其两种反应过程中能量的变化曲线如下图a、b所示,下列说法正确的是

A.上述反应的ΔH=-91kJ·mol-1
B.a反应正反应的活化能为510kJ·mol-1
C.b过程中第Ⅰ阶段为吸热反应,第Ⅱ阶段为放热反应
D.b过程使用催化剂后降低了反应的活化能和ΔH
E.b过程的反应速率:第Ⅱ阶段>第Ⅰ阶段
您最近一年使用:0次
2021-07-14更新
|
648次组卷
|
3卷引用:江西省景德镇一中2020-2021学年高一下学期期末考试化学试题
江西省景德镇一中2020-2021学年高一下学期期末考试化学试题湖北省襄阳市第一中学2022-2023学年高一下学期4月月考化学试题(已下线)易错点20 化学反应机理-备战2023年高考化学考试易错题
9 . 煤的气化可以减少环境污染,而且生成的CO和H2被称作合成气,能合成很多基础有机化工原料。
(1)工业上可利用CO生产乙醇:2CO(g)+4H2(g) CH3CH2OH(g)+H2O(g) ΔH1
CH3CH2OH(g)+H2O(g) ΔH1
又知:H2O(l)=H2O(g) ΔH2
CO(g)+H2O(g) CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
工业上也可利用CO2(g)与H2(g)为原料合成乙醇:
2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(l)ΔH
CH3CH2OH(g)+3H2O(l)ΔH
则ΔH与ΔH1、ΔH2、ΔH3之间的关系是ΔH=____________ 。
(2)一定条件下,H2、CO在体积固定的绝热密闭容器中发生如下反应:4H2(g)+2CO(g) CH3OCH3(g)+H2O(g),下列选项不能判断该反应达到平衡状态的是
CH3OCH3(g)+H2O(g),下列选项不能判断该反应达到平衡状态的是__________ 。
A.v(H2)正=2v(CO)逆 B.平衡常数K不再随时间而变化
C.混合气体的密度保持不变 D.CH3OCH3和H2O的体积之比不随时间而变化
(3)工业可采用CO与H2反应合成再生能源甲醇,反应:CO(g)+2H2(g) CH3OH(g),在一容积可变的密闭容器中充有10 mol CO和20 mol H2,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(α)与温度(T)、压强(p)的关系如图1所示。
CH3OH(g),在一容积可变的密闭容器中充有10 mol CO和20 mol H2,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(α)与温度(T)、压强(p)的关系如图1所示。
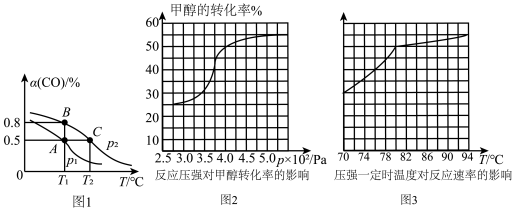
①合成甲醇的反应为______________ (填“放热”或“吸热”)反应。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为____________________ 。p1和p2的大小关系为___________ 。
③若达到平衡状态A时,容器的体积为10 L,则在平衡状态B时容器的体积为________ L。
(4)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为CH3OH(g)+CO(g) HCOOCH3(g) ΔH2="-29.1" kJ·mol-1。科研人员对该反应进行了研究,部分研究结果如图2、3:
HCOOCH3(g) ΔH2="-29.1" kJ·mol-1。科研人员对该反应进行了研究,部分研究结果如图2、3:
①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是________ (填“3.5×106Pa”“4.0×106Pa”或“5.0×106Pa”)。
②实际工业生产中采用的温度是80℃,其理由是___________________ 。
(1)工业上可利用CO生产乙醇:2CO(g)+4H2(g)
 CH3CH2OH(g)+H2O(g) ΔH1
CH3CH2OH(g)+H2O(g) ΔH1又知:H2O(l)=H2O(g) ΔH2
CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3工业上也可利用CO2(g)与H2(g)为原料合成乙醇:
2CO2(g)+6H2(g)
 CH3CH2OH(g)+3H2O(l)ΔH
CH3CH2OH(g)+3H2O(l)ΔH则ΔH与ΔH1、ΔH2、ΔH3之间的关系是ΔH=
(2)一定条件下,H2、CO在体积固定的绝热密闭容器中发生如下反应:4H2(g)+2CO(g)
 CH3OCH3(g)+H2O(g),下列选项不能判断该反应达到平衡状态的是
CH3OCH3(g)+H2O(g),下列选项不能判断该反应达到平衡状态的是A.v(H2)正=2v(CO)逆 B.平衡常数K不再随时间而变化
C.混合气体的密度保持不变 D.CH3OCH3和H2O的体积之比不随时间而变化
(3)工业可采用CO与H2反应合成再生能源甲醇,反应:CO(g)+2H2(g)
 CH3OH(g),在一容积可变的密闭容器中充有10 mol CO和20 mol H2,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(α)与温度(T)、压强(p)的关系如图1所示。
CH3OH(g),在一容积可变的密闭容器中充有10 mol CO和20 mol H2,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(α)与温度(T)、压强(p)的关系如图1所示。
①合成甲醇的反应为
②A、B、C三点的平衡常数KA、KB、KC的大小关系为
③若达到平衡状态A时,容器的体积为10 L,则在平衡状态B时容器的体积为
(4)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为CH3OH(g)+CO(g)
 HCOOCH3(g) ΔH2="-29.1" kJ·mol-1。科研人员对该反应进行了研究,部分研究结果如图2、3:
HCOOCH3(g) ΔH2="-29.1" kJ·mol-1。科研人员对该反应进行了研究,部分研究结果如图2、3:①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是
②实际工业生产中采用的温度是80℃,其理由是
您最近一年使用:0次
2017-02-17更新
|
656次组卷
|
2卷引用:江西省高安中学2020-2021学年高一上学期第一次月考(A)化学试题



