1 . 下列说法不正确的是
| A.对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同 |
| B.盐酸与某强碱中和放出的热随反应物的用量改变而改变,但中和热不变 |
| C.燃烧热随化学方程式前面的化学计量数的改变而改变 |
| D.放热反应的反应物的总能量高于生成物的总能量 |
您最近一年使用:0次
名校
解题方法
2 . 二甲醚(CH3OCH3)具有优良的燃烧性能,被称为21世纪的“清洁能源”。一步法合成二甲醚是以合成气(CO/H2)为原料,在一定温度、压强和催化剂作用下进行,反应器中发生了下列反应:
I:CO(g)+2H2(g) CH3OH(g)∆H1=-90.7kJ·mol-1
CH3OH(g)∆H1=-90.7kJ·mol-1
II:2CH3OH(g) CH3OCH3(g)+H2O(g)∆H2=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g)∆H2=-23.5kJ·mol-1
III:CO(g)+H2O(g) CO2(g)+H2(g)ΔH3=-41.2kJ·mol-1
CO2(g)+H2(g)ΔH3=-41.2kJ·mol-1
(1)一种新合成二甲醚的方法为一定条件下:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g),该反应的∆H=
CH3OCH3(g)+3H2O(g),该反应的∆H=___________ kJ·mol-1;判断该反应在一定温度下、体积恒定的密闭容器中,下列不能作为达到化学平衡状态的依据是___________ 。
A.平均摩尔质量保持不变B.容器的密度不变
C.容器内压强保持不变D.单位时间内消耗2molCO2,同时消耗1mol二甲醚
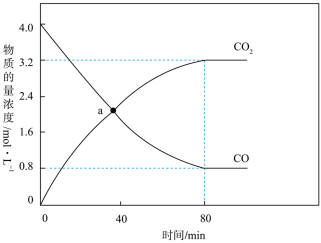
(2)若反应CO(g)+H2O(g) CO2(g)+H2(g)的正、逆反应速率分别可表示为v正=k正c(CO)·c(H2O);v逆=k逆c(CO2)·c(H2),k正、k逆分别为正、逆反应速率常数,c为物质的量浓度。一定温度下,在体积为1L的恒容密闭容器中加入4molH2O(g)和4molCO(g)发生上述反应,测得CO和CO2的物质的量浓度随时间的变化如图所示。a点时,v逆:v正=
CO2(g)+H2(g)的正、逆反应速率分别可表示为v正=k正c(CO)·c(H2O);v逆=k逆c(CO2)·c(H2),k正、k逆分别为正、逆反应速率常数,c为物质的量浓度。一定温度下,在体积为1L的恒容密闭容器中加入4molH2O(g)和4molCO(g)发生上述反应,测得CO和CO2的物质的量浓度随时间的变化如图所示。a点时,v逆:v正=___________ 。
(3)可采用CO和二甲醚催化合成乙醇。
反应I:CH3OCH3(g)+CO(g) CH3COOCH3(g)ΔH1
CH3COOCH3(g)ΔH1
反应II:CH3COOCH3(g)+2H2(g) CH3OH(g)+C2H5OH(g)ΔH2
CH3OH(g)+C2H5OH(g)ΔH2
①压强为pkpa时,温度对二甲醚和乙酸甲酯平衡转化率的影响如图甲所示,则∆H1___________ (填“>”或“<”)0。
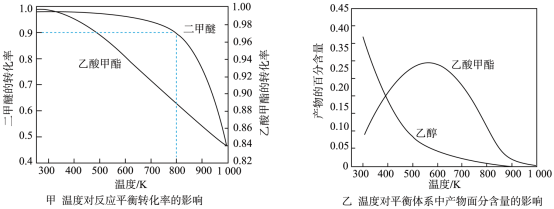
②温度对平衡体系中乙酸甲酯的含量和乙醇的影响如图乙所示,在300~600K范围内,乙酸甲酯的含量逐渐增大,而乙醇的百分含量逐渐减小的原因是:___________ 。
③若压强为pkpa、温度为800K时,向2L恒容密闭容器中充入1molCH3OCH3和1molCO发生反应I,2min时达到平衡,该条件下反应I的平衡常数K=___________ L/mol。
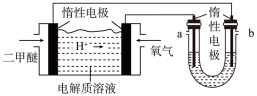
(4)25℃时,以二甲醚燃料电池(电解质溶液为稀硫酸)为电源,电解600mL一定浓度的NaCl溶液。电解一段时间后,NaCl溶液的pH变为12(假设电解前后NaCl溶液的体积不变),则理论上消耗二甲醚的物质的量为___________ mol。若向U形管内电解后的溶液中通入CO2气体,使所得溶液c(HCO )∶c(CO
)∶c(CO )=2∶1,则此时溶液中的c(H+)=
)=2∶1,则此时溶液中的c(H+)=___________ mol·L-1(室温下,H2CO3的Ka1=4×10-7,Ka2=5×10-11)。
I:CO(g)+2H2(g)
 CH3OH(g)∆H1=-90.7kJ·mol-1
CH3OH(g)∆H1=-90.7kJ·mol-1II:2CH3OH(g)
 CH3OCH3(g)+H2O(g)∆H2=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g)∆H2=-23.5kJ·mol-1III:CO(g)+H2O(g)
 CO2(g)+H2(g)ΔH3=-41.2kJ·mol-1
CO2(g)+H2(g)ΔH3=-41.2kJ·mol-1(1)一种新合成二甲醚的方法为一定条件下:2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g),该反应的∆H=
CH3OCH3(g)+3H2O(g),该反应的∆H=A.平均摩尔质量保持不变B.容器的密度不变
C.容器内压强保持不变D.单位时间内消耗2molCO2,同时消耗1mol二甲醚
(2)若反应CO(g)+H2O(g)
 CO2(g)+H2(g)的正、逆反应速率分别可表示为v正=k正c(CO)·c(H2O);v逆=k逆c(CO2)·c(H2),k正、k逆分别为正、逆反应速率常数,c为物质的量浓度。一定温度下,在体积为1L的恒容密闭容器中加入4molH2O(g)和4molCO(g)发生上述反应,测得CO和CO2的物质的量浓度随时间的变化如图所示。a点时,v逆:v正=
CO2(g)+H2(g)的正、逆反应速率分别可表示为v正=k正c(CO)·c(H2O);v逆=k逆c(CO2)·c(H2),k正、k逆分别为正、逆反应速率常数,c为物质的量浓度。一定温度下,在体积为1L的恒容密闭容器中加入4molH2O(g)和4molCO(g)发生上述反应,测得CO和CO2的物质的量浓度随时间的变化如图所示。a点时,v逆:v正=
(3)可采用CO和二甲醚催化合成乙醇。
反应I:CH3OCH3(g)+CO(g)
 CH3COOCH3(g)ΔH1
CH3COOCH3(g)ΔH1反应II:CH3COOCH3(g)+2H2(g)
 CH3OH(g)+C2H5OH(g)ΔH2
CH3OH(g)+C2H5OH(g)ΔH2①压强为pkpa时,温度对二甲醚和乙酸甲酯平衡转化率的影响如图甲所示,则∆H1

②温度对平衡体系中乙酸甲酯的含量和乙醇的影响如图乙所示,在300~600K范围内,乙酸甲酯的含量逐渐增大,而乙醇的百分含量逐渐减小的原因是:
③若压强为pkpa、温度为800K时,向2L恒容密闭容器中充入1molCH3OCH3和1molCO发生反应I,2min时达到平衡,该条件下反应I的平衡常数K=
(4)25℃时,以二甲醚燃料电池(电解质溶液为稀硫酸)为电源,电解600mL一定浓度的NaCl溶液。电解一段时间后,NaCl溶液的pH变为12(假设电解前后NaCl溶液的体积不变),则理论上消耗二甲醚的物质的量为
 )∶c(CO
)∶c(CO )=2∶1,则此时溶液中的c(H+)=
)=2∶1,则此时溶液中的c(H+)=
您最近一年使用:0次
名校
解题方法
3 . 山东“十四五”规划提出“推动绿色发展,绘就绿水青山齐鲁画卷”。 加氢可缓解
加氢可缓解 带来的环境压力,同时带来巨大的经济效益。
带来的环境压力,同时带来巨大的经济效益。 加氢过程,主要发生的三个竞争反应为:
加氢过程,主要发生的三个竞争反应为:
反应Ⅰ:
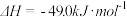
反应Ⅱ:
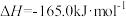
反应Ⅲ:
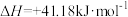
回答下列问题:
(1)①由CO、H2合成甲醇的热化学方程式为_______ 。
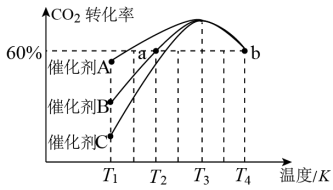
②相同时间内,在不同催化剂下用CO2和H2合成甲醇(其他条件均相同),CO2的转化率随温度变化如图所示,其中活化能最低的反应所用的催化剂是催化剂_______ (填“A”、“B”或“C”)。
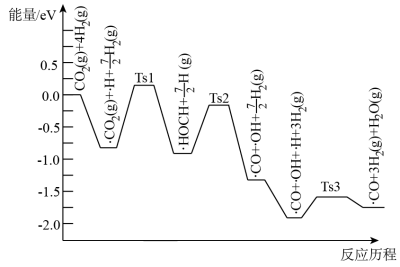
③在 催化剂表面上反应Ⅱ的前三步反应历程如图所示(吸附在
催化剂表面上反应Ⅱ的前三步反应历程如图所示(吸附在 催化剂表面用“∙”标注,Ts表示过渡态),则物质吸附在催化剂表面,形成过渡态的过程会
催化剂表面用“∙”标注,Ts表示过渡态),则物质吸附在催化剂表面,形成过渡态的过程会_______ (填“放出热量”或“吸收热量”),反应历程中最小能垒(活化能)步骤的化学方程式为_______ 。
(2)我国科学家研究了不同反应温度对含碳产物组成的影响。在反应器中按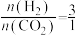 ,通入H2和CO2,分别在0.1MPa和1MPa下进行反应。实验中温度对平衡组成体系的(CO2、CO、CH4)三种物质分析,其CO和CH4的影响如下图所示(该反应条件下甲醇产量极低,因此忽略“反应I”,只考虑反应Ⅱ和反应III)。
,通入H2和CO2,分别在0.1MPa和1MPa下进行反应。实验中温度对平衡组成体系的(CO2、CO、CH4)三种物质分析,其CO和CH4的影响如下图所示(该反应条件下甲醇产量极低,因此忽略“反应I”,只考虑反应Ⅱ和反应III)。

①lMPa时,表示CH4和CO平衡组成随温度变化关系的曲线分别是_______ 、_______ 。M点平衡组成含量高于N点的原因是_______ 。
②当CH4和CO平衡组成均为40%时,该温度下反应Ⅲ的平衡常数Kp为_______ 。
 加氢可缓解
加氢可缓解 带来的环境压力,同时带来巨大的经济效益。
带来的环境压力,同时带来巨大的经济效益。 加氢过程,主要发生的三个竞争反应为:
加氢过程,主要发生的三个竞争反应为:反应Ⅰ:

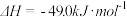
反应Ⅱ:

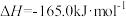
反应Ⅲ:

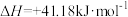
回答下列问题:
(1)①由CO、H2合成甲醇的热化学方程式为
②相同时间内,在不同催化剂下用CO2和H2合成甲醇(其他条件均相同),CO2的转化率随温度变化如图所示,其中活化能最低的反应所用的催化剂是催化剂

③在
 催化剂表面上反应Ⅱ的前三步反应历程如图所示(吸附在
催化剂表面上反应Ⅱ的前三步反应历程如图所示(吸附在 催化剂表面用“∙”标注,Ts表示过渡态),则物质吸附在催化剂表面,形成过渡态的过程会
催化剂表面用“∙”标注,Ts表示过渡态),则物质吸附在催化剂表面,形成过渡态的过程会
(2)我国科学家研究了不同反应温度对含碳产物组成的影响。在反应器中按
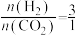 ,通入H2和CO2,分别在0.1MPa和1MPa下进行反应。实验中温度对平衡组成体系的(CO2、CO、CH4)三种物质分析,其CO和CH4的影响如下图所示(该反应条件下甲醇产量极低,因此忽略“反应I”,只考虑反应Ⅱ和反应III)。
,通入H2和CO2,分别在0.1MPa和1MPa下进行反应。实验中温度对平衡组成体系的(CO2、CO、CH4)三种物质分析,其CO和CH4的影响如下图所示(该反应条件下甲醇产量极低,因此忽略“反应I”,只考虑反应Ⅱ和反应III)。
①lMPa时,表示CH4和CO平衡组成随温度变化关系的曲线分别是
②当CH4和CO平衡组成均为40%时,该温度下反应Ⅲ的平衡常数Kp为
您最近一年使用:0次
名校
解题方法
4 . 已知几种共价键的键能数据如下:
反应Ⅰ: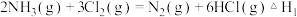
反应Ⅱ:
下列说法正确的是
| 共价键 |  |  |  |  |  |  |
键能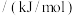 | 391 | 945 | 243 | 432 | 193 | 366 |
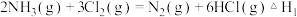
反应Ⅱ:

下列说法正确的是
A. |
B. |
C.稳定性: |
D.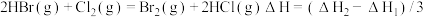 |
您最近一年使用:0次
2020-10-19更新
|
134次组卷
|
3卷引用:黑龙江省大庆中学2020-2021学年高一下学期期末考试化学试题
名校
解题方法
5 . 党的十九大报告中多次提及“绿色环保”、“生态文明”,而 CO2的有效利用可以缓解温室效应,解决能源短缺问题。
(1)某研究所的科研人员在新型纳米催化剂 Na-Fe3O4和 HMCM-22 的表面,以 CO2为碳源,与电解水产生的 H2催化转化为高附加值的烃类化合物,其过程如图。
图中 CO2转化为 CO 的反应为:CO2(g) + H2(g)=CO(g) + H2O(g) ΔH1 = + 41 kJ•mol-1。已知:2CO2(g) + 6H2(g)=C2H4(g) + 4H2O(g) ΔH2=-128 kJ•mol-1。图中 CO 转化为 C2H4的热化学方程式是__________________ 。
(2)甲醇是未来重要的绿色能源之一,在工业中常用 CO、H2合成甲醇,其反应为:CO(g)+2H2(g)⇌CH3OH(g) ΔH3 < 0
①为了探究浓度对反应速率的影响,200℃ 时在 10 L 恒容密闭容器中进行实验,测得的实验数据如下表所示:
该反应速率的通式为 v正=k正 cm(CO)•cn(H2)(k 正是与温度有关的速率常数)。由表中数据可确定反应速率通式中 m =_______ 、n =_____ (取正整数)。实验发现,当实验 1 中 c(H2) = 0.25 mol•L-1时达到平衡,请计算该反应的平衡常数 K = _____ 。
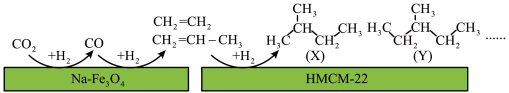
②若将一定比例的 CO 和 H2 在装有催化剂的反应器中反应 12 小时,体系中甲醇的产率和催化剂的催化活性与温度的关系如图所示。
请判断温度为 470 K 时,图中 P 点_________ (填“是”或“不是”)处于平衡状态,490 K 之后,甲醇产率随温度升高而减小的可能原因为:_____ 、 _____ 。
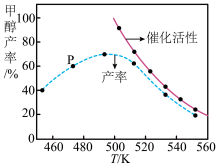
(3)近年来,有研究人员用 CO2 通过电催化生成多种燃料,其工作原理如图所示。
①请写出 Cu 电极上产生 CH3OH 的电极反应式:_____________ 。
②如果Cu 电极上只生成 0.15 mol C2H4和 0.30 mol CH3OH,则 Pt 电极上产生O2的物质的量为___________ mol。
③已知 HCOOH 为一元弱酸,常温下将 0.1 mol•L-1 HCOOH 溶液与 0.1 mol•L-1 NaOH 溶液按体积比 a : b混和(忽略溶液体积的变化),混合后溶液恰好显中性,则 HCOOH 的电离常数 Ka=_____________ (用含 a、b 的代数式表示)。
(1)某研究所的科研人员在新型纳米催化剂 Na-Fe3O4和 HMCM-22 的表面,以 CO2为碳源,与电解水产生的 H2催化转化为高附加值的烃类化合物,其过程如图。

图中 CO2转化为 CO 的反应为:CO2(g) + H2(g)=CO(g) + H2O(g) ΔH1 = + 41 kJ•mol-1。已知:2CO2(g) + 6H2(g)=C2H4(g) + 4H2O(g) ΔH2=-128 kJ•mol-1。图中 CO 转化为 C2H4的热化学方程式是
(2)甲醇是未来重要的绿色能源之一,在工业中常用 CO、H2合成甲醇,其反应为:CO(g)+2H2(g)⇌CH3OH(g) ΔH3 < 0
①为了探究浓度对反应速率的影响,200℃ 时在 10 L 恒容密闭容器中进行实验,测得的实验数据如下表所示:
| 实验 | 起始浓度/(mol·L-1) | 初始速率/(mol·L-1·min-1) | |
| CO | H2 | ||
| 1 | 0.25 | 0.50 | 0.391 |
| 2 | 0.25 | 1.00 | 0.781 |
| 3 | 0.50 | 0.50 | 0.780 |
②若将一定比例的 CO 和 H2 在装有催化剂的反应器中反应 12 小时,体系中甲醇的产率和催化剂的催化活性与温度的关系如图所示。

请判断温度为 470 K 时,图中 P 点
(3)近年来,有研究人员用 CO2 通过电催化生成多种燃料,其工作原理如图所示。

①请写出 Cu 电极上产生 CH3OH 的电极反应式:
②如果Cu 电极上只生成 0.15 mol C2H4和 0.30 mol CH3OH,则 Pt 电极上产生O2的物质的量为
③已知 HCOOH 为一元弱酸,常温下将 0.1 mol•L-1 HCOOH 溶液与 0.1 mol•L-1 NaOH 溶液按体积比 a : b混和(忽略溶液体积的变化),混合后溶液恰好显中性,则 HCOOH 的电离常数 Ka=
您最近一年使用:0次
2020-06-04更新
|
866次组卷
|
3卷引用:黑龙江省大庆铁人中学2021届高三下学期5月第三次模拟考试理综化学试题
黑龙江省大庆铁人中学2021届高三下学期5月第三次模拟考试理综化学试题四川省成都市第七中学2020届高三三诊模拟考试理科综合化学试题(已下线)专题14 化学反应原理综合-2020年高考真题和模拟题化学分项汇编
名校
6 . 下列四幅图示所表示的信息与对应的叙述相符的是
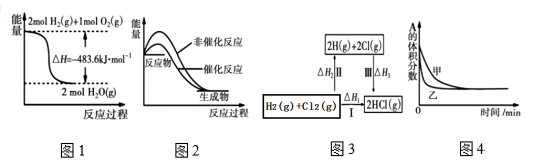

| A.图1表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8kJ·mol−1 |
| B.图2表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| C.图3表示一定条件下H2和Cl2生成HCl的反应热与途径无关,则 △H1=△H2+△H3 |
D.图4表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强大 3C(g)+D(s)的影响,乙的压强大 |
您最近一年使用:0次
2019-05-10更新
|
1834次组卷
|
22卷引用:黑龙江省大庆中学2022届高三上学期第一次月考化学试题
黑龙江省大庆中学2022届高三上学期第一次月考化学试题湖南省常德市石门县第六中学2020-2021学年高二上学期期末考试(合格考)化学试题黑龙江省绥化市第一中学2021-2022学年高二上学期期中考试化学试卷内蒙古赤峰市第四中学分校2021-2022学年高二上学期9月月考化学试题【市级联考】安徽省蚌埠市2019届高三下学期第一次质量监测考试化学试题(已下线)专题07 化学反应中的能量变化——2019年高考真题和模拟题化学分项汇编福建省莆田四中2019-2020学年高二上学期期中考试化学试题陕西省西安中学2020届高三上学期第三次月考化学试题2020届高三《新题速递·化学》1月第01期(考点01-06)湖南省衡阳市常宁五中2020届高三11月月考化学试题安徽省亳州市2019-2020学年高三上学期期末教学质量检测化学试题江西省宜春市奉新县第一中学2020届高三上学期第四次月考化学试题(已下线)专题6.1 化学能与热能(练)——2020年高考化学一轮复习讲练测山西省晋中市祁县中学校2019-2020学年高二11月月考化学试题江西省上饶市横峰中学、铅山一中、弋阳一中2020-2021学年高二上学期开学联考化学试题(课改班)安徽省合肥市第十一中学2020-2021学年高二上学期第一次月考化学试题北京五中2021届高三上学期第二次月考化学试题福建省建瓯市芝华中学2021届高三上学期第二次阶段考(期中)化学试题新疆北屯高级中学2021届高三上学期10月月考化学试题陕西省西安市长安区第一中学2021届高三上学期第三次月考化学试题广东省佛山市第二中学2020-2021学年高二上学期期中考试化学试题贵州省贵阳市普通中学2021-2022学年高三上学期期末考试化学试题
名校
解题方法
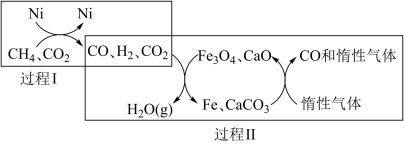
7 . CH4超干重整CO2技术可得到富含CO的化工原料。回答下列问题:
(1)CH4超干重整CO2的催化转化如图所示:
①已知相关反应的能量变化如图所示:
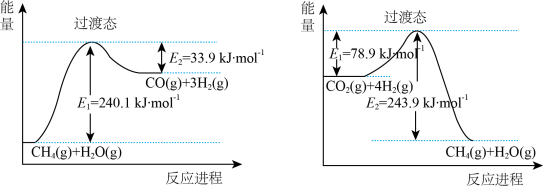
过程Ⅰ的热化学方程式为________ 。
②关于上述过程Ⅱ的说法不正确的是________ (填序号)。
a.实现了含碳物质与含氢物质的分离
b.可表示为CO2+H2=H2O(g)+CO
c.CO未参与反应
d.Fe3O4、CaO为催化剂,降低了反应的ΔH
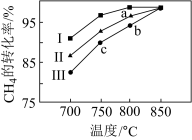
③其他条件不变,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应CH4(g)+CO2(g)=2CO(g)+2H2(g)进行相同时间后,CH4的转化率随反应温度的变化如图所示。a点所代表的状态________ (填“是”或“不是”)平衡状态;b点CH4的转化率高于c点,原因是________ 。
(2)在一刚性密闭容器中,CH4和CO2的分压分别为20kPa、25kPa,加入Ni/α-Al2O3催化剂并加热至1123K使其发生反应CH4(g)+CO2(g)=2CO(g)+2H2(g)。
①研究表明CO的生成速率υ(CO)=1.3×10-2·p(CH4)·p(CO2)mol·g-1·s-1,某时刻测得p(CO)=20kPa,则p(CO2)=________ kPa,υ(CO)=________ mol·g-1·s-1。
②达到平衡后测得体系压强是起始时的1.8倍,则该反应的平衡常数的计算式为Kp=________ (kPa)2。(用各物质的分压代替物质的量浓度计算)
(3)CH4超干重整CO2得到的CO经偶联反应可制得草酸(H2C2O4)。常温下,向某浓度的草酸溶液中加入一定浓度的NaOH溶液,所得溶液中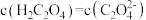 ,则此时溶液的pH=
,则此时溶液的pH=________ 。(已知常温下H2C2O4的Ka1=6×10-2,Ka2=6×10-5,lg6=0.8)
(1)CH4超干重整CO2的催化转化如图所示:

①已知相关反应的能量变化如图所示:

过程Ⅰ的热化学方程式为
②关于上述过程Ⅱ的说法不正确的是
a.实现了含碳物质与含氢物质的分离
b.可表示为CO2+H2=H2O(g)+CO
c.CO未参与反应
d.Fe3O4、CaO为催化剂,降低了反应的ΔH
③其他条件不变,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应CH4(g)+CO2(g)=2CO(g)+2H2(g)进行相同时间后,CH4的转化率随反应温度的变化如图所示。a点所代表的状态
(2)在一刚性密闭容器中,CH4和CO2的分压分别为20kPa、25kPa,加入Ni/α-Al2O3催化剂并加热至1123K使其发生反应CH4(g)+CO2(g)=2CO(g)+2H2(g)。

①研究表明CO的生成速率υ(CO)=1.3×10-2·p(CH4)·p(CO2)mol·g-1·s-1,某时刻测得p(CO)=20kPa,则p(CO2)=
②达到平衡后测得体系压强是起始时的1.8倍,则该反应的平衡常数的计算式为Kp=
(3)CH4超干重整CO2得到的CO经偶联反应可制得草酸(H2C2O4)。常温下,向某浓度的草酸溶液中加入一定浓度的NaOH溶液,所得溶液中
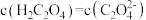 ,则此时溶液的pH=
,则此时溶液的pH=
您最近一年使用:0次
2019-04-30更新
|
2028次组卷
|
8卷引用:黑龙江省大庆实验中学2020-2021学年高二上学期期末考试化学试题
名校
8 . 已知以下的热化学反应方程式:
Fe2O3(s)+1/3CO(g) = 2/3Fe3O4(s)+1/3CO2(g) ΔH=-15.73 kJ/mol
Fe3O4(s)+CO(g) = 3FeO(s)+CO2(g) ΔH=+640.4 kJ/mol
Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) ΔH=-24.8 kJ/mol
则42 g CO气体还原足量FeO固体得到Fe固体和CO2气体时对应的ΔH约为
Fe2O3(s)+1/3CO(g) = 2/3Fe3O4(s)+1/3CO2(g) ΔH=-15.73 kJ/mol
Fe3O4(s)+CO(g) = 3FeO(s)+CO2(g) ΔH=+640.4 kJ/mol
Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) ΔH=-24.8 kJ/mol
则42 g CO气体还原足量FeO固体得到Fe固体和CO2气体时对应的ΔH约为
| A.-327 kJ/mol | B.+327 kJ/mol | C.-218 kJ/mol | D.+218 kJ/mol |
您最近一年使用:0次
2018-11-18更新
|
1106次组卷
|
4卷引用:黑龙江省大庆市东风中学2021-2022学年高二上学期期中考试化学试题



