名校
解题方法
1 . 长征五号B运载火箭是中国近地轨道运载能力最大的新一代运载火箭,承担中国空间站舱段发射任务.采用液氧、液氢作为推进剂.回答下列问题:
(1)与偏二甲肼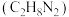 、四氧化二氨推进剂相比,液氢、液氧推进剂的优点是
、四氧化二氨推进剂相比,液氢、液氧推进剂的优点是___________ ;
(2)已知: ;
;
 ;
;
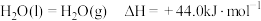 ;
;
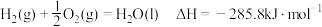 .
.
请写出液氢和液氧生成气态水的热化学方程式:______________ ,氢气的燃烧热
________ ;
(3)如果长征五号B运载火箭所携带的燃料为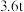 液氢、液氢,且液氢、液氧恰好完全反应生成气态水,总共释放能量
液氢、液氢,且液氢、液氧恰好完全反应生成气态水,总共释放能量________  (保留3位有效数字);
(保留3位有效数字);
(4)光催化制氢是能源研究热点.一种光催化水分解制取氢气的机理如图所示.

①该转化过程中,________ 能转化为化学能;
②由图可知, 转化为
转化为 的催化剂是
的催化剂是________ (填字母)。
A. B.
B. C.
C. D.紫外线
D.紫外线
(1)与偏二甲肼
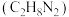 、四氧化二氨推进剂相比,液氢、液氧推进剂的优点是
、四氧化二氨推进剂相比,液氢、液氧推进剂的优点是(2)已知:
 ;
; ;
;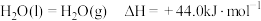 ;
;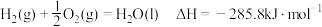 .
.请写出液氢和液氧生成气态水的热化学方程式:

(3)如果长征五号B运载火箭所携带的燃料为
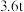 液氢、液氢,且液氢、液氧恰好完全反应生成气态水,总共释放能量
液氢、液氢,且液氢、液氧恰好完全反应生成气态水,总共释放能量 (保留3位有效数字);
(保留3位有效数字);(4)光催化制氢是能源研究热点.一种光催化水分解制取氢气的机理如图所示.

①该转化过程中,
②由图可知,
 转化为
转化为 的催化剂是
的催化剂是A.
 B.
B. C.
C. D.紫外线
D.紫外线
您最近一年使用:0次
名校
2 . 请完成下列有关非金属元素及其化合物的问题:
(1)氮及其化合物用途广泛。写出 的电子式:
的电子式:_______ 。
(2)将空气中的氮气转化为氮的化合物的过程称为固氮。下列能实现人工固氮的是_______(填字母)。
(3)肼 又称联氨,是一种可燃性的液体,可用作火箭燃料。肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼—空气燃料电池放电时负极的电极反应式是
又称联氨,是一种可燃性的液体,可用作火箭燃料。肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼—空气燃料电池放电时负极的电极反应式是_______ 。
(4)传统制备肼的方法,是以 氧化
氧化 ,制得肼的稀溶液。该反应的离子方程式是
,制得肼的稀溶液。该反应的离子方程式是_______ 。
(5)黑火药是中国古代的四大发明之一,其成分含有硝酸盐等,已知其爆炸反应为: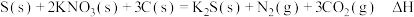
已知①碳的燃烧热为 ,
,
② ,
,
③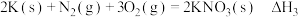 ;
;
则 为
为_______ (用含有 、
、 、
、 的代数式表示)。
的代数式表示)。
(6)铵盐常用作化肥,在实验室中检验 固体中含有
固体中含有 的实验方案为:
的实验方案为:_______ 。
(7)可以用氢氟酸刻蚀玻璃,氢氟酸发生反应的化学方程式是:_______ 。
(1)氮及其化合物用途广泛。写出
 的电子式:
的电子式:(2)将空气中的氮气转化为氮的化合物的过程称为固氮。下列能实现人工固氮的是_______(填字母)。
A. 和 和 在一定条件下反应生成 在一定条件下反应生成 | B.雷雨闪电时空气中的 和 和 化合生成NO 化合生成NO |
C. 经过催化氧化生成NO 经过催化氧化生成NO | D. 和 和 反应生成 反应生成 |
 又称联氨,是一种可燃性的液体,可用作火箭燃料。肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼—空气燃料电池放电时负极的电极反应式是
又称联氨,是一种可燃性的液体,可用作火箭燃料。肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼—空气燃料电池放电时负极的电极反应式是(4)传统制备肼的方法,是以
 氧化
氧化 ,制得肼的稀溶液。该反应的离子方程式是
,制得肼的稀溶液。该反应的离子方程式是(5)黑火药是中国古代的四大发明之一,其成分含有硝酸盐等,已知其爆炸反应为:
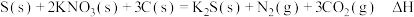
已知①碳的燃烧热为
 ,
,②
 ,
,③
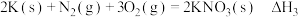 ;
;则
 为
为 、
、 、
、 的代数式表示)。
的代数式表示)。(6)铵盐常用作化肥,在实验室中检验
 固体中含有
固体中含有 的实验方案为:
的实验方案为:(7)可以用氢氟酸刻蚀玻璃,氢氟酸发生反应的化学方程式是:
您最近一年使用:0次
名校
解题方法
3 . I.某学习小组利用铁与稀硫酸的反应,探究影响化学反应速率的因素,结果如表:
(1)实验1、2表明_______ 对反应速率有影响。
(2)探究反应物浓度影响反应速率的实验有_______ (填实验序号)。
(3)该小组的实验中,探究的反应速率的影响因素还有_______ ,体现该影响因素的实验有_______ (填实验序号)。
II汽车尾气的主要成分有CO、SO2、NO、NO2等。
(4)利用氨水可以将SO2、NO2吸收,原理如下图所示:
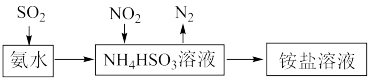
请写出NO2被吸收反应的离子方程式_______ 。
(5)科研工作者目前正在尝试以二氧化钛(TiO2)催化分解汽车尾气的研究。
①已知:
反应Ⅰ:2NO(g)+O2(g)=2NO2(g) ΔH1=-113.0kJ·mol-1
反应Ⅱ:2SO2(g)+O2(g)=2SO3(1) ΔH2=-288.4kJ·mol-1
反应Ⅲ:3NO2(g)+H2O(g)=2HNO3+NO(g) ΔH3=-138.0kJ·mol-1
则反应NO2(g)+SO2(g)=NO(g)+SO3(1) ΔH4=_______ 。
②已知TiO2催化尾气降解原理可表示为:
2CO(g)+O2(g) 2CO2(g) ΔH5;
2CO2(g) ΔH5;
2H2O(g)+4NO(g)+3O2(g) 4HNO3(g) ΔH6。
4HNO3(g) ΔH6。
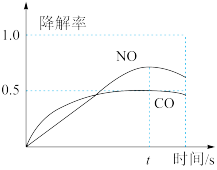
在O2、H2O(g)浓度一定条件下,模拟CO、NO的降解,得到其降解率(即转化率)如下图所示。请解释ts后NO降解率下降的可能原因_______ 。
| 实验序号 | 铁的质量(g) | 铁的形态 | V(H2SO4) | c(H2SO4)(mol/L) | 反应前溶液的温度(℃) | 金属完全消失的时间(s) |
| 1 | 0.10 | 片状 | 50 | 0.8 | 20 | 200 |
| 2 | 0.10 | 粉状 | 50 | 0.8 | 20 | 25 |
| 3 | 0.10 | 片状 | 50 | 1.0 | 20 | 125 |
| 4 | 0.10 | 片状 | 50 | 1.0 | 35 | 50 |
(1)实验1、2表明
(2)探究反应物浓度影响反应速率的实验有
(3)该小组的实验中,探究的反应速率的影响因素还有
II汽车尾气的主要成分有CO、SO2、NO、NO2等。
(4)利用氨水可以将SO2、NO2吸收,原理如下图所示:
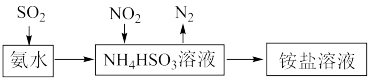
请写出NO2被吸收反应的离子方程式
(5)科研工作者目前正在尝试以二氧化钛(TiO2)催化分解汽车尾气的研究。
①已知:
反应Ⅰ:2NO(g)+O2(g)=2NO2(g) ΔH1=-113.0kJ·mol-1
反应Ⅱ:2SO2(g)+O2(g)=2SO3(1) ΔH2=-288.4kJ·mol-1
反应Ⅲ:3NO2(g)+H2O(g)=2HNO3+NO(g) ΔH3=-138.0kJ·mol-1
则反应NO2(g)+SO2(g)=NO(g)+SO3(1) ΔH4=
②已知TiO2催化尾气降解原理可表示为:
2CO(g)+O2(g)
 2CO2(g) ΔH5;
2CO2(g) ΔH5;2H2O(g)+4NO(g)+3O2(g)
 4HNO3(g) ΔH6。
4HNO3(g) ΔH6。在O2、H2O(g)浓度一定条件下,模拟CO、NO的降解,得到其降解率(即转化率)如下图所示。请解释ts后NO降解率下降的可能原因

您最近一年使用:0次
4 . I.钛(Ti)因具有硬度大、熔点高、耐酸腐蚀等优点而被应用于航空、电子等领域,由金红石(TiO2)制取单质Ti的步骤如下:
TiO2→TiCl4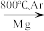 Ti
Ti
已知:i. C(s)+O2(g)=CO2(g) ΔH=−393.5 kJ∙mol−1
ii. 2CO(g)+O2(g)=2CO2(g) ΔH=−566 kJ∙mol−1
ⅲ. TiO2(s)+2Cl2(g)=TiCl(s)+O2(g) ΔH=+141 kJ∙mol−1
(1)TiO2(s)+2Cl2(g)+2 C(s)=TiCl(s)+2CO(g)的ΔH=_______
(2)反应TiCl4+2Mg 2MgCl2+Ti在Ar气氛中进行的理由是
2MgCl2+Ti在Ar气氛中进行的理由是_______
Ⅱ. 50mL 0.50 mol∙L−1盐酸与50mL 0.55 mol∙L−1 NaOH溶液在简易量热计中进行中和反应,假设盐酸和氢氧化钠溶液的密度都是1g·cm−3,又知中和反应后生成溶液的比热容c=4.18J·g−1·℃−1。为了计算中和热,某学生实验记录的数据如下:
(3)依据该学生的实验数据计算,该实验测得的中和热ΔH=_______ (结果保留一位小数)。如用0.5 mol∙L−1的盐酸与NaOH固体进行实验,则实验中测得的中和热数值将_______ (填“偏大”、“偏小”或“不变”)。
Ⅲ.25℃时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n随时间t的变化如图1所示,已知达到平衡后,降低温度,A的转化率将增大。
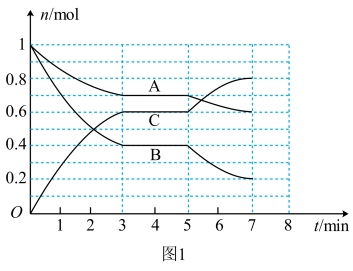
(4)根据图1数据,写出该反应的化学方程式:_______ 。此反应的平衡常数表达式K=_______ 。
(5)在5~7min内,若K不变,则此处曲线变化的原因是_______ 。
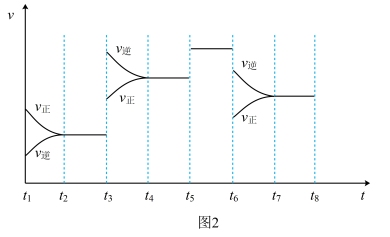
(6)此反应的反应速率v和时间t的关系如图2,各阶段的平衡常数如表所示。K1、K2、K3、K4之间的关系为_______ (用“>”、“<”或“=”连接)
TiO2→TiCl4
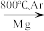 Ti
Ti已知:i. C(s)+O2(g)=CO2(g) ΔH=−393.5 kJ∙mol−1
ii. 2CO(g)+O2(g)=2CO2(g) ΔH=−566 kJ∙mol−1
ⅲ. TiO2(s)+2Cl2(g)=TiCl(s)+O2(g) ΔH=+141 kJ∙mol−1
(1)TiO2(s)+2Cl2(g)+2 C(s)=TiCl(s)+2CO(g)的ΔH=
(2)反应TiCl4+2Mg
 2MgCl2+Ti在Ar气氛中进行的理由是
2MgCl2+Ti在Ar气氛中进行的理由是Ⅱ. 50mL 0.50 mol∙L−1盐酸与50mL 0.55 mol∙L−1 NaOH溶液在简易量热计中进行中和反应,假设盐酸和氢氧化钠溶液的密度都是1g·cm−3,又知中和反应后生成溶液的比热容c=4.18J·g−1·℃−1。为了计算中和热,某学生实验记录的数据如下:
| 试验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
Ⅲ.25℃时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n随时间t的变化如图1所示,已知达到平衡后,降低温度,A的转化率将增大。

(4)根据图1数据,写出该反应的化学方程式:
(5)在5~7min内,若K不变,则此处曲线变化的原因是
(6)此反应的反应速率v和时间t的关系如图2,各阶段的平衡常数如表所示。K1、K2、K3、K4之间的关系为

| t2~t3 | t4~t5 | t5~t6 | t7~t8 |
| K1 | K2 | K3 | K4 |
您最近一年使用:0次
名校
5 . 能源是人类赖以生存和发展的重要物质基础,常规能源的合理利用和新能源的合理开发是当今社会面临的严峻课题。回答下列问题:
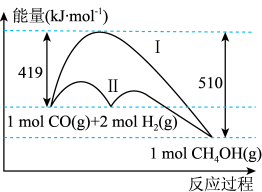
(1)工业上用CO生产燃料甲醇,一定条件下发生反应: ,反应过程中的能量变化情况如图所示。曲线
,反应过程中的能量变化情况如图所示。曲线_______ (选填“Ⅰ”或“Ⅱ”)表示使用催化剂的反应过程。计算当反应生成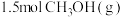 时,能量变化值是
时,能量变化值是_______ kJ。
(2)用 表示阿伏加德罗常数,在
表示阿伏加德罗常数,在 (气态)完全燃烧生成
(气态)完全燃烧生成 和液态水的反应中,每有
和液态水的反应中,每有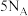 个电子转移时,放出650kJ的热量。其燃烧热的热化学方程式为
个电子转移时,放出650kJ的热量。其燃烧热的热化学方程式为_______ 。
(3)已知拆开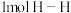 键、
键、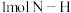 键、
键、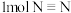 键分别需要的能量是436kJ、391kJ、946kJ,则
键分别需要的能量是436kJ、391kJ、946kJ,则 与
与 反应生成
反应生成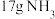 需放出的热量为
需放出的热量为_______ kJ。
(4)二氧化碳是引起“温室效应”的主要物质,节能减排以及高效利用能源能够减少二氧化碳的排放。有一种用 生产甲醇燃料的方法:
生产甲醇燃料的方法:
已知:①

②

③

④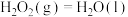

则表示 燃烧生成
燃烧生成 气体和液态水的反应热
气体和液态水的反应热 为
为_______  (用含a、b、c、d的代数式表示)。
(用含a、b、c、d的代数式表示)。
(5)已知乙醇的燃烧热为 。已知单位质量的燃料完全燃烧时所放出的热量称为该燃料的热值,则乙醇的热值是
。已知单位质量的燃料完全燃烧时所放出的热量称为该燃料的热值,则乙醇的热值是_______  。(取小数点后一位)
。(取小数点后一位)
(1)工业上用CO生产燃料甲醇,一定条件下发生反应:
 ,反应过程中的能量变化情况如图所示。曲线
,反应过程中的能量变化情况如图所示。曲线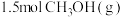 时,能量变化值是
时,能量变化值是
(2)用
 表示阿伏加德罗常数,在
表示阿伏加德罗常数,在 (气态)完全燃烧生成
(气态)完全燃烧生成 和液态水的反应中,每有
和液态水的反应中,每有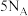 个电子转移时,放出650kJ的热量。其燃烧热的热化学方程式为
个电子转移时,放出650kJ的热量。其燃烧热的热化学方程式为(3)已知拆开
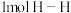 键、
键、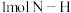 键、
键、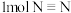 键分别需要的能量是436kJ、391kJ、946kJ,则
键分别需要的能量是436kJ、391kJ、946kJ,则 与
与 反应生成
反应生成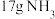 需放出的热量为
需放出的热量为(4)二氧化碳是引起“温室效应”的主要物质,节能减排以及高效利用能源能够减少二氧化碳的排放。有一种用
 生产甲醇燃料的方法:
生产甲醇燃料的方法:已知:①


②


③


④

则表示
 燃烧生成
燃烧生成 气体和液态水的反应热
气体和液态水的反应热 为
为 (用含a、b、c、d的代数式表示)。
(用含a、b、c、d的代数式表示)。(5)已知乙醇的燃烧热为
 。已知单位质量的燃料完全燃烧时所放出的热量称为该燃料的热值,则乙醇的热值是
。已知单位质量的燃料完全燃烧时所放出的热量称为该燃料的热值,则乙醇的热值是 。(取小数点后一位)
。(取小数点后一位)
您最近一年使用:0次
名校
解题方法
6 . 汽车尾气主要含有一氧化碳、二氧化硫、一氧化氮等物质,是造成城市空气污染的主要因素之一、请回答下列问题:
(1)目前解决汽车尾气污染问题所采取的措施主要有___________ (至少填两种)。
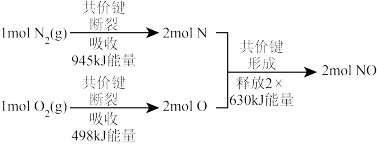
(2)已知汽缸中氮气和氧气反应生成一氧化氮的能量变化值如图所示,则由该反应生成1molNO时,应___________ (填“释放”或“吸收”)___________ kJ能量。
(3)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图所示:
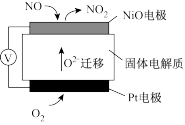
①Pt电极上发生的是___________ 反应(填“氧化”或“还原”)。
②外电路中,电子流动方向是从___________ 电极流向___________ 电极(填“NiO”或“Pt”)。
③NiO电极上的电极反应式为___________ 。
(4)在恒温恒容的密闭容器中,充入等物质的量的CO和NO混合气体,发生如下反应:2CO(g)+2NO(g)⇌2CO2(g)+N2(g),t0时达到平衡,测得反应过程中CO2的体积分数与时间的关系如下图所示。
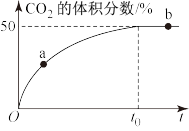
①比较大小:a处v正___________ b处v逆(填“>”、“<”或“=”)
②平衡后往该密闭容器中再充入一定量的氦气,则CO2的体积分数___________ 50%。(填“>”、“<”或“=”)
③能说明上述反应已达化学平衡状态的是___________ (填字母)。
A.v正(CO)=v逆(NO) B.混合气体密度保持不变
C.反应容器内压强保持不变 D.混合气体的平均摩尔质量不变
(1)目前解决汽车尾气污染问题所采取的措施主要有
(2)已知汽缸中氮气和氧气反应生成一氧化氮的能量变化值如图所示,则由该反应生成1molNO时,应

(3)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图所示:

①Pt电极上发生的是
②外电路中,电子流动方向是从
③NiO电极上的电极反应式为
(4)在恒温恒容的密闭容器中,充入等物质的量的CO和NO混合气体,发生如下反应:2CO(g)+2NO(g)⇌2CO2(g)+N2(g),t0时达到平衡,测得反应过程中CO2的体积分数与时间的关系如下图所示。

①比较大小:a处v正
②平衡后往该密闭容器中再充入一定量的氦气,则CO2的体积分数
③能说明上述反应已达化学平衡状态的是
A.v正(CO)=v逆(NO) B.混合气体密度保持不变
C.反应容器内压强保持不变 D.混合气体的平均摩尔质量不变
您最近一年使用:0次
2022-03-29更新
|
198次组卷
|
2卷引用:福建省宁德市部分达标中学2020-2021学年高一下学期期中联合考试化学试题
名校
解题方法
7 . 回答下列问题
(1)最新一期国际学术期刊《自然·纳米技术》介绍了我国科学家曾杰团队的成果:在含铂高效催化剂作用下把二氧化碳高效转化清洁液态燃料——甲醇(CH3OH)。
①该法利用CO2制取甲醇的有关化学反应如下:
CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) ΔH1=-178 kJ·mol-1
2CO (g) + O2(g) = 2CO2 (g) ΔH2=-566 kJ·mol-1
2H2 (g) + O2(g) = 2 H2O (g) ΔH3=-483.6 kJ·mol-1
由此计算CO (g) +2H2 (g) = CH3OH(g) ΔH=___________ kJ/mol。
②甲醇燃烧时发生如下反应(a、b、c、d均大于0):
2CH3OH(l) + 3O2(g) = 2CO2(g) +4H2O (l) ΔH1=-a kJ·mol-1
2CH3OH(g) + 3O2(g) = 2CO2(g) + 4H2O (l) ΔH1=-b kJ·mol-1
CH3OH(l) + 3/2O2(g) = CO2(g) + 2H2O (l) ΔH1=-c kJ·mol-1
CH3OH(l) +O2(g) = CO(g) + 2 H2O (l) ΔH1=-d kJ·mol-1
由此知,a、b、c、d由小到大排序为___________ 。
③将甲醇完全燃烧生成液态水的反应设计成原电池,以KOH为电解质。工作时负极的电极反应式___________ 。
(2)某温度时,在0.5L密闭容器中,某一可逆反应的A、B气体物质的量随时间变化的曲线如图所示,由图中数据分析可得:
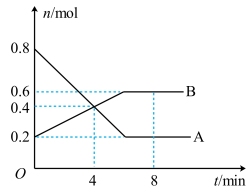
①该反应的化学方程式为___________ 。
②若降低温度,则该反应的正反应速率___________ (填“加快”“减慢”或“不变”,下同),逆反应速率___________ 。
③平衡时A的转化率为___________ 。
④反应达到平衡,此时体系内压强与开始时的压强之比为___________ 。
(1)最新一期国际学术期刊《自然·纳米技术》介绍了我国科学家曾杰团队的成果:在含铂高效催化剂作用下把二氧化碳高效转化清洁液态燃料——甲醇(CH3OH)。
①该法利用CO2制取甲醇的有关化学反应如下:
CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) ΔH1=-178 kJ·mol-1
2CO (g) + O2(g) = 2CO2 (g) ΔH2=-566 kJ·mol-1
2H2 (g) + O2(g) = 2 H2O (g) ΔH3=-483.6 kJ·mol-1
由此计算CO (g) +2H2 (g) = CH3OH(g) ΔH=
②甲醇燃烧时发生如下反应(a、b、c、d均大于0):
2CH3OH(l) + 3O2(g) = 2CO2(g) +4H2O (l) ΔH1=-a kJ·mol-1
2CH3OH(g) + 3O2(g) = 2CO2(g) + 4H2O (l) ΔH1=-b kJ·mol-1
CH3OH(l) + 3/2O2(g) = CO2(g) + 2H2O (l) ΔH1=-c kJ·mol-1
CH3OH(l) +O2(g) = CO(g) + 2 H2O (l) ΔH1=-d kJ·mol-1
由此知,a、b、c、d由小到大排序为
③将甲醇完全燃烧生成液态水的反应设计成原电池,以KOH为电解质。工作时负极的电极反应式
(2)某温度时,在0.5L密闭容器中,某一可逆反应的A、B气体物质的量随时间变化的曲线如图所示,由图中数据分析可得:

①该反应的化学方程式为
②若降低温度,则该反应的正反应速率
③平衡时A的转化率为
④反应达到平衡,此时体系内压强与开始时的压强之比为
您最近一年使用:0次
2021-12-04更新
|
232次组卷
|
2卷引用:辽宁省辽河油田第一高级中学2020-2021学年高一(A部)下学期期中考试化学试题
名校
解题方法
8 . 回答下列问题:
(1)下列关于充电电池、干电池的叙述合理的是___ 。
①干电池可以实现化学能向电能的转化和电能向化学能的转化
②锌锰干电池长时间连续使用时内装糊状物可能流出腐蚀电器
③充电电池可以无限制地反复放电、充电
④充电是使放电时的氧化还原反应逆向进行
(2)为应对全球气候问题,中国政府承诺“2030年碳达峰”“2060年碳中和”。二氧化碳再次成为科学家们研究的重点。回答下列问题:
已知:①H2(g)+ O2(g)=H2O(l) ΔH1=-285.8kJ/mol
O2(g)=H2O(l) ΔH1=-285.8kJ/mol
②C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(l) ΔH2=-1366.8kJ/mol
③H2O(l)=H2O(g) ΔH3=+44kJ⋅mol-1
则CO2与H2反应生成C2H5OH(g)和H2O(g)的热化学方程式为___ 。
(3)镁和铝插入NaOH溶液介质中,___ 为负极,其电极反应式为___ 。
(4)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可表示为:Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难于溶水但能溶于酸。正极的反应式是
2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难于溶水但能溶于酸。正极的反应式是___ 。
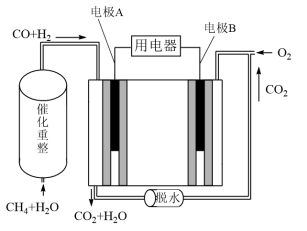
(5)一种熔融碳酸盐燃料电池原理示意如图:电池工作时,外电路上电流的方向应从___ 电极(“填A或B”)流向用电器。内电路中,CO 向
向___ 电极(“填A或B”)移动,电极A上CO参与的电极反应为___ 。
(1)下列关于充电电池、干电池的叙述合理的是
①干电池可以实现化学能向电能的转化和电能向化学能的转化
②锌锰干电池长时间连续使用时内装糊状物可能流出腐蚀电器
③充电电池可以无限制地反复放电、充电
④充电是使放电时的氧化还原反应逆向进行
(2)为应对全球气候问题,中国政府承诺“2030年碳达峰”“2060年碳中和”。二氧化碳再次成为科学家们研究的重点。回答下列问题:
已知:①H2(g)+
 O2(g)=H2O(l) ΔH1=-285.8kJ/mol
O2(g)=H2O(l) ΔH1=-285.8kJ/mol②C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(l) ΔH2=-1366.8kJ/mol
③H2O(l)=H2O(g) ΔH3=+44kJ⋅mol-1
则CO2与H2反应生成C2H5OH(g)和H2O(g)的热化学方程式为
(3)镁和铝插入NaOH溶液介质中,
(4)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可表示为:Cd+2NiO(OH)+2H2O
 2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难于溶水但能溶于酸。正极的反应式是
2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难于溶水但能溶于酸。正极的反应式是(5)一种熔融碳酸盐燃料电池原理示意如图:电池工作时,外电路上电流的方向应从
 向
向
您最近一年使用:0次
名校
9 . Ⅰ.合成氨的反应为N2(g)+3H2(g) 2NH3(g)△H=-92kJ·mol-1是一个可逆反应,反应条件是高温、高压,并且需要合适的催化剂。则:
2NH3(g)△H=-92kJ·mol-1是一个可逆反应,反应条件是高温、高压,并且需要合适的催化剂。则:
(1)如果将1mol氮气和3mol氢气混合,使其充分反应,反应放出的能量总小于上述数值,为什么?___ 。
(2)实验室模拟工业合成氨时,在容积为2L的密闭容器内,充入2mol氮气和3mol氢气,反应经过2分钟后,容器内压强变为原来的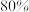 ,则0~2分钟内用氮气表示的化学反应速率是
,则0~2分钟内用氮气表示的化学反应速率是___ ,此时氢气的转化率为___ 。
(3)在容积为2L的密闭容器内,充入1mol氮气和3mol氢气,在500℃、有催化剂作用条件下,当合成氨的反应达到化学平衡时,下列说法正确的是___ 。
a.正反应速率和逆反应速率相等且为零
b.氮气和氢气的转化率相等
c.氮气的转化率达到最大值
d.氮气和氢气的浓度相等
e.NH3的体积分数保持不变
f.反应达到该条件下的最大限度
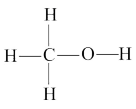
(4)燃煤废气中的CO2能转化为基础化工原料、清洁能源甲醇(CH3OH,甲醇的结构式如图所示):3H2(g)+CO2(g) CH3OH(g)+H2O(g)△H。已知:
CH3OH(g)+H2O(g)△H。已知:
则△H=___ 。
(5)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101kPa下,已知该反应每消耗9.95gCuCl(s)放热4.44kJ,该反应的热化学方程式是___ 。
(6)根据所学知识,比较下列反应热的大小。
①同一反应的生成物状态不同时反应热不同,如2H2(g)+O2(g)=2H2O(g)△H1,2H2(g)+O2(g)=2H2O(l)△H2,则△H1___ △H2(填“>”、“<”或“=”,下同)。
②同一反应的反应物状态不同时,反应热不同,如S(g)+O2(g)=SO2(g)△H1,S(s)+O2(g)=SO2(g)△H2,则△H1___ △H2。
 2NH3(g)△H=-92kJ·mol-1是一个可逆反应,反应条件是高温、高压,并且需要合适的催化剂。则:
2NH3(g)△H=-92kJ·mol-1是一个可逆反应,反应条件是高温、高压,并且需要合适的催化剂。则:(1)如果将1mol氮气和3mol氢气混合,使其充分反应,反应放出的能量总小于上述数值,为什么?
(2)实验室模拟工业合成氨时,在容积为2L的密闭容器内,充入2mol氮气和3mol氢气,反应经过2分钟后,容器内压强变为原来的
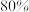 ,则0~2分钟内用氮气表示的化学反应速率是
,则0~2分钟内用氮气表示的化学反应速率是(3)在容积为2L的密闭容器内,充入1mol氮气和3mol氢气,在500℃、有催化剂作用条件下,当合成氨的反应达到化学平衡时,下列说法正确的是
a.正反应速率和逆反应速率相等且为零
b.氮气和氢气的转化率相等
c.氮气的转化率达到最大值
d.氮气和氢气的浓度相等
e.NH3的体积分数保持不变
f.反应达到该条件下的最大限度
(4)燃煤废气中的CO2能转化为基础化工原料、清洁能源甲醇(CH3OH,甲醇的结构式如图所示):3H2(g)+CO2(g)
 CH3OH(g)+H2O(g)△H。已知:
CH3OH(g)+H2O(g)△H。已知:| 化学键 | C—H | C—O | C=O | H—H | O—H |
| 键能/kJ·mol-1 | 412 | 351 | 745 | 436 | 462 |

(5)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101kPa下,已知该反应每消耗9.95gCuCl(s)放热4.44kJ,该反应的热化学方程式是
(6)根据所学知识,比较下列反应热的大小。
①同一反应的生成物状态不同时反应热不同,如2H2(g)+O2(g)=2H2O(g)△H1,2H2(g)+O2(g)=2H2O(l)△H2,则△H1
②同一反应的反应物状态不同时,反应热不同,如S(g)+O2(g)=SO2(g)△H1,S(s)+O2(g)=SO2(g)△H2,则△H1
您最近一年使用:0次
2021-09-25更新
|
551次组卷
|
2卷引用:福建省泉州第五中学2020-2021学年高一下学期期中考试化学试题
20-21高一上·全国·课时练习
解题方法
10 . 对于任何一个化学反应过程,不论该化学反应过程是一步完成,还是多步完成,其反应放出或吸收的总热量不变。已知在相同条件下1mol碳燃烧生成1mol一氧化碳放出的热量为Q1,1mol一氧化碳燃烧生成1mol二氧化碳放出的热量为Q2,1mol碳燃烧生成1mol二氧化碳放出的热量为Q3,则Q1、Q2与Q3的关系___________ 。
您最近一年使用:0次



